초록
일과성림프구증후군(passenger lymphocyte syndrome)은 이식편대숙주병의 아형으로, 공여자에서 유래한 B 림프구가 수혜자의 적혈구에 대한 항체를 생성하여 용혈성 빈혈을 일으키는 질환이다. 일과성림프구증후군의 진단은 직접항글로불린(direct antiglobulin test) 검사 양성 소견을 비롯하여 용혈성 빈혈을 시사하는 소견과, 원인이 되는 공여자 유래 항체의 동정을 포함한다. 치료는 보존적 치료를 주로 하며, 공여자 혈액형의 적혈구 수혈과 면역억제제 투여, 그리고 필요 시 혈장교환술을 시도해 볼 수 있다. 만성 신부전 상태로 고혈압, 관상동맥질환의 과거력을 가진 64세 남성이 ABO 양방향 불일치 신장이식을 받았다. 수혜자의 혈액형은 A+형이었으며, 공여자의 혈액형은 B+형이었다. 이식 후, 환자의 혈색소 수치가 감소하였으며, A형 적혈구 수혈에도 불구하고 혈색소 수치는 일시적으로 증가하였다가 다시 감소하였다. 수술 후 25일째, 혈색소 수치는 6.3 g/dL까지 감소하였다. 젖산탈수소효소 수치의 증가와 직접항글로불린 검사 결과 양성, 항체용출검사상 anti-A가 검출되어 일과성림프구증후군이 원인으로 추정되었다. 이후 적혈구 수혈을 A형에서 O형으로 전환하였으며, 혈장교환술을 시행하였고 혈색소 수치는 다시 회복하여 수술 후 35일째 특이 합병증 없이 퇴원하였다. 본 증례는 ABO 양방향 불일치 장기이식에서의 일과성림프구증후군 증례로서 한국에서 첫 보고이다.
Abstract
Passenger lymphocyte syndrome (PLS) is a subtype of graft-versus-host disease caused by the production of antibodies by transferred donor B-lymphocytes against red blood cells (RBCs) of the recipient. A 64-year-old male diagnosed with stage five chronic kidney disease underwent bidirectional ABO-mismatched kidney transplantation. The blood groups of the recipient and the donor were A+ and B+, respectively. After transplantation, hemoglobin (Hb) levels were eventually reduced to 6.3 g/dL on postoperative day (POD) 25. Elevated lactate dehydrogenase levels and positive direct antiglobulin test results indicated immune-mediated hemolysis as a possible cause of anemia. After switching RBC transfusion from type-A to type-O and conducting plasma exchange four times, on POD 35, Hb levels of the patient recovered up to 9.1 g/dL, and the patient was discharged from the hospital without complications. To the best of our knowledge, PLS in a bidirectional ABO-mismatched solid organ transplantation has been reported once in India, and this is the first case to be reported in Korea.
일과성림프구증후군(passenger lymphocyte syndrome, PLS)은 이식편대숙주병의 한 종류로 장기이식 후 나타나며 일반적으로 ABO 불일치 장기이식 후에는 10일에서 14일 후 나타나는 것으로 알려져 있다[1]. 이는 공여자의 장기 내 존재하는 B 림프구가 수혜자의 혈액 내로 유입되면서 항체를 형성하여 혈청학적, 임상적 증상을 일으켜 발생하는 현상이다[2]. ABO 불일치 장기이식 시 용혈 현상을 야기할 수 있다는 가설은 1964년 Starzl 등[3]에 의해 처음 제기되었다. 이후 Beck 등이 장기이식 후 환자 본인의 적혈구에 대한 고역가의 ABO 항체를 처음 확인하였고, Stevens 등이 최초로 passenger lymphocytes라는 단어를 사용하여 공여자에서 유래한 일과성 림프구가 수혜자의 적혈구를 표적으로 하는 항체를 생성하는 현상을 설명하였다[4, 5].
ABO 불일치 장기이식에서 PLS 진단의 근거가 되는 임상적, 검사실적 소견으로는 갑작스럽게 시작된 용혈성 빈혈, 직접항글로불린 검사 양성, 적혈구 항원에 대한 공여자 유래 항체 등이 있다[6, 7]. PLS의 치료는 일반적으로 보존적인 방법이 사용되며, 혈색소 수치 회복을 위해 수혜자 및 공여자의 혈액형에 모두 적합한 적혈구를 수혈하는 것이 도움이 된다[8, 9]. 증상이 중증이거나 지속적일 경우, 추가적으로 스테로이드, rituximab 등의 면역억제제 또는 정주용 면역글로불린(intravenous immunoglobulin), 혈장교환술 등의 치료를 고려할 수 있다[8].
PLS는 조혈모세포이식과 고형 장기이식 모두에서 발생할 수 있다[10, 11]. 고형 장기이식의 경우 신장이식보다는 간이식에서 발생빈도가 더 높으며, ABO, Rh, Kidd, Duffy 등 다양한 혈액형 항원에 대한 항체가 원인이 될 수 있으나, 임상적으로 유의미한 용혈을 일으키는 경우는 ABO 항원에 대한 항체가 그 원인이 되는 경우가 가장 많다[12]. ABO 불일치 장기이식에 의한 PLS의 증례는 대부분 ABO 부부적합(minor mismatch) 이식에 한정된다[2, 13]. 이에 ABO 양방향 부적합(bidirectional mismatch) 신장이식 후 발생한 용혈성 빈혈로 일과성림프구증후군을 진단하였던 드문 증례를 소개하고자 한다.
만성 신부전 상태의 64세 남자 환자가 ABO 불일치 신장이식을 위해 입원하였다. 환자의 혈액형은 A+형, 공여자의 혈액형은 B+형이었다. 환자는 과거력상 고혈압, 척추관협착증 및 관상동맥질환이 있었다. 환자는 10여년 전 만성신부전 진단 후 2개월 전부터 혈액투석 중이었으며, 입원 시 크레아티닌 수치는 8.2 mg/dL이었다. Anti-B 역가는 연속희석법을 통해 측정하였으며, IgG 역가의 경우 dithiothreitol 처리를 통해 IgM의 활성을 제거한 뒤 측정하였다. 입원 시 측정한 anti-B 역가는 1:16/1:2 (IgM/IgG)였으며, 수술 전 면역억제를 위해 prednisolone, mycophenolate mofetil, tacrolimus, basiliximab을 투여하였다. 수술 전 혈장교환술은 수술 4일 전 환자 혈장 용량의 1.2배에 해당하는 신선동결혈장 29단위를 사용하여 1회 시행되었으며, 수술 당일 시행한 검사 결과 anti-B 역가는 1:4/1:2 (IgM/IgG)였다.
수술 전 날 혈색소 12.0 g/dL이었으며 수술 직후 시행한 혈액 검사상 혈색소 10.5 g/dL, 백혈구 수 11,850/μL, 혈소판 수 96,000/μL이었다. 환자의 혈색소 수치는 수술 후 10일째 9.0 g/dL, 15일째 7.3 g/dL로 점차 감소하였으며 이에 수술 후 15일째 A형 적혈구 1단위를 수혈하였다. 수혈 후 혈색소 수치는 8.2 g/dL로 증가하였으나 수술 후 17일째 6.6 g/dL로 감소하여 A형 적혈구 1단위를 추가로 수혈하였고, 수혈 후 7.5 g/dL로 증가하였으나 다시 감소하였다. 수술 후 20일째 A형 적혈구 출고 시까지 시행된 혈액형 검사에서 정상적인 A+ 소견을 보였고, 비예기항체 선별검사 음성이었으며, 실온 생리식염수단계의 교차시험 결과는 적합하였다. 수술 후 25일째 수혈 후 혈색소 수치 상승이 없어 진단검사의학과 협의진료가 의뢰되었으며, 당시 시행한 혈액형검사상 환자의 혈장이 A1 혈구와 응집 반응(2+)을 보였다. 또한, 직접항글로불린 검사는 polyspecific 약양성, anti-IgG 음성, anti-C3d 약양성, anti-IgM 음성, anti-IgA 음성 소견을 나타내었다. 이에 항체용출검사를 시행하였고, 용출된 항체가 A1 혈구와 응집하는 것으로 공여자 유래 anti-A 항체에 의해 수혜자 적혈구가 감작되었음을 확인하였다. 또한, 총 빌리루빈 수치는 수술 후 25일째 1.4 mg/dL (참고범위 0.5–1.8 mg/dL), 망상적혈구수는 수술 후 23일째 2.83% (참고범위 0.50–2.85%)이었고 합토글로빈 수치는 측정범위 이하로 검출되지 않았으며(<5.0 mg/dL), 젖산탈수소효소는 수술 후 25일째 253 IU/L (참고범위 119–247 IU/L)로 증가된 소견으로 PLS에 의한 용혈성 빈혈에 합당한 소견을 보였다.
이후 적혈구제제의 혈액형을 A형에서 O형으로 변경하여 수혈하였으며, 혈색소 수치는 수술 후 25일째 6.3 g/dL에서 O형 적혈구 제제 1단위 수혈 후 8.2 g/dL로 상승하였다(Fig. 1). 용혈에 의한 이식 신장의 손상을 예방하기 위하여, 혈장교환술을 총 4회 시행하였다. 수술 후 25일째 혈장교환술 전 시행한 anti-A 역가는 1:2/1:2 (IgM/IgG)이었고, 수술 후 혈장교환술 3회 시행 후 32일째 anti-A 역가는 1:1/1:2 이하(IgM/IgG)로 감소하였다. 혈색소 수치는 점차 회복하였고, 특이 합병증 없이 환자는 35일째 퇴원하였으며 이후 외래를 통해 경과 관찰하였다. ABO 혈액형 검사상 A1 혈구에 대한 응집 반응은 49일째까지 1+로 유지되다가 71일째 음전되었다(Table 1, Fig. 2).
PLS는 전통적으로 간이식과 연관된 증례가 가장 많이 보고되어 왔으나, 소장, 심장, 폐, 췌장, 신장 등을 포함한 다른 고형 장기이식들에서의 증례도 보고되고 있다[14-17]. 장이식의 경우 비교적 덜 보고되었지만 이식 수술 수 대비 빈도가 높을 것으로 추측되는데 이는 해당 장기에 포함된 림프 조직의 양이 많기 때문이다[18]. 신장이식의 경우 발생 빈도가 간이식보다는 낮으며, 1991년 이전의 ABO 불일치 장기이식 증례들을 문헌 분석한 Ramsey 등[12]의 보고에 따르면 ABO 불일치 신장이식 환자의 17%에서 공여자 유래 항체의 생성, 9%에서 용혈 현상이 관찰되었다.
2013년까지 신장이식 환자에서 보고된 99건의 PLS 증례를 문헌 분석한 Nadarajah 등[13]의 연구에 따르면, 이식 수술 후 용혈이 관찰되기까지 기간은 5일에서 23일 사이로 최빈값은 17일이었다. 용혈의 지속기간은 최단 3일에서 최장 183일로 다양하였다. 상기 연구에서 다루었던 99건의 증례 중 ABO 항원에 대한 항체에 의한 증례는 80건이었으며, 그 중 44건이 수혜자 A형에게 O형 장기를, 23건이 수혜자 B형에게 O형 장기를, 6건이 수혜자 AB형에게 B형 장기를, 5건이 수혜자 AB형에게 A형 장기를, 2건이 수혜자 AB형에게 O형 장기를 이식한 경우였다.
ABO 불일치 장기이식 시 PLS는 현재까지 보고된 거의 모든 증례에서 ABO 부부적합 이식일 때 발생했다. 특히 A형 수혜자가 O형 장기를 받았을 때 발생한 경우가 가장 많았으며, 이는 A형과 O형이 일반 인구에서 차지하는 비율이 높은 것에 더불어, A형 적혈구에 발현된 A형 항원의 숫자가 AB형 적혈구의 A형 항원 혹은 B형 적혈구의 B형 항원보다 많아 O형 공여자의 림프구가 생성한 anti-A가 용혈을 더 쉽게 일으킬 수 있기 때문이다[13]. 본 증례와 같은 ABO 양방향 부적합 장기이식에서의 PLS는 2020년 Prethika 등[19]이 최초로 보고하였는데, 본 증례와는 반대로 B형 수혜자가 A형 공여자의 신장을 이식받았다. 그들의 증례에서는 탈감작을 통해 anti-A IgG 역가를 1:64에서 수술 직전 1:4까지 낮추었고 이식 후 정상적인 요 배출과 정상 범위의 크레아티닌 수치로 공여받은 신장의 기능은 확인되었으나, 수술 후 4일째 5.9 g/dL로 갑작스러운 혈색소 수치 감소가 관찰되었다. 추가 검사 상 직접항글로불린 검사 2+ 양성, 젖산탈수소효소 271 IU/L로, 갑작스럽게 발생한 혈색소 수치 감소, 혈액도말검사상 구상적혈구(spherocyte) 소견 등을 종합하여 면역용혈빈혈 및 PLS를 진단하였고, 환자는 O형 적혈구 수혈을 포함한 대증 치료 후 회복되어 수술 후 8일 째 퇴원하였다. 일반적인 ABO 부부적합에 의한 일과성림프구증후군의 경우 공여자 유래 림프구에 의한 용혈을 예방하기 위해 공여자 혈액형의 적혈구를 수혈하지만, Prethika 등[19]의 증례에서 볼 수 있는 것처럼 양방향 부적합의 경우 공여자 혈액형의 적혈구를 수혈할 경우 수혜자 본인의 항체에 의해 용혈이 발생하므로 공여자와 수혜자 모두에게 적합한 O형 적혈구의 수혈이 적절할 것으로 판단된다.
ABO 양방향 부적합 장기이식 시 PLS의 발생은 흔치 않은데, 이에 대한 이유로 생각될 수 있는 것들은 다음과 같다. 첫째로 PLS와 연관되어 발견되는 항체는 IgM보다 IgG인 경우가 많은데, IgG 타입의 anti-A와 anti-B는 A형이나 B형보다는 O형 공여자에서 그 역가가 훨씬 높다[4, 12]. 둘째로 림프구의 경우 ABO 항원이 직접 발현되는 것이 아니라 분비자(secretor) 여부에 따라 혈장 내에 분비된 항원이 림프구에 고정되는 것으로 알려져 있는데, PLS가 이식편대숙주병의 일종이며 고형 장기이식 시 면역거부반응을 예방하기 위해 ABO 항원형이 최우선적으로 고려되는 점을 염두에 두었을 때, A형이나 B형 공여자로부터의 양방향 부적합 장기이식의 경우 공여자의 림프구가 수혜자 체내의 면역반응에 의해 빠르게 제거될 가능성이 높다[20, 21].
ABO 부적합은 전통적으로 신장이식의 가장 큰 면역학적 장애물 중 하나였으나, 1985년 이식 전 탈감작을 통해 최초의 ABO 부적합 신장이식에 성공한 뒤로 해외 및 국내에서 ABO 부적합 신장이식의 사례는 점점 증가하고 있으며 탈감작 방법의 발전과 이식 장기 수요와 공급 사이의 불균형에 따라 앞으로도 계속 그 비율이 증가할 것으로 생각된다[22]. 반면에, 인구의 노령화와 신종 감염병 유행으로 인한 헌혈량 저하로 적혈구 제제의 수급과 분배는 갈수록 어려워질 가능성이 높다. 따라서 ABO 불일치 고형 장기이식 후 수혈을 위한 적혈구 제제의 혈액형 결정은 혈액형별 재고량을 포함한 현실적인 혈액 관리의 문제에서 자유로울 수 없다. 2020년 Kim 등[23]은 ABO 양방향 부적합 고형 장기이식 시 주부적합(major mismatch)에 준하여 수혜자의 혈액형에 맞춘 적혈구 제제를 수혈할 것을 제안하였다. 2022년 Chung 등[24]의 보고에 따르면, 한국의 77개 대형 병원으로부터 취합한 설문 결과 설문에 응답한 34개 기관 중 19개 기관(55.9%)에서 수혜자의 혈액형과 동일한 적혈구를, 15개 기관(44.1%)에서 O형 적혈구를 ABO 양방향 부적합 고형 장기이식 시에 수혈하는 것으로 나타났다.
고형 장기이식 후 발생한 갑작스러운 빈혈, 용혈에 합당한 검사실적 결과, 직접항글로불린 검사 양성 등의 소견을 보일 때 PLS를 의심해 볼 수 있으며, 이후 용출검사를 통해 수혜자의 적혈구를 둘러싼 공여자 유래항체를 동정하여 PLS를 진단할 수 있다[19]. 간이식 혹은 신장이식 시 PLS를 유발할 수 있는 항체로는 anti-A 혹은 anti-B가 가장 흔하였으나, anti-D를 포함하여 Rh 항원에 대한 항체에 의한 사례들도 보고되었으며 드물게는 anti-K, anti-Fy(a), anti-Jk(a), anti-Kp(b)에 의한 사례도 보고된 바 있다[8, 17]. 따라서 환자 및 공여자의 항원 표현형을 고려하여 원인 항체의 정확한 동정을 위한 신중한 탐색 과정이 필요할 것으로 생각된다.
본 연구에서는 ABO 불일치 장기이식 중에서도 양방향 부적합 신장이식 환자에서 나타난 PLS 1예를 보고하였다. 양방향 부적합 장기이식에 의한 PLS의 증례는 이전에 한 번 보고된 바 있으며[19] 한국에서의 증례로는 최초 보고이다. 본 증례의 환자는 공여자 유래 B 림프구가 사멸할 때까지 O형 적혈구의 수혈 및 알부민 용액을 이용한 혈장교환술을 통해 치료받았다.
REFERENCES
1. Foell D, Glasmeyer S, Senninger N, Wolters H, Palmes D, Bahde R. 2017; Successful management of passenger lymphocyte syndrome in an ABO-compatible, nonidentical isolated bowel transplant: a case report and review of the literature. Transfusion. 57:1396–400. DOI: 10.1111/trf.14086. PMID: 28369932.

2. Moosavi MM, Duncan A, Stowell SR, Roback JD, Sullivan HC. 2020; Passenger lymphocyte syndrome; a review of the diagnosis, treatment, and proposed detection protocol. Transfus Med Rev. 34:178–87. DOI: 10.1016/j.tmrv.2020.06.004. PMID: 32826130.

3. Starzl TE, Marchioro TL, Rowlands DT Jr, Kirkpatrick CH, Wilson WE, Rifkind D, et al. 1964; Immunosuppression after experimental and clinical homotransplantation of the liver. Ann Surg. 160:411–39. DOI: 10.1097/00000658-196409000-00007. PMID: 14206848. PMCID: PMC1408795.
4. Klein HG, Anstee DJ, editors. Mollison's blood transfusion in clinical medicine. 12th ed. Chichester, Chichester, West Sussex, UK: John Wiley & Sons Inc.;2014.
5. Stevens J, Callender CO, Jilly PN. 1981; Emergence of red blood cell agglutinins following renal transplantation in a patient with systemic lupus erythematosus. Transplantation. 32:398–400. DOI: 10.1097/00007890-198111000-00012. PMID: 7036456.

6. ElAnsary M, Hanna MO, Saadi G, ElShazly M, Fadel FI, Ahmed HA, et al. 2015; Passenger lymphocyte syndrome in ABO and Rhesus D minor mismatched liver and kidney transplantation: a prospective analysis. Hum Immunol. 76:447–52. DOI: 10.1016/j.humimm.2015.03.006. PMID: 25842056.

7. Ainsworth CD, Crowther MA, Treleaven D, Evanovitch D, Webert KE, Blajchman MA. 2009; Severe hemolytic anemia post-renal transplantation produced by donor anti-D passenger lymphocytes: case report and literature review. Transfus Med Rev. 23:155–9. DOI: 10.1016/j.tmrv.2008.12.005. PMID: 19304116.

8. Peck JR, Elkhammas EA, Li F, Stanich PP, Latchana N, Black S, et al. 2015; Passenger lymphocyte syndrome: a forgotten cause of postliver transplant jaundice and anemia. Exp Clin Transplant. 13:200–2.
9. de Bruijn S, Philipse E, Couttenye MM, Bracke B, Ysebaert D, Michielsen P, et al. 2017; Passenger lymphocyte syndrome (PLS): a single-center retrospective analysis of minor ABO-incompatible liver transplants. J Clin Transl Hepatol. 5:9–15. DOI: 10.14218/JCTH.2016.00072. PMID: 28507920. PMCID: PMC5411361.

10. Reed M, Yearsley M, Krugh D, Kennedy MS. 2003; Severe hemolysis due to passenger lymphocyte syndrome after hematopoietic stem cell transplantation from an HLA-matched related donor. Arch Pathol Lab Med. 127:1366–8. DOI: 10.5858/2003-127-1366-SHDTPL. PMID: 14521453.

11. Audet M, Panaro F, Piardi T, Huang P, Cag M, Cinqualbre J, et al. 2008; Passenger lymphocyte syndrome and liver transplantation. Clin Dev Immunol. 2008:715769. DOI: 10.1155/2008/715769. PMID: 19277202. PMCID: PMC2652582.

12. Ramsey G. 1991; Red cell antibodies arising from solid organ transplants. Transfusion. 31:76–86. DOI: 10.1046/j.1537-2995.1991.31191096190.x. PMID: 1986468.

13. Nadarajah L, Ashman N, Thuraisingham R, Barber C, Allard S, Green L. 2013; Literature review of passenger lymphocyte syndrome following renal transplantation and two case reports. Am J Transplant. 13:1594–600. DOI: 10.1111/ajt.12219. PMID: 23617703.

14. Romero S, Solves P, Lancharro A, Cano I, Moscardó F, Carpio N, et al. 2015; Passenger lymphocyte syndrome in liver transplant recipients: a description of 12 cases. Blood Transfus. 13:423–8.
15. Horlait G, Bulpa P, Evrard P. 2013; Passenger lymphocyte syndrome mimicking hemolytic uremic syndrome after lung transplantation. J Heart Lung Transplant. 32:271–2. DOI: 10.1016/j.healun.2012.11.020. PMID: 23265912.

16. Panaro F, DeChristopher P, Rondelli D, Testa G, Sankary H, Popescu M, et al. 2004; Severe hemolytic anemia due to passenger lymphocytes after living-related bowel transplant. Clin Transplant. 18:332–5. DOI: 10.1111/j.1399-0012.2004.00158.x. PMID: 15142057.

17. Sengupta P, Biswas S, Chowdhury S, Nandi AR. 2015; Passenger lymphocyte syndrome in a renal transplant recipient. J Assoc Physicians India. 63:86–8.
18. Berger M, Zeevi A, Farmer DG, Abu-Elmagd KM. 2012; Immunologic challenges in small bowel transplantation. Am J Transplant. 12(Suppl 4):S2–8. DOI: 10.1111/j.1600-6143.2012.04332.x. PMID: 23181675.

19. Prethika PA, Shastry S, Mohan G, Prabhu RA, Nagaraju SP, Rangaswamy D. 2020; Passenger lymphocyte syndrome in a bidirectional ABO-mismatched renal transplant. Asian J Transfus Sci. 14:63–6. DOI: 10.4103/ajts.AJTS_98_19. PMID: 33162710. PMCID: PMC7607991.

20. Rachkewich RA, Crookston MC, Tilley CA, Wherrett JR. 1978; Evidence that blood group A antigen on lymphocytes is derived from the plasma. J Immunogenet. 5:25–9. DOI: 10.1111/j.1744-313X.1978.tb00627.x. PMID: 641356.

21. Dunstan RA. 1986; Status of major red cell blood group antigens on neutrophils, lymphocytes and monocytes. Br J Haematol. 62:301–9. DOI: 10.1111/j.1365-2141.1986.tb02933.x. PMID: 3511947.

22. Alexandre GP, De Bruyere M, Squifflet JP, Moriau M, Latinne D, Pirson Y. 1985; Human ABO-incompatible living donor renal homografts. Neth J Med. 28:231–4.
23. Kim H, Ko DH. 2020; Transfusion in ABO-incompatible solid organ transplantation. Korean J Blood Transf. 31:70–2. DOI: 10.17945/kjbt.2020.31.1.70.

24. Chung Y, Ko DH, Lim J, Kim KH, Kim H. 2022; Choice of ABO group for blood component transfusion in ABO-incompatible solid organ transplantation: a questionnaire survey in Korea and guideline proposal. Ann Lab Med. 42:105–9. DOI: 10.3343/alm.2022.42.1.105. PMID: 34374356. PMCID: PMC8368232.

Fig. 1
Hb and LDH levels of the patient after renal transplantation. The light blue line indicates postoperative Hb level observed over time, and the orange vertical bars indicate LDH levels (LDH reference range: 119–247 IU/L). Yellow, red, and green arrows indicate transfusion of type-A RBCs, transfusion of type-O RBCs, and therapeutic plasma exchange, respectively.
Abbreviations: Hb, hemoglobin; LDH, lactate dehydrogenase; RBC, red blood cell.
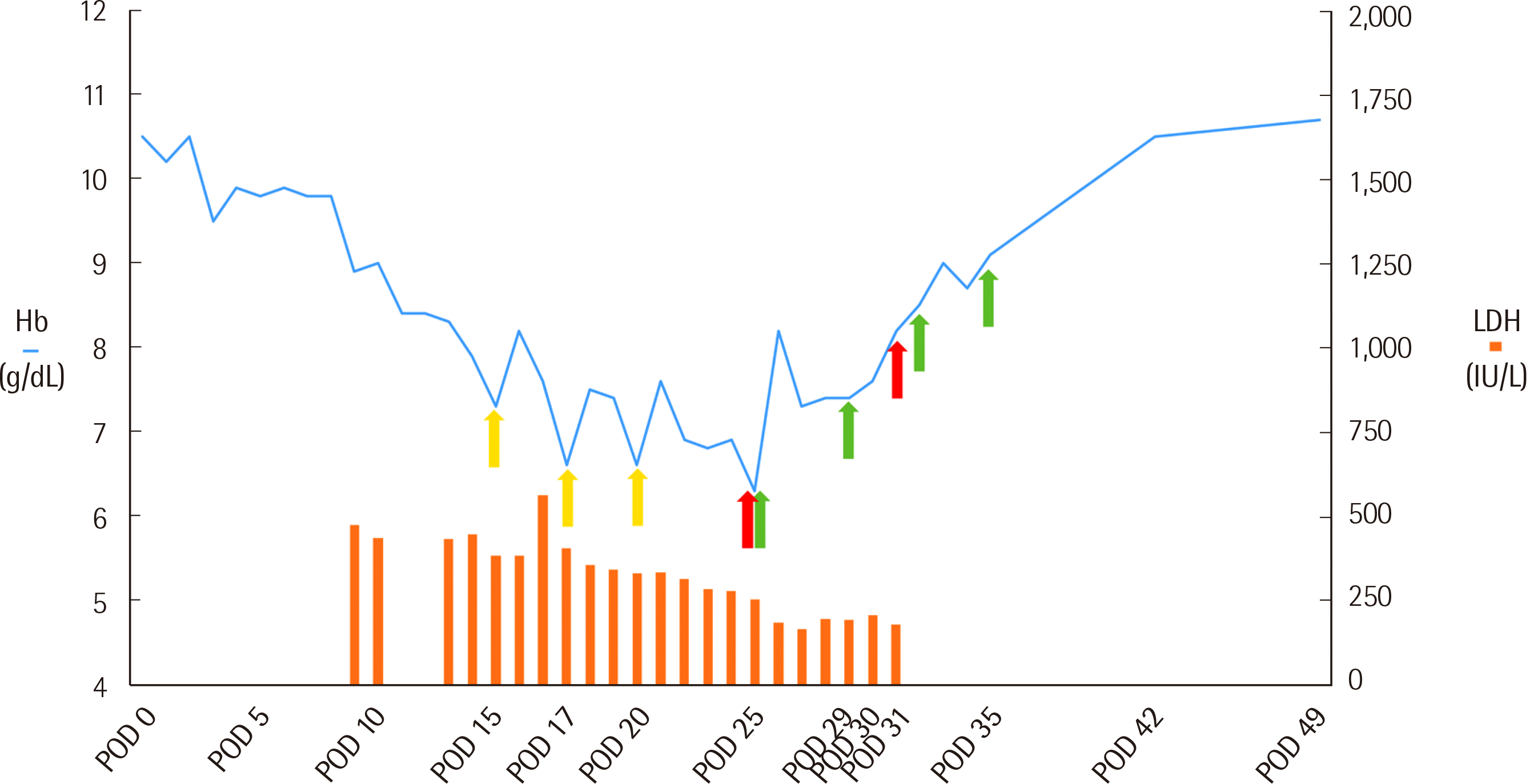
Fig. 2
ABO typing of the patient after renal transplantation. The tests were conducted, and the results were observed using an automated column agglutination technique by VISION Max (Ortho Clinical Diagnostics, Männedorf, Switzerland).
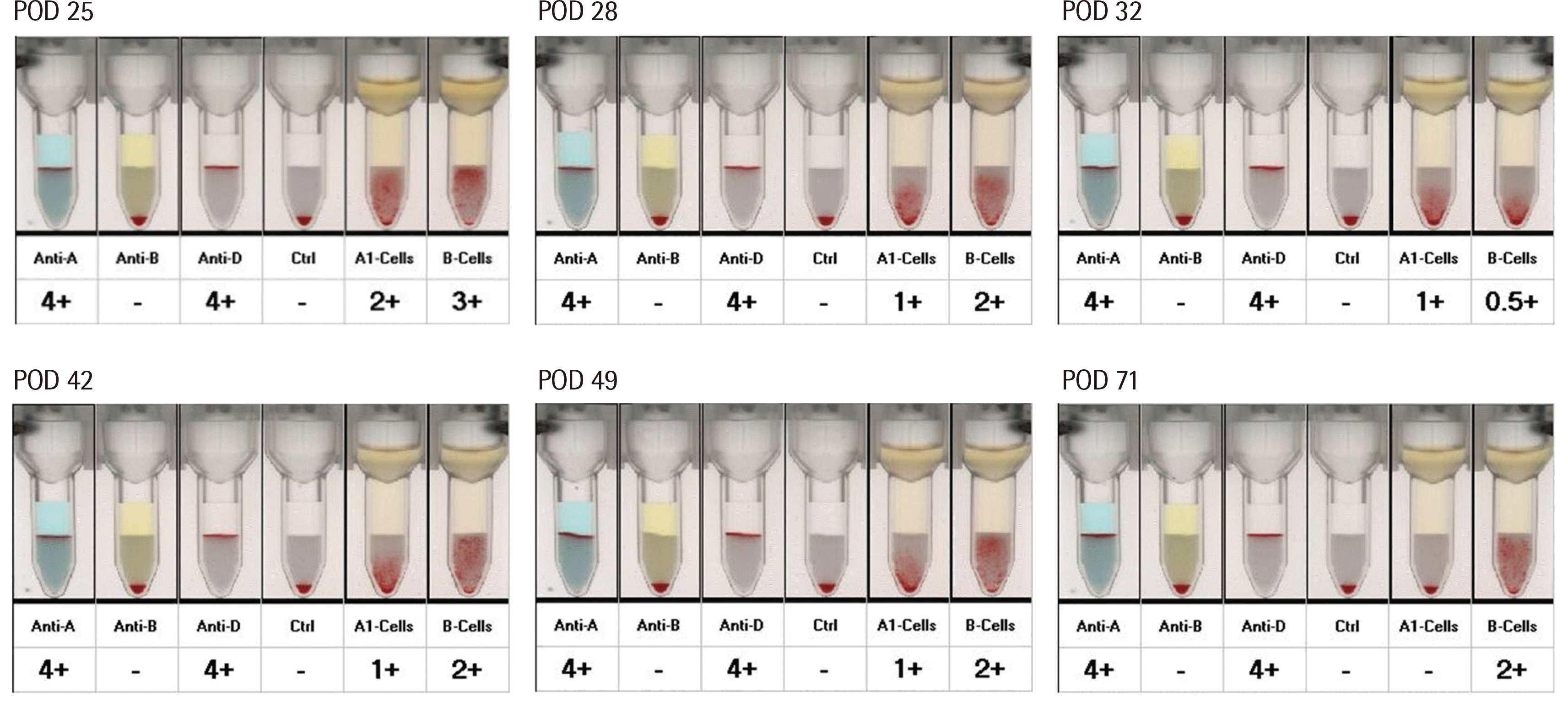
Table 1
Agglutination strengths with A1 cells and anti-A titer results of the patient serum after renal transplantation
| Day | A1 cell | Anti-A (IgM) | Anti-A (IgG) |
|---|---|---|---|
| POD 25 | 2+ | 1:2 | 1:2 |
| POD 28 | 1+ | 1:1 | 1:2 |
| POD 32 | 1+ | 1:1 | < 1:2 |
| POD 42 | 1+ | 1:1 | 1:2 |
| POD 49 | 1+ | 1:1 | 1:2 |
| POD 57 | 2+ | 1:1 | 1:2 |
| POD 71 | - | 1:1 | < 1:2 |
| POD 78 | - | N/T | N/T |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download