초록
국내 체액세포분석 수기검사의 실태조사를 위한 온라인 설문조사에서 종합병원 이상 규모의 76개 기관의 회신을 받았다. 설문 문항은 체액세포분석에 대한 검사 전 단계, 검사 단계, 검사 후 단계(혈구계수기를 이용한 세포수 산정, 세포침전)에 대한 질문을 포함하고 있다. 설문조사 결과 국내 기관마다 체액세포검사의 검사법이 일치하지 않음을 확인하였다. 이를 바탕으로 진단혈액학회 표준화위원회에서는 검사 전 단계(검체 채취 및 이송), 검사 단계(세포계수법, 슬라이드 제작법), 검사 후 단계(보고, 검사소요시간), 정도관리에 대한 임상검사실 지침을 제안하였다. 이 설문조사 결과와 지침이 향후 표준안을 설정하는 바탕이 되어 궁극적으로 환자 진료에 긍정적 영향을 미치게 되길 기대한다.
Abstract
To investigate the current status of body fluid analysis for cellular composition in Korea, an online survey was performed. Responses were received from 76 laboratories of general hospitals in Korea. The questionnaire included questions on pre-analytical, analytical, and post-analytical processes of body fluid cellular analysis (cell count using hemocytometers and cytospin) performed in each laboratory. The survey showed that the body fluid cellular analysis in Korea is not harmonized. Based on this, the “Committee for Standardization in Korean Society for Laboratory Hematology” suggests clinical laboratory guidelines for the pre-analytical (sample collection and handling), analytical (cell count, slide preparation), post-analytical (reporting, turnaround time), and quality control steps. We hope that the results of this survey and guideline will serve as a basis for setting future standards of body fluid cellular analysis in Korea, and ultimately have a positive impact on patient care.
대한진단혈액학회 표준화위원회에서는 2020년도 학회 전문의 회원을 대상으로 희망하는 표준화 사업에 대하여 설문조사를 시행한 바 있다. 희망하는 표준화 사업은 골수검사가 가장 많았으며 그중 대부분은 골수검사 판독 보고서와 관련된 것이었고 해당 주제로 2021년도에 진단검사의학회 학술지인 Laboratory Medicine Online에 보고한 바 있다[1]. 그 다음 순서로 체액세포분석 검사, 출혈/혈전 질환의 진단검사, 유세포검사 등의 순이었다. 체액세포분석 검사는 감염성 질환, 염증성 질환, 출혈, 종양 등의 질병을 진단하는 데에 있어서 중요하다. 특히, 백혈구수의 정확한 감별 계수는 임상적으로 진단과 치료 목표 수립에 중요한 역할을 한다[2, 3]. 자동혈구분석기를 이용한 체액세포검사가 도입되어 국내 현황 조사 및 지침 제안을 위하여 대한진단검사의학회 정도관리위원회 주최로 설문조사 및 학회 발표가 진행된 바가 있으며 국제 혈액학 표준화위원회의 지침을 필두로 많은 연구들이 진행되고 있다[4-6]. 그러나 수기법에 대해서는 국내 어떤 표준안이나 지침 제안 없이 각 검사실 자체적으로 정립되어 있는 방법에 따라 검사가 이루어지고 있는 실정이다. 이에 우선적으로 국내 현황을 파악하기 위하여 설문조사를 진행하였으며 설문조사 결과를 공유하고 추가 체액세포검사의 검체관리와 검사법, 정도관리에 대한 지침을 제안하고자 한다.
연구대상자는 해당 연도 기준 진단혈액학회 회원 중 전문수탁기관은 제외하고, 종합병원 이상에 근무하는 임상검사실 진단혈액 담당 전문의이다. 2021년도 7월 15일에서 8월 25일 총 167명에게 이메일을 발송하여 온라인 설문조사를 실시하였다. 한 기관에서 전문의가 여러 명인 경우, 한 명을 선정하여 보냈으며 총 76기관의 76명(45.5%)에게서 회신을 받았다.
설문은 총 29문항으로 5개의 부분으로 이루어졌다. 첫 번째는 의뢰되는 검체 및 건수에 대한 8문항, 두 번째는 체액세포분석 검사의 처방, 검사용기, 검사소요시간 등 검사의 기본 정보에 대한 7문항, 세 번째는 혈구계를 이용한 세포 수 산정에 관한 8문항, 네 번째는 세포침전(cytospin)에 관한 4문항, 마지막으로 정도관리 2문항으로 구성되었다. 문항을 검사 전 단계, 검사 단계, 검사 후 단계로 나누어 정리하였고 각 문항별 설문 응답 빈도를 분석하고 주관식 질문의 경우 별도로 기술하였다.
월별 평균 검사건수에서 뇌척수액과 흉수는 51-100건이 가장 많았고 그 다음으로 31-50건과 101-300건순이었다(Fig. 1, Supplementary Table 1). 복강액은 1-10건과 51-100건이 가장 많았고 그 다음 31-50건순이었다. 기관지폐포세척액은 1-10건이 가장 많았고 그 다음은 11-20건, 1건 미만순이었고 관절액은 1-10건, 11-20건, 21-30건 등의 순이었다. 심막액은 1-10건이 가장 많았고 그 다음 1건 미만순이었다. 투석액은 각각 22기관에서 1건 미만과 1-10건 동일하게 답변을 주었으며 시행하고 있지 않다고 답변한 기관도 12기관으로 다른 검체들보다 많았다.
체액세포분석 검사의 검사처방, 검사용기 등에 대한 설문과 응답은 Supplementary Table 2에 정리하였다.
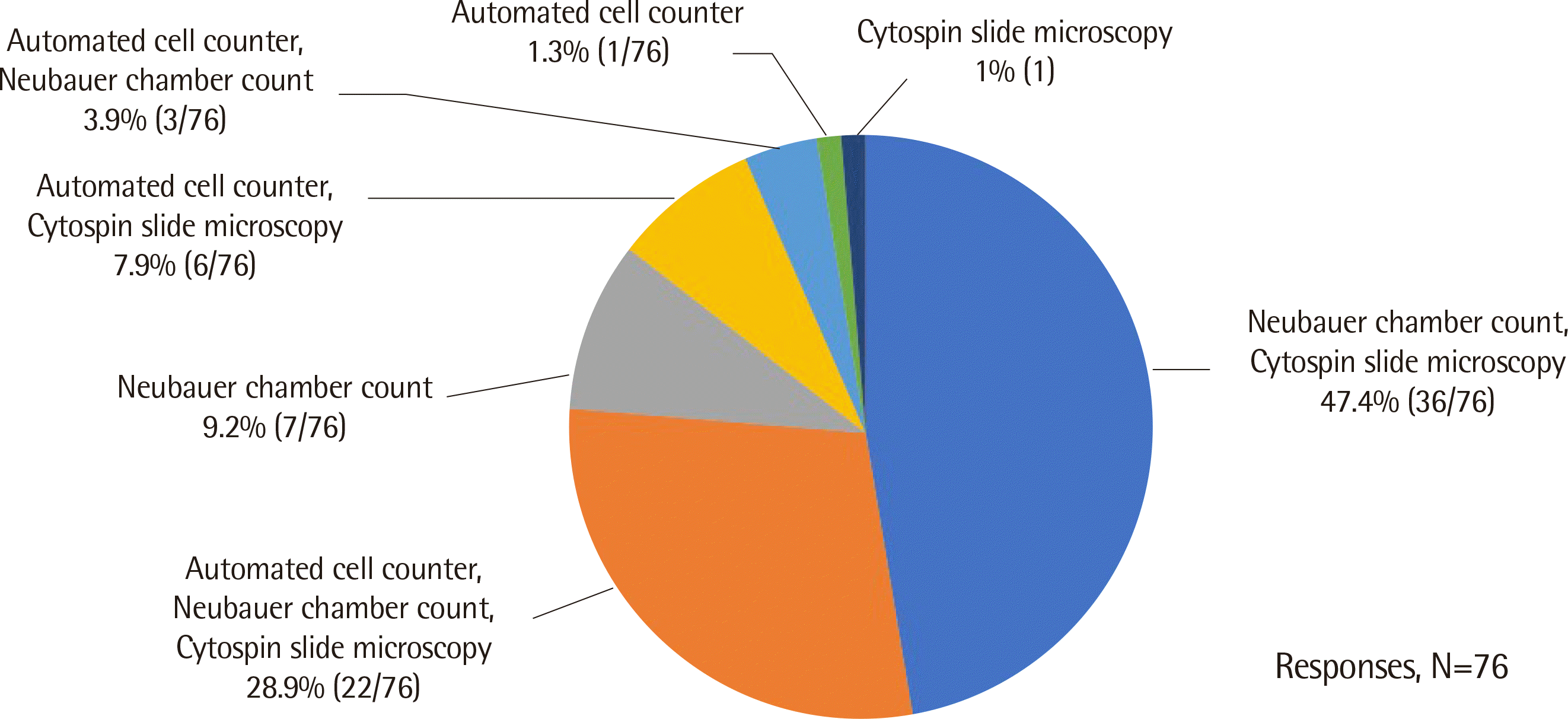
체액세포분석 검사의 처방으로는 건강보험심사평가원[7]의 수가코드 D0326 백혈구백분율(혈액 외), D0327 체액일반검사(뇌척수액, 복수, 늑막액, 관절액 등)(색조, 비중, 세포수, 세포감별계산, 산도), 그리고 D0329 체액염색검경(뇌척수액, 복수, 늑막액, 관절액 등)의 조합을 가장 많이 사용하고 있었다. 검사실에서 시행하고 있는 체액검사의 검사법은 Neubauer 계산 챔버(chamber) 혈구계산 및 세포침전(cytospin) 두 가지를 시행하는 기관이 47.4% (36/76), 자동혈구분석, Neubauer 계산 챔버 혈구계산 및 세포침전, 세 가지 검사법을 시행하는 기관이 28.9% (22/76), Neubauer 계산 챔버 혈구계산만 시행하는 기관이 9.2% (7/76), 자동혈구분석기 및 세포침전을 시행하는 기관이 7.9% (6/76)이었다. 대부분인 89.5% (68/76)에서 Neubauer 계산 챔버 혈구계산을 시행하고 있었고, 세포침전도 85.5% (65/76)에서 시행하고 있었다(Fig. 2). 자동혈구분석기와 수기법 모두 시행하는 경우 각각의 적응증에 대한 답변은 Table 1과 같았다.
체액검사를 시행하는 용기는 검체에 따라 다르다고 보고한 기관이 50% (38/76)이었으며, 단일 시험관으로는 EDTA 시험관을 사용하는 기관이 44.7% (34/76)로 가장 많았다. 검체에 따라 시험관이 다른 경우, EDTA 시험관을 사용하는 검체의 경우, 흉수(89.7%), 복강액(87.2%), 관절액(87.2%), 심막액(76.9%) 등의 순이었다. 뇌척수액의 경우에는 86.1% (31/38)에서 plain 시험관을 사용한다고 응답하였다. 검체의 거절 기준이 있는 경우가 대부분(91%)이었는데, 응고된 검체, 양이 부족한 검체, 찌꺼기가 있는 검체, 장기간 실온에 방치한 경우 등이 해당되었고 대부분의 기관에서 한 가지 이상의 거절 기준이 있었다.
수기법을 이용한 세포수 산정 방법의 국내현황 설문 및 응답은 Supplementary Table 3에 기술하였다. 검사 전 검체 혼합은 79.2% (57/72)에서 수기 혼합(manual mixing)을 시행하고 있었으며 16.7% (12/72)에서 자동 혼합기(automated mixer)를 사용하고 있었고 4% (3/72)에서는 두 가지 방법 모두를 사용 중인 것으로 응답하였다. 희석액은 97% (70/72)에서 사용 중이었으며 생리식염수(normal saline) (81%)를 가장 많이 사용하고 있었다. 용혈제는 81% (56/69)에서 사용 중인 것으로 응답하였으며 아세트산(acetic acid) (23%), Turk’s 용액(14%), 빙초산(glacial acetic acid) (13%), 염산(hydrochloric acid) 용액(13%) 등을 사용하고 있었다.
희석 전 유핵세포를 계수하는 Neubauer 계산 챔버의 혈구계수기 영역의 경우 56% (39/70)에서 혈구계수기 모서리에 있는 4개의 큰 사각영역(Fig. 3의 1, 3, 7, 9 영역)에서 계수한다고 응답하였으며, 26% (18/70)의 기관에서 전체 영역을 계수한다고 하였고, 11% (8/70)의 기관에서 세포수에 따라 다르다고 하였다. 유핵세포 측정 부위 선정 시의 예외 기준에 대해서는 38개 기관에서 응답하였으며, 복수응답을 포함하여 47% (18/38)에서 뇌척수액은 전체 영역에서 계수한다고 하였고, 37% (14/38)에서 세포수가 적은 경우 전체 영역에서 계수한다고 하였다. 희석 전 적혈구를 계수하는 혈구계수기 영역의 경우 33% (23/70)에서 혈구계수기 중앙부 큰 사각 영역(Fig. 3의 5 영역)에서 계수한다고 응답하였으며, 30% (21/70)에서 중앙부 큰 사각영역 내의 5개의 작은 사각영역(Fig. 3의 A, B, C, D, E 영역)에서 계수한다고 하였고, 17% (12/70)에서 전체 영역에서 계수한다고 하였다. 적혈구 측정 부위 선정 시의 예외 기준에 대해서는 24개 기관에서 응답하였으며, 복수응답을 포함하여 21% (5/24)에서 뇌척수액은 전체 영역에서 계수한다고 하였고, 33% (8/24)에서 세포수가 적은 경우 전체 영역에서 계수한다고 하였다.
세포 감별계산 시 슬라이드 제작은 60% (43/72) 및 15% (11/73)의 기관에서 각각 세포침전 및 직접도말(direct smear)을 시행하고 있었으며, 25% (18/72)에서는 세포침전 및 직접도말을 모두 사용하고 있었다. 세포 감별계산 슬라이드 제작의 예외 기준은 기관마다 상이하였는데, 78% (31/40)에서는 유핵세포가 각 검사실별 설정한 세포수 미만인 경우 세포 감별계산을 시행하지 않아 슬라이드를 제작하지 않는다고 응답하였으며, 그 중 유핵세포가 10개 미만인 경우 세포 감별계산을 위한 슬라이드를 제작하지 않는 기관이 71% (22/31)로 가장 많았다. 또한 18% (7/40)에서는 모든 검체에 대해 슬라이드를 제작한다고 응답하였으며, 8% (3/40)에서는 모든 뇌척수액에 대해 세포침전을 시행하여 세포 감별계산 슬라이드를 제작한다고 하였다.
세포침전 도말(cytospin slide)을 시행하는 기관을 대상으로 하였고 총 64기관이 설문에 참여하였다. 설문과 응답은 Supplementary Table 4에 기술하였다. 세포침전 원심분리 조건에 대하여 51개 기관에서 상대원심력(relative centrifugal force, g-force) 단위와 시간을 응답하였다. 응답 중 상대원심력의 범위는 28-3,041 g, 시간의 범위는 2-10분이었으며, 100 g 미만, 2-5분 사이로 원심을 시행하는 검사실이 27.5% (14/51)로 가장 많았다. 세포침전에서 악성 세포가 의심될 경우 추가검사를 시행하는지에 대해서는 21.9% (14/64)의 기관에서 시행한다고 응답하였다. 악성 세포가 의심될 경우, 어떤 추가검사를 시행하는지에 대해서는 특수염색을 시행하는 기관이 11기관으로 가장 많았으며, 특수염색 중에서는 periodic acid-Schiff (PAS) 염색을 시행하는 경우가 9기관으로 제일 많았다.
① 혈구계수기를 이용한 세포수 산정
혈구계수기를 이용한 세포수 산정 검사에서 보고하는 항목에 대해서 73기관에서 응답하였는데 응답한 모든 기관에서 세포 계수(cell count) 및 감별계산(differential count)을 시행한다고 하였으며, 수소이온농도지수(pH), 색(color), 비중(specific gravity), 혼탁도(turbidity)의 경우 일부 기관에서 보고한다고 하였다(Supplementary Table 3). 감별계산을 시행하는 경우 보고하는 항목에 대해서는 84.9% (62/73)의 기관에서 림프구(lymphocyte), 67.1% (49/73)에서 호산구(eosinophil), 60.3% (44/73)에서 중성구(neutrophil), 60.3% (44/73)에서 단구(monocyte) 항목을 보고한다고 하였으며 각 기관마다 보고하는 항목에서 매우 다양한 결과를 보였다. 87.3% (62/71)의 기관에서 악성세포가 의심될 경우 보고한다고 응답하였다. 악성세포의 가능성을 보고하는 방식은 결과 코멘트에 악성세포의 가능성을 기술하는 경우가 56.5% (35/62), 별도로 악성세포 보고 항목이 존재하는 경우가 43.5% (27/62)였다.
② 세포침전
세포침전에서 보고하는 항목에 대해서 64개 기관이 응답하였으며, 96.9% (62/64)의 기관에서 림프구, 93.8% (56/64)에서 호산구, 87.5% (56/64)에서 중성구, 78.1% (50/64)에서 단구, 76.6% (49/64)에서 대식세포(macrophage), 70.3% (45/64)에서 호염기구, 64.1% (41/64)에서 중피세포 항목을 보고한다고 하였다(Supplementary Table 4). 세포침전에서 악성세포가 의심될 경우 96.9%의 기관 (62/64)에서 이를 보고한다고 응답하였다. 악성세포의 가능성을 보고하는 방식에 대해서는 별도로 보고항목이 존재하는 경우가 50.0% (31/62), 결과 코멘트에 악성세포의 가능성을 기술하는 경우가 50.0% (31/62)였다.
검사를 즉시 시행하지 못하는 경우, 검사를 1시간 이내에 보고하는 기관이 48.7% (37/76), 2시간 이내 보고하는 기관이 21.1% (16/76), 이외에 즉시 시행(3.9%)이나 4시간(3.9%), 24시간(2.6%)이라고 답한 곳도 있었다(Supplementary table 2). 검사/검체에 따라 다르다고 답변한 기관은 19.7% (15/76)였다. 검사 소요 시간의 경우, 2시간 이내가 22.4% (17/76), 24시간 이내가 17.1% (13/76), 1시간 이내가 15.8% (12/76), 4시간이 5.3% (4/76), 이외에 설정 안 된 기관 3.9% (3/76)와 기타 의견이 있었다. 검사/검체에 따라 다른 경우는 27.6% (21/76)였다.
설문조사 결과 69.7% (53/76)의 기관에서 체액세포분석 검사의 내부정도관리를 시행하고 있다고 답하였다(Table 2). 내부정도관리로 검사자 간 비교를 수행하는 경우가 36.8% (28/76)로 가장 많았으며 수행 주기는 월 1회부터 연 1-2회까지 다양한 답변을 보였다. 체액세포분석 검사에 자동혈구분석기를 사용하는 경우 자동혈구분석기 체액전용 정도관리물질을 이용하여 일 1회 내부정도관리를 시행하는 기관이 23.7% (18/76)였다. 그 외에 희석액, 용혈제 및 염색제 등 시약 관리(14.5%, 11/76), 굴절계 관리(10.5%, 8/76), 배경신호 점검(background check) (5.3%, 4/76), 병리과 결과 및 임상양상과 판독결과를 비교(5.3%, 4/76), 원심분리기 점검(1.3%, 1/76) 순으로 답하였다. 외부정도관리의 경우 75.0% (57/76)에서 외부정도관리 프로그램에 참여한다고 답하였고, 대한임상검사정도관리협회의 신빙도 조사사업에 참여하는 기관이 68.4% (52/76)로 가장 많았으며 The College of American Pathologists (CAP) survey에 참여하는 곳이 15.8% (12/76)였다. 타 기관과 비교하는 경우가 2.6% (2/76)였다.
설문 결과, 혈구계 이용 세포수 산정 및 감별계산, 세포침전 도말의 검사법, 검사 보고 방법, 정도관리 등이 다양하게 이루어지고 있으며 처방에서부터 표준화가 이루어지지 않고 있다는 것을 확인할 수 있었다. 체액세포분석 검사 처방으로는 검사와 수가코드를 매칭할 수 있는 설문을 시행하지 못하여 제안에 한계가 있으나 검사는 체액일반검사와 세포침전검사+백혈구 감별계산 또는 체액일반검사+백혈구 감별계산과 세포침전검사로 구성하는 것이 적합할 것으로 생각된다. 세포침전은 D0329 체액염색검경(뇌척수액, 복수, 늑막액, 관절액 등) 또는 C5627 체액 세포병리검사(주: 1. Cyto-centrifuge를 이용한 경우) 코드를 사용하는 것으로 보인다. 국내 76기관의 체액세포분석 수기법 설문조사를 바탕으로 진단혈액학회 표준화위원회에서는 체액세포분석 수기법의 임상검사실 지침을 검사 전 단계, 검사 단계, 검사 후 단계 및 정도관리로 나누어 제안하고자 한다.
체액 검체의 경우, 항응고제에 따라 결과에 영향을 줄 수 있어 적절한 것을 사용해야한다[8, 9]. 세포계수, 감별계산 및 형태학적 판독을 위해서, 뇌척수액의 경우, 혈관손상(traumatic tap)이 아니라면 plain 시험관을 사용할 수 있다. 장액(serous fluid)은 EDTA 시험관을 이용하여 세포계수 및 감별계산이 필요하고 24시간 이내에 냉장된 검체로 검사를 시행할 수 있다. 윤활액(synovial fluid)의 경우에는 국내 대부분의 기관에서 답한 EDTA 시험관 또는 리튬 헤파린 시험관을 사용할 수도 있고 옥살레이트(oxalate) 시험관은 칼슘옥살레이트 결정이 생길 수 있어 사용하지 말아야 한다[8]. 뇌척수액, 장액은 실온에서 운반하여 최대한 빨리 검사를 시행하는 것이 좋으며 윤활액, 기관지세척액의 경우도 실온에서 운반하고 기관지세척액의 경우 3시간 이내에 세포 계수, 감별계산을 시행하는 것이 좋다. 검사 결과에 영향을 줄 수 있으므로 검사 전에 검체 상태를 확인하고 시행하는 것이 중요하다[10].
혈구계수 전에 자동 혼합기나 수기로 검체를 혼합하도록 한다[8]. 다양한 희석액을 사용할 수 있으며 생리식염수는 적혈구 및 백혈구 희석에 사용할 수 있고 아세트산이나 저장성 식염수의 경우 적혈구 용혈을 일으켜 백혈구 희석에 사용할 수 있다[8]. 혈구계수기를 이용한 유핵세포수의 산정은 세포수에 따라 달리 적용하는 것이 권장된다[3, 8, 9]. 혈구계수기의 9개의 큰 사각영역에 200개 미만의 세포가 존재하는 경우 9개의 큰 사각영역에 있는 세포를 모두 계수하며, 9개의 큰 사각영역에서 200개 이상의 세포가 존재하는 경우에는 모서리에 있는 4개의 큰 사각영역(Fig. 3의 1, 3, 7, 9 영역)에 존재하는 세포를 계수하는 것이 권장된다. 적혈구의 수는 중앙부 큰 사각영역 내의 5개의 작은 사각영역(Fig. 3의 A, B, C, D, E 영역)에서 계수하여 산정하는 것이 권장된다[8]. 혈구계수기의 사각영역에 존재하는 세포수에 따라 유핵세포와 적혈구 모두 같은 기준을 적용하는 방법도 있다(Table 3) [11].
체액검사의 내부정도관리를 위해 체액세포분석 검사에 사용하는 시약 및 기구를 주기적으로 관리해야한다. 혈구계수기, 현미경 및 굴절계는 시각적으로 깨끗하고, 스크래치, 먼지 혹은 찌꺼기 등이 없도록 관리한다. 체액 희석 시 검증된 파이펫이나 희석 장비를 사용하며 주기적으로 관리한다. 희석액은 무균적으로 준비되어야 하며 세균 오염을 막기 위해 냉장 보관해야 하고 주기적으로 희석액의 오염 여부를 확인한다[15]. 희석액의 배경신호 점검을 시행한다. 수기로 희석할 경우 매일 확인하고 장비를 사용할 경우 장비의 정도관리 주기를 따른다. 체액 세포수 감별계산의 내부정도관리를 위해 적어도 하나의 정도관리 물질을 2회 반복 분석하거나 8시간 간격으로 분석한다. 측정값 간 일치도의 한계는 검사실마다 자체 설정할 수 있으며 사용 가능한 정도관리 물질은 이전에 검사한 환자 검체 혹은 표준화되고 검증된 방법으로 도말, 염색한 슬라이드의 세포수와 상관성을 보이는 물질이어야 한다[16]. 체액세포 검사의 외부정도관리를 위해 외부정도관리 프로그램에 참여해야 한다. 외부정도관리 프로그램에 참여하지 않을 경우 대체할 수 있는 프로그램을 마련하여 실행한다. 환자 검체를 6개월마다 다른 검사실과 동시에 비교하는 방법, 병원 내에서 시행하는 다른 방법과 비교(자동화 장비 결과와 비교), 의무기록을 검토하여 임상적 타당성을 검증하는 방법 등이 있다. 검사자 간 비교를 실시한다고 답한 기관도 있었는데 이는 외부정도관리를 시행하였다고 보기 어렵다.
Supplementary Table 1. Responses to the questionnaires on the number of tests performed per month according to sample types in body fluid cellular analyses
Supplementary Table 2. Responses to the questionnaires on sample preparation for body fluid cellular analysis
Supplementary Table 3. Responses to the questionnaires on manual cell count using hemocytometer in body fluid cellular analysis
Supplementary Table 4. Responses to the questionnaires on cytospin data in body fluid cellular analysis
REFERENCES
1. Bang HI, Kim IS, Park SH, Lee ST, Hwang SM, Huh J, et al. 2021; Standards and guidelines for reporting diagnostic test results in acute leukemia patients: Bone marrow examination, flow cytometry, and cytogenetics/molecular genetics tests. Lab Med Online. 11:1–10. DOI: 10.47429/lmo.2021.11.1.1.

2. Fleming C, Russcher H, Lindemans J, de Jonge R. 2015; Clinical relevance and contemporary methods for counting blood cells in body fluids suspected of inflammatory disease. Clin Chem Lab Med. 53:1689–706. DOI: 10.1515/cclm-2014-1247. PMID: 25879321.

3. Kim JM. Chi HS, editor. 2013. Specimen preparation and total cell counts. Atlas of diagnostic cytology. Seoul: Panmuneducation;p. 1–11.
4. Bourner G, De La Salle B, George T, Tabe Y, Baum H, Culp N, et al. 2014; ICSH guidelines for the verification and performance of automated cell counters for body fluids. Int J Lab Hematol. 36:598–612. DOI: 10.1111/ijlh.12196. PMID: 24628711.

5. Koo MS, Lim J, Kim SY, Koo SH, Kwon GC. 2019; Comparison of red blood cell, white blood cell and differential counts between UF-5000 system and manual method. J Lab Med Qual Assur. 41:172–8. DOI: 10.15263/jlmqa.2019.41.3.172.

6. Cho J, Oh J, Lee SG, Lee YH, Song J, Kim JH. 2020; Performance evaluation of body fluid cellular analysis using the Beckman Coulter Unicel DxH 800, Sysmex XN-350, and UF-5000 automated cellular analyzers. Ann Lab Med. 40:122–30. DOI: 10.3343/alm.2020.40.2.122. PMID: 31650728. PMCID: PMC6822009.

7. Health Insurance Review, Assessment Service. 2021. February 2021 Health Insurance Health Care Benefits. Health Insurance Review and Assessment Service;Wonju:
8. Clinical, Laboratory Standards Institute. 2006. Body fluid analysis for cellular composition; Approved guideline. CLSI guideline H56-A. Clinical and Laboratory Standards Institute;Wayne, PA:
9. Korean Society for Laboratory Medicine. 2021. Specimen preparation and total cell counts. Laboratory medicine. 6th ed. Seoul: Panmuneducation;p. 391–8.
10. Milevoj Kopcinovic L, Culej J, Jokic A, Bozovic M, Kocijian I. 2020; Laboratory testing of extravascular body fluids: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Part I -Serous fluids. Biochem Med (Zagreb). 30:010502. DOI: 10.11613/BM.2020.010502. PMID: 31839720. PMCID: PMC6904973.
11. Hussong JW, Sorensen E, et al. Hussong JW, Kjeldsberg CR, editors. 2015. Laboratory methods. Kjeldsberg's body fluid analysis. Chicago, IL: The American Society for Clinical Pathology;p. 3–30.
12. Jones CD, Cornbleet PJ. 1997; CE Update-Body Fluids I: Wright-Giemsa cytology of body fluids. Techniques for optimal cytocentrifuge slide preparation. Lab Med. 28:713–6. DOI: 10.1093/labmed/28.11.713.

13. Stransinger SK, Di Lorenzo MS, editors. Urinalysis and body fluids. Philadelphia, PA: F. A. Davis;2021. p. 254–9.
14. Pinto D, Chandra A, Crothers BA, Kurtycz DFI, Schmitt F. 2020; The international system for reporting serous fluid cytopathology-diagnostic categories and clinical management. J Am Soc Cytopathol. 9:469–77. DOI: 10.1016/j.jasc.2020.05.015. PMID: 32620534.

15. College of American Pathologists. 2017. Commission on Laboratory Accreditation Program: Hematology-coagulation checklist; 2017. Northfield, IL: College of American Pathologists.
16. Clinical Laboratory Improvement Amendments of 1988. 42 U.S. Code § 263a, Oct. 31, 1988. https://www.govinfo.gov/content/pkg/USCODE-2020-title42/pdf/USCODE-2020-title42-chap6A-subchapII-partF-subpart2-sec263a.pdf.
Fig. 1
Number of body fluid cellular analysis tests per month; of various sample types from 76 clinical laboratories in Korea.
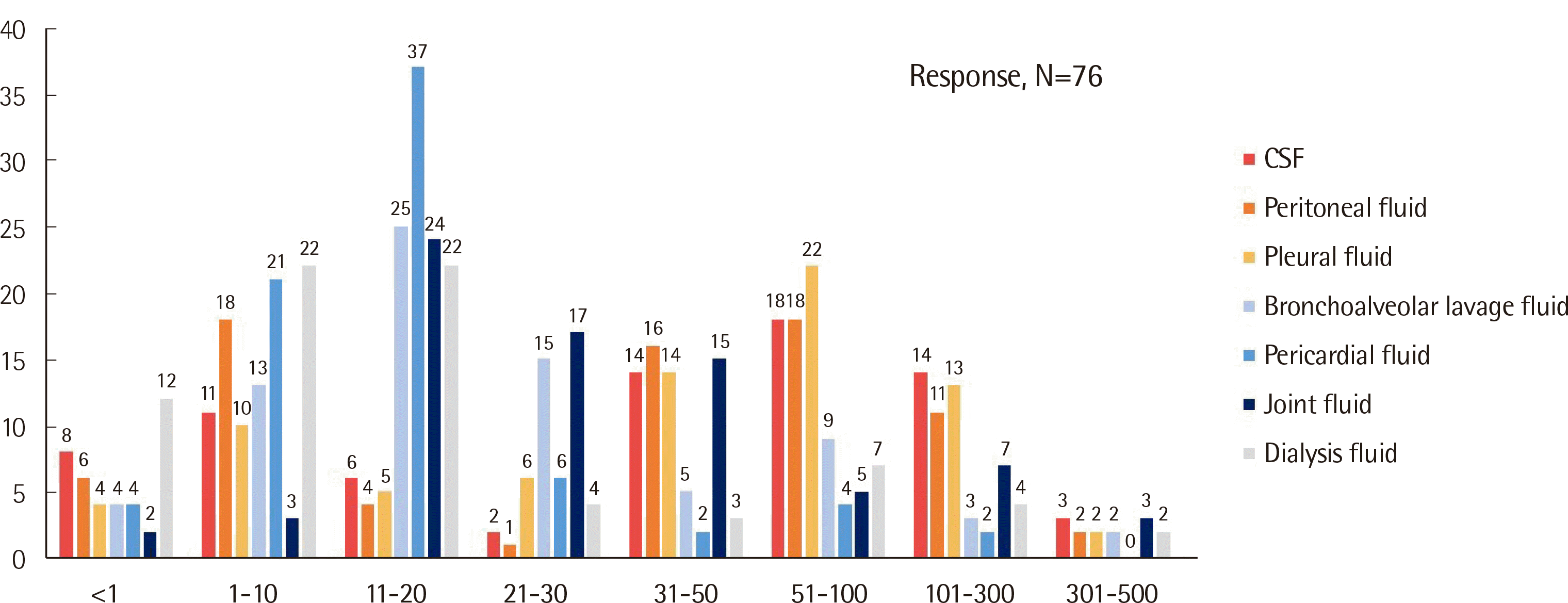
Fig. 3
Schematic diagram of hemocytometer. The hemocytometer is composed of nine large squares, and four squares (labeled as 1, 3, 7, and 9) in the corners are divided into 16 smaller squares. The central square (labeled as 5) is divided into 25 smaller squares, and each is further divided into 16 smaller squares.
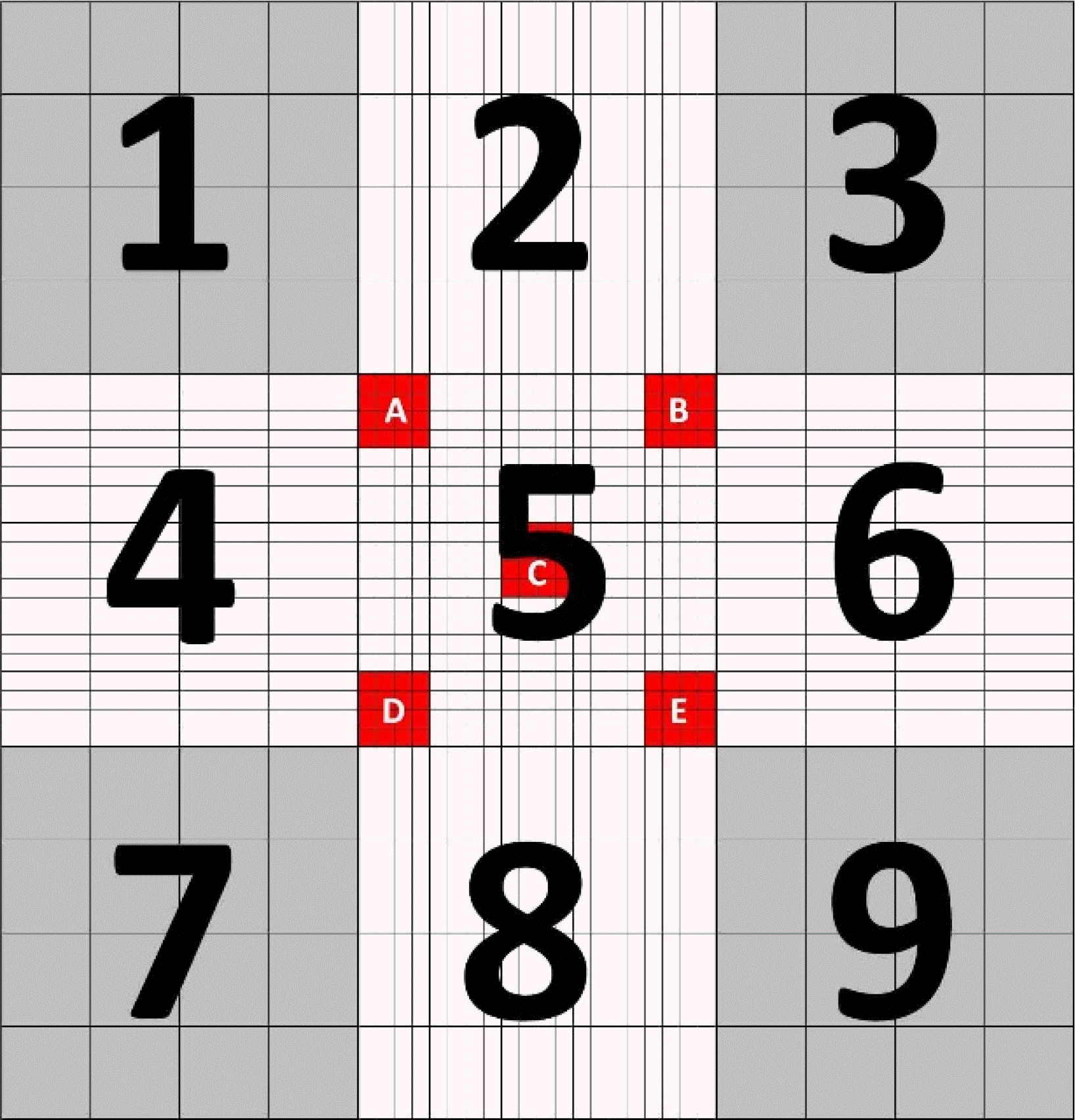
Table 1
Indications and applications of body fluid cellular analysis in laboratories, using both automated cell counting and manual analyses
Table 2
Responses to the questionnaire on quality control (QC) of body fluid cellular analysis
Table 3
Counting of total nucleated and red blood cells based on the cell count readings of the hemocytometer
| Cells per square(s) | Squares counted (see Fig. 3) | Volume counted* |
|---|---|---|
| < 200 in 9 large squares | All 9 squares (1-9) | 0.9 μL |
| ≥ 200 in 9 large squares | 4 corner squares (1, 3, 7, 9) | 0.4 μL |
| ≥ 200 in 1 large square | 5 small squares (A, B, C, D, E) within the central large square | 0.02 μL |
| Overlapping cells | Consider a dilution |
The total cells counted per μL. Total cells/μL=N of cells counted × dilution factor/N of squares counted × volume of each square. Adapted from [8].




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download