Abstract
Objectives
This study aimed to evaluate the effect of silver fluoride (AgF) on the formation of cariogenic biofilm and surface of dentin in vitro.
Methods
Bovine dentin specimens with artificial caries were prepared and divided into 3 groups untreated control, AgF-treated, and silver diamine fluoride (SDF)-treated. Streptococcus mutans cultured in brain heart infusion (BHI) broth was used to induce biofilm. The specimens were placed in a well plate containing BHI broth and S. mutans bacterial suspension, and incubated under aerobic conditions supplemented with 5% CO2 at 37℃ for 24 hours. After the incubation, the specimens were washed twice with phosphate-buffered saline (PBS) and sonicated to obtain a bacterial suspension. The diluted bacterial suspension was then smeared on a blood agar plate and cultured for 72 hours at 5% CO2 and 37℃. Following this, the number of bacterial colony forming units (CFUs) was counted and converted into logarithms for analysis. Additional specimens of each group were observed by scanning electron microscope (SEM). Energy dispersive X-ray spectroscopy (EDS) was also performed for component analysis of the dentin surface.
Results
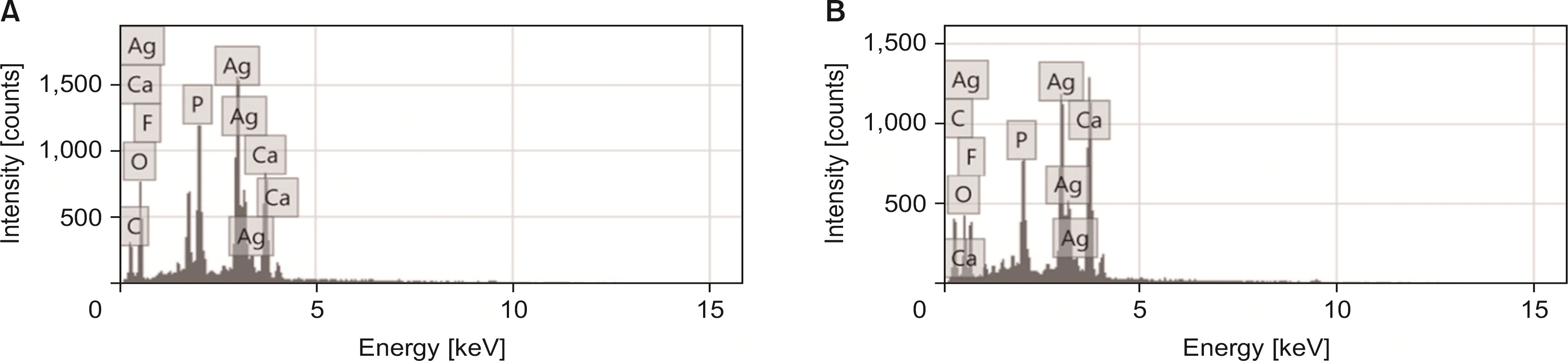
The number of S. mutans bacterial CFUs was significantly lower in the AgF and SDF groups than in the untreated control group. It was shown that SDF inhibited biofilm formation more than AgF; however, there was no statistical significance. The SEM images showed particles formed after AgF and SDF application were deposited on the dentin. It is confirmed through EDS analysis that the particles contained silver and fluoride ions.
치아 우식증의 표준적인 치료 방법은 감염되고 탈회된 조직을 제거하고 수복재료로 채워 넣는 것이지만, 이는 때때로 어려운 과제가 될 수 있다1). 환자의 어린 연령 또는 장애로 인해 적절한 협조를 얻을 수 없는 경우, 치과에 대한 접근성이 떨어지거나 경제적인 어려움이 있는 환자들은 치아 우식증의 치료를 제때 받지 못하는 경우가 있다. 이러한 경우에 대한 대안적인 치료 방법으로 우식 병소에 silver diamine fluoride (SDF)를 도포하는 방법이 제안되었다.
SDF는 은과 불소를 포함하는 무색의 염기성 액체로, 일반적으로 사용되는 38%의 SDF에는 24-28%의 은, 5-6%의 불소가 포함되어 있으며 용액의 안정성을 위해 8%의 암모니아가 함유되어 있다2). 우식 병소에 SDF를 도포하면 은 이온의 항균작용과 불소 이온의 재광화 작용을 통해 우식의 진행을 멈추고 새로운 우식의 발생을 예방할 수 있다.
SDF의 단점으로는 도포 후 치면의 검은색 변색, 용액의 불쾌한 냄새와 치은 자극 등이 있다. 치면의 변색을 해결하기 위해서는 potassium iodide 도포 및 nanosilver의 개발 등의 연구가 진행중이다3,4). SDF 용액에 포함된 암모니아로 인한 냄새와 치은 자극은 일시적이기 때문에 상대적으로 강조되지 않았지만, 이로 인해 치은 격리를 위한 추가적인 과정과 시간이 소요되고 환자의 불편 및 보호자의 불만 등의 문제가 발생하는 것은 임상에서 SDF의 적극적인 사용을 제한하는 요소이다. 이러한 문제 해결을 위해 최근 암모니아를 포함하지 않는 중성 pH의 silver fluoride (AgF) 제제인 Riva Star AquaTM (SDI, Bayswater, Australia)가 개발되었다.
치아우식 병소는 치아의 표면에 자리잡은 성숙한 세균막 하에서 발생하기 때문에 우식 병소에 대한 기계적인 제거 없이 약제의 도포만으로 기존 우식을 정지하고 새로운 우식 형성의 예방을 위해서는 도포하는 약제의 세균막 형성 억제 효과가 필수적이다5). SDF는 오랜 기간 사용되어 오면서 우식 억제 및 예방에 필요한 항균 효과가 증명되었지만, 새로 개발된 AgF의 항균 효과에 대해서는 연구가 미흡한 실정이다.
이 연구는 탈회된 상아질에 도포한 AgF의 세균막 형성 억제 효과를 대표적인 우식원성 세균인 Streptococcus mutans를 이용해 실험실 환경에서 평가하고 이를 SDF의 결과와 비교분석하는 것이다. 또한 두 용액 도포 후 상아질 표면에 발생하는 변화를 현미경으로 관찰하여 분석하고자 한다.
Bovine incisor의 법랑질을 제거하고, 저속의 다이아몬드 디스크를 사용하여 주수 하에 3.0 mm×3.0 mm×2.0 mm 크기로 절단 후 표면을 1000 grit sand paper로 연마하여 상아질 시편을 제작하였다. 상아질 시편의 상면을 관찰하기 위해 시편의 상면을 제외한 면은 silicone (Examixfine injection type, GC corporation, Tokyo, Japan)으로 막아주었다.
상아질 시편 상면에 인공 우식을 유발하기 위해 이전 연구를 참고하여 acetic acid 탈회용액을 제조하였다6). 50 mM acetic acid, 3 mM calcium chloride, 3 mM potassium hypophosphate, 6 mM methylhydroxydiphosphonate를 혼합하여 탈회용액을 제조 후 10% hydrochloric acid와 10 M potassium hydroxide를 이용하여 pH 4.95로 적정한 다음 용액을 0.22 μm vacuum filter system을 이용하여 filtering 방식으로 멸균하였다. 멸균된 탈회용액에 상아질 시편을 넣고 3일간 37℃ 항온수조에 보관하여 상아질 시편 상면의 탈회를 유발하였다.
제작한 시편을 3군으로 나누어 시편의 상면에 각 군당 해당하는 용액을 도포하였다. 1군은 대조군으로 인공 우식을 유발한 상아질 시편을 그대로 사용하였다. 2군은 SDF를 도포한 군으로, Riva StarTM (SDI, Bayswater, Australia)의 38% SDF 1.0 μl를 멸균된 fine-sized microbrush로 10초간 시편에 균일하게 도포한 뒤 3분 후 멸균된 증류수로 세척하였다. 3군은 AgF를 도포한 군으로, Riva Star AquaTM의 25% AgF 1.0μl를 2군과 같은 방식으로 도포 후 세척하였다. SDF의 양은 임상 사용 권고 기준을 참고하여 시편의 크기에 맞게 조정하여 결정하였으며7), AgF의 양은 제조사의 사용 지침을 참고하여 SDF와 동량으로 설정하였다8,9).
S. mutans ATCC 25175 표준 균주를 brain heart infusion (BHI) 액체배지 (BD bioscience, NJ, USA)에 5% CO2가 보충된 37℃의 호기성 조건에서 18시간 동안 배양하였다. 배양 후 분광 광도계(Smart Plus 2700; Young-woo Inst., Seoul, Korea)로 혼탁도를 측정하여 1×109 CFU/ml로 희석하여 S. mutans 현탁액을 제조하였다.
처리한 각 군의 시편을 1% sucrose를 포함하는 BHI 액체배지 1980 μl가 들어있는 12-well plate 하방에 놓고 S. mutans 현탁액 20 μl를 접종 후 5% CO2가 보충된 37℃의 호기성 환경에서 24시간 배양하였다.
24시간 배양한 시편을 phosphate-buffered saline (PBS)으로 2회 세척하고 시편을 10초간 초음파 처리(VC 100, Sonics & Materials Inc., Danbury, CT, USA)하여 세균 부유액을 만들었다. PBS로 희석한 세균 부유액 50 μl를 blood agar plate (Hanil-KOMED, Seongnam, Gyeonggi-do, Korea)에 도말하여 72시간 배양하였다. 배양된 각 세균의 colony-forming unit (CFU)을 관찰하여 측정된 각 세균의 수를 log10CFU 값으로 변환하여 분석하였다.
AgF는 1970년대 초반 사용되기 시작했으며, Craig 등10)은 소아의 유치 및 영구치 우식 병소에 40%의 AgF를 도포하여 효과적인 결과를 보고했다. 과거에는 AgF 용액 도포 후에 환원제인 불화주석을 추가로 도포해야 하는 과정이 필요하여 번거로웠으며, 불안정한 상태인 AgF 용액의 관리 역시 어려워 점차 사용 빈도가 줄어들게 되었다1). 최근 개발된 중성 pH의 AgF인 Riva Star AquaTM는 이와 같은 불편을 해소했으며 치은 자극이 없어 임상에서 더욱 쉽게 사용할 수 있다는 장점이 있다11,12).
이 연구에서 SDF와 AgF 모두 S. mutans 세균막 형성을 효과적으로 억제했다. Patel 등13)은 Riva starTM의 38% SDF에 36,457 ppm의 불소와 415,443 ppm의 은 이온이 포함되어 있다고 보고했다. 은 이온은 세균의 대사 및 생식 경로를 저해해 세포 사멸을 유발할 수 있으며, S. mutans 다당류 합성 과정에서 glucosyl 및 fructosyl 전이효소 활성을 억제하여 S. mutans의 치면 부착을 저해한다2,14). 고농도의 불소는 세균의 세포 구성 요소에 결합해 탄수화물 대사 및 당 흡수와 관련된 효소에 영향을 주어 세균막 형성을 억제할 수 있다4). 이 연구에서 사용된 Riva star aquaTM의 25% AgF는 38% SDF보다 불소와 은 이온의 함량이 낮지만 이번 실험의 결과 충분한 세균막 형성 억제 효과를 보였다.
통계적으로 유의한 차이는 없었지만 AgF의 S. mutans 세균막 형성 억제 효과는 SDF보다 적었다. 앞서 언급한 두 용액의 은과 불소 함량의 차이 외에도 두 용액의 pH 차이가 결과에 영향을 주었을 수 있다. SDF 용액은 pH 9-10의 염기성 용액이며 탈회된 상아질에 SDF가 침투하면 그 부위를 알칼리성 환경으로 만든다15). 알칼리성 환경은 교원질 분해효소를 비활성화 시키고 인산염과 교원질 사이의 공유결합 형성을 촉진하여 탈회된 상아질의 재광화를 촉진하게 되는데, 상아질 표면이 재광화되면 표면이 부드러워져서 세균의 부착을 저해할 수 있다13,15,16). 또한 Nakajo 등17)은 S. mutans의 세균막이 알칼리성 환경에 취약하다고 보고한 바 있다.
상아질 표면을 주사전자현미경과 EDS 분석을 통해 관찰한 결과, SDF와 AgF 도포 시 상아질 표면에 은과 불소 이온을 포함하는 입자가 생성되어 상아세관을 막고 있는 것이 관찰되었다. 은과 불소 이온의 항균효과와 함께, 용액 도포 후 표면에 축적되는 입자가 상아세관을 효과적으로 봉쇄하여 세균막의 형성을 억제할 수 있을 것으로 생각된다18).
이 연구는 실험실 환경의 연구이기 때문에 실제 구강 환경을 정확히 반영할 수 없었다는 것과 단기간의 연구라는 한계점이 있다. 대표적인 우식원성 세균을 사용하여 효과를 평가한 데에는 의의가 있으나 실제 구강 환경은 더 많은 세균들이 상호작용하고 있으며 다양한 자극들이 전해지는 곳이므로 본 연구의 결과와 차이가 있을 수 있다. 또한 AgF 도포의 효과에 대한 장기적인 추가 연구가 필요하다.
References
1. Shah S, Bhaskar V, Venkatraghavan K, Choudhary P, Trived K. 2014; Silver diamine fluoride: a review and current applications. J Adv Oral Res. 5:25–35. DOI: 10.1177/2229411220140106.

2. Crystal YO, Marghalani AA, Ureles SD, Wright JT, Sulyanto R, Divaris K, et al. 2017; Use of silver diamine fluoride for dental caries management in children and adolescents, including those with special health care needs. Pediatr Dent. 39:135E–145E. PMID: 32074885.
3. Roberts A, Bradley J, Merkley S, Pachal T, Gopal JV, Sharma D. 2020; Does potassium iodide application following silver diamine fluoride reduce staining of tooth? A systematic review. Aust Dent J. 65:109–117. DOI: 10.1111/adj.12743. PMID: 31900927.

4. Zhao IS, Yin IX, Mei ML, Lo ECM, Tang J, Li Q, et al. 2020; Remineralising dentine caries using sodium fluoride with silver nanoparticles: an in vitro study. Int J Nanomedicine. 15:2829–2839. DOI: 10.2147/IJN.S247550. PMID: 32368057. PMCID: PMC7185692.
5. Strużycka I. 2014; The oral microbiome in dental caries. Polish J Microbiol. 63:127–135. DOI: 10.33073/pjm-2014-018. PMID: 25115106.

6. Schwendicke F, Eggers K, Meyer-Lueckel H, Dörfer C, Kovalev A, Gorb S, et al. 2015; In vitro Induction of residual caries lesions in dentin: comparative mineral loss and nano-hardness analysis. Caries Res. 49:259–265. DOI: 10.1159/000371897. PMID: 25832626.

7. Horst JA, Ellenikiotis H, Milgrom PM. 2016; UCSF protocol for caries arrest using silver diamine fluoride: rationale, indications, and consent. J Calif Dent Assoc. 44:16–28. DOI: 10.1038/sj.bdj.2017.311. PMID: 26897901. PMCID: PMC4778976.
8. SDI. Riva star aqua [Internet]. Available from: https://www.sdi.com.au/pdfs/instructions/au/riva%20star%20aqua%20Bottle_sdi_ininstructio_au.pdf. cited 2022 Sep 23.
9. SDI. Riva star [Internet]. Available from: https://www.sdi.com.au/pdfs/instructions/au/riva%20star%20Bottle_sdi_instructions_au.pdf. cited 2022 Sep 23.
10. Craig GG, Powell KR, Cooper MH. 1981; Caries progression in primary molars: 24-month results from a minimal treatment programme. Community Dent Oral Epidemiol. 9:260–265. DOI: 10.1111/j.1600-0528.1981.tb00342.x. PMID: 6955124.

11. Turton B, Horn R, Durward C. 2021; Caries arrest and lesion appearance using two different silver fluoride therapies on primary teeth with and without potassium iodide: 12-month results. Clin Exp Dent Res. 7:609–619. DOI: 10.1002/cre2.367. PMID: 33370847. PMID: 44bc3123351e42f8bbb5b287f2e5d953.

12. SDI. Riva star aqua [Internet]. Available from: https://www.sdi.com.au/wp-content/uploads/2021/04/2021-August-Jarod-Johnson-DPR-Riva-Star-Aqua.pdf. cited 2022 Aug 09.
13. Patel J, Foster D, Smirk M, Turton B, Anthonappa R. 2021; Acidity, fluoride and silver ion concentrations in silver diamine fluoride solutions: a pilot study. Aust Dent J. 66:188–193. DOI: 10.1111/adj.12822. PMID: 33450061.

14. Takahashi M, Matin K, Matsui N, Shimizu M, Tsuda Y, Uchinuma S, et al. 2021; Effects of silver diamine fluoride preparations on biofilm formation of Streptococcus mutans. Dent Mater J. 40:911–917. DOI: 10.4012/dmj.2020-341. PMID: 33731542.

15. Manuschai J, Talungchit S, Naorungroj S. 2021; Penetration of Silver Diamine Fluoride in Deep Carious Lesions of Human Permanent Teeth: An In Vitro Study. Int J Dent. 2021:3059129. DOI: 10.1155/2021/3059129. PMID: 34976061. PMCID: PMC8716243. PMID: eb6503ed12d845128c5cb773a955c877.

16. Jia L, Tao S, Yang J, Liang K, Yu Z, Gao Y, et al. 2021; Adhesion of Streptococcus mutans on remineralized enamel surface induced by poly (amido amine) dendrimers. Colloids Surf B Biointerfaces. 197:111409. DOI: 10.1016/j.colsurfb.2020.111409. PMID: 33147567.
17. Nakajo K, Komori R, Ishikawa S, Ueno T, Suzuki Y, Iwami Y, et al. 2006; Resistance to acidic and alkaline environments in the endodontic pathogen Enterococcus faecalis. Oral Microbiol Immunol. 21:283–288. DOI: 10.1111/j.1399-302X.2006.00289.x. PMID: 16922926.

18. Hamama HH, You CK, Burrow MF. 2015; Effect of silver diamine fluoride and potassium iodide on residual bacteria in dentinal tubules. Aust Dent J. 60:80–87. DOI: 10.1111/adj.12276. PMID: 25721282.

Fig. 1
The mean and standard deviation of bacterial counts of Streptococcus mutans expressed as log10CFU/ml. *Statistically significant compared to control group (P<0.05). SDF: silver diamine fluoride, AgF: silver fluoride.
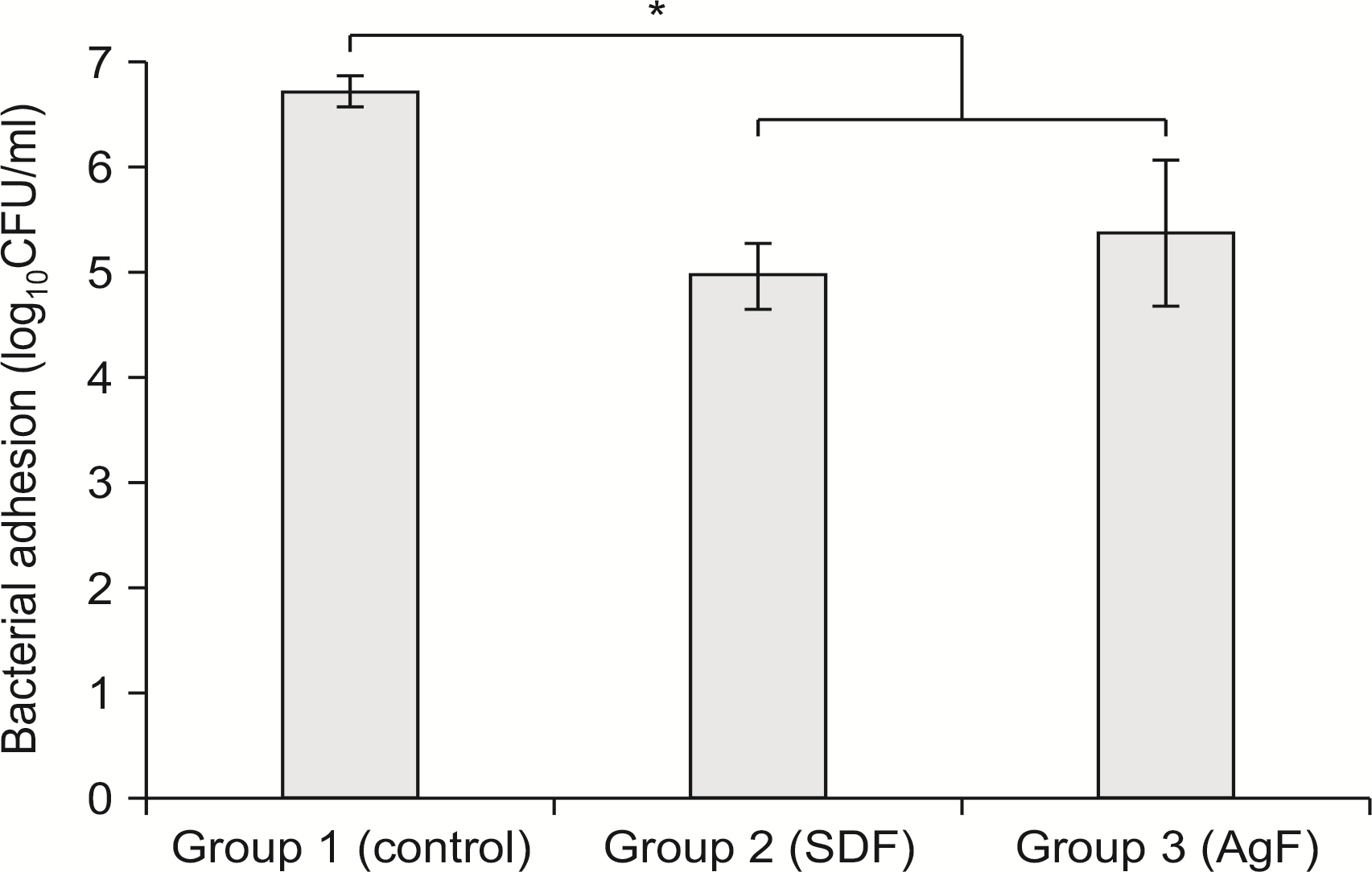
Fig. 2
Scanning electron microscope images of dentin specimen (×1,000). (A) Control, (B) silver diamine fluoride application, (C) silver fluoride application.

Fig. 3
Energy dispersive X-ray spectroscopy analysis of dentin specimen. (A) Silver diamine fluoride application, (B) silver fluoride application.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download