Abstract
Purpose
To evaluate the correlation between the fibrillar pattern of the Achilles tendon on ultrasonography (US) and functional outcomes in patients who underwent open tendon repair after Achilles tendon rupture.
Methods
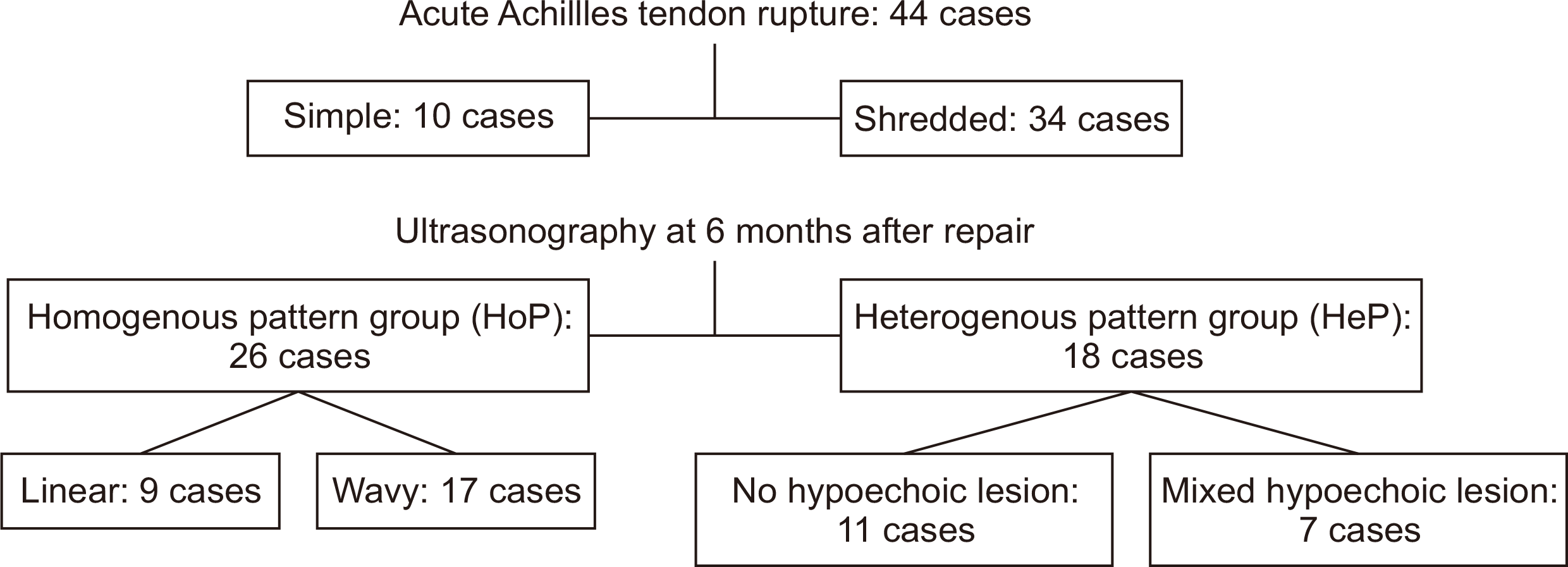
Materials and Data of 44 patients who had been subjected to US at least 6 months after repair, during the period between July 2012 and July 2019 were reviewed. Those with bilateral tendon rupture, re-rupture, open injury, and chronic or insertional rupture, were excluded from the review. We divided them into two groups, the homogenous group (HoP) and the heterogenous group (HeP) based on the fibrillar pattern on US. We also divided the HoP into linear and wavy subgroups, and the HeP into no hypoechoic lesion and hypoechoic lesion subgroups. The rupture type of the Achilles tendon, radiographic factors including US and magnetic resonance images, patient-related, surgical factors, and clinical results at the last visit after repair were assessed retrospectively.
Results
The tendon thickness was 11.4±1.7 mm in the HoP, and 14.5±3.0 mm in the HeP (p<0.001). A shredded pattern was observed in 17 cases (65.4%) in the HoP, and in 17 cases (94.4%) in the HeP (p=0.031). The mean value of the number of sutures used was 8.9±3.05 in the HoP and 11.39±1.75 in the HeP (p=0.001). The mean value of the difference in calf circumference was 0.9±0.67 cm in the HoP and 1.36±0.71 cm in the HeP (p=0.037). There were no statistically significant differences in the fibrillar patterns and patient-related factors.
Conclusion
The fibrillar pattern observed after repair was correlated with the functional outcome and showed a significant relationship with the rupture pattern and the number of sutures used. Therefore, we suggest a careful individualized postoperative rehabilitation protocol to maximize functional outcomes by referring to the fibrillar pattern in US, especially in shredded ruptures.
아킬레스건 파열은 가장 흔한 건 파열이며 배드민턴, 배구, 그리고 축구 등과 같은 높은 활동을 요구하는 운동에서 주로 발생하고 그 발병률이 높아지고 있다.1) 아킬레스건 파열은 임상 소견, 신체 진찰, 영상의학적 검사를 통해서 진단을 내릴 수 있으며 영상의학적 검사로 초음파 검사가 반향(echo) 양상의 변화, 건의 혈관 분포, 활주 등을 확인할 수 있어 진단뿐만 아니라 치유 과정 및 추시 관찰에 흔히 사용되고 있다.2-12) 초음파 검사에서의 아킬레스건 섬유 모양 유형(fibrillar pattern)을 분석한 연구 결과들이 있지만 수술 후 평가에서의 초음파의 이용은 아직 명확한 지침이 없으며 연구가 많지 않다.8,9,11-13) 아킬레스건 파열 수술 후 재활 과정은 대게 획일화되어 있는데,14) 아킬레스건 수술 후 초음파로 추시한 환자들에게서 다양한 섬유 모양 유형을 보여 이 섬유 유형이 다른 경우 임상 결과가 다르지 않을까 하는 의문과 나아가 동일한 재활 방법을 적용하는 것이 무방한지 의분을 갖게 되었다. 이에 저자들은 아킬레스건 파열로 수술을 시행한 환자에서 초음파 추시가 가능하였던 증례들을 분석하여 수술 후 초음파 검사에서 관찰되는 아킬레스건 섬유 모양 유형과 임상적 인자들의 상관관계를 분석하고 임상 결과를 예측할 수 있는지 알아보고자 하였다.
이 연구는 소속 기관의 임상시험 심사위원회의 승인을 받아 이루어졌다(IRB no. 2020-03-022). 2012년 7월부터 2019년 7월까지 아킬레스건 파열로 본원에 내원하여 수술적 치료를 시행 받은 환자 총 132명 중 아킬레스건 양측 파열, 재파열, 개방성 파열, 만성파열, 아킬레스건 견열 골절, 기시부, 부착부, 그리고 근-건 접합부 파열은제외하였고, 수술 시행 후 6개월째 초음파 검사를 시행하고 12개월 이상 외래에서 추시하였던 44명을 대상으로 하였다. 수술은 전 예에서 단일 술자(책임저자)에 의해 시행되었다.
환자들을 아킬레스건 수술 후 6개월째 초음파 종단면에서 보이는 아킬레스건 섬유의 배열과 반향 양상이 균일한 지 여부에 따라 두 군으로 나누었다. 비교적 건 섬유의 배열 방향이 균일하며 내부 반향 양상이 균일한 경우 균일 섬유 유형(homogenous fibrillar pattern group, HoP)이라고 하고, 섬유의 배열 방향이 일정하지 않고 내부 반향 양상이 균일하지 않은 경우를 불균일 섬유 유형(heterogenous fibrillar pattern group, HeP)이라고 하였다(Fig. 1). HoP 군은 다시 건 섬유가 선형으로 배열되어 있는 경우인 선형 유형(linear pattern)과 건 섬유가 부분적으로 두꺼워져 있거나 비선형으로 배열되어 있는 경우인 비선형 유형(wavy pattern)으로 세분하였다. HeP군은 국소적인 저반향성 병변이 보이지 않는 경우(no hypoechoic lesion)와 저반향성 병변이 섞여있는 경우(hypoechoic lesion)로 다시 세분하였다(Fig. 2).
환자의 아킬레스건 파열부의 중심부에서 가장 두꺼운 부분의 두께(mm)를 측정하였으며 아킬레스건 단면 모양을 확인하기 위해 두께를 측정한 부분의 축면에서 아킬레스건의 전후방 길이에 대한 내외측 길이의 비율을 측정하여 편평한 정도(flatness)를 측정하였다. 수술 전 시행한 자기공명영상(magnetic resonance image, MRI) 검사의 시상면 영상에서 파열 모양, 파열 간격(cm)을 확인하였으며, 아킬레스건의 원위부에 고신호강도가 혼재되어 있는 경우(mixed high signal intensity) 건병증이 동반되어 있는 것으로 판단하였다(Fig. 3).
환자 관련 요인으로는 무증상 및 유증상 고요산혈증(>7.0 mg/dL)과 류마티스 관절염, 강직성 척추염과 같은 전신 염증성 질환 여부(과거력, 류마티스인자, 항CCP항체, 항핵항체 및 HLA-B27)를 확인하였다.
수술 중 족저건 파열 여부를 확인하였다. 부건(paratenon)을 절개하여 아킬레스건 파열 모양을 확인해 파열단의 길이가 일정하지 않고 풀어헤쳐진 모양을 보이며 세절의 범위가 건의 지름을 초과하여 Krackow 봉합술15)이 필요한 경우를 세절파열(shredded rupture), 파열 단의 끝부분 섬유 길이가 비교적 일정하면서 깨끗하며 세절의 범위가 건의 지름을 초과하지 않아 Krackow 봉합술 없이 봉합이 가능한 경우를 단순파열(simple rupture)로 나누어 분류하였다(Fig. 4).
아킬레스건 봉합은 세절형 파열의 경우 Krackow 방법으로, 단순파열의 경우에는 Bunnell 방법으로 중심봉합을 시행하고 건 주변부는 연속봉합을 추가로 시행하였으며 모든 봉합에는 흡수성 봉합사만을 사용하였다. 수술 시 건 봉합에 사용한 봉합사의 총 사용량을 조사하였고 족저건 보강술 시행 유무 또한 확인하였다.
본 연구에서 HoP는 26예였으며, HoP 중 linear pattern은 총 9예(20.5%), wavy pattern은 총 17예(38.6%)였다. HeP은 18예였으며, HeP 중 저반향성 병변이 섞여있지 않는 경우는 총 11예(25.0%), 저반향성 병변이 섞여있는 경우는 총 7예(15.9%)였다.
아킬레스건 두께는 HoP에서 11.4±1.7 mm, HeP에서 14.5±3.0 mm으로 통계적으로 유의한 차이를 보였다(p<0.001). HoP에서 파열 모양은 세절파열이 17예(65.4%), 단순파열이 9예(34.6%)였고, HeP에서 파열 모양은 세절파열이 17예(94.4%), 단순파열이 1예(5.6%)였으며 유의한 차이를 보여 파열 모양과 아킬레스 섬유의 배열 양상은 연관성을 보였다(p=0.031). 수술 시 봉합사 사용량은 HoP에서 8.9±3.05개, HeP에서 11.39±1.75개로 HeP에서 봉합사 사용량이 많았으며 유의한 차이를 보였다(p=0.001). 임상적 결과 평가에서 최종 추시 시 양측 종아리 둘레 차이는 HoP에서 0.9±0.67 cm, HeP에서 1.36±0.71 cm로 확인되었으며 유의한 차이를 보였다(p=0.037). 아킬레스 모양의 편평한 정도, 아킬레스건의 유무, 염증성 질환의 유무(고요산혈증, 류마티스인자, 항CCP항체, 항핵항체 및 HLA-B27), 파열 간격, 족저건 파열 유무, 족저건 보강술 유무, 일측 발뒤꿈치 들림 여부, stiffness, 일상생활로의 복귀 유무는 통계적 유의성을 보이지 않았다(Table 1).
파열 모양으로 분류하였을 때 세절파열은 총 34예였으며 단순파열은 총 10예였다. 건 두께는 세절파열에서 13.2±2.7 mm 단순파열에서 10.9±2.1 mm으로 세절파열일 때 건 두께가 더 두꺼운 양상을 보였으며 통계적으로 유의한 차이를 보였다(p=0.018). 아킬레스건의 둥근 정도, 아킬레스건병증의 유무, 고요산혈증의 유무, 파열 간격, 족저건 파열 유무, 족저건 보강술 유무, 일측 발뒤꿈치 들림 여부, stiffness, 일상생활로의 복귀 유무는 통계적 유의성을 보이지 않았다. 하지만 수술 시 봉합사 사용량은 통계적 유의성은 없었지만 세절파열에서 9.5±3개로 실 사용량이 더 많았다(p=0.208; Table 2).
그리고 건의 두께는 HoP 중 linear pattern에서 11.0±2.1 mm, wavy pattern에서 11.6±1.4 mm 측정되었으며 두 군 간의 통계적 유의성을 보이지 않았다(p=0.234). HeP 중 no hypoechoic lesion에서 건의 두께는 13.6±2.5 mm 측정되었고, hypoechoic lesion에서 건의 두께는 16.0±2.9 mm 측정되었으며 두 군 간의 통계적 유의성을 보이지 않았다(p=0.103). 건의 두께는 linear pattern, wavy pattern, no hypoechoic lesion, hypoechoic lesion으로 갈수록 점점 두꺼워지는 양상을 보였으며 linear pattern은 HeP의 no hypoehoic lesion과 hypoechoic lesion 각각에서 유의한 차이를 보였다(p=0.014, p=0.005). wavy pattern 역시 HeP의 no hypoehoic lesion과 hypoechoic lesion 각각에서 유의한 차이를 보였다(p=0.024, p=0.002) (Fig. 5).
초음파 검사는 아킬레스건 파열 및 위치를 확인하는 데 사용되고 있으며 파열 간격이 어느 정도인지 확인할 수 있다. 수술 후 건 회복 과정을 추시할 수 있고 동적인 검사가 가능하여 추시하는 동안 건의 혈관 분포와 활주 변화뿐만 아니라 구조와 형태적 변화를 확인할 수 있다.2,4,6,8-12,16-19) Karjalainen 등9)은 수술한 부위의 초음파 결과는 건측과 차이를 보이며, 수술 이후 아킬레스건은 두꺼워지고 수술 후 그 두께가 서서히 감소한다고 하였으며 건의 음영이 혼합된 형태로 보인다고 보고하였다.
아킬레스건 봉합 후 6개월째에는 통상적으로 스포츠 활동의 재개가 가능하다고 판단되어 스포츠 활동에 복귀시키는 것이 일반적인데,14) 저자들이 6개월째 초음파를 본 결과 개인마다 섬유 모양의 차이가 상당하여 파열 모양에 따라 각각 다른 재활 속도 및 스포츠 활동의 허용 여부가 결정될 필요가 있는 것이 아닐까 하는 의문이 들었다. 이에 섬유 모양과 상관관계가 있는 인자들이 무엇인지 알아보고 임상 결과와는 어떤 연관성이 있는지 알아보고자 본 연구를 진행하였으며, 아킬레스건의 두께, 종아리 둘레 길이 차이 값이 초음파 결과와 유의한 상관관계가 있음을 확인하였다.
아킬레스건의 기능 평가로는 일측 발뒤꿈치 들림 여부, 일상생활로의 복귀, 관절가동범위 등의 기본적인 방법으로 평가하는 것이 일반적이다.20) 저자들은 이러한 기본적인 평가 방법이 환자가 실제 완전한 회복을 이루었는지에 대한 지표가 되는 것은 아니라고 판단하였다. Rupp 등8)은 아킬레스건 수술 후 시행한 초음파 검사 결과와 임상적 기능은 통계적 상관관계가 없다고 보고하였고, Leppilahti 등21)은 전신 질환의 유무, 수상 전 아킬레스건의 증상, 운동 활동으로의 복귀는 임상 결과와 연관성이 있으나 아킬레스건의 두께는 힘이나 임상 결과와 통계적 상관관계가 없다고 보고하였다. 본 연구에서는 최종 추시 시의 임상결과인 일측 발뒤꿈치 들림 여부, stiffness, 일상생활로의 복귀 유무는 수술 후 시행한 초음파 결과와 유의한 차이를 보이지 않았다. 그러나 수술 후 6개월째 확인되는 아킬레스건의 초음파 소견에서 단순파열과 세절파열은 HoP 군과 HeP 군에서 유의한 차이를 보였다. 두 군 간에 파열 모양이 유의한 차이가 있었으며, 또한 HeP에서 HoP에 비하여 건의 두께와 calf circumference 차이가 증가하였으며 유의한 차이를 보였다. 아킬레스건의 경우 건병증이 있을 때 정상에 비하여 그 두께는 증가되어 보인다.22) HeP인 경우에는 실 사용량이 더 많아 두꺼워질 수 있고, 건을 봉합한 뒤 봉합된 부위의 직접적인 건의 회복과 그 외의 부위는 섬유화되는 부분이 같이 혼재되어 있을 가능성이 있어 두꺼워 보일 수 있다. 또한 세절파열의 경우에는 단순파열보다 두께가 두꺼울 뿐만 아니라 저에코성의 빈 공간이나 섬유성 상흔조직이 혼재될 수도 있어 더 두껍게 보일 수 있을 것으로 추정된다. 이를 미루어 판단할 때 HeP인 경우에는 비록 임상 결과는 유의한 차이가 없다 할지라도 HoP보다 건의 회복 상태가 좋지 않을 수 있어, 수술 후 같은 기간이 지났다고 하여도 똑같은 강도로 술 후 재활을 하는 것이 적절하지 않을 수 있으며 초음파 소견에 따라 환자에게 적정 강도의 재활이 개별화되어 적용될 필요가 있다고 생각된다. 또한 본 연구에서는 두 군 간에 통계적으로 유의한 임상적 차이가 없었지만 섬유 패턴에 따라 HoP와 HeP 사이에는 더 세심한 증상이나 활동 회복 정도에 대한 평가 지표가 필요할 수 있다고 판단되며 나아가 더 장기적인 대규모의 연구를 통해 건 실질의 섬유 차이가 일반적으로 수술과 무관하게 나타나는 건병증의 증상이나 기능 저하 등과 다르게 판단되어야 하는지, 동일하게 건병증으로 취급되어야 하는지도 밝혀져야 할 부분이라 생각한다.
Mahoney 등23)은 통풍 및 다른 전신 질환이 아킬레스건의 파열을 유발할 수 있다고 보고하였으며 Hess24)는 만성 건병증이 아킬레스 파열의 원인이 될 수 있다 하였다. 본 연구에서는 아킬레스건 봉합 후 추시 과정에서도 건의 재생이나 모양에 고요산혈증, 전신 질환, 그리고 아킬레스건병증이 영향을 주지 않을까 하여 분석하였으며, HeP에서 HoP에 비하여 해당 질환을 가진 환자의 비율이 높았으나 통계적 유의성은 없었다. 하지만 파열의 모양이 다양하여 향후 많은 증례의 분석을 통하여 파열 모양과의 연관성을 입증하는 것이 필요할 것으로 보인다.
Szaro와 Ghali Gataa22)는 아킬레스건병증이 있을 때 건은 정상 건에 비하여 영상학적으로 두께가 비후되어 있으며, 단순히 크기만 커지는 것이 아니라 단면의 모양이 다르게 변한다고 하였다. 이에 본 연구에서는 아킬레스건 단면의 flatness를 확인하였으나 임상결과와 유의한 상관관계를 보이지 않았다. 더불어 초음파에서 보이는 아킬레스 섬유 모양은 최종 추시 시의 임상적 결과에 통계적으로 유의한 영향을 미치지는 못하는 것으로 나타났다. 하지만 6개월째의 초음파상 섬유 모양은 파열 양상, 그리고 건의 비후와 유의한 상관관계가 있어, flatness가 소실된 아킬레스건에 대하여는 좀 더 개별화된 추시가 필요할 수 있다. 즉, 비후된 세절파열에서는 두께가 증가하여 flatness가 소실되어 보이는데, 지연성 건병증의 가능성 혹은 탄성 소실로 지연성 재파열 위험 등을 배제할 수 없기 때문에 좀 더 오랜 기간 추시할 필요가 있는 것이 아닐까 생각된다.
본 연구의 한계점으로는 아킬레스건 급성 파열 후 수술을 시행한 환자들 중 초음파 검사를 시행했던 환자들만을 선별하여 연구 대상으로 포함시킨 후향적 연구로 연구 대상 선정에 있어 선택 편향(selection bias)를 배제할 수 없다는 점이 있다. 더불어 대상자의 수가 44명으로 상대적으로 적어 일관적인 지표를 제시하기 적절하지 않을 수 있다.
또한 수술 후 추시 기간에 따라 순차적으로 초음파 소견을 분석한 것이 아니라 수술 후 6개월 이상이 지난 최종 추시 시의 초음파 소견만 분석하였기 때문에 기간에 따른 초음파 소견 및 임상적 인자의 변화를 반영하지 못하였다는 단점도 있다. 그리고 초음파 소견 평가에서 한 사람이 초음파 소견을 평가 후 군을 나누어 치료자의 주관이 반영되었을 가능성을 배제할 수 없다.
때문에 향후 연구에서는 초음파 검사 소견과 임상적 인자들의 관계를 보다 명확히 판단하기 위해 대상자의 수를 늘리고, 추시 기간에 따라 초음파 소견을 관찰하며, 다기관 임상 연구를 시행하는 것이 바람직하다고 판단된다. 더불어 임상적 평가 방법을 다양화하고 통상적인 기간보다 더 긴 기간의 장기 추시 소견을 분석하는 것이 필요할 것이다.
References
1. Lantto I, Heikkinen J, Flinkkilä T, Ohtonen P, Leppilahti J. 2015; Epidemiology of Achilles tendon ruptures: increasing incidence over a 33-year period. Scand J Med Sci Sports. 25:e133–8. doi: 10.1111/sms.12253. DOI: 10.1111/sms.12253. PMID: 24862178.

2. Ciloglu O, Görgülü FF. 2020; Evaluation of a torn Achilles tendon after surgical repair: an ultrasound and elastographic study with 1-year follow-up. J Ultrasound Med. 39:1263–9. doi: 10.1002/jum.15214. DOI: 10.1002/jum.15214. PMID: 31943316.
3. Nicholson G, Walker J, Dawson Z, Bissas A, Harris N. 2020; Morphological and functional outcomes of operatively treated Achilles tendon ruptures. Phys Sportsmed. 48:290–7. doi: 10.1080/00913847.2019.1685364. DOI: 10.1080/00913847.2019.1685364. PMID: 31662010.
4. Braccagni M, Grange S, Arcade A, Klasan A, Boyer B, Farizon F, et al. 2021; What are the sonographic outcomes of acute Achilles tendon rupture? Nonoperative versus surgical repair? Surg Technol Int. 39:427–32. doi: 10.52198/21.STI.39.OS1505. DOI: 10.52198/21.STI.39.OS1505.
5. Kim DH, Choi JH, Park CH, Park HJ, Yoon KJ, Lee YT. 2021; The diagnostic significance of ultrasonographic measurement of the Achilles tendon thickness for the insertional Achilles tendinopathy in patients with heel pain. J Clin Med. 10:2165. doi: 10.3390/jcm10102165. DOI: 10.3390/jcm10102165. PMID: 34067786. PMCID: PMC8157148.

6. Gitto S, Draghi AG, Bortolotto C, Draghi F. 2016; Sonography of the Achilles tendon after complete rupture repair: what the radiologist should know. J Ultrasound Med. 35:2529–36. doi: 10.7863/ultra.16.01092. DOI: 10.7863/ultra.16.01092. PMID: 27738294.
7. Kauwe M. 2017; Acute Achilles tendon rupture: clinical evaluation, conservative management, and early active rehabilitation. Clin Podiatr Med Surg. 34:229–43. doi: 10.1016/j.cpm.2016.10.009. DOI: 10.1016/j.cpm.2016.10.009. PMID: 28257676.
8. Rupp S, Tempelhof S, Fritsch E. 1995; Ultrasound of the Achilles tendon after surgical repair: morphology and function. Br J Radiol. 68:454–8. doi: 10.1259/0007-1285-68-809-454. DOI: 10.1259/0007-1285-68-809-454. PMID: 7788228.

9. Karjalainen PT, Ahovuo J, Pihlajamäki HK, Soila K, Aronen HJ. 1996; Postoperative MR imaging and ultrasonography of surgically repaired Achilles tendon ruptures. Acta Radiol. 37:639–46. doi: 10.1177/02841851960373P244. DOI: 10.1177/02841851960373P244. PMID: 8915267.

10. Rominger MB, Bachmann G, Schulte S, Zedler A. 1998; [Value of ultrasound and magnetic resonance imaging in the control of the postoperative progress after Achilles tendon rupture]. Rofo. 168:27–35. German. doi: 10.1055/s-2007-1015178. DOI: 10.1055/s-2007-1015178. PMID: 9501931.
11. Bleakney RR, Tallon C, Wong JK, Lim KP, Maffulli N. 2002; Long-term ultrasonographic features of the Achilles tendon after rupture. Clin J Sport Med. 12:273–8. doi: 10.1097/00042752-200209000-00003. DOI: 10.1097/00042752-200209000-00003. PMID: 12394198.

12. Hollenberg GM, Adams MJ, Weinberg EP. 2000; Sonographic appearance of nonoperatively treated Achilles tendon ruptures. Skeletal Radiol. 29:259–64. doi: 10.1007/s002560050604. DOI: 10.1007/s002560050604. PMID: 10883444.

13. O’Reilly MA, Massouh H. 1993; Pictorial review: the sonographic diagnosis of pathology in the Achilles tendon. Clin Radiol. 48:202–6. doi: 10.1016/S0009-9260(05)80284-3. DOI: 10.1016/S0009-9260(05)80284-3.
14. Gould HP, Bano JM, Akman JL, Fillar AL. 2021; Postoperative rehabilitation following Achilles tendon repair: a systematic review. Sports Med Arthrosc Rev. 29:130–45. doi: 10.1097/JSA.0000000000000309. DOI: 10.1097/JSA.0000000000000309. PMID: 33972490.

15. Krackow KA, Thomas SC, Jones LC. 1986; A new stitch for ligament-tendon fixation. Brief note. J Bone Joint Surg Am. 68:764–6. doi: 10.2106/00004623-198668050-00020. DOI: 10.2106/00004623-198668050-00020.

16. Chiodo CP, Glazebrook M, Bluman EM, Cohen BE, Femino JE, Giza E, et al. 2010; Diagnosis and treatment of acute Achilles tendon rupture. J Am Acad Orthop Surg. 18:503–10. doi: 10.5435/00124635-201008000-00007. DOI: 10.5435/00124635-201008000-00007. PMID: 20675643.

17. Margetić P, Miklić D, Rakić-Ersek V, Doko Z, Lubina ZI, Brkljacić B. 2007; Comparison of ultrasonographic and intraoperative findings in Achilles tendon rupture. Coll Antropol. 31:279–84.
18. Maffulli N, Dymond NP, Regine R. 1990; Surgical repair of ruptured Achilles tendon in sportsmen and sedentary patients: a longitudinal ultrasound assessment. Int J Sports Med. 11:78–84. doi: 10.1055/s-2007-1024767. DOI: 10.1055/s-2007-1024767. PMID: 2180833.

19. Majewski M, Lehmann M, Dick W, Steinbrück K. 2003; [Value of sonography to monitor the course of Achilles tendon rupture after treatment--comparison of conservative therapy, percutaneous tendon adaptation, and open suture]. Unfallchirurg. 106:556–60. German. doi: 10.1007/s00113-003-0623-8. DOI: 10.1007/s00113-003-0623-8. PMID: 12883782.
20. Deng S, Sun Z, Zhang C, Chen G, Li J. 2017; Surgical treatment versus conservative management for acute Achilles tendon rupture: a systematic review and meta-analysis of randomized controlled trials. J Foot Ankle Surg. 56:1236–43. doi: 10.1053/j.jfas.2017.05.036. DOI: 10.1053/j.jfas.2017.05.036. PMID: 29079238.
21. Leppilahti J, Lähde S, Forsman K, Kangas J, Kauranen K, Orava S. 2000; Relationship between calf muscle size and strength after achilles rupture repair. Foot Ankle Int. 21:330–5. doi: 10.1177/107110070002100410. DOI: 10.1177/107110070002100410. PMID: 10808974.

22. Szaro P, Ghali Gataa K. 2021; The correlations between dimensions of the normal tendon and tendinopathy changed Achilles tendon in routine magnetic resonance imaging. Sci Rep. 11:6131. doi: 10.1038/s41598-021-85604-9. DOI: 10.1038/s41598-021-85604-9. PMID: 33731785. PMCID: PMC7969943.

23. Mahoney PG, James PD, Howell CJ, Swannell AJ. 1981; Spontaneous rupture of the Achilles tendon in a patient with gout. Ann Rheum Dis. 40:416–8. doi: 10.1136/ard.40.4.416. DOI: 10.1136/ard.40.4.416. PMID: 7259334. PMCID: PMC1000740.
24. Hess GW. 2010; Achilles tendon rupture: a review of etiology, population, anatomy, risk factors, and injury prevention. Foot Ankle Spec. 3:29–32. doi: 10.1177/1938640009355191. DOI: 10.1177/1938640009355191. PMID: 20400437.
Figure 1
(A) Longitudinal scan of a homogenous fibrillary pattern showing parallel longitudinal architecture of the tendon. (B) Axial scan of a homogenous fibrillary pattern. (C) Longitudinal scan of a heterogenous fibrillary pattern showing not parallel longitudinal architecture of the tedndon. (D) Axial scan of a heterogenous fibrillary pattern showing multiple hypoechogenic area.
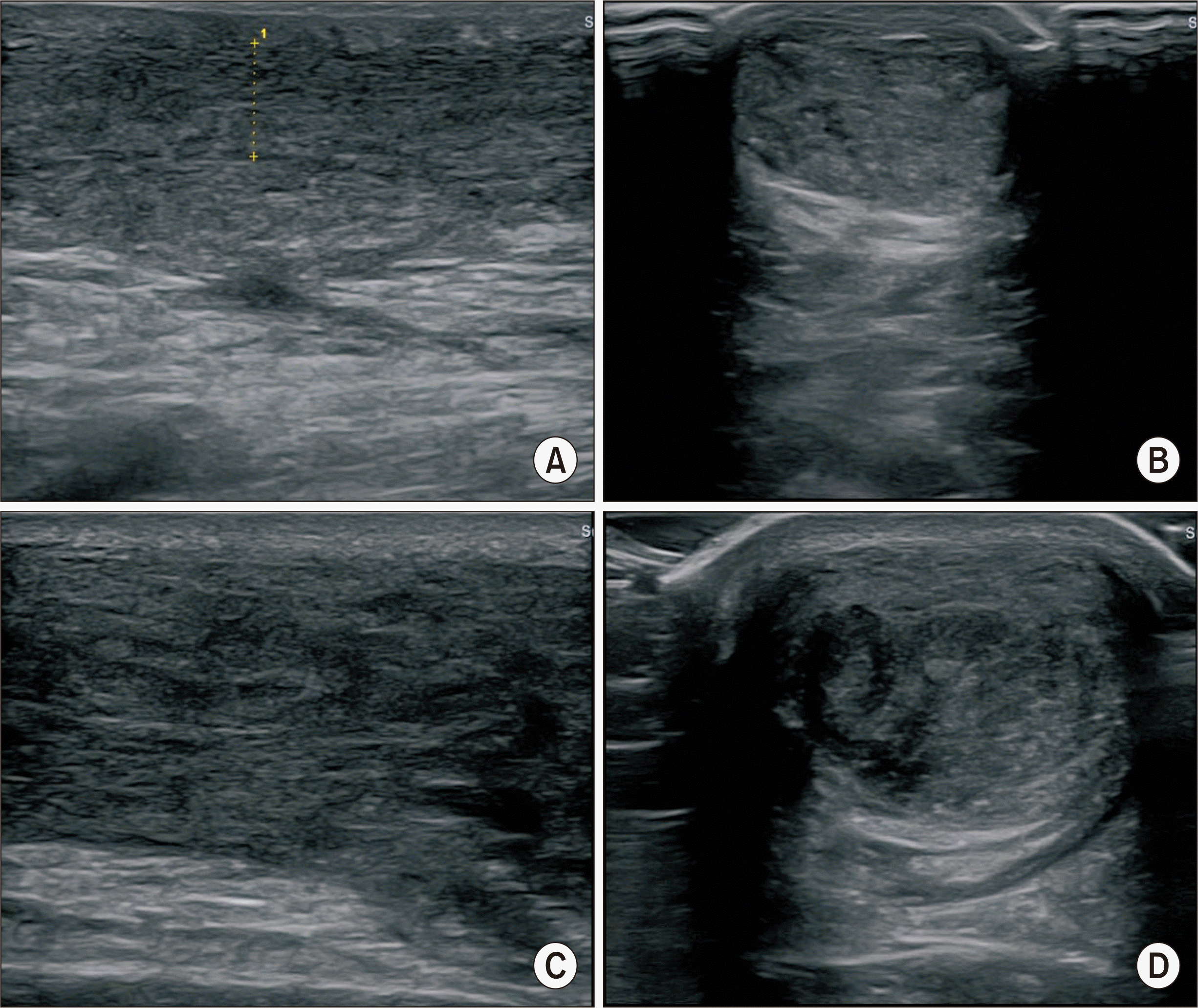
Figure 3
Saggital magnetic resonance image of a Achilles tendon rupture. On T2-weighted image the Achilles tendon fiber is ruptured 5 cm above the calcaneal tubercle. Red arrow indicates the mixed high signal intensity of distal Achilles tendon stump meaning tendinopathy.
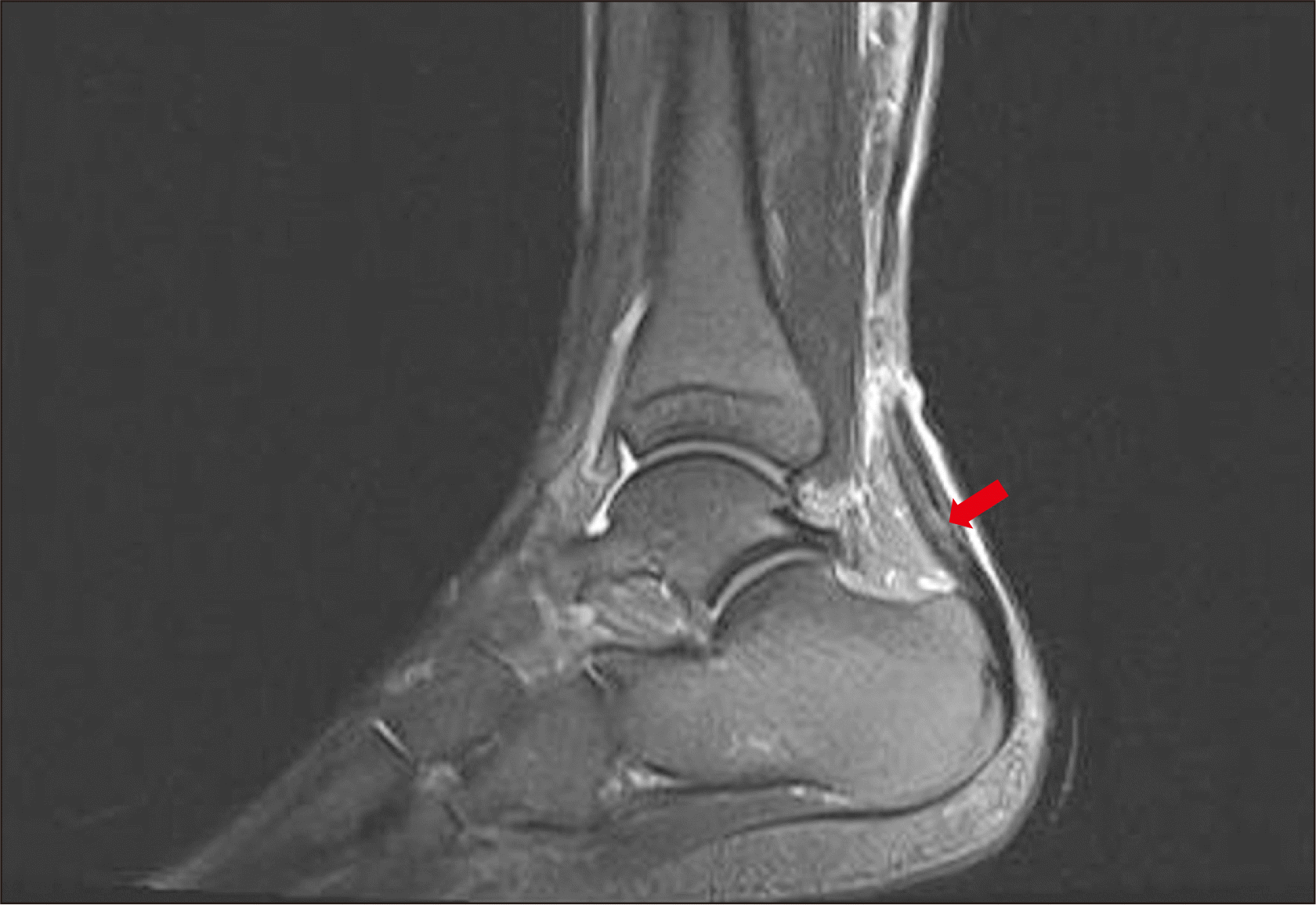
Figure 4
Intraoperative medical photo of Achilles tendon rupture fiber. (A) Simple rupture and (B) shredded rupture.
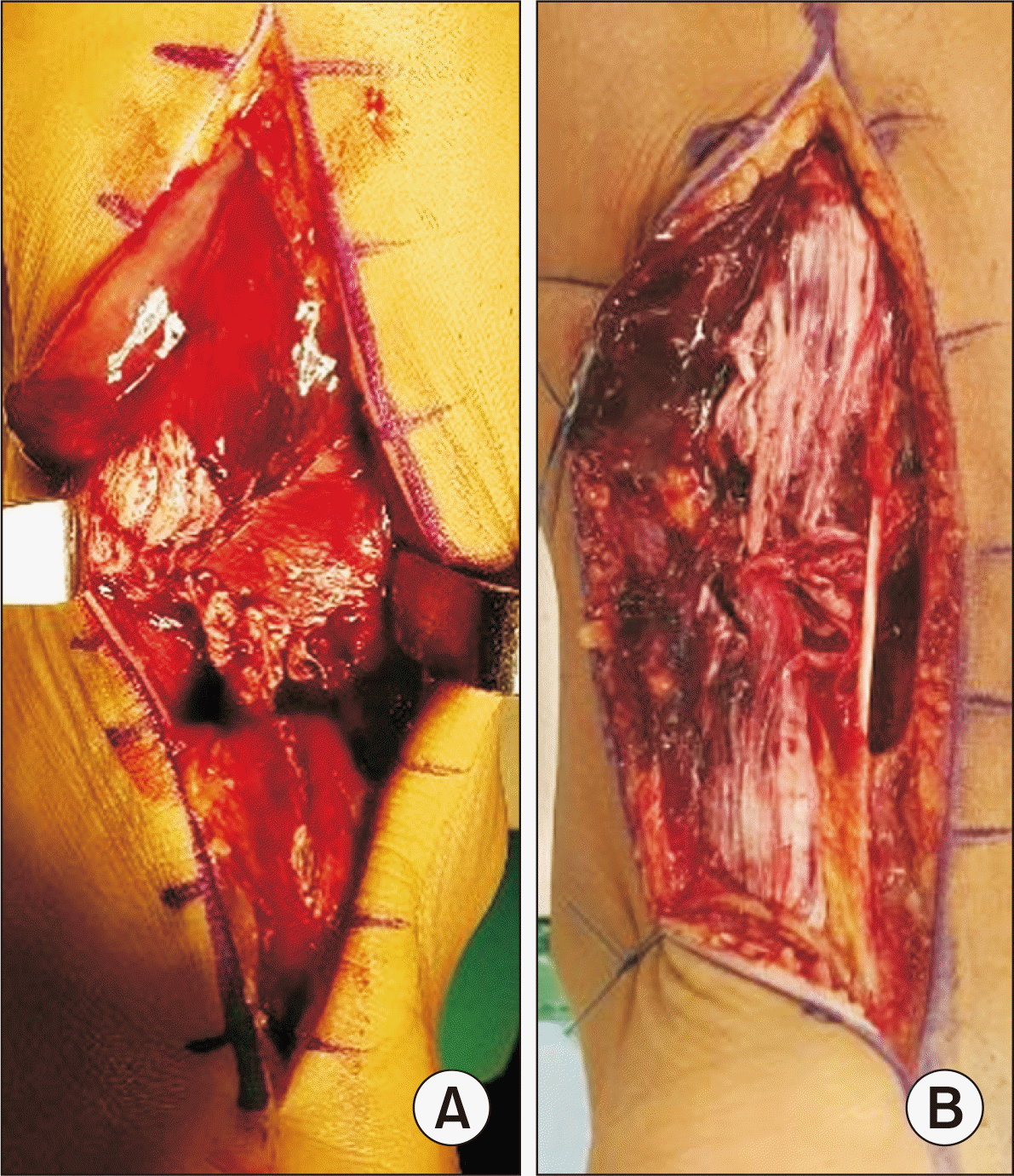
Figure 5
The mean value graph of tendon thickness of each group. The mean value showed an increase from homogenous group to heterogenous group. There is a significant difference between homogenous group and heterogenous group. There is no significant difference between linear pattern group and wavy pattern group, and no significant difference between no hypoechoic lesion group and hypoechoic lesion group.
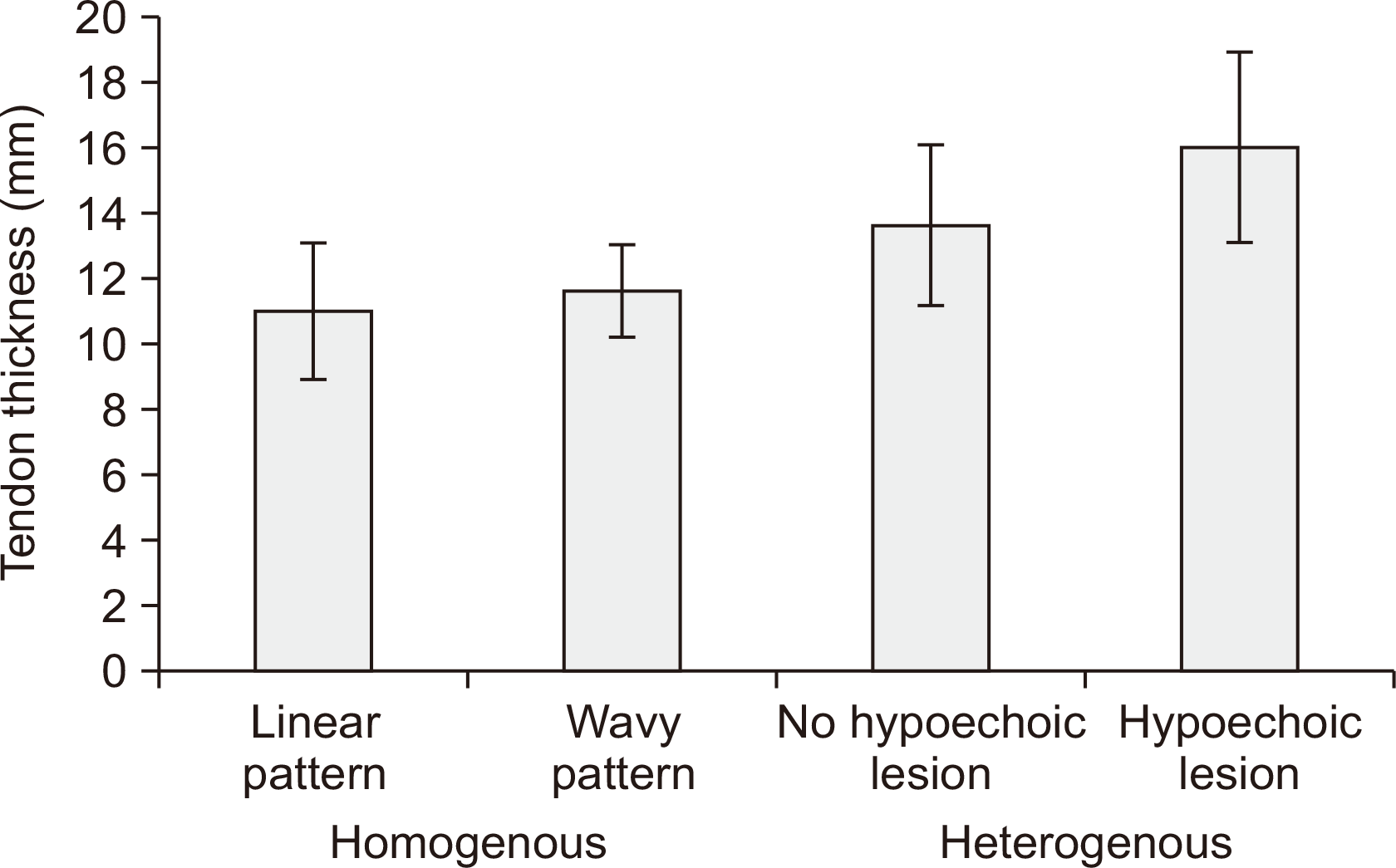
Table 1
Comparison of Data in Patients with Homogenous Group and Heterogenous Group
| Variable | Homogenous group (n=26) | Heterogenous group (n=18) | p-value |
|---|---|---|---|
| Age (yr) | 42.7 (20~55) | 43.4 (25~78) | |
| Sex | |||
| Male | 22 (84.6) | 16 (88.9) | |
| Female | 4 (15.4) | 2 (11.1) | |
| Fibrillar pattern | |||
| Linear homogenous | 9 (20.5) | ||
| Wavy homogenous | 17 (38.6) | ||
| No hypoechoic lesion | 11 (25.0) | ||
| Hypoechoic lesion | 7 (15.9) | ||
| Follow up (mo) | 14 (12~19) | 14.27 (12~30) | |
| Tendon thickness (mm) | 11.4±1.7 | 14.5±3.0 | <0.001* |
| Flatness | 1.89±0.54 | 1.73±0.17 | 0.272 |
| Mixed high signal intensity in MRI | 5 (19.2) | 6 (33.3) | 0.314 |
| Hyperuricemia (>7.0 mg/dL) | 5 (19.2) | 6 (33.3) | 0.314 |
| RF | 0 (0) | 1 (5.6) | 0.229 |
| anti-CCP antibody | 1 (3.8) | 0 (0) | 0.405 |
| ANA | 0 (0) | 0 (0) | >0.999 |
| HLA-B27 | 0 (0) | 0 (0) | >0.999 |
| Rupture pattern | 0.031* | ||
| Shredded | 17 (65.4) | 17 (94.4) | |
| Simple | 9 (34.6) | 1 (5.6) | |
| Rupture gap (cm) | 2.81±1.67 | 2.94±1.84 | 0.818 |
| Plantaris rupture | 6 (23.1) | 7 (38.9) | 0.258 |
| Plantaris augmentation | 18 (69.2) | 11 (61.1) | 0.576 |
| Number of used suture | 8.9±3.05 | 11.39±1.75 | 0.001* |
| Calf circumference (cm) | 0.9±0.67 | 1.36±0.71 | 0.037* |
| Single heel rise | 25 (96.2) | 18 (100) | >0.999 |
| Stiffness† | 3 (11.5) | 3 (13.6) | 0.676 |
| Return to normal activity | 21 (80.8) | 10 (55.6) | 0.071 |
Table 2
Comparison of Data in Patients with Shredded Rupture Group and Simple Rupture Group
| Variable | Shredded rupture (n=34) | Simple rupture (n=10) | p-value |
|---|---|---|---|
| Tendon thickness (cm) | 13.2±2.7 | 10.9±2.1 | 0.018* |
| Flatness | 1.78±0.3 | 2.1±0.85 | 0.441 |
| High signal intensity in MRI | 9 (26.5) | 2 (20.0) | >0.999 |
| Hyperuricemia (>7.0 mg/dL) | 8 (23.5) | 3 (30.0) | 0.692 |
| Rupture gap (cm) | 2.67±1.53 | 3.52±2.21 | 0.175 |
| Plantaris rupture | 9 (26.5) | 4 (40.0) | 0.449 |
| Plantaris augmentation | 22 (64.7) | 7 (70.0) | >0.999 |
| Number of used suture | 9.5±3.03 | 8.1±3.21 | 0.208 |
| Calf circumference (cm) | 1.15±0.75 | 0.89±0.56 | 0.293 |
| Single heel rise | 34 (100) | 9 (90.0) | 0.227 |
| Stiffness† | 5 (14.7) | 1 (10.0) | >0.999 |
| Return to normal activity | 24 (70.6) | 7 (70.0) | >0.999 |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download