Abstract
Background/Aims
Helicobacter pylori (H. pylori) infection highly correlates with erythematous/exudative gastritis, which is one of the endoscopic findings of the Sydney classification system. The present study aimed to evaluate the association between endoscopic severity of erythematous/exudative gastritis and H. pylori infection.
Methods
We prospectively enrolled asymptomatic adults who were diagnosed with erythematous/exudative gastritis during screening esophagogastroduodenoscopy. A rapid urease test was performed in all participants to diagnose H. pylori infection. The severity of erythematous/exudative gastritis was determined based on the Sydney classification system. Two investigators independently evaluated the endoscopic findings. The primary endpoint was H. pylori infection rate according to the severity of erythematous/exudative gastritis (mild vs. moderate-to-severe).
Results
A total of 177 patients with erythematous/exudative gastritis were included. The rate of H. pylori infection was 86.4% in all patients. Of 177 included patients, 78 were at mild degree, 48 were at moderate degree, and 51 were at severe degree. The inter-observer variation was 4.6% and kappa value was 0.593. H. pylori infection rate was similar between patients with mild erythematous/exudative gastritis and those with moderate-to-severe erythematous/exudative gastritis (91.0% vs. 82.8%, p=0.115). Even after adjusting potential confounding variables, the severity of erythematous/exudative gastritis was not associated with H. pylori infection rate.
헬리코박터 파일로리(Helicobacter pylori, H. pylori)는 미세호기성 그람 음성 막대균으로 인간의 위 점막에서 발견되고 만성 위염과 위궤양, 위암의 주요한 원인이다.1 위궤양이 있었던 환자에서 H. pylori 제균 치료는 궤양의 재발율을 낮추고,2 일반 인구 집단에서 위암을 예방하는 데도 효과가 있다. 한 메타분석에 의하면 헬리코박터 제균을 하지 않은 군에 비해 제균한 군에서 위암을 약 50% 예방하는 것이 가능하다고 보고되었다.3 우리나라 성인의 H. pylori의 혈청학적 양성율은 1998년에 66.9%, 2005년에 59.6%, 2011년에 54.5%로 감소 추세이기는 하나 여전히 높은 수준이기 때문에 H. pylori 감염을 적절히 진단하고 치료할 필요가 있다.1,4-6
우리나라에서는 위암의 유병률이 서구에 비해 높아 위암을 조기에 진단하여 위암 생존율을 높이려는 노력이 있어왔다. 상부위장관 내시경 검사는 병변을 직접 관찰할 수 있고 의심되는 병변에서 조직 검사를 바로 할 수 있어서 위암의 조기 진단에 있어 효과적인 방법이다.7 이에 우리나라에서는 1999년부터 40세 이상 성인에 대하여 상부위장관 내시경 검사 또는 상부위장관 조영술을 2년 간격으로 국가암검진사업의 일환으로 시행하고 있다.8 그러나 이러한 위암의 조기 진단만으로는 위암 발생 자체를 낮출 수는 없어 헬리코박터 제균 치료를 통해 위암 발생을 줄이고자 하는 노력 또한 필요하다. 따라서 우리나라에서 대규모의 검사가 이루어지는 검진 내시경 시행 시 급속요소분해효소 검사와 같은 헬리코박터 진단 검사를 보다 적극적으로 시행하고 H. pylori 감염을 치료한다면 위염을호전시킬 수 있을 뿐 아니라 위암 발생 예방에 보다 큰 도움이될 것으로 기대된다.
내시경적 위염의 소견과 H. pylori 감염 사이의 관련성은 교토 분류 체계(Kyoto classification)에 제시되어 있다.9 하지만 이것은 19개의 소견이 나열식으로 되어 있어 분류 체계가 다소 복잡하고 미만성 발적(diffuse redness), 점상 발적(spotty redness), 반상 발적(patchy redness), 측선상 발적(red streak)과 같은 소견이 어떻게 다른지 명확한 설명이 부족하여 보완이 필요하다.10 또한, 국내에서는 내시경적 위염 소견에 따른 H. pylori 감염과의 관련성에 대한 연구가 부족하다. 이에 본 연구에서는 기존에 널리 알려져 있는 시드니 분류 체계(Sydney classification)의 내시경적 위염 소견과 중증도가 H. pylori 감염을 예측하는 데 얼마나 도움이 되는지 알아보고자 하였다.11 시드니 분류 체계에도 여러 가지 내시경적 위염 소견이 제시되어 있으나 기존 연구에서 H. pylori 감염과의 연관성이 제시되고 있으면서 연구자가 내시경 소견을 바탕으로 직관적으로 판단하기에 용이한 지표인 발적성/삼출성 위염(erythematous/exudative gastritis)을 중심으로 H. pylori 감염률을 분석해 보고자 하였다.12 발적성/삼출성 위염은 시드니 분류 체계에서 경도, 중등도, 중증의 세 단계로 구분하고 있는데 발적성/삼출성 위염의 정도가 심하지 않을 경우에는 관찰자가 H. pylori 감염 가능성을 간과할 가능성이 있다. 그러나 현재까지 발적성/삼출성 위염의 중증도에 따라 H. pylori 감염이 동반되어 있을 가능성이 달라지는지에 대해서는 알려진 바가 없다. 만약 경도의 발적성/삼출성 위염이라도 중등도 혹은 중등의 발적성/삼출성 위염만큼 H. pylori 감염이 동반되어 있을 가능성이 높다면 경도의 발적성/삼출성 위염이라 해서 간과해서는 안 될 것이다. 이에 본 연구에서는 발적성/삼출성 위염의 중증도에 따라 H. pylori 감염의 빈도에 차이가 있는지를 알아보고자 하였다.
본 연구는 전향적 연구로 2019년 10월부터 2020년 9월까지 한솔병원에 건강검진을 목적으로 내원한 18세에서 75세의 수검자를 대상으로 하였다. 연구에 동의한 환자를 대상으로 위내시경을 시행하고 내시경 소견을 기술한 뒤 발적성/삼출성 위염의 소견을 보이는 환자를 대상으로 분석하였다. 내시경 검사를 시행한 환자 중 이전 위암 또는 위수술 또는 H. pylori 감염을 진단을 받은 환자, 검사 전 4주 이내에 비스테로이드성 소염진통제, 항혈소판제, 항응고제, 스테로이드, 항생제, 프로톤펌프억제제 복용 환자, 이전에 H. pylori 제균 치료를 받은 환자, 위궤양 또는 십이지장 궤양 과거력이 있는 환자, 빈혈, 출혈성 경향의 혈액 질환 환자, 심한 간질환, 신질환 환자, 심폐기능 저하 환자는 연구 대상에서 제외하였다. 이 연구는 한솔병원 임상연구윤리위원회의 승인을 받았다(IRB No. HSHIRB2019001). 검사자(O.Z.K.)가 전체 내시경검사를 진행하였고 내시경 소견에 대한 평가를 하였다. 다른 평가자(K.H.R.)는 검사 영상을 다시 판독하여 발적성/삼출성 위염의 중증도를 재평가하였다.
시드니 분류의 발적성/삼출성 위염은 발적만 있을 경우에는 발적성 위염, 발적과 삼출물이 동시에 있을 경우에는 발적성/삼출성 위염이라고 표시한다. 이 연구에서는 발적만 있는 발적성 위염은 제외하고 발적과 삼출물이 동시에 있는 경우만을 대상으로 하였다. 발적성/삼출성 위염의 중증도는 삼출물이 몇 개의 작은 점(punctuate spot) 모양으로 보일 때 경도,삼출물이 조각(patches) 또는 반상(plaques)의 모양으로 국소적으로 보일 때 중등도, 삼출물이 광범위하게 덮여 있을 때중증으로 분류하였다(Fig. 1).11 발적성/삼출성 위염의 내시경소견을 보인 환자에게 삼출물이 주로 관찰되는 부위인 상체부대만에서 급속요소분해검사(campylobacter-like organism test, CLO® test, Kimberly-Clark, Roswell, NM, USA)를 시행하여 양성 또는 음성을 판정하였다.
연구의 일차결과지표(primary study outcome)는 경도 발적성/삼출성 위염을 중등도 또는 중증 발적성/삼출성 위염과 비교하여 H. pylori 감염률이 차이가 있는지로 하였다. 이차결과지표(secondary study outcome)로는 발적성/삼출성 위염 환자에서 H. pylori 감염에 연관되는 인자를 분석하였다.
2016년부터 2017년까지 진행한 국내 연구에서 H. pylori 감염률은 약 42%였다.13 경도의 발적성/삼출성 위염 환자에서의 H. pylori 감염률을 42%, 중등도 혹은 중증의 발적성/삼출성 위염 환자에서의 H. pylori 감염률을 65%라고 가정하고, 검정력을 80%, 유의수준 0.05 (양측검정), 중도탈락률은 10%로 설정하였다. 상기 조건을 통해 계산된 표본 수는 180명이었다.
수집된 데이터를 바탕으로 H. pylori 감염 여부에 따라 경도 대비 중등도/중증 발적성/삼출성 위염이 유의하게 차이가 있는지에 대해 연속형 변수는 student t-test, 명목형 변수는 Fisher’s exact test와 다변량 로지스틱 회귀분석을 시행하였다. p-value가 0.05 미만일 때 통계적으로 유의하다고 평가하였다. 관찰자 간 차이는 절대적 차이(absolute difference)와 코헨의 카파계수(Cohen’s kappa value)로 분석하였다. 다변수 분석은 나이, 성별과 발적성/삼출성 위염의 중증도를 기본 공변량으로 포함하고 단변수 분석에서 p-value가 0.1 미만을 보이는 변수들을 추가 공변량으로 포함하여 수행하였다. 상기 통계적 분석은 IBM SPSS Statistics ver. 27.0 for Windows (IBM Co., Armonk, NY, USA)로 시행하였다.
총 1,801명의 대상자가 연구 참여에 동의하여 등록되었고,이 중 참여를 철회한 3명을 제외한 1,798명에 대하여 위내시경 검사를 통해 스크리닝을 진행하였다. 이 중 발적성/삼출성위염 소견이 없었거나 발적성 위염이 있더라도 삼출성 위염이 동반되지 않았던 환자 1,621명은 연구에서 배제되었고, 발적성 위염과 삼출성 위염이 동시에 존재하였던 환자 177명에 대해 연구가 진행되었다. 이 중 남성은 97명 여성은 80명이었다. 177명의 환자 중 경도 발적성/삼출성 위염은 78명, 중등도 발적성/삼출성 위염은 48명, 중증 발적성/삼출성 위염은 51명이었다. 전체 발적성/삼출성 위염 환자에서 H. pylori 감염 환자가 차지하는 비율은 86.5%였다. 세 군 사이에 이상지질혈증은 중등도 발적성/삼출성 위염에서 비율이 낮게 나타났으나 성별, 나이 그리고 이 외 기저 특성에서는 군 간 유의한 차이를 보이지 않았다(Table 1).
일차결과지표인 발적성/삼출성 위염의 중증도에 따른 H. pylori 감염 비율을 보기 위해 경도 발적성/삼출성 위염과 중등도 혹은 중증 발적성/삼출성 위염을 비교 분석하였다. 그 결과 H. pylori 감염률은 경도 발적성/삼출성 위염에 비해 중등도 혹은 중증 발적성/삼출성 위염에서 유의한 차이를 보이지 않았다(경도 91.0%, 중등도 혹은 중증 82.8%, p=0.115) (Table 2). 두 내시경 의사(O.Z.K., K.H.R.)의 코헨의 카파계수(kappa value)는 0.593으로 중등도(moderate)로 나왔고, 관찰자 간 차이(relative interobserver variation)는 절대적 차이(absolute difference)가 4.6%, 개인간 표준분포(individual SD)가 5%로 측정되었다(Table 3).
H. pylori 감염에 영향을 미치는 인자를 분석하기 위해 발적성/삼출성 위염의 중증도를 공변량으로 포함하여 로지스틱 회귀모델로 분석하였을 때 발적성/삼출성 위염의 중증도는 H. pylori 감염과 연관이 없었으며, 다른 기저 특성 중에도 유의한 인자를 발견할 수 없었다(Table 4).
발적성/삼출성 위염의 중증도가 심할수록 H. pylori 감염 가능성이 높을 것이라 예측하였으나 발적성/삼출성 위염의 중증도에 따라 H. pylori 감염 비율은 유의한 차이가 나지 않았다. 다만, 발적성/삼출성 위염이 있는 전체 연구 대상자에서의 H. pylori 감염률은 86.4%로 국내 일반 인구집단의 감염률인 42%에 비해 크게 높음을 확인하였다.13 중증도에 따른 분석에서 양 군 간에 유의한 차이를 보이지 않았기 때문에 발적성/삼출성 위염의 중증도를 기준으로 H. pylori의 감염 여부를 구분하여 판단하지 않아도 될 것으로 보인다. 다시 말하자면, 발적성/삼출성 위염이 경도라 하더라도 발적성/삼출성 위염이 중등도 혹은 중증인 경우에 비해 H. pylori 감염 가능성이 낮다고 판단할 수는 없음을 알 수 있다.
국내 다른 연구에서는 교토 분류의 내시경 소견을 적용하여 H. pylori 감염을 예측할 수 있는 인자를 연구하였다. H. pylori 감염을 예측할 수 있는 인자 중에 백탁 점액의 H. pylori 감염률은 87.5%로 본 연구와 비슷한 수치였다. 또한 점막 부종, 역류성 식도염, 출혈 반(hemorrhagic spots), 측선상 발적(red streak), 십이지장염을 관련 인자로 제시하였다.14 일본에서 시행된 연구에 의하면 H. pylori의 감염을 예측할 수 있는 내시경적 소견은 다음과 같다. 미만성 발적(diffuse redness), 반상 발적(patchy redness), 두꺼워진/구불구불한 점막 주름(enlarged, tortuous fold), 점막 부종(mucosal swelling), 위소구 부종(swelling of areae gastricae)이 있는 경우와 결절형 변화(nodular change), 점상 발적(spotty redness), 측선상 발적(red streak), 집합 세정맥의 규칙적인 배열(regular arrangement of collecting venules), 위저선 용종(fundic gland polyposis), 편평 미란, 융기형 미란, 출혈성(hemorrhagic) 미란, 출혈반성(bleeding spot) 미란이 없는 경우 등이 있다.15
H. pylori 연관 위염 중에 발적성/삼출성 위염은 다른 위염에 비해 감별하기가 용이하여 진단이 수월하다. 하지만 발적성/삼출성 위염의 중증도에 따라 H. pylori 감염 빈도와의 연관성을 밝힌 연구는 없었다. 위궤양 환자를 대상으로 H. pylori와 궤양 삼출물과의 관계를 분석한 연구에서는 전체 연구 대상자의 96%에서 위 궤양의 흰색 삼출물로부터 H. pylori가 발견되었음을 보고하였다.12 H. pylori가 가지고 있는 강력한 요소분해효소, 많은 양의 세포외부 과산화수소분해효소(extracelluar catalase)와 같은 독성 요소가 위염을 일으키는 것으로 생각된다.12 이러한 병인론이 흰색 삼출물에서 H. pylori가 높은 빈도로 발견되는 것과 연관이 있음을 알 수 있다.
본 연구의 제한점으로는 단일 기관에서 내시경 소견만을 바탕으로 발적성/삼출성 위염을 진단하고 중증도를 분류하여 객관성이 부족하다는 점을 들 수 있다. 두 명의 관찰자가 독립적으로 내시경 소견을 판독하여 중등도의 일치도를 보임을 확인하였으나, 보다 명확한 결론을 내기 위해서는 다수의 내시경 의사가 참여하는 다기관 연구가 필요하다.
그리고 발적성/삼출성 위염이 없는 대상자를 연구에 포함시키지 못하였기 때문에 발적성/삼출성 위염 자체가 H. pylori 감염과 얼마나 연관성이 높은가에 대해서는 평가할 수 없었다는 제한점이 있다. 그리고 과거 H. pylori 감염이 있었던 환자나 이전 H. pylori 제균 치료를 받았던 환자를 분석에 포함시키지 않았기 때문에 H. pylori 감염 후 변화하는 위염의 중증도를 평가하지 못한 한계도 있다. 또한, 급속요소분해효소 검사만으로 H. pylori 감염을 판정하였기 때문에 급속요소분해효소 검사의 위음성으로 인해 H. pylori 감염률이 저평가 되었을 가능성도 존재한다.
그럼에도 불구하고 본 전향적 연구는 발적성/삼출성 위염의 중증도가 H. pylori 감염을 예측하는 데 연관이 있는지를 확인한 최초의 연구로, 발적성/삼출성 위염의 중증도에 따라 H. pylori 감염률은 차이를 보이지 않았다. 이는 내시경 검사 중 경도의 발적성/삼출성 위염이 관찰되더라도 H. pylori 검사를 적극적으로 시행해야 함을 시사한다.
목적: H. pylori 감염은 시드니 분류 시스템의 내시경적 소견 중 하나인 발적성/삼출성 위염과 높은 연관성을 가지고 있다고 알려져 있다. 본 연구는 발적성/삼출성 위염의 내시경적 중증도에 따른 H. pylori 감염률을 평가하고자 하였다.
대상 및 방법: 이 연구는 전향적 연구로 검진 목적의 위내시경으로 발적성/삼출성 위염을 진단받은 무증상의 성인을 대상으로 하였다. H. pylori 감염을 진단하기 위해 급속요소분해검사가 시행되었다. 발적성/삼출성 위염의 중증도는 시드니 분류 체계를 사용하여 2명의 관찰자가 내시경 소견을 평가하였다. 연구의 일차결과지표는 경도 발적성/삼출성 위염을 중등도 또는 중증 발적성/삼출성 위염과 비교하여 H. pylori 감염률이 차이가 있는지로 하였다.
결과: 총 177명의 환자가 포함되었다. 발적성/삼출성 위염 전체 환자의 H. pylori 감염률은 86.4%였다. 177명의 환자 중 78명은 경도, 48명은 중등도, 51명은 중증이었다. 헬리코박터 감염률은 경도와 중등도-중증 발적성/삼출성 위염 모두 유사하였다(91.0% vs. 82.8%, p=0.115).
결론: 헬리코박터 감염은 발적성/삼출성 위염에서 흔하게 관찰되었다. 그러나 발적성/삼출성 위염의 중증도에 따라서는 헬리코박터 감염은 차이가 없었다. 따라서 경도의 발적성/삼출성 위염 환자에서라도 헬리코박터 감염에 대한 검사는 필요함을 알 수 있다.
색인단어: 헬리코박터 파일로리; 발적성/삼출성 위염; 시드니 분류 체계
REFERENCES
1. Kim BJ, Kim JG. 2015; Epidemiology and pathophysiology of Helicobacter pylori infections in Korea. Korean J Med. 89:133–141. DOI: 10.3904/kjm.2015.89.2.133.
2. Leodolter A, Kulig M, Brasch H, Meyer-Sabellek W, Willich SN, Malfertheiner P. 2001; A meta-analysis comparing eradication, healing and relapse rates in patients with Helicobacter pylori-associated gastric or duodenal ulcer. Aliment Pharmacol Ther. 15:1949–1958. DOI: 10.1046/j.1365-2036.2001.01109.x. PMID: 11736726.
3. Ford AC, Yuan Y, Forman D, Hunt R, Moayyedi P. 2020; Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database Syst Rev. 7:CD005583. DOI: 10.1002/14651858.CD005583.pub3. PMID: 32628791. PMCID: PMC7389270.
4. Kim JH, Kim HY, Kim NY, et al. 2001; Seroepidemiological study of Helicobacter pylori infection in asymptomatic people in South Korea. J Gastroenterol Hepatol. 16:969–975. DOI: 10.1046/j.1440-1746.2001.02568.x. PMID: 11595059.
5. Yim JY, Kim N, Choi SH, et al. 2007; Seroprevalence of Helicobacter pylori in South Korea. Helicobacter. 12:333–340. DOI: 10.1111/j.1523-5378.2007.00504.x. PMID: 17669107.
6. Lim SH, Kwon JW, Kim N, et al. 2013; Prevalence and risk factors of Helicobacter pylori infection in Korea: nationwide multicenter study over 13 years. BMC Gastroenterol. 13:104. DOI: 10.1186/1471-230X-13-104. PMID: 23800201. PMCID: PMC3702482.
7. Lee HJ, Chung JM, Seo EH, Jeon SW. 2008; Clinicopathologic characteristics of gastric cancer diagnosed at health screening. Korean J Med. 75:665–672.
8. Cho SJ. 2010; Screening of gastric cancer. Korean J Med. 79:219–223. DOI: 10.4174/jkss.2010.79.3.223.
9. Kamada T, Haruma K, Inoue K, Shiotani A. 2015; Helicobacter pylori infection and endoscopic gastritis -Kyoto classification of gastritis. Nihon Shokakibyo Gakkai Zasshi. 112:982–993.
10. Lee SY. 2019; Helicobacter pylori Infection and the Kyoto classification of gastritis. Korean J Helicobacter Up Gastrointest Res. 19:81–87. DOI: 10.7704/kjhugr.2019.19.2.81.
11. Tytgat GN. 1991; The Sydney System: endoscopic division. Endoscopic appearances in gastritis/duodenitis. J Gastroenterol Hepatol. 6:223–234. DOI: 10.1111/j.1440-1746.1991.tb01469.x. PMID: 1912432.
12. Ohkusa T, Okayasu I, Yamada M, et al. 1991; A high frequency of detection of Helicobacter pylori in whitish exudate of gastric ulcer. J Clin Gastroenterol. 13:649–655. DOI: 10.1097/00004836-199112000-00008. PMID: 1722231.
13. Lim SH, Kim N, Kwon JW, et al. 2018; Trends in the seroprevalence of Helicobacter pylori infection and its putative eradication rate over 18 years in Korea: a cross-sectional nationwide multicenter study. PLoS One. 13:e0204762. DOI: 10.1371/journal.pone.0204762. PMID: 30332428. PMCID: PMC6192591.
14. Lim E, Jo IH, Kim YJ, Chung WC. 2021; In situ diagnosis of Helicobacter pylori infection using the endoscopic Kyoto scoring system. Korean J Helicobacter Up Gastrointest Res. 21:322–332. DOI: 10.7704/kjhugr.2021.0046.
15. Kato T, Yagi N, Kamada T, et al. 2013; Diagnosis of Helicobacter pylori infection in gastric mucosa by endoscopic features: a multicenter prospective study. Dig Endosc. 25:508–518. DOI: 10.1111/den.12031. PMID: 23369058.
Fig. 1
Gastroscopy findings of erythematous/exudative gastritis. (A) Mild erythematous/exudative gastritis is called when a few punctate exudates are visible. (B) Moderate erythematous/exudative gastritis is called when focally patches or plaques of exudate are seen. (C) Severe erythematous/exudative gastritis is called when extensive areas are covered by exudate.
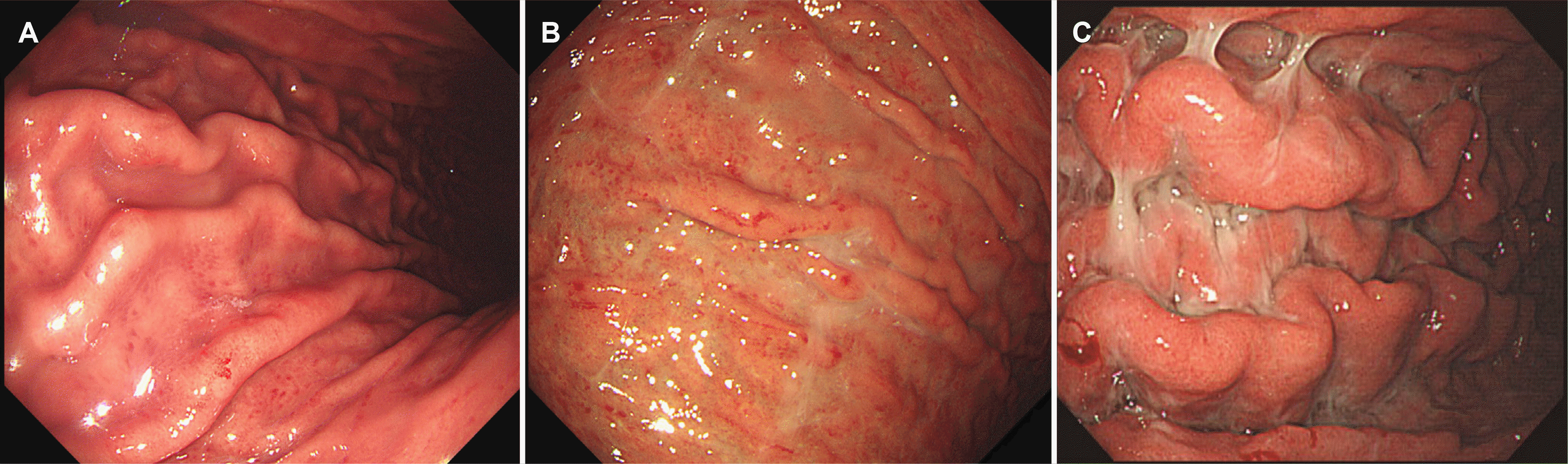
Table 1
Baseline Characteristics of Patients with Erythematous/exudative Gastritis
Table 2
Comparison of Mild Erythematous/exudative Gastritis with Moderate and Severe Erythematous/exudative Gastritis
| Mild erythematous/exudative gastritis (n=78) | Moderate, severe erythematous/exudative gastritis (n=99) | p-value | |
|---|---|---|---|
| H. pylori | 0.115 | ||
| Negative | 7 (9.0) | 17 (17.2) | |
| Positive | 71 (91.0) | 82 (82.8) |
Table 3
Severity of Erythematous/exudative Gastritis Determined by Two Different Investigators
Table 4
Logistic Regression Analysis for Identifying Factors associated with H. pylori Infection




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download