Abstract
Latent tuberculosis (TB) infections (LTBI) impose clinical challenges in terms of the diagnosis and treatment of inflammatory bowel disease (IBD), especially in TB-endemic areas. While steroids and biologics have become increasingly useful in the treatment of patients with moderate-to-severe IBD, the risk of reactivation or developing TB is increased due to their potent immunosuppressive effects. Tumor necrosis factor-alpha inhibition may result in the activation of a latent TB infection, and most cases manifest as more severe forms of disseminated TB. All potential users of immunosuppressive therapy should be screened for LTBI, and appropriate measures for the management of latent and active TB should be undertaken with immediate initiation of anti-TB treatment. Biologics should be withheld during TB treatment, and the proper timing for the resumption of IBD therapy during or after TB treatment should be individualized. This review summarizes the latest knowledge on the risk assessment, detection, and management of latent and active TB infections in patients with IBD.
Go to : 
염증성 장질환(inflammatory bowel disease, IBD)은 면역세포의 침윤으로 인해 위장관에 염증과 궤양이 유발되는 만성 염증성 면역 질환으로, 궤양성 대장염과 크론병이 대표적이다. 최근 서구 및 선진국뿐만 아니라 아시아 지역에서도 유병률이 증가하고 있으며,1 발생 기전은 아직 명확히 정의된 바 없으나 장내 세균총의 변화를 야기하는 유전·환경적 영향, 서구화된 식이 등과 함께 위장관 내 미생물총에 대한 점막의 비정상적인 면역 반응이 중요한 병인으로 생각되고 있다.2,3 IBD의 치료 목표는 증상 조절과 점막 병변의 치유 그리고 넓게는 조직학적 관해로서, 환자의 질병 활성도와 병소의 위치에 따라 비정상적인 면역 반응에 관계된 면역조절 단백을 타겟으로 한 상향식 치료가 권고되고 있다.4 현재 중등도 이상의 IBD에서 관해 유도에 주가 되는 스테로이드와 생물학제제 등을 포함한 면역치료 약제들은 환자의 증상과 질병 경과를 효과적으로 호전시킬 수 있지만, 동시에 강력한 면역 억제효과로 인한 기회감염 또한 중요한 부작용 중 하나이다.
이러한 기회 감염 중 가장 임상적으로 문제가 되는 것이 잠복 결핵의 활성화이다. 우리나라는 결핵의 고위험 지역으로 우리나라의 결핵 유병률은 2015년 10만 명당 35.7명이었다.5,6 결핵 감염자 중 10%는 활동성 결핵으로 발병하고, 나머지 90%는 체내에 결핵균이 존재하지만 활동성이 억제되어 증상이나 전염력이 없어 치료가 필요하지 않은 잠복결핵(latent tuberculosis infection, LTBI) 상태를 유지한다. 그러나 LTBI는 숙주 면역 조절의 균형이 틀어진 상태에서는 활동성 결핵으로 발병할 수 있는데, 특히 스테로이드나 면역조절제 등을 투여 받는 IBD 환자들처럼 면역력이 저하된 경우에는 LTBI가 활동성 결핵으로 전환될 위험성이 높을 뿐만 아니라 기존의 IBD가 악화될 가능성 또한 있어 결핵의 선별 검사와 치료가 중요하다. 본고에서는 최근 문헌 검토를 통해 IBD 환자에서 잠복, 활동성 결핵에 대한 검사 및 치료 또는 현재 IBD 환자에게 투여되고 있는 약제의 위험도와 주의 요인들에 대해 기술해보고자 한다.
Go to : 
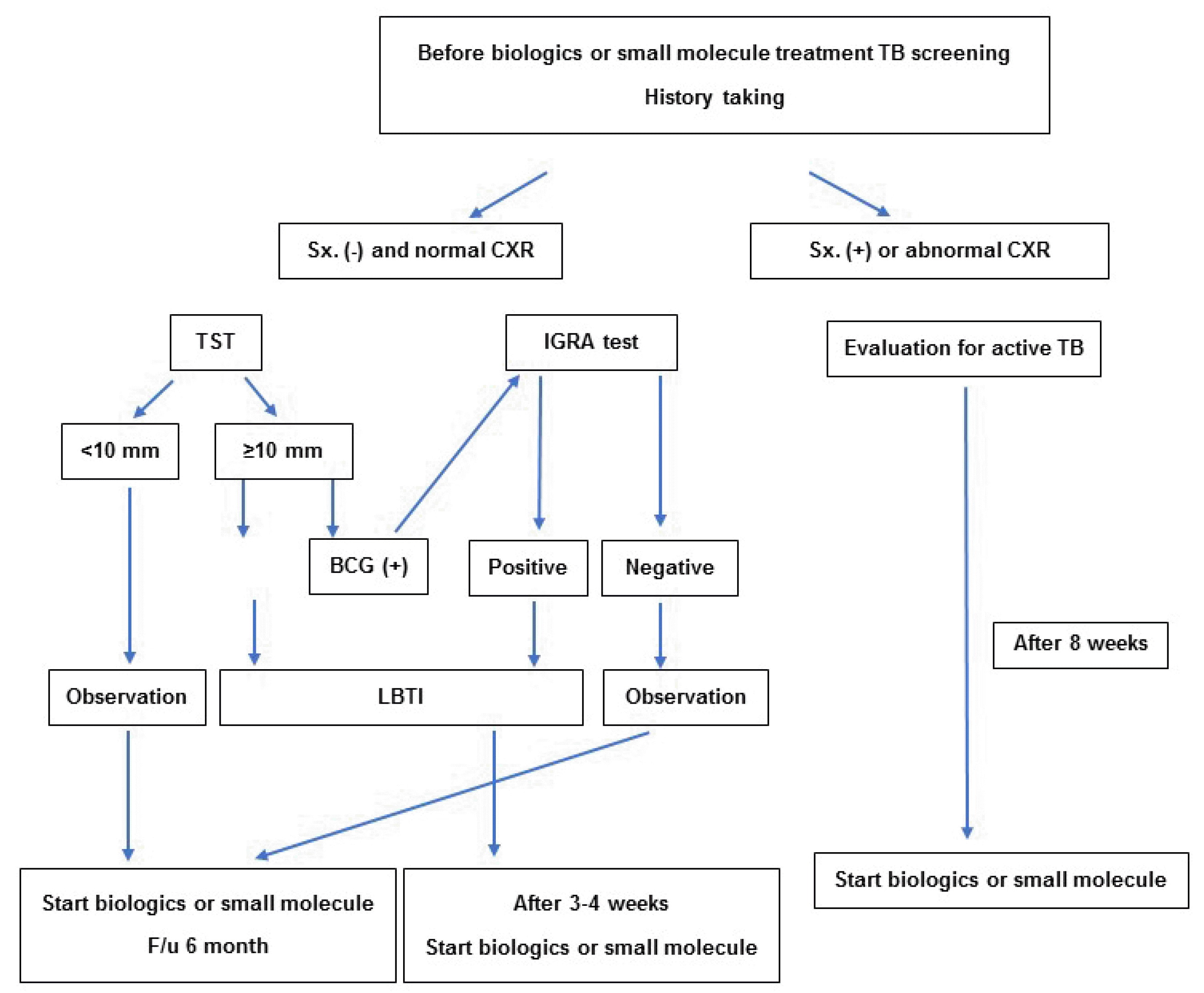
잠복 결핵은 특히 면역 저하 환자들에서 그 진단이 쉽지않다. 우리나라에서 결핵의 진단에는 tuberculin skin test (TST) 그리고 interferon-γ releasing assay (IGRA)가 일반적으로 사용되고 있는데, 이런 검사들을 시행하기 전 환자에 대한 문진이 시행되어야 한다. 결핵 감염이 의심되거나 생물학제제를 사용 중 또는 예정인 IBD 환자는 잠복 또는 활동성 결핵 감염에 대한 확인이 필요하다. 환자의 병력 청취를 통해 과거 결핵의 치료 여부, 최근 결핵 환자와의 접촉력, 결핵 호발 지역으로의 여행력 또는 현재 호소하는 증상 등을 확인하고, 신체 검사 및 흉부 엑스레이 영상 그리고 진단 검사를 통해 결핵 감염 여부를 종합적으로 판단한다. 활동성 결핵으로 진단되면 즉각적으로 결핵 치료를 시작하고, 활동성이 아닌 경우라도 다음 해당하는 환자군에서는 잠복 결핵 감염으로 진단할 수 있겠다.7
1) 활동성 결핵의 임상 및 방사선학적 증거가 없으나 TST또는 IGRA 검사가 양성인 경우
2) TST 또는, IGRA 검사 결과가 하나가 음성이거나 둘 다음성이지만 이전에 결핵이 적절히 치료되지 않은 증거가 있는 경우
3) 다른 기준에 해당하지 않더라도 과거 결핵 치료력 없이자연 치유된 병변이 존재하는 경우 또는 치료되지 않은 결핵을 시사하는 흉부 엑스레이 소견이 확인된 경우
4) 결핵균을 보균하고 있으나 결핵 선별 검사가 시행되기전인 결핵 환자와 밀접한 접촉을 하였거나 결핵 선별 검사를 통해 양성으로 판정되었으나 아직 치료가 시행되지 않은 환자와 밀접한 접촉을 한 경우
LTBI를 진단하는 기준은 지역과 나라마다 상이하여 아직 확실히 정립된 바가 없으나, 우리나라에서는 이전 결핵 치료력과 결핵 환자와의 접촉력을 포함한 위험인자의 유무, 신체 검진, 흉부 엑스레이 그리고 TST와 IGRA 검사를 기본으로 하고 있다. TST는 결핵균 항원을 피내 주사 후 48-72시간 뒤 주사 부위에 생긴 경결의 크기를 확인하여 10 mm 이상일 때 양성으로 진단하며, IGRA는 M. tuberculosis 균에서 정제된 항원으로 환자의 말초 혈액 림프구를 자극하여 생성된 in-terferon gamma를 확인한다. 국내에서는 1962년부터 모든 영유아들에게 결핵균에 대한 Bacillus Calmette-Guerin 예방접종을 시행하고 있어 TST의 위양성률이 높으며 피하 경결을 해석하기 위한 추적 관찰이 필요하므로8 이에 대한 진단 특이도가 높은 IGRA 검사를 같이 시행하는 경우가 많다.9 TST 단독으로 결핵을 진단하는 것은 추천되고 있지 않으며, 국내 결핵 진료지침 4판을 비롯한 국외 가이드라인 에서는 일반적으로 IGRA 단독 또는 TST와 IGRA를 병합한 검사를 시행하여 이 중 하나라도 양성인 경우 잠복 결핵으로 진단하도록 권고하고 있다.10,11
TST와 IGRA 검사에서 양성 결과는 결핵균 감염을 의미하기는 하나 잠복 결핵과 활동성 결핵을 감별하는 기준이 되지는 않는다. 반드시 활동성 결핵이 우선적으로 배제된 후에야 잠복 결핵의 진단이 가능하며, 활동성 결핵 과거력에 대한 확인이 잠복 결핵의 진단 검사보다 우선되어야 한다. 예를 들어 과거 결핵 치료력이 없는 환자에서 흉부 X-ray 상 자연 치유된 이전 결핵을 시사하는 소견이 확인된 경우에는 활동성 결핵을 배제한 후 잠복 결핵으로 진단할 수 있다.
스테로이드나 면역억제제는 TST와 IGRA 검사 결과의 해석에 혼동을 줄 수 있다. IBD 환자들은 질병의 악화 시점을 정확히 예측하기 어려우며, 면역억제제에 노출된 환자들에서 결핵을 비롯한 감염의 위험성이 높은 것으로 보고된 바 있다.12 그러므로 IBD가 진단되면 특히 생물학적제제가 포함된 치료를 시작하기 전 미리 잠복 결핵 감염 여부에 대한 검사를 시행하는 것이 바람직하다.13 스테로이드나 면역억제제를 투여 받고 있는 IBD 환자들에서 결핵 검사를 시행하는 시점은 신중하게 결정되어야 하며, 검사 시에는 약물 복용력을 필히 확인해야 한다. 한 달 이상의 스테로이드 그리고 3개월 이상의 thiopurine 또는 methotraxate 등과 같은 면역 저하 약물을 장기간 투여 받고 있던 환자에서는 잠복 결핵 검사의 진단 민감도가 낮아질 수 있어, 이런 환자들에서는 1-2주 후 추가로 TST를 재검하는 것이 추천된다.14-17 2가지 면역억제제를 동시에 투여 받고 있거나, IBD가 현재 활동성이지만 아직 면역억제제를 투여 받고 있지 않은 환자에서는 TST 결과가 위음성으로 확인될 수 있어 이에 대한 주의가 필요하다. 또한 증상 조절을 위해 생물학적제제를 교환, 교체하기 전이나 다른 위험인자나 다른 질병이 동반된 등의 특수한 상황에서도 결핵 감염 여부에 대한 재검사가 고려되어야 한다(Fig. 1).
활동성 결핵의 치료는 isoniazid, rifampin, ethambutol, pyrazinamide의 병합 요법 2개월 후 pyrazinamide를 제외한 나머지 3가지 약물을 4-7개월까지 추가로 복용하는 화학 요법(2HERZ+4HE[R])이 적용된다. 잠복 결핵의 치료 방법은 국가마다 상이하나, 우리나라에서는 LTBI의 표준 치료로 isoniazid가 우선적으로 투여되고 있다. Isoniazid는 5 mg/kg/일로 최대 300 mg/일까지 9개월간 투여하는데, 최소 6개월간은 투여가 권장되고 있다. 9개월간 투여 시 결핵균을 대략 90%까지, 6개월간 투여 시에는 60-80%까지 예방효과가 있다는 보고가 있다.18 과거 결핵 치료력이 없는 환자에서 흉부 X-ray 상 자연 치유된 이전 결핵 병변이 확인된 경우 예방적으로 isoniazid를 24주간 투여하였을 때 결핵 발병률이 65%감소하였다는 연구 결과가 있는데,19 이는 이러한 환자를 잠복결핵으로 진단하고 치료 시 활동성 결핵의 발병을 예방할 수있음을 시사한다. 그러나 이전 결핵 치료를 시행 받고 완치되었던 기왕력이 있는 환자들에서는 새로운 감염이 의심되지 않는 한 잠복 결핵에 대한 치료는 권고되지 않는다.20,21
Isoniazid 외에 환자의 순응도나 약제 부작용에 따라 다른 치료 방법들도 가능하다. Isoniazid에 간독성을 보인 환자들은 rifampin 단독 요법으로 교체해 볼 수 있는데, 4개월간 투여하며 10 mg/kg/일로 600 mg/일이 그 최대 용량이다. 또한 3개월간의 rifampin과 isoniazid의 병합 요법도 가능한데, 이는 6개월의 isoniazid 투여와 비슷한 치료율을 보이고 있어 환자의 순응도에 따라 선택할 수 있다.
IBD 환자들은 잠복 결핵이 진단되면 즉시 잠복 결핵에 대한 치료를 시행해야 한다. 치료 시점은 생물학적제제의 개시 시기로부터 적어도 3-4주 전에 선행되어야 하며, 생물학적제제를 투여 중이라면 생물학적제제를 중단하고 잠복 결핵에 대한 치료를 시작한 뒤 최소 3주 후에 생물학적제제의 투여를 시작할 수 있다. 생물학적제제 투여 중에 새롭게 IGRA 양성 소견이 발견되었다면 흉부 X-ray, TST를 통해 활동성 결핵을 반드시 감별해야 하며 이에 따라 치료를 고려해야 한다.10
IBD 환자가 활동성 결핵이 진단된 경우에는 일반적으로 결핵 치료 기간 중에는 투여 중단이 권고된다.4 그러나 IBD의 증상 악화로 생물학제제의 신속한 치료가 필요하다고 판단되는 경우에는 항결핵 치료에 대한 반응이 양호하며 결핵 증상이 중증 미만 그리고 약제 감수성 결핵에 대한 치료가 최소2개월 이상 진행되었음을 확인한 후 약물 투여를 고려해 볼수 있다.20 Aminosalicylates, 스테로이드 그리고 azathioprine, mercaptopurine, methotraxate를 포함한 면역 조절제를 투여 중인 초기 IBD 환자는 위약과 비교 시 결핵 발병의위험성이 높지 않아 가이드라인에서는 이러한 환자들에서는잠복 결핵에 대한 치료는 권고되고 있지 않으나 향후 면역억제 치료가 예상되는 환자의 경우에는 잠복 결핵 진단 초기에치료를 고려하는 것이 필요하겠다.14-16
생물학제제의 사용은 통상적 치료에 반응이 없는 IBD를 포함한 면역 관련 질환자 들에서 증상과 조직학적 호전을 야기함으로써 많은 이점을 가져왔으나, 최근 그 사용이 증가되면서 결핵균의 재활성화 위험성이 재조명되고 있다. IBD 환자들에게 사용되는 생물학적제제 중 infliximab, adalimumab 그리고 golimumab을 포함한 항TNF제제는 감염균 침입 시 면역반응에 중요한 인자로 작용하는 TNF-α를 억제함으로써 잠복 결핵균의 활동성 전환을 가속화 시켜 특히 도입면역 요법(induction therapy) 시 위험도를 증가시킨다.22 RATIO registry 연구에 따르면 항TNF제제를 투여하였을 때 결핵 유병률이 높은 지역에서 결핵의 재활성화 위험성이 다른 지역보다 10.3배 더 높았으며,23 한 국내 연구에 의하면 항TNF제제를 투여받는 IBD 환자에서의 결핵 발병률은 투여 받은 적이 없는 환자에 비해 12배, 일반 인구에 비해서는 42배까지 증가하였다.24 결핵은 보통 항TNF제제를 시작하고 수개월 이내 발병하는 경우가 많았으며,12,25 항TNF제제 중 결핵을 포함한 감염 위험성은 infliximab에서 가장 높고 다음은 adalimumab 순으로 알려져 있다.4,26 또한 항TNF제제 단독 투여군에 비해 methotrexate나 azathioprine을 병합한 군에서는 결핵 재활성화 위험성이 13배 더 높은 것으로 확인되었으며,14 이외에 Janus kinase inhibitor인 tofacitinib도 IBD 환자에서 결핵 발병 위험성이 비교군에 비해 높게 보고되었으므로 항TNF제제와의 병합 투여 시 더욱 주의가 필요하다.
결핵 치료 후 IBD에 대한 치료로 항TNF제제를 포함한 생물학제제나 소분자 치료를 시작 또는 재개하는 이상적인 시기에 대해서는 아직 합의된 바가 없다. 그러나 이러한 치료를 시작할 때에는 면역 저하로 인한 감염의 악화 가능성을 고려하여 항 결핵 치료가 종료되고 최소 4-8주 이상 지난 후 투여 또는 재개를 권고하고 있다.7,27 또한 현재까지의 연구 결과에 따르면 생물학제제 중에서도 vedolizumab이나 항 IL-12/23 제제인 ustekinumab은 기회감염과 악성 종양의 부작용이 상대적으로 낮게 보고되고 있어 생물학적제제 선택 시 감염취약 환자에서 우선적으로 고려될 수 있겠다.
잠복 결핵의 재활성화 여부의 확인을 위해 IBD 환자들에서 생물학제제 개시 전 흉부 X-ray, TST, IGRA 등을 포함한 결핵에 대한 선별 검사가 권고되고 있는데,4 특히 항TNF제제를 투여 받고 있는 환자들은 매년 흉부 X-ray와 IGRA 검사를 통해 활동성 결핵을 배제해야 한다. 항TNF제제를 투여 중인 IBD 환자에서는 선별 검사가 음성이더라도 결핵 감염을 완전히 배제하기 어렵기 때문이다.28,29 또한 결핵 감염에 대한 고위험군이거나 항TNF제제를 고려 중인 환자들에서도 매년 결핵에 대한 재검이 권고된다.4 그러므로 IBD 치료로 생물학적제제를 고려 중인 환자에서는 잠복 결핵에 대한 선별 검사를 우선적으로 시행하는 것이 권고되며, 최근 또는 과거 결핵균에 대한 노출력이 명확한 경우에는 생물학제제 투여 시작 전 잠복 결핵에 대한 치료가 선행되어야 한다.
Go to : 
결론적으로 IBD 환자에서 활동성 결핵이 진단된 경우에는 즉각적으로 항 결핵 치료를 시작해야 하며, 잠복 결핵에 대해서는 통상적으로 isoniazid의 9개월 투여가 권장된다. IBD 환자들의 많은 수에서 증상 조절을 위해 면역억제제가 투여되고 있는데, 이는 LTBI의 활성화 또는 결핵의 일차성 감염 위험성이 높아 주의가 필요하다. 모든 IBD 환자들은 항TNF제제를포함한 생물학적제제 투여를 시작하기 전 결핵에 대한 스크리닝 검사를 해야 하며, 항TNF제제를 투여 받는 동안에도 주의깊은 모니터링이 필요하다. 그러나 현재 시점에서는 생물학제제를 투여 받는 IBD 환자들에서 결핵의 관리에 대한 합의안은아직 없는 상태로, 흉부 X-ray를 시행하는 빈도, 항TNF제제투여 도중 IGRA 결과의 해석, IGRA는 양성이나 흉부 X-ray가정상 소견일 경우의 임상적 해석 그리고 임파선염과 같은 동반증상 등을 포함한 포괄적 권고안의 마련이 필요하다. 또한,질환 초기에 장결핵과의 감별30과 생물학적제제 투여와 관련된결핵 발병 위험성에 대한 연구 그리고 향후 면역억제제에 영향을 받지 않으며 민감도와 정확도가 높은 LTBI 진단 검사와잠복 및 활동성 결핵에 대한 좀 더 효과적이며 안전한 치료법개발을 위한 잘 설계된 연구들이 필요할 것으로 사료된다.
Go to : 
REFERENCES
1. Sood A, Kaur K, Mahajan R, et al. 2021; Colitis and Crohn's Foundation (India): a first nationwide inflammatory bowel disease registry. Intest Res. 19:206–216. DOI: 10.5217/ir.2019.09169. PMID: 32646197. PMCID: PMC8100380.
2. Rustgi SD, Kayal M, Shah SC. 2020; Sex-based differences in inflammatory bowel diseases: a review. Therap Adv Gastroenterol. 13:1756284820915043. DOI: 10.1177/1756284820915043. PMID: 32523620. PMCID: PMC7236567.
3. Geuking MB, Köller Y, Rupp S, McCoy KD. 2014; The interplay between the gut microbiota and the immune system. Gut Microbes. 5:411–418. DOI: 10.4161/gmic.29330. PMID: 24922519. PMCID: PMC4153781.
4. Banerjee R, Ali RAR, Wei SC, Adsul S. 2020; Biologics for the management of inflammatory bowel disease: a review in tuberculosis-endemic countries. Gut Liver. 14:685–698. DOI: 10.5009/gnl19209. PMID: 33191310. PMCID: PMC7667923.
5. Shim TS, Koh WJ, Yim JJ, Lew WJ. 2004; Diagnosis and treatment of latent tuberculosis infection in Korea. Tuberc Respir Dis. 57:101–117. DOI: 10.4046/trd.2004.57.2.101.
6. 2021 annual report on the notified tuberculosis in Korea. [Internet]. Cheongju: Korea Disease Control and Prevention Agency;2021. cited 2022 Jul 19. Available from: https://www.kdca.go.kr/npt/biz/npp/portal/nppPblctDtaView.do?pblctDtaSeAt=1&pblctDtaSn=2598.
7. Kucharzik T, Ellul P, Greuter T, et al. 2021; ECCO guidelines on the prevention, diagnosis, and management of infections in inflammatory bowel disease. J Crohns Colitis. 15:879–913. DOI: 10.1093/ecco-jcc/jjab052. PMID: 33730753.
8. Alrajhi S, Germain P, Martel M, et al. 2020; Concordance between tuberculin skin test and interferon-gamma release assay for latent tuberculosis screening in inflammatory bowel disease. Intest Res. 18:306–314. DOI: 10.5217/ir.2019.00116. PMID: 32182640. PMCID: PMC7385575.
9. Goletti D, Sanduzzi A, Delogu G. 2014; Performance of the tuberculin skin test and interferon-γ release assays: an update on the accuracy, cutoff stratification, and new potential immune-based approaches. J Rheumatol Suppl. 91:24–31. DOI: 10.3899/jrheum.140099. PMID: 24788997.
10. Korean guidelines for tuberculosis. [Internet]. Seoul: The Korean Academy Of Tuberculosis And Respiratory Diseases;2020. cited 2022 Jul 19. Available from: https://www.lungkorea.org/bbs/index.html?code=guide&category=&gubun=&page=1&number=10303&mode=view&keyfield=&key=.
11. Tuberculosis: clinical diagnosis and management of tuberculosis, and measures for its prevention and control. [Internet]. London: National Institute for Health and Clinical Excellence (UK);2011. cited 2022 Jul 19. Available from: https://www.ncbi.nlm.nih.gov/books/NBK97852/.
12. Bonovas S, Fiorino G, Allocca M, et al. 2016; Biologic therapies and risk of infection and malignancy in patients with inflammatory bowel disease: a systematic review and network meta-analysis. Clin Gastroenterol Hepatol. 14:1385–1397.e10. DOI: 10.1016/j.cgh.2016.04.039. PMID: 27189910.
13. Maaser C, Sturm A, Vavricka SR, et al. 2019; ECCO-ESGAR guideline for diagnostic assessment in IBD part 1: initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis. 13:144–164. DOI: 10.1093/ecco-jcc/jjy113. PMID: 30137275.
14. Lorenzetti R, Zullo A, Ridola L, et al. 2014; Higher risk of tuberculosis reactivation when anti-TNF is combined with immunosuppressive agents: a systematic review of randomized controlled trials. Ann Med. 46:547–554. DOI: 10.3109/07853890.2014.941919. PMID: 25105206.
15. Bogas M, Machado P, Mourão AF, et al. 2010; Methotrexate treatment in rheumatoid arthritis: management in clinical remission, common infection and tuberculosis. Results from a systematic literature review. Clin Rheumatol. 29:629–635. DOI: 10.1007/s10067-010-1380-z. PMID: 20140758.
16. Chen YJ, Wu CY, Shen JL, Chen TT, Chang YT. 2013; Association between traditional systemic antipsoriatic drugs and tuberculosis risk in patients with psoriasis with or without psoriatic arthritis: results of a nationwide cohort study from Taiwan. J Am Acad Dermatol. 69:25–33. DOI: 10.1016/j.jaad.2012.12.966. PMID: 23375515.
17. Rahier JF, Ben-Horin S, Chowers Y, et al. 2009; European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 3:47–91. DOI: 10.1016/j.crohns.2009.02.010. PMID: 21172250.
18. Cohn DL, O'Brien RJ, Geiter LJ, et al. 2000; Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR Morb Mortal Wkly Rep. 49:1–54. DOI: 10.1037/e548072006-001. PMID: 32053584. PMCID: PMC7041302.
19. International Union Against Tuberculosis Committee on Prophylaxis. Efficacy of various durations of isoniazid preventive therapy for tuberculosis: five years of follow-up in the IUAT trial. International Union Against Tuberculosis Committee on Prophylaxis. Bull World Health Organ. 1982; 60:555–564. PMID: 6754120. PMCID: PMC2536088.
20. Park DI, Hisamatsu T, Chen M, et al. 2018; Asian Organization for Crohn's and Colitis and Asia Pacific Association of Gastroenterology consensus on tuberculosis infection in patients with inflammatory bowel disease receiving anti-tumor necrosis factor treatment. Part 2: Management. J Gastroenterol Hepatol. 33:30–36. DOI: 10.1111/jgh.14018. PMID: 29024102.
21. Korean Association for the Study of Intestinal Diseases. Inflammatory bowel disease. Seoul: Medbook;2016.
22. Hibi T, Kamae I, Pinton P, et al. 2021; Efficacy of biologic therapies for biologic-naïve Japanese patients with moderately to severely active ulcerative colitis: a network meta-analysis. Intest Res. 19:53–61. DOI: 10.5217/ir.2019.09146. PMID: 32312035. PMCID: PMC7873404.
23. Tubach F, Salmon D, Ravaud P, et al. 2009; Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: the three-year prospective French Research Axed on Tolerance of Biotherapies registry. Arthritis Rheum. 60:1884–1894. DOI: 10.1002/art.24632. PMID: 19565495. PMCID: PMC2921546.
24. Singh JA, Wells GA, Christensen R, et al. 2011; Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev. 2011:CD008794. DOI: 10.1002/14651858.CD008794.pub2. PMCID: PMC7173749. PMID: 21328309.
25. Ford AC, Peyrin-Biroulet L. 2013; Opportunistic infections with anti-tumor necrosis factor-α therapy in inflammatory bowel disease: meta-analysis of randomized controlled trials. Am J Gastroenterol. 108:1268–1276. DOI: 10.1038/ajg.2013.138. PMID: 23649185.
26. Ogata H, Hagiwara T, Kawaberi T, Kobayashi M, Hibi T. 2021; Safety and effectiveness of adalimumab in the treatment of ulcerative colitis: results from a large-scale, prospective, multicenter, observational study. Intest Res. 19:419–429. DOI: 10.5217/ir.2020.00033. PMID: 33166442. PMCID: PMC8566831.
27. British Thoracic Society Standards of Care Committee. 2005; BTS recommendations for assessing risk and for managing Mycobacterium tuberculosis infection and disease in patients due to start anti-TNF-alpha treatment. Thorax. 60:800–805. DOI: 10.1136/thx.2005.046797. PMID: 16055611. PMCID: PMC1747200.
28. Cagatay T, Bingol Z, Kıyan E, et al. 2018; Follow-up of 1887 patients receiving tumor necrosis-alpha antagonists: tuberculin skin test conversion and tuberculosis risk. Clin Respir J. 12:1668–1675. DOI: 10.1111/crj.12726. PMID: 29028148.
29. Abitbol Y, Laharie D, Cosnes J, et al. 2016; Negative screening does not rule out the risk of tuberculosis in patients with inflammatory bowel disease undergoing anti-TNF treatment: a descriptive study on the GETAID cohort. J Crohns Colitis. 10:1179–1185. DOI: 10.1093/ecco-jcc/jjw129. PMID: 27402916.
30. Limsrivilai J, Pausawasdi N. 2021; Intestinal tuberculosis or Crohn's disease: a review of the diagnostic models designed to differentiate between these two gastrointestinal diseases. Intest Res. 19:21–32. DOI: 10.5217/ir.2019.09142. PMID: 32311862. PMCID: PMC7873401.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download