Abstract
Inflammatory bowel disease (IBD), comprising Crohn’s disease and ulcerative colitis, is a chronic inflammatory condition of the gastrointestinal tract, which is often accompanied by altered gut microbial composition. Gut dysbiosis in IBD is considered to be the reason for the high risk of Clostridioides difficile infection (CDI) in patients with IBD. Therefore, CDI should be evaluated in IBD patients with a symptom flare. Medical treatment of non-severe CDI in IBD is similar to that in non-IBD patients and includes oral vancomycin or fidaxomicin. The risk of recurrent CDI in IBD is higher than in non-IBD patients and this could be mitigated by fecal microbiota transplantation. As CDI may worsen the clinical outcomes of IBD, patients should be carefully monitored and an escalation of IBD therapy needs to be considered when there is no improvement seen with the antimicrobial treatment of CDI. This review discusses the risk, pathophysiology, diagnosis, and management of CDI in IBD.
크론병과 궤양성 대장염으로 대표되는 염증성 장질환(inflammatory bowel disease, IBD)은 위장관에 걸쳐 만성적으로 반복되는 염증 질환이며 최근 국내를 비롯하여 아시아 지역에서 발병률이 급격히 증가하고 있다.1,2 명확한 발병 원인은 밝혀지지 않았으나 유전 인자, 항생제 사용 및 식생활 변화 등의 환경 요인과 장내 미생물에 대한 면역 체계 이상 반응 등이 가능한 원인으로 알려진다.3 IBD 환자에서 장내 미생물의 변화가 동반되는데, 이러한 장내 미생물 불균형은 IBD 환자에서 Clostridioides difficile infection (CDI)의 위험성을 높이는 주요 원인이다.4
Clostridioides difficile (C. diff)은 아포(spore)를 생성하는 그람 양성 혐기성 균으로 원내 설사의 주요 원인이다.5 C. diff 에 노출되면 무증상 집락 형성에서부터 심한 전격성 장염에 이르기까지 다양한 임상 스펙트럼을 보인다.5 IBD 환자에서 CDI의 위험성은 일반인에 비해 높고 증상도 IBD의 재발 증상과 유사하므로 감별이 쉽지 않다. 또한 IBD의 주된 치료인 면역 억제제의 사용은 CDI의 위험성을 더욱 증가시킬 수 있으므로 정확한 진단과 이에 따른 적절한 치료가 중요하다. 본고에서는 CDI의 위험인자와 역학, IBD에서의 CDI 진단과 치료에 대해 알아보고자 한다.
일반인에서 CDI의 위험인자는 입원, 항생제 사용, 고령(65세이상), 여성, 면역억제제 사용과 복합적인 내과 동반 질환 등이다.6 그러나 IBD 환자들은 이러한 위험인자가 없더라도 CDI 위험이 높은데, 이는 의료진과의 잦은 접촉, 면역억제제 사용 및 장내 미생물 불균형 등과 연관이 있을 것으로 여겨진다. 전향 연구에 의하면 입원력이나 스테로이드 및 면역조절제, 항생제 사용력이 없는 임상적 관해인 IBD 환자에서 C. diff 보균율이 일반인에 비해 높았다(8.2% vs. 1.0%).7 일반인에 비해 크론병 환자의 경우 CDI 위험률은 2배, 궤양성 대장염의 경우 3배에 이른다.8 크론병에 비해 궤양성 대장염에서 CDI 위험이 더 높은데, 이는 크론병에 비해 궤양성 대장염에서 대장 침범이 많고 이로 인한 장내 미생물 불균형 위험이 높은 것과 연관이 있는 것으로 생각된다.9 IBD군에서 CDI 위험인자는 다양하게 보고되었다. 응급실 방문, 입원, 최근 비스테로이드성 항염증약 사용이 CDI 위험인자로 보고되었고10,11 위산분비억제제, 항생제, 면역조절제는 서로 상반된 결과가 발표되기도 하였다.12-14 최근 22개의 연구를 메타분석한 결과에 의하면 대장 침범, 생물학제제 및 항생제 사용이 IBD에서 CDI의 독립적 위험인자였다.15
일반인에서 CDI의 전형적인 증상은 최근 항생제 사용 혹은의료기관 방문 후에 발생하는 수양성 설사, 복통, 구역감 및 발열 등이다.19 흔한 혈액 검사실 소견은 백혈구 상승 및 대변 백혈구 양성이다. IBD 환자들은 항생제 사용이나 의료기관 노출 없이도 CDI 발생이 가능하고 증상만으로는 IBD 재발과 감별이 불가능하며 CDI의 특징적인 내시경 소견인 노란색의 위막형성도 CDI가 동반된 IBD 환자에서는 드물기 때문에20 새로이 발생하는 설사 증상에서는 이전 항생제 사용과 관계없이 CDI 검사를 시행해야 한다.21
CDI 진단 방법은 대변에서 독소 분비 유무와 관련 없이모든 C. diff 균을 찾아내는 glutamate dehydrogenase (GDH) enzyme immune-assay (EIA) 법과 독소 유전자를 polymerase chain reaction (PCR)으로 검출하는 방법이 있다. 이들 방법은 민감도가 높다는 장점이 있으나 특이도가 낮은 단점이 있다. 설사 등의 증상이 있을 경우에는 이들 검사의 양성 예측도가 높지만 IBD 환자에서는 증상이 감별에 도움을 주지 못하므로 검사의 임상적 의의가 적다.4,21-23 따라서 특이도가 높은 C. diff 독소 A와 B에 대한 EIA 검사와 함께 사용하여 검사의 정확도를 높여야 한다. 독소에 대한 PCR 검사 혹은 GDH EIA 검사에서 양성이지만 독소 A와 B에 대한 EIA 검사가 음성일 경우에는 CDI보다는 C. diff 집락 형성으로 보고 증상의 다른 원인을 찾아야 한다.
IBD 환자에서 CDI가 함께 있을 경우 병의 경과를 악화시킬 수 있다. CDI가 있는 경우, IBD의 치료 스텝-업, 응급실 방문, 긴 입원 기간 및 수술의 위험성이 높았다.24-26 입원한 궤양성 대장염 환자에서 CDI가 있는 경우 대장 절제율이 4.3%에서 8.8%로 상승하였고27 최근 메타분석에서도 CDI는 IBD에서 수술률과 사망률을 증가시켰다.15,28,29 CDI가 있는 IBD 환자는 CDI가 없는 환자에 비해 사망률이 4배 증가하였다.28,30 흥미롭게도 크론병에 비해 궤양성 대장염에서 이러한 차이가 더욱 두드러진다.9,31,32 명확한 원인은 알 수 없으나 궤양성 대장염에서 CDI 영향이 더욱 큰 것은 대장 침범이 CDI의 독립 위험인자인 점,31 장내 미생물의 역할이 대장에서 큰 점, 그리고 메타분석에서 대장 국한 크론병의 환자 수가 적어 통계적으로 의미 있는 결과를 보여주지 못한 점32 등을 고려하면 질환 침범 부위(대장)에 기인하는 것으로 생각된다. 그러나 한국 IBD 질병 경과에 미치는 CDI의 영향은 서양과 차이가 있어 보인다. 국내 7개의 3차 기관에서 전향적으로 증상재발한 궤양성 대장염 환자를 대상으로 C. diff 검사를 시행하였다. 총 81명 중 8명(9.9%)에서 CDI가 진단되었으나 CDI 유무에 따라 입원 기간이나 수술률에 차이는 없었다.33 환자 수가 적은 단점은 있으나 한국 IBD 환자에서 CDI는 IBD 질병경과에 크게 영향을 주지 않는 것으로 보이며 향후 대규모연구가 필요하다.
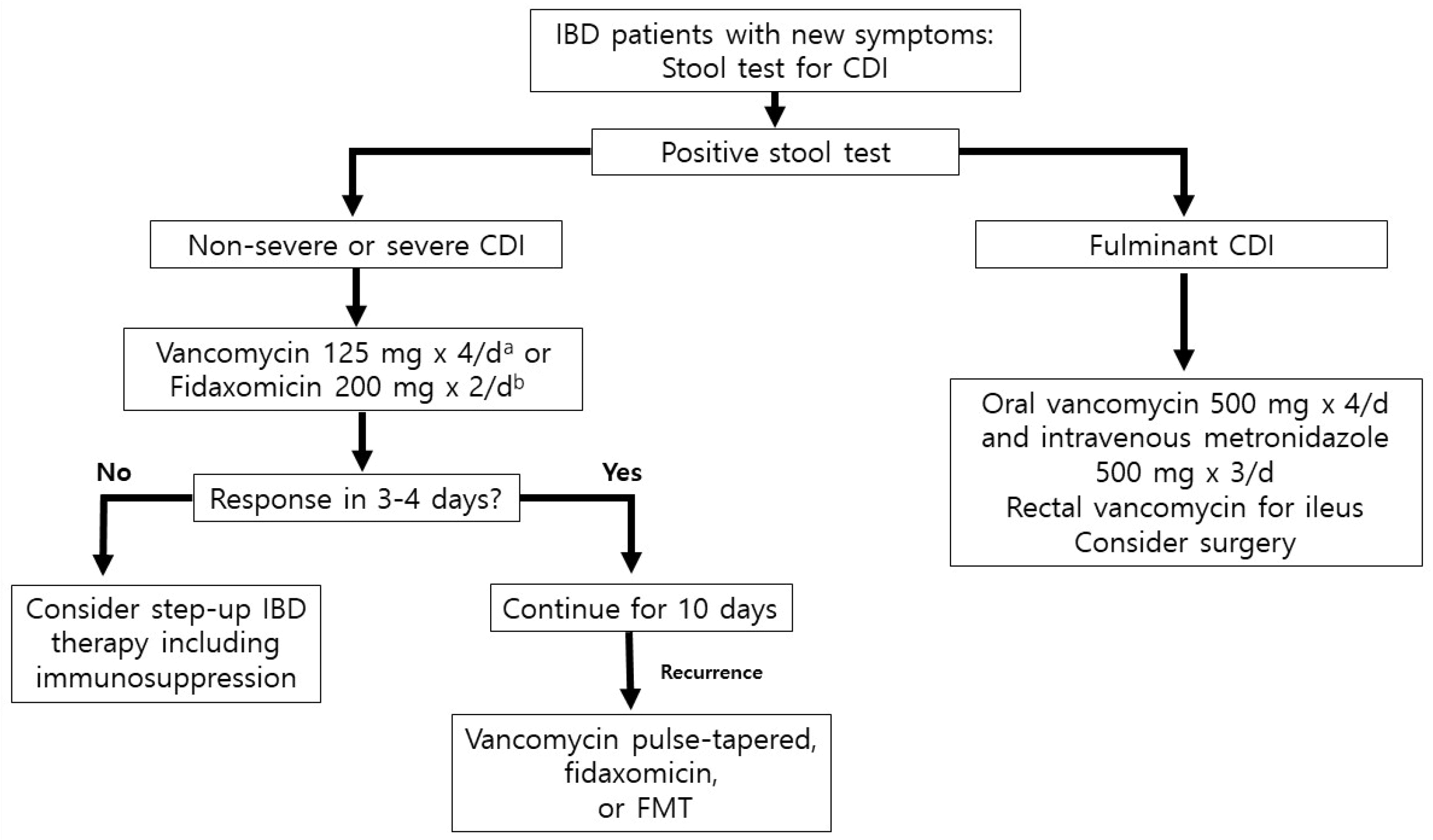
IBD에서 CDI의 치료는 일반인과 동일하다. 증상이 있으면서 대변 검사에서 CDI로 진단된 모든 IBD 환자는 적절한 항생제 치료를 받아야 한다(Fig. 1). 미국감염학회는 백혈구 수가 15,000 cells/mL를 초과하거나 백혈구 기준과 함께 혈청creatinine이 1.5 mg/dL를 초과하는 경우를 severe로 정의하고 혈압 저하, 장마비 혹은 독성거대결장이 동반되는 경우를 전격성 장염으로 정의하며 위 사항에 해당하지 않는 경우를 non-severe로 정의하였다.5
처음으로 non-severe 혹은 severe CDI가 발생한 IBD 환자는 경구 반코마이신 125 mg을 하루 4회 10일간 복용하거나 아직 한국에 출시되지는 않았지만 피닥소마이신 200 mg을 하루 2번 10일간 복용한다. 피닥소마이신은 재발률도 감소시키지만 반코마이신에 비해 비싸 널리 사용되지는 않는다.34경구 반코마이신을 장기간 사용하는 경우(3-6주)가 단기간 사용하는 경우(2주 이내)에 비해 재발률을 낮춘다는 후향 연구결과가 있으나(1.8% vs. 11.7%) 전향 연구에 의한 검증이 필요하다.35 메트로니다졸은 고병원성 C. diff 균주와 메트로니다졸 내성 균주 등의 출현으로 치료 효과가 떨어져 최근 가이드라인에서는 더 이상 추천되지 않고 반코마이신 및 피닥소마이신 등의 약제가 없는 경우 제한적으로 사용할 것을 권유하고 있다.21,36 IBD 성인 환자에서 메트로니다졸에 비해 반코마이신은 수술률과 재입원율을 감소시켰고 병원 입원 기간도 절반 정도로 줄였다.31,37 그러나 국내에서는 고병원성 C. diff 균주 및 약제 내성 균주가 흔하게 보고되지 않고 non-severe CDI에서의 효과는 반코마이신과 차이가 없으므로 국내non-severe CDI의 경우에는 메트로니다졸을 적극적으로 사용하자는 주장도 있다.38 CDI가 동반된 한국 IBD 환자에서메트로니다졸의 효과에 대해서는 추가 연구가 필요하다.
전격성 CDI인 경우에는 반코마이신 500 mg을 하루 네 번 경구 혹은 비위관 투여와 함께 메트로니다졸 500 mg을 하루 3회 정주 투여한다. 장마비가 있는 경우에는 반코마이신을 직장으로 투여한다. 독성거대결장이나 장 천공 확인을 위해 복부 영상 검사도 한 번씩 시행한다. 의식 변화, 발열, 심폐 부전, 젖산증 및 백혈구 증가 등이 동반될 때는 수술 치료를 고려해야 한다.39
약제 중단 후 8주 이내에 증상 재발과 함께 대변 검사에서 CDI가 확인되면 CDI 재발로 정의한다.5 일반인에서 CDI 재발률은 10-35%이지만 IBD 환자에서는 이보다 33% 더 높다.40,41 CDI 재발이 확인되면 초기 감염 때 사용하였던 약제에 따라 달리 치료해야 한다. 메트로니다졸 혹은 피닥소마이신을 사용하였다면 경구 반코마이신 125 mg을 하루 4회 10일간 사용하고 초기 감염 시 경구 반코마이신 표준용법을 사용하였다면 반코마이신 pulse-tapered 용법을 사용한다. 즉, 반코마이신 125 mg을 하루 4회 2주간 복용하고 이후 하루 2회 1주간 복용, 하루 1회 1주간 복용, 이후 2-3일에 하루 1회 복용을 2-8주간 복용하는 용법이다.5 국내에서는 사용 불가 하지만피닥소마이신 표준 요법을 사용할 수도 있다.
CDI 재발을 방지하기 위해서는 일반적으로 무분별한 항생제 및 위산억제제 사용을 피하도록 한다. 알코올 기반 손 세정제는 C. diff 아포(spore)를 사멸시키지 못하므로 C. diff 전파를 막기 위해서는 반드시 손을 흐르는 물에 씻도록 한다. 베즐로톡수맙은 C. diff 독소 B에 대한 단일클론 항체로서 CDI에 대한 항생제 치료 중에 1회 정주함으로써 향후 CDI의 재발을 절반으로 감소시키는 효과를 인정받아 미국 Food and Drug Administration 승인을 얻었다.42 그러나 IBD 환자에서의 CDI 재발 예방 효과는 좀 더 대규모 연구가 필요하다.
대장을 침범한 IBD는 CDI 재발의 주요 위험인자 중의 하나인데, 이는 만성적인 대장 염증으로 인한 장내미생물총 불균형으로 인한 것으로 생각된다. 그러므로 건강인의 대변 미생물총을 환자의 대장에 이식(fecal microbiota transplantation, FMT)하여 이 불균형을 극복함으로써 CDI 재발을 막고자 하는 가설이 제기되었고 여러 연구에서 IBD 환자에서 FMT의 CDI 재발 방지 효과를 보고하였다. CDI가 재발한 145명의 IBD 환자를 대상으로 한 후향 연구에 의하면, FMT는 약 80%의 CDI 치료율을 보였다.43 49명의 IBD 환자를 대상으로 한 전향 연구에 의하면 FMT 8주째 성공률은 약 90%였고 초반에 반응이 없던 환자에서 추가 FMT를 시행하였을 때 전체 C. diff 집락 소실율은 91.8%였다.44 따라서 IBD에서 CDI가 재발한 경우 FMT를 효과적인 치료 중 하나로 고려해 볼 수 있다.
CDI는 기존의 IBD의 재발을 유발할 수 있으므로 IBD에 대한 스텝-업 치료가 필요할 수 있는 반면 IBD 치료에 사용하는 면역억제제의 사용은 CDI 경과를 악화시킬 위험이 있다. 따라서 CDI 발생 시 IBD 치료는 임상의에게 매우 어려운 상황이 될 수 있다. 현재까지 이에 대한 무작위 전향 연구는 없으므로 주로 후향 연구 결과 혹은 전문가의 의견에 의존하고있다.
CDI를 동반한 IBD 입원 환자 155명을 대상으로 한 후향 연구에서 104명은 코르티코스테로이드, thiopurine, methotrexate, 생물학제제와 같은 면역억제제와 항생제를 함께 사용하였고 51명은 항생제만 단독으로 사용하였다. 사망, 대장절제술, 거대결장, 장천공, 쇼크 혹은 호흡부전과 같은 불량한 임상 결과들은 복합군의 12%에서 발생하였으나 항생제 단독군에서는 한 명도 없었다. 다변량 분석에서 복합군과 불량 임상 경과와의 독립적 연관성은 없었으나 2개 이상의 면역억제제 사용은 의미 있는 연관성을 보였다.45 한편, 최근 207명의 CDI를 동반한 IBD 환자를 대상으로 한 다기관 연구에서는 면역억제제 사용군이 사용하지 않은 군에 비해 90일 이내 심각한 임상 결과(사망, 패혈증 혹은 대장절제술)의 위험성을 오히려 낮추었다.46 한 설문 연구에 의하면, CDI 동반한 IBD 재발 환자의 경우 약 절반(46%)의 소화기 임상의는 항생제와 면역억제제 치료를 함께 하겠다고 답변한 반면 나머지 절반에서는 항생제 단독으로 치료하겠다고 답하여 실제 임상에서도 어려운 상황임을 보여주었다.47 아직 무작위 전향 연구가 없는 현 상황에서 전문가들은 면역억제제를 무조건 중단하는 것은 권유하지 않고 3-4일간의 적절한 항생제에도 반응하지 않는 경우에는 코르티코스테로이드를 비롯한 면역억제제의 사용을 조심스럽게 제시하고 있다.21 그러나 이러한 지침은 메타분석에 기인한 것이 아니며 전문가의 의견이므로 환자마다 개별화 하여 결정해야 한다.
CDI는 IBD 환자에서 흔한 합병증이므로 장 증상이 새로이 시작된 IBD 환자에서는 반드시 CDI 검사를 시행하고 진단이 되면 경구 반코마이신을 사용한다. 재발하는 경우에는 FMT를 고려해 볼 수 있다. 적절한 항생제의 사용에도 불구하고 3-4일 내 호전이 없다면 면역억제제 등의 IBD 약제 스텝-업이 필요하지만 환자 개개인의 상황에 맞추어 치료 방향을 결정하는 것이 중요하다. 마지막으로 CDI의 역학과 임상 양상 및 치료는 각 나라마다 다를 수 있다는 점을 이해해야 한다. 우리나라에서 CDI는 북미에 비해 고병원성 C. diff 균주가 흔하지 않고 메트로니다졸 내성률도 낮으며 피닥소마이신 사용이 불가하므로 non-severe CDI의 초치료로 경구 메트로니다졸을 사용해 볼 수 있고 CDI가 IBD 경과에 미치는 영향도 아직은 명확하지 않다는 점을 명심할 필요가 있다.
REFERENCES
1. Sood A, Kaur K, Mahajan R, et al. 2021; Colitis and Crohn's Foundation (India): a first nationwide inflammatory bowel disease registry. Intest Res. 19:206–216. DOI: 10.5217/ir.2019.09169. PMID: 32646197. PMCID: PMC8100380.
2. Hong SW, Ye BD. 2020; The first step to unveil the epidemiology of inflammatory bowel disease in Central Asia. Intest Res. 18:345–346. DOI: 10.5217/ir.2020.00121. PMID: 33131230. PMCID: PMC7609391.
3. Franzosa EA, Sirota-Madi A, Avila-Pacheco J, et al. 2019; Gut microbiome structure and metabolic activity in inflammatory bowel disease. Nat Microbiol. 4:293–305. DOI: 10.1038/s41564-018-0306-4. PMID: 30531976. PMCID: PMC6342642.
4. Khanna S. 2021; Management of Clostridioides difficile infection in patients with inflammatory bowel disease. Intest Res. 19:265–274. DOI: 10.5217/ir.2020.00045. PMID: 32806873. PMCID: PMC8322030.
5. McDonald LC, Gerding DN, Johnson S, et al. 2018; Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 66:987–994. DOI: 10.1093/cid/ciy149. PMID: 29562266.
6. Lessa FC, Winston LG, McDonald LC. Emerging Infections Program C. difficile Surveillance Team. 2015; Burden of Clostridium difficile infection in the United States. N Engl J Med. 372:2369–2370. DOI: 10.1056/NEJMc1505190. PMID: 25714160.
7. Clayton EM, Rea MC, Shanahan F, et al. 2009; The vexed relationship between Clostridium difficile and inflammatory bowel disease: an assessment of carriage in an outpatient setting among patients in remission. Am J Gastroenterol. 104:1162–1169. DOI: 10.1038/ajg.2009.4. PMID: 19319128.
8. Rodemann JF, Dubberke ER, Reske KA, Seo DH, Stone CD. 2007; Incidence of Clostridium difficile infection in inflammatory bowel disease. Clin Gastroenterol Hepatol. 5:339–344. DOI: 10.1016/j.cgh.2006.12.027. PMID: 17368233.
9. Ananthakrishnan AN, McGinley EL, Binion DG. 2008; Excess hospitalisation burden associated with Clostridium difficile in patients with inflammatory bowel disease. Gut. 57:205–210. DOI: 10.1136/gut.2007.128231. PMID: 17905821.
10. Micic D, Yarur A, Gonsalves A, et al. 2018; Risk factors for Clostridium difficile isolation in inflammatory bowel disease: a prospective study. Dig Dis Sci. 63:1016–1024. DOI: 10.1007/s10620-018-4941-7. PMID: 29417331.
11. Regnault H, Bourrier A, Lalande V, et al. 2014; Prevalence and risk factors of Clostridium difficile infection in patients hospitalized for flare of inflammatory bowel disease: a retrospective assessment. Dig Liver Dis. 46:1086–1092. DOI: 10.1016/j.dld.2014.09.003. PMID: 25294795.
12. Kariv R, Navaneethan U, Venkatesh PG, Lopez R, Shen B. 2011; Impact of Clostridium difficile infection in patients with ulcerative colitis. J Crohns Colitis. 5:34–40. DOI: 10.1016/j.crohns.2010.09.007. PMID: 21272802.
13. Gu YB, Zhang MC, Sun J, Lv KZ, Zhong J. 2017; Risk factors and clinical outcome of Clostridium difficile infection in patients with IBD: a single-center retrospective study of 260 cases in China. J Dig Dis. 18:207–211. DOI: 10.1111/1751-2980.12461. PMID: 28251812.
14. Anderson A, Click B, Ramos-Rivers C, et al. 2017; Lasting impact of Clostridium difficile infection in inflammatory bowel disease: a propensity score matched analysis. Inflamm Bowel Dis. 23:2180–2188. DOI: 10.1097/MIB.0000000000001251. PMID: 29084081. PMCID: PMC5685936.
15. Balram B, Battat R, Al-Khoury A, et al. 2019; Risk factors associated with Clostridium difficile infection in inflammatory bowel disease: a systematic review and meta-analysis. J Crohns Colitis. 13:27–38. DOI: 10.1093/ecco-jcc/jjy143. PMID: 30247650.
16. Guh AY, Mu Y, Winston LG, et al. 2020; Trends in U.S. Burden of Clostridioides difficile infection and outcomes. N Engl J Med. 382:1320–1330. DOI: 10.1056/NEJMoa1910215. PMID: 32242357. PMCID: PMC7861882.
17. Khanna S, Pardi DS, Aronson SL, et al. 2012; The epidemiology of community-acquired Clostridium difficile infection: a populationbased study. Am J Gastroenterol. 107:89–95. DOI: 10.1038/ajg.2011.398. PMID: 22108454. PMCID: PMC3273904.
18. Kim YS, Han DS, Kim YH, et al. 2013; Incidence and clinical features of Clostridium difficile infection in Korea: a nationwide study. Epidemiol Infect. 141:189–194. DOI: 10.1017/S0950268812000581. PMID: 22717061. PMCID: PMC9152062.
19. Bagdasarian N, Rao K, Malani PN. 2015; Diagnosis and treatment of Clostridium difficile in adults: a systematic review. JAMA. 313:398–408. DOI: 10.1001/jama.2014.17103. PMID: 25626036. PMCID: PMC6561347.
20. Goodhand JR, Alazawi W, Rampton DS. 2011; Systematic review: Clostridium difficile and inflammatory bowel disease. Aliment Pharmacol Ther. 33:428–441. DOI: 10.1111/j.1365-2036.2010.04548.x. PMID: 21198703.
21. Khanna S, Shin A, Kelly CP. 2017; Management of Clostridium difficile Infection in inflammatory bowel disease: expert review from the clinical practice updates committee of the AGA institute. Clin Gastroenterol Hepatol. 15:166–174. DOI: 10.1016/j.cgh.2016.10.024. PMID: 28093134.
22. Polage CR, Gyorke CE, Kennedy MA, et al. 2015; Overdiagnosis of Clostridium difficile Infection in the Molecular Test Era. JAMA Intern Med. 175:1792–1801. DOI: 10.1001/jamainternmed.2015.4114. PMID: 26348734. PMCID: PMC4948649.
23. Planche TD, Davies KA, Coen PG, et al. 2013; Differences in outcome according to Clostridium difficile testing method: a prospective multicentre diagnostic validation study of C difficile infection. Lancet Infect Dis. 13:936–945. DOI: 10.1016/S1473-3099(13)70200-7. PMID: 24007915. PMCID: PMC3822406.
24. Jodorkovsky D, Young Y, Abreu MT. 2010; Clinical outcomes of patients with ulcerative colitis and co-existing Clostridium difficile infection. Dig Dis Sci. 55:415–420. DOI: 10.1007/s10620-009-0749-9. PMID: 19255850.
25. Murthy SK, Steinhart AH, Tinmouth J, Austin PC, Daneman N, Nguyen GC. 2012; Impact of Clostridium difficile colitis on 5-year health outcomes in patients with ulcerative colitis. Aliment Pharmacol Ther. 36:1032–1039. DOI: 10.1111/apt.12073. PMID: 23061526.
26. Jen MH, Saxena S, Bottle A, Aylin P, Pollok RC. 2011; Increased health burden associated with Clostridium difficile diarrhoea in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 33:1322–1331. DOI: 10.1111/j.1365-2036.2011.04661.x. PMID: 21517920.
27. Shrestha MP, Taleban S. 2021; Colectomy rates are increasing among inpatients with concomitant ulcerative colitis and Clostridioides difficile. J Clin Gastroenterol. 55:709–715. DOI: 10.1097/MCG.0000000000001412. PMID: 32804686.
28. Tariq R, Law CCY, Khanna S, Murthy S, McCurdy JD. 2019; The impact of Clostridium difficile infection on mortality in patients with inflammatory bowel disease: a systematic review and metaanalysis. J Clin Gastroenterol. 53:127–133. DOI: 10.1097/MCG.0000000000000968. PMID: 29206751.
29. Chen Y, Furuya-Kanamori L, Doi SA, Ananthakrishnan AN, Kirk M. 2017; Clostridium difficile infection and risk of colectomy in patients with inflammatory bowel disease: a bias-adjusted meta-analysis. Inflamm Bowel Dis. 23:200–207. DOI: 10.1097/MIB.0000000000000998. PMID: 28079620.
30. Khanna S, Pardi DS. 2012; IBD: Poor outcomes after Clostridium difficile infection in IBD. Nat Rev Gastroenterol Hepatol. 9:307–308. DOI: 10.1038/nrgastro.2012.87. PMID: 22547310.
31. Issa M, Vijayapal A, Graham MB, et al. 2007; Impact of Clostridium difficile on inflammatory bowel disease. Clin Gastroenterol Hepatol. 5:345–351. DOI: 10.1016/j.cgh.2006.12.028. PMID: 17368234.
32. Law CC, Tariq R, Khanna S, Murthy S, McCurdy JD. 2017; Systematic review with meta-analysis: the impact of Clostridium difficile infection on the short- and long-term risks of colectomy in inflammatory bowel disease. Aliment Pharmacol Ther. 45:1011–1020. DOI: 10.1111/apt.13972. PMID: 28206678.
33. Kim DB, Lee KM, Park SH, et al. 2018; Is Clostridium difficile infection a real threat in patients with ulcerative colitis? A prospective, multicenter study in Korea. Intest Res. 16:267–272. DOI: 10.5217/ir.2018.16.2.267. PMID: 29743839. PMCID: PMC5934599.
34. Venugopal AA, Johnson S. 2012; Fidaxomicin: a novel macrocyclic antibiotic approved for treatment of Clostridium difficile infection. Clin Infect Dis. 54:568–574. DOI: 10.1093/cid/cir830. PMID: 22156854.
35. Lei DK, Ollech JE, Andersen M, et al. 2019; Long-duration oral vancomycin to treat Clostridioides difficile in patients with inflammatory bowel disease is associated with a low rate of recurrence. Am J Gastroenterol. 114:1904–1908. DOI: 10.14309/ajg.0000000000000460. PMID: 31714359.
36. Johnson S, Louie TJ, Gerding DN, et al. 2014; Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis. 59:345–354. DOI: 10.1093/cid/ciu313. PMID: 24799326.
37. Horton HA, Dezfoli S, Berel D, et al. 2014; Antibiotics for treatment of Clostridium difficile infection in hospitalized patients with inflammatory bowel disease. Antimicrob Agents Chemother. 58:5054–5059. DOI: 10.1128/AAC.02606-13. PMID: 24913174. PMCID: PMC4135854.
38. Kim J, Kim J, Kim B, Pai H. 2022; Which is the preferred regimen for non-severe Clostridioides difficile infection in Korea, vancomycin or metronidazole? Infect Chemother. 54:213–219. DOI: 10.3947/ic.2022.0027. PMID: 35706079. PMCID: PMC9259900.
39. Dalal RS, Allegretti JR. 2021; Diagnosis and management of Clostridioides difficile infection in patients with inflammatory bowel disease. Curr Opin Gastroenterol. 37:336–343. DOI: 10.1097/MOG.0000000000000739. PMID: 33654015. PMCID: PMC8169557.
40. Garey KW, Sethi S, Yadav Y, DuPont HL. 2008; Meta-analysis to assess risk factors for recurrent Clostridium difficile infection. J Hosp Infect. 70:298–304. DOI: 10.1016/j.jhin.2008.08.012. PMID: 18951661.
41. Razik R, Rumman A, Bahreini Z, McGeer A, Nguyen GC. 2016; Recurrence of Clostridium difficile infection in patients with inflammatory bowel disease: the recidivism study. Am J Gastroenterol. 111:1141–1146. DOI: 10.1038/ajg.2016.187. PMID: 27215924.
42. Wilcox MH, Gerding DN, Poxton IR, et al. 2017; Bezlotoxumab for prevention of recurrent Clostridium difficile infection. N Engl J Med. 376:305–317. DOI: 10.1056/NEJMoa1602615. PMID: 28121498.
43. Tariq R, Disbrow MB, Dibaise JK, et al. 2020; Efficacy of fecal microbiota transplantation for recurrent C. Difficile infection in inflammatory bowel disease. Inflamm Bowel Dis. 26:1415–1420. DOI: 10.1093/ibd/izz299. PMID: 31821444.
44. Allegretti JR, Kelly CR, Grinspan A, Mullish BH, Kassam Z, Fischer M. 2020; Outcomes of fecal microbiota transplantation in patients with inflammatory bowel diseases and recurrent Clostridioides difficile infection. Gastroenterology. 159:1982–1984. DOI: 10.1053/j.gastro.2020.07.045. PMID: 32738249.
45. Ben-Horin S, Margalit M, Bossuyt P, et al. 2009; Combination immunomodulator and antibiotic treatment in patients with inflammatory bowel disease and clostridium difficile infection. Clin Gastroenterol Hepatol. 7:981–987. DOI: 10.1016/j.cgh.2009.05.031. PMID: 19523534.
46. Lukin DJ, Lawlor G, Hudesman DP, et al. 2019; Escalation of immunosuppressive therapy for inflammatory bowel disease is not associated with adverse outcomes after infection with Clostridium difficile. Inflamm Bowel Dis. 25:775–781. DOI: 10.1093/ibd/izy308. PMID: 30312400.
47. Yanai H, Nguyen GC, Yun L, et al. 2011; Practice of gastroenterologists in treating flaring inflammatory bowel disease patients with clostridium difficile: antibiotics alone or combined antibiotics/immunomodulators? Inflamm Bowel Dis. 17:1540–1546. DOI: 10.1002/ibd.21514. PMID: 21674710.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download