Abstract
There has been a rise in the incidence of inflammatory bowel disease (IBD) in developing countries, including South Korea. Consequently, the use of immunosuppressive agents such as immunomodulators or biologics has also increased. Due to immunosuppression, patients on these agents are at increased risk of various opportunistic infections during treatment, which may sometimes lead to serious adverse outcomes. Viral hepatitis, especially hepatitis B, is one of the infectious conditions that can be reactivated during immunosuppressive therapy, and adequate strategies for monitoring and prophylaxis are needed to prevent it. South Korea is one of the countries with intermediate endemicity for hepatitis A and B. Thus, taking adequate precautions against viral hepatitis could prevent new infections or reactivation of these conditions in patients with IBD on immunosuppressive therapy. In this review article, we have summarized the latest evidence on viral hepatitis in patients with IBD that would be of assistance in clinical practice.
Go to : 
염증성 장질환(inflammatory bowel disease, IBD)은 소화기관에 만성적으로 발생하는 염증성 질환을 의미하며 궤양성 대장염과 크론병으로 나뉘어진다. 일반적으로 북미나 유럽 등 선진국에서 발병률이 높은 것으로 알려져 있으나,1 최근에는 한국을 비롯한 아시아, 아프리카, 남미 등 빠르게 발전하고 있는 많은 국가들에서 발병률이 증가하고 있는 추세이다.2-5 이러한 발병률의 증가 추세와 더불어 치료제도 많은 발전으로 인해 면역조절제와 생물학적제제 등 다양한 면역억제제가 치료에 사용되면서 질병 조절 및 치료에 많은 효과를 보이고 있다.6-13 하지만 이들은 면역억제 상태를 초래하기 때문에 세균이나 바이러스 등에 의한 기회감염의 발생 위험도 같이 증가하게 된다.14-16 바이러스성 감염 또한 마찬가지인데, 특히 B형간염 바이러스(HBV)의 경우 면역억제 상태에서 재활성화의 위험성이 증가하며 이로 인한 전격 간 부전 및 사망에까지 이를 수 있다.17,18 따라서 IBD 환자들을 치료하는 데 있어 바이러스성 간염의 위험도를 평가하고 이에 따른 관리를 하는 것은 환자의 예후에 있어 매우 중요하다.19 따라서 본고에서는 IBD 환자에서의 바이러스성 간염에 대해 예방과 관리에 대한 내용을 중점적으로 다루고자 한다.
Go to : 
A형간염 바이러스(HAV)는 껍질이 없는 작은 단일사슬 RNA 바이러스로 ‘분변-경구’ 경로로 사람에서 사람으로 직접 전염된다. 따라서 오염된 물이나 음식을 통해 전염될 수 있으며 위생 상태가 불량할 경우 잘 일어난다. A형간염은 보통 스스로 회복되며 B형간염이나 C형간염과는 다르게 만성 질환으로 진행되지 않는다. 또한 치사율이 높은 전격 간염으로 진행되는 경우도 드물며 한 번 감염될 경우 평생 면역력을 획득하며 백신접종을 통해 예방이 가능하다.
A형간염은 전 세계적으로 산발적 또는 유행성으로 발병하며 사회, 경제적인 수준에 따라 발병률에 차이를 보인다.20,21 사회, 경제적인 수준이 낮고 위생수준이 떨어지는 국가에서는 대부분 10살 이전의 유년기에 A형간염 바이러스에 감염되고 보통 특별한 증상 없이 넘어간다. 반면 사회, 경제적인 수준이 높고 위생수준이 높은 국가에서는 A형간염 발병률이 낮으며 상습적인 주사약물 사용자, 남성 간의 성관계를 갖는 자, 발병률이 높은 국가에 여행을 다녀오는 자 등 감염 위험률이 높은 청소년이나 성인 등 위험인자가 있는 사람 위주로 발병한다. 사회, 경제적인 수준이 중간 정도인 국가에서는 소아기에 감염되지 않다가 청소년, 성인이 되고 나서 종종 감염이 일어난다. 이와 같이 국가별로 A형간염의 발병률에 차이를 보이기 때문에 이를 고려하여 예방접종을 시행하는 것이 필요하다.
우리나라의 경우 급격한 사회, 경제적인 발전으로 인해 A형간염의 발병률도 크게 변해왔다. 2010년에 발표된 국내 역학 연구에 따르면 높은 발병률을 보였던 1980년대에 유년기를 보내면서 HAV에 노출된 성인들은 대부분이 면역력을 갖추고 있었으나 10-20대의 젊은 사람들은 이후 사회, 경제적인 발전 및 이로 인한 위생수준 개선으로 인해 A형간염의 발병률이 감소하면서 HAV의 노출 가능성이 떨어졌고 이로 인해 A형간염에 대한 면역력을 10% 미만에서만 보유하고 있었다.21 따라서 면역력이 없는 청소년이나 젊은 성인들을 중심으로 A형간염이 급격하게 증가하였고 따라서 2015년부터 정부에서 12-23개월의 모든 소아와 A형간염에 대한 면역력이 없는 고위험군 소아청소년이나 성인에게 A형간염 예방접종을 시행하는 것을 권고하고 있다.
HAV에 감염이 되면 증상 발현 초기에 혈청 IgM anti-HAV 항체가 형성되어 급성기에 최고치를 보였다가 3-6개월 후에 대부분 자연 소실되어 급성 감염을 나타내는 표지자로써 사용된다. 반면 혈청 IgG anti-HAV 항체도 HAV 감염 초기에 나타나기 시작하여 일생 동안 항체가를 유지하여 질병을 예방하는 역할을 한다.24 따라서 혈청 IgG anti-HAV 항체의 존재는 과거 HAV에 감염되었거나 예방접종을 받았음을 시사한다.
일반적으로 건강한 성인은 A형간염에 대한 선별 검사가 필요하지 않다. 하지만 면역이 저하된 환자들은 A형간염에 걸릴 경우 전격성 간염으로 간부전이 진행할 위험성이 높기 때문에23 IBD 환자들은 면역조절제나 생물학적제제를 사용함으로써 면역이 저하된 상태가 많음을 고려하여 혈청학적 선별 검사가 권유된다. 따라서 IBD 환자들은 A형간염 백신을 접종하지 않았거나 접종력이 불확실한 경우, A형간염의 과거력이 없는 경우에는 혈청 IgG anti-HAV 항체를 측정하여 HAV 감염에 대한 검사를 권고하며 만약 음성일 경우 예방접종을 시행하는 것을 권고한다.
A형간염에 대한 예방접종은 HAV 불활성화 백신이 주로 사용되고 있으며 우리나라에서는 1997년 말부터 사용되었다. 6-12개월의 간격을 두고 총 2회를 투여하며 건강한 성인과소아에서 99% 이상의 방어항체 형성을 보여주며25,26 이는 20-25년 이상 지속된다.27
하지만 면역억제제를 사용하는 경우 항체 생성률이 낮아질수 있다. 2014년 국내 IBD 환자들을 대상으로 HAV 백신의 효과를 비교한 연구28에서는 총 2회의 백신 접종 후 97.6%의 환자에게서 항체가 생성되었다. 하지만 항종양괴사인자(anti-tumor necrosis factor, 항TNF)를 투여 받은 환자군에서는 92.4%로 그렇지 않은 군의 99.1%보다 항체 생성률이 낮았다. 또한 2가지 이상의 면역억제제를 투여한 환자군에서도 한 가지의 면역억제제를 투여한 환자보다 항체 생성률이 유의미하게 낮았다(92.6% 대 98.4%). 따라서 IBD 환자에게는 HAV 백신을 접종하려면 IBD를 진단받은 시점에 바로 시행하는 것이 권고되며 적어도 면역억제제가 투여되기 전에 이루어지는 것이 효과적이다. 하지만 면역억제제가 투여되기 전에 접종하지못하였다면 면역억제제가 투여되는 중이라도 예방접종을 시행하는 것이 권고된다.29
정리하면 IBD 환자에게서 HAV에 대한 방어항체(혈청 IgG anti-HAV)가 음성일 경우 HAV 불활성화 백신을 6-12개월의 간격을 두고 총 2회 접종할 것을 권고한다. 일반적으로 2회의 적절한 예방접종 후 혈청 IgG anti-HAV 생성률은 매우 높기 때문에 혈액 검사를 통해 확인할 필요는 없으나 면역억제제가 투여될 경우 항체 생성률이 떨어지기 때문에 가급적이면 진단 당시 또는 면역억제제가 투여되기 전에 예방접종이 시행될 것을 권고한다.
B형간염 바이러스(HBV)는 hepadnaviridae 속에 속하는 이중가닥 DNA 바이러스이며 임상적으로 급성 및 만성 B형간염을 일으킨다. 급성 B형간염은 무증상기부터 전격성 간염까지, 만성 B형간염은 무증상 보균자부터 만성 간염, 간경화, 간세포암까지 다양한 임상경과를 보일 수 있다.
2015년 World Health Organization (WHO) 보고에 따르면 전 세계적으로 2억 5,700만 명이 바이러스에 감염되어 있고 해마다 887,000명 정도의 사람들이 B형간염과 연관된 간 질환으로 사망하고 있다.30 HBV 감염률은 지역마다 차이를 보이는데 2015년 WHO 조사에 따르면 북미와 남미는 평균 0.7%, 유럽은 1.6%로 낮은 반면에 동남아시아와 동지중해 지역은 각각 2.0%, 3.3%를 보였다. 반면 아프리카와 서태평양 지역에서는 6.1-6.2% 정도로 높은 감염률을 보였다. 한국은 1980년대에 8-10%의 높은 HBV 감염률을 보였으나 1983년 모든 신생아를 대상으로 HBV 예방접종을 권고하고 1995년 영유아 대상 정기예방접종으로 도입한 이후로 95% 이상의 높은 접종율을 유지하면서 1990년대에 4.6%, 2010년에는 2.9%로 지속적으로 감소되어 왔다.31 특히 소아청소년군에서는 1998년 2.2%에서 2008년 0.6%, 2020년 0.2%로 지속적으로 감소해왔다.32
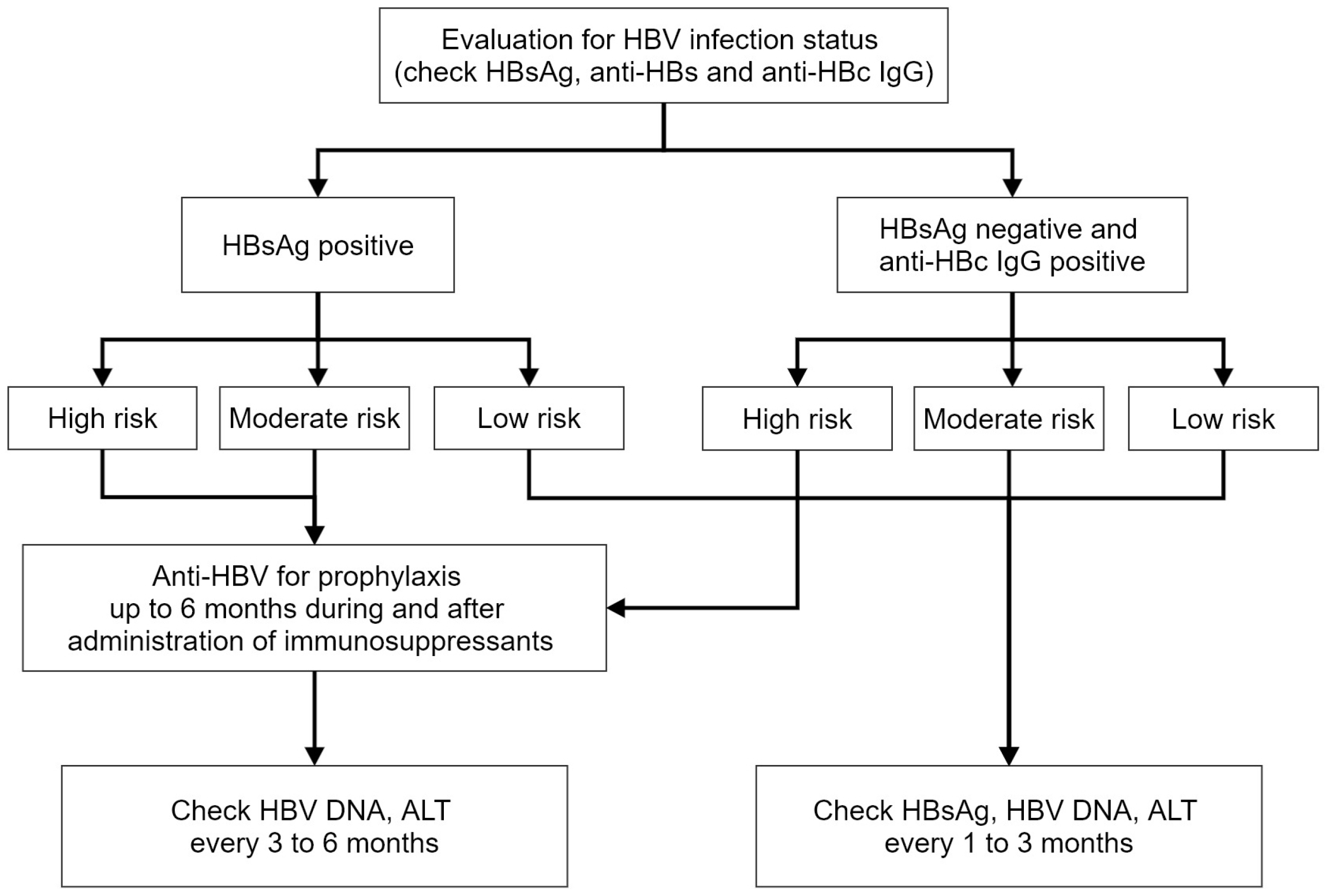
비록 IBD 환자들의 HBV 감염률이 일반인과 크게 다르지는 않다고 하나 추후 면역억제제를 사용할 가능성이 높으며 이는 만성 HBV 감염자 또는 과거 감염자에서 재활성화의 위험성을 증가시킬 수 있고 이는 심각한 합병증을 유발할 수 있다.37-41 따라서 모든 IBD 환자들은 진단 시점에 HBV와 관련된 혈청 검사(HBsAg, anti-HBs, anti-HBc IgG)를 시행하여 HBV 감염 여부를 확인하는 것을 권고한다.17,18,42-44 만일 HBsAg이나 anti-HBc IgG가 양성으로 확인되면 HBV DNA 검사도 시행해야 한다.
WHO는 HBV 유병률과 상관없이 모든 국가의 신생아에게 HBV 예방접종을 시행하는 것을 권고하고 있다.45 하지만 IBD 환자의 예방접종 비율은 상당히 낮은 것으로 보고되어 왔는데,46 2009년 스페인에서 시행된 2,076명의 IBD 환자를 대상으로 시행된 연구에서는 12%의 환자들만 HBV에 대한 예방접종력이 확인되었고33 2018년 국내에서 발표된 연구에서도 210명의 IBD 환자의 38.5%에서만 HBV에 대한 면역력을 갖추고 있는 것으로 확인되었다.36 따라서 모든 IBD 환자들은 HBV 감염력과 면역력이 없는 것으로 확인될 경우(HBsAg, anti-HBs, anti-HBc IgG 모두 음성) HBV 예방접종을 시행하는 것을 권고한다.17,44
HBV 백신은 가능한 IBD 진단 시점에 접종하는 것을 권고하며 적어도 면역억제제가 투여되기 2주 전에 접종할 것을 권고한다.44 최근 14개의 IBD 환자의 B형간염 예방접종과 관련된 기존 연구를 분석한 결과에 따르면 예방접종 후 적절한 면역반응은 64%로47 일반 성인의 90% 이상보다는 낮은 결과를 보여주었다.48 특히 면역억제제나 항TNF 제제를 투여 받을 경우 더 낮은 반응률을 보였는데 두 가지 약제 모두 투여 받지 않은 환자와 비교하여 면역억제제의 경우 1.33배, 항TNF의 경우 1.57배 낮은 면역반응을 보여주었다.49 하지만 만약 IBD의 진단 시점에 면역억제제의 시작이 필요하다면 동시에 HBV 백신 접종을 고려해 볼 수 있다.
일반적인 HBV 예방접종 방법은 불활성화 HBV 백신을 0, 1, 6개월에 총 3회 접종하는 일정을 사용하고 있다. 하지만 면역억제제를 사용하고 있는 IBD 환자들에게 이와 같이 접종을 한다면 앞서 언급한 대로 면역반응이 일반인보다 떨어질 수 있기 때문에 더 많은 용량을 짧은 간격으로 맞는 방법을 고려할 수도 있다.42 한 연구에서는 148명의 IBD 환자를 대상으로 HBV 백신을 두 배 용량으로 0, 1, 2개월의 짧은 기간에 걸쳐 접종한 경우 면역 반응률이 75%로 기존 방법대로 접종한 군의 41%보다 높은 반응을 보여주었다.50
일반인의 경우 백신 접종 후 혈청학적 검사를 통해 면역반응 여부를 확인하는 것이 필요하지는 않다. 하지만 IBD 환자들, 특히 면역억제제를 투여 받는 환자들 에서는 면역반응률이 일반인보다 낮기 때문에 예방접종 후 1-3개월 후에 HBV에 대한 혈청학적 검사를 시행하여 면역반응 여부를 확인해야할 것을 권고하며17,43,44 적절한 면역반응은 국내 지침에서 혈청 anti-HBs가 10 U/L 이상으로 정의하고 있다.24,51 만약 적절한 면역반응을 얻지 못하였다면 기존과 동일한 0, 1, 6개월간격으로 재접종할 것을 권유한다.52,53
HBV 재활성화는 무증상 HBV 보균자나 과거 감염에서 회복되었던 자에서 활동성 간염이 발생하는 것을 말한다. 이는 다음과 같은 두 가지 상황으로 나눌 수 있다. 1) 만성 B형간염의 악화: HBsAg 양성 환자에서 혈청 HBV DNA가 새롭게 검출되거나 기존보다 100배 이상 증가하는 것, 2) 과거 B형간염의 재발: HBsAg 음성 환자에서 면역억제의 상황으로 인해 HBsAg 양성으로 바뀌거나 혈청 HBV DNA 값이 불검출에서 100 U/mL 이상으로 검출되는 것.
여기에 혈청 ALT가 3배 이상 또는 100 U/L 이상 상승이 동반되는 경우 HBV 재활성화에 의한 활동성 간염으로 정의한다.18 HBV 재활성화의 위험인자들은 바이러스, 환자 그리고 치료약제로 나눌 수 있는데 치료 약제 중 항암제의 경우 HBsAg 양성 환자에게서 투여된 이후 20-50%까지 재활성화가 보고되었다. IBD 환자에서도 코티코스테로이드, 면역조절제나 항TNF 등 면역억제제를 투여 받을 경우 HBV 재활성화의 빈도가 증가하며 이로 인한 간기능 저하가 17.2-36% 정도로 보고되었으며 이들 중 4% 이상은 전격 간 부전이 발생하였고 일부는 사망에까지 이르렀다.34,37,39-41 특히 면역억제제를 2가지 이상 투여하거나 3개월 이상 투여할 경우 재활성화로 인한 간기능 저하의 위험성이 증가하였다. 반면 HBsAg은 음성이고 anti-HBc IgG만 양성인 과거 감염 환자에서는 HBV 재활성화의 빈도가 매우 낮았다.40,41 이와 같이 HBV 감염상태(HBsAg, anti-HBc IgG)와 IBD 치료약제에 따라서 재활성화의 위험성이 다르게 나타나는데, 이를 고위험(≥10%),중등도 위험(1-10%), 저위험(<1%)으로 나눌 수 있다(Table 1).55,56
Risk of Hepatitis B Reactivation associated with Immunosuppressive Therapy for IBD and Management56
코티코스테로이드를 중등도 이상의 용량(경구 프레드니솔론 기준 하루 10 mg 이상)을 장기간(4주 이상) 사용할 경우 HBsAg 양성 환자에서는 높은 빈도로, HBsAg 음성 및 an-ti-HBc IgG 양성 환자에서는 중간 빈도로 HBV 재활성화를 일으킬 수 있다.55 또한 저용량(경구 프레드니솔론 기준 하루 10 mg 미만)을 장기간 사용할 경우에도 HBs Ag 양성 환자에서 중간 빈도로 HBV 재활성화를 일으킬 수 있다.55 반면, 저용량 코티코스테로이드를 단기간(4주 미만) 사용할 경우에는 HBV 재활성화 위험도가 낮다.55
IBD 치료에서 많이 사용되는 infliximab, adalimumab과 같은 항TNF 제제의 경우 HBsAg 양성 환자에서는 높은 빈도(12-39%)로 HBV 재활성화를 일으킨다고 보고되었으며,37,41,57 HBsAg 음성 및 anti-HBc IgG 양성 환자에서는 중간 빈도(0-5%)로 HBV 재활성화를 일으킨다고 보고되었다.55,58 TNF는 HBV가 간세포로의 침투를 차단하고 DNA의 증식을 억제하는 등의 기전을 통해 바이러스 증식을 억제하는 중요한 역할을 하는데 항TNF는 이를 억제하기 때문에 면역반응과 HBV 증식의 균형을 무너뜨리면서 HBV 재활성화를 일으킬 수 있다.59 반면 vedolizumab, ustekinumab 등 항인테그린 또는 항인터루킨 제제는 HBsAg 양성 환자에서 중간 빈도로 HBV 재활성화를 일으키는 것으로 알려져 있으며,60 데이터가 충분하지는 않지만 tofacitinib 등의 cytokine based agent도 중간 빈도의 위험성을 가질 것으로 예상된다. 반면 methotrexate, azathioprine이나 6-mercaptopurine은 HBsAg 양성 환자에서 HBV 재활성화 위험도가 높지 않은 것으로 알려져 있다.55
만성 HBV 보균자(HBsAg 양성 또는 HBV DNA 양성)의 경우 중등도 위험 또는 고위험군에 속할 경우 HBV 재활성화 예방을 위해서 예방적 항바이러스제 투약을 권고한다.61 투약 시작 시기는 대부분의 문헌에서 면역억제제 투약 1주일 이전에 시작할 것을 권고하고 있으나18,43 투약 시기와 재활성화 간에 큰 연관성이 없음을 보고한 연구도 있다.59 치료약제로는 다른 약제와 비교하여 내성이 빈도가 낮은 entecavir나 tenofovir를 선택하는 것을 권고하며 용량 및 용법은 만성 B형간염에서의 치료와 동일하게 적용한다. 투여 기간은 면역억제제 투약 중단 이후로도 최소 6개월 이상까지 유지할 것을 권고한다.18,43
IBD 환자에서 급성 B형간염은 흔치 않으며 관련된 임상 정보도 제한적이다.63 건강한 사람에서 급성 B형간염은 95% 이상에서 스스로 회복하기 때문에 항바이러스제 투약 없이 보존적 치료로 충분하지만 INR 1.5 이상의 coagulopathy나 4주 이상 지속되는 황달 등 중증 급성 B형간염의 경과를 보일 경우 전격성 간 부전 및 사망 위험성을 줄이기 위해 항바이러스제 투약이 필요하다.42 또한 면역저하자, C형간염이나 human immunodeficiency virus 감염이 동반된 자, 기저 간질환을 갖고 있는 자 또는 고령의 환자에서도 질병 경과가 좋지 않은 것으로 알려져 있으나 이들에게서 항바이러스제를 투약하는 것이 효과적인지는 아직까지 뚜렷하게 입증되지 않았다. 따라서 IBD 환자에서 급성 B형간염이 발생할 경우 임상 경과 및 면역저하상태에 따라서 항바이러스제 치료를 결정하는 것이 좋을 것으로 생각된다.
C형간염 바이러스(HCV)는 RNA virus로 flaviviridae 속에 속한다. C형간염 바이러스에 감염된 환자의 70%가 만성 감염으로 이어지며 2015년 WHO 자료에 따르면 전 세계 인구의 1%인 7,100만 명이 만성적으로 HCV에 감염되어 있다.30 만성 C형간염도 지역에 따라 유병률이 다른데, 동지중해 지역에서는 2.3%에 이르는 반면에 동남아시아 지역은 0.5%의 유병률을 보인다. 우리나라의 경우 2020년에 조사한 통계자료에 따르면 전체 인구의 0.7%가 HCV 항체 양성을 보였으며 이는 연령이 높을수록 양성율도 올라가는 추이를 보였다.32 알려진 위험인자로는 주사약제 사용자, 장기간 혈액투석을 받은 자, HCV에 감염된 산모에게서 태어난 신생아 등이 있으며 혈액, 주사기, 성관계를 통해서 전염될 수 있다.64 하지만 IBD 환자에서 HCV 감염률은 여러 연구들에서 일반인과 비교하여 큰 차이가 없는 것으로 알려져 있다.33,35,65,66
만일 HCV 감염이 확인되면 특별한 금기사유가 있지 않는 한 급성, 만성 여부에 상관없이 일반인과 동일하게 direct acting antivirals (DAAs)를 포함한 항바이러스제 치료를 고려해야 한다.67-69 최근 79명의 HCV 감염이 동반된 IBD 환자들을 대상으로 DAAs 치료에 대한 효과와 안전성을 분석한 연구에 따르면 96.2%의 환자가 sustained virologic response를 보였으며 5건의 DAAs와 관련된 부작용이 발생하였으나 모두 경미하였다.70 이들 중 면역조절제나 생물학적제제 등의 면역억제제를 사용한 환자 39명이 포함되었다는 점을 고려하였을 때는 면역억제제와 같이 사용해도 효과와 안전성과 관련해서 큰 문제가 없을 것으로 예상할 수 있으나 더 많은 임상 연구와 데이터를 통한 평가가 필요할 것으로 생각된다. 다만 DAAs는 다른 약물과의 상호작용이 많기 때문에 치료 전 기존에 사용하고 있는 약제와의 상호작용을 미리 확인하는 것이 중요하다.68,69,71 또한 많은 연구들에서 HCV가 감염된 IBD 환자에서 항TNF를 포함한 면역억제제를 사용한 치료 시 HCV 감염이 악화되는 경우가 많지 않았기 때문에40,72-74 DAAs 치료가 급하지는 않을 것으로 생각된다. 따라서 환자의 질병활성도를 포함한 임상 상황과 복용 중인 약제 등을 고려하여 HCV 치료 여부를 결정하는 것이 좋을 것으로 생각된다.
Go to : 
IBD 환자들은 치료약제로 많이 사용되는 면역억제제들에 의해 바이러스성 간염을 포함한 많은 기회감염들의 위험에 노출되어 있다. 우리나라는 아직까지 A형간염과 B형간염의 유병률이 높으며 특히 이들은 백신접종을 통해 미리 예방할 수 있기 때문에 진단과 동시에 선별 검사를 시행하여 면역력이 없는 환자를 대상으로 백신접종을 시행하는 것이 중요하다. 그리고 만성 HBV 보균자나 과거 HBV 감염자는 면역억제제 사용에 따른 HBV 재활성화의 위험성이 높기 때문에 사용 약제에 따른 재활성화 위험성 평가 및 이에 따른 예방적 항바이러스제 투약이 중요하다. 본고를 통해 실제 진료현장에서 IBD 환자의 바이러스성 간염 예방 및 관리에 대해 도움이 되기를 바란다.
Go to : 
Notes
Financial support
This research was supported by a grant of the Korea Health Technology R&D Project through the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (grant number: HR21C0198). This work was also supported by the National Research Foundation of Korea (NRF) grant, funded by the Korean government (MSIT), awarded to Sang Hyoung Park (No. 2021R1G1A1094252).
Go to : 
REFERENCES
1. GBD 2017 Inflammatory Bowel Disease Collaborators. The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2020; 5:17–30. DOI: 10.1016/S2468-1253(19)30333-4. PMID: 31648971. PMCID: PMC7026709.
2. Kwak MS, Cha JM, Lee HH, et al. 2019; Emerging trends of inflammatory bowel disease in South Korea: a nationwide population-based study. J Gastroenterol Hepatol. 34:1018–1026. DOI: 10.1111/jgh.14542. PMID: 30447025.
3. Park SH, Kim YJ, Rhee KH, et al. 2019; A 30-year trend analysis in the epidemiology of inflammatory bowel disease in the Songpa-Kangdong district of Seoul, Korea in 1986-2015. J Crohns Colitis. 13:1410–1417. DOI: 10.1093/ecco-jcc/jjz081. PMID: 30989166.
4. Ng SC, Shi HY, Hamidi N, et al. 2017; Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet. 390:2769–2778. DOI: 10.1016/S0140-6736(17)32448-0. PMID: 29050646.
5. Sood A, Kaur K, Singh A, et al. 2021; Trends of inflammatory bowel disease at a tertiary care center in Northern India. Intest Res. 19:282–290. DOI: 10.5217/ir.2020.00010. PMID: 32806872. PMCID: PMC8322028.
6. Singh A, Mahajan R, Kedia S, et al. 2022; Use of thiopurines in inflammatory bowel disease: an update. Intest Res. 20:11–30. DOI: 10.5217/ir.2020.00155. PMID: 33845546. PMCID: PMC8831775.
7. Hibi T, Kamae I, Pinton P, et al. 2021; Efficacy of biologic therapies for biologic-naïve Japanese patients with moderately to severely active ulcerative colitis: a network meta-analysis. Intest Res. 19:53–61. DOI: 10.5217/ir.2019.09146. PMID: 32312035. PMCID: PMC7873404.
8. Ooi CJ, Hilmi IN, Kim HJ, et al. 2021; Efficacy and safety of vedolizumab in ulcerative colitis in patients from Asian countries in the GEMINI 1 study. Intest Res. 19:71–82. DOI: 10.5217/ir.2019.09159. PMID: 32877600. PMCID: PMC7873399.
9. Banerjee R, Chuah SW, Hilmi IN, et al. 2021; Efficacy and safety of vedolizumab in Crohn's disease in patients from Asian countries in the GEMINI 2 study. Intest Res. 19:83–94. DOI: 10.5217/ir.2019.09160. PMID: 33378612. PMCID: PMC7873405.
10. Oh SJ, Shin GY, Soh H, et al. 2021; Long-term outcomes of infliximab in a real-world multicenter cohort of patients with acute severe ulcerative colitis. Intest Res. 19:323–331. DOI: 10.5217/ir.2020.00039. PMID: 32806875. PMCID: PMC8322032.
11. Hisamatsu T, Kim HJ, Motoya S, et al. 2021; Efficacy and safety of ustekinumab in East Asian patients with moderately to severely active ulcerative colitis: a subpopulation analysis of global phase 3 induction and maintenance studies (UNIFI). Intest Res. 19:386–397. DOI: 10.5217/ir.2020.00080. PMID: 33249802. PMCID: PMC8566834.
12. Hisamatsu T, Suzuki Y, Kobayashi M, et al. 2021; Long-term safety and effectiveness of adalimumab in Japanese patients with Crohn's disease: 3-year results from a real-world study. Intest Res. 19:408–418. DOI: 10.5217/ir.2020.00025. PMID: 33207857. PMCID: PMC8566837.
13. Ogata H, Hagiwara T, Kawaberi T, Kobayashi M, Hibi T. 2021; Safety and effectiveness of adalimumab in the treatment of ulcerative colitis: results from a large-scale, prospective, multicenter, observational study. Intest Res. 19:419–429. DOI: 10.5217/ir.2020.00033. PMID: 33166442. PMCID: PMC8566831.
14. Dave M, Purohit T, Razonable R, Loftus EV Jr. 2014; Opportunistic infections due to inflammatory bowel disease therapy. Inflamm Bowel Dis. 20:196–212. DOI: 10.1097/MIB.0b013e3182a827d2. PMID: 24051931.
15. Khanna S. 2021; Management of Clostridioides difficile infection in patients with inflammatory bowel disease. Intest Res. 19:265–274. DOI: 10.5217/ir.2020.00045. PMID: 32806873. PMCID: PMC8322030.
16. Kim YS. 2021; Does cytomegalovirus load predict the outcome of acute severe ulcerative colitis? Intest Res. 19:357–359. DOI: 10.5217/ir.2021.00120. PMID: 34731562. PMCID: PMC8566827.
17. Kucharzik T, Ellul P, Greuter T, et al. 2021; ECCO guidelines on the prevention, diagnosis, and management of infections in inflammatory bowel disease. J Crohns Colitis. 15:879–913. DOI: 10.1093/ecco-jcc/jjab052. PMID: 33730753.
18. Korean Association for the Study of the Liver (KASL). 2022; KASL clinical practice guidelines for management of chronic hepatitis B. Clin Mol Hepatol. 28:276–331. DOI: 10.3350/cmh.2022.0084. PMID: 35430783. PMCID: PMC9013624.
19. Park SK, Choi CH, Chun J, et al. 2020; Prevention and management of viral hepatitis in inflammatory bowel disease: a clinical practice guideline by the Korean Association for the Study of Intestinal Diseases. Intest Res. 18:18–33. DOI: 10.5217/ir.2019.09155. PMID: 32013312. PMCID: PMC7000641.
20. Bell BP, Shapiro CN, Alter MJ, et al. 1998; The diverse patterns of hepatitis A epidemiology in the United States-implications for vaccination strategies. J Infect Dis. 178:1579–1584. DOI: 10.1086/314518. PMID: 9815207.
21. Moon HW, Cho JH, Hur M, et al. 2010; Laboratory characteristics of recent hepatitis A in Korea: ongoing epidemiological shift. World J Gastroenterol. 16:1115–1118. DOI: 10.3748/wjg.v16.i9.1115. PMID: 20205283. PMCID: PMC2835789.
22. Hou JK, Velayos F, Terrault N, Mahadevan U. 2010; Viral hepatitis and inflammatory bowel disease. Inflamm Bowel Dis. 16:925–932. DOI: 10.1002/ibd.21284. PMID: 20480515.
23. Hollinger FB, Ticehurst JR, Fields BN, Knipe DM, Howley PM. 1996. Fields virology. 3rd ed. Lippincott-Raven;Philadelphia (PA):
24. Korea Centers for Disease Control and Prevention. 2017. Epidemiology and management of vaccine preventable disease. 5th ed. Korea Centers for Disease Control and Prevention;Cheongju:
25. Bell BP, Negus S, Fiore AE, et al. 2007; Immunogenicity of an inactivated hepatitis A vaccine in infants and young children. Pediatr Infect Dis J. 26:116–122. DOI: 10.1097/01.inf.0000253253.85640.cc. PMID: 17259872.
26. Irving GJ, Holden J, Yang R, Pope D. 2012; Hepatitis A immunisation in persons not previously exposed to hepatitis A. Cochrane Database Syst Rev. 2012:CD009051. DOI: 10.1002/14651858.CD009051.pub2. PMCID: PMC6823267.
27. Van Damme P, Banatvala J, Fay O, et al. 2003; Hepatitis A booster vaccination: is there a need? Lancet. 362:1065–1071. DOI: 10.1016/S0140-6736(03)14418-2. PMID: 14522539.
28. Park SH, Yang SK, Park SK, et al. 2014; Efficacy of hepatitis A vaccination and factors impacting on seroconversion in patients with inflammatory bowel disease. Inflamm Bowel Dis. 20:69–74. DOI: 10.1097/01.MIB.0000437736.91712.a1. PMID: 24284413.
29. Rubin LG, Levin MJ, Ljungman P, et al. 2014; 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis. 58:309–318. DOI: 10.1093/cid/cit816. PMID: 24421306.
30. Global hepatitis report 2017. [Internet]. Available from: https://www.who.int/publications/i/item/9789241565455. Geneva: World Health Organization;2017. Apr. 19. cited 2022 May 21.
31. Yim SY, Kim JH. 2019; The epidemiology of hepatitis B virus infection in Korea. Korean J Intern Med. 34:945–953. DOI: 10.3904/kjim.2019.007. PMID: 30919608. PMCID: PMC6718747.
32. Korean National Health and Nutrition Examination Survey (KNHANES). 2022. [Internet]. Korea Disease Control and Prevention Agency;Cheongju: Available from: https://knhanes.kdca.go.kr/knhanes/sub04/sub04_04_01.do. cited 2022 May 21.
33. Loras C, Saro C, Gonzalez-Huix F, et al. 2009; Prevalence and factors related to hepatitis B and C in inflammatory bowel disease patients in Spain: a nationwide, multicenter study. Am J Gastroenterol. 104:57–63. DOI: 10.1038/ajg.2008.4. PMID: 19098850.
34. Park SH, Yang SK, Lim YS, et al. 2012; Clinical courses of chronic hepatitis B virus infection and inflammatory bowel disease in patients with both diseases. Inflamm Bowel Dis. 18:2004–2010. DOI: 10.1002/ibd.22905. PMID: 22337144.
35. Huang ML, Xu XT, Shen J, Qiao YQ, Dai ZH, Ran ZH. 2014; Prevalence and factors related to hepatitis B and C infection in inflammatory bowel disease patients in China: a retrospective study. J Crohns Colitis. 8:282–287. DOI: 10.1016/j.crohns.2013.08.017. PMID: 24067604.
36. Yeo SJ, Lee HS, Jang BI, et al. 2018; Nonimmunity against hepatitis B virus infection in patients newly diagnosed with inflammatory bowel disease. Intest Res. 16:400–408. DOI: 10.5217/ir.2018.16.3.400. PMID: 30090039. PMCID: PMC6077318.
37. Esteve M, Saro C, González-Huix F, Suarez F, Forné M, Viver JM. 2004; Chronic hepatitis B reactivation following infliximab therapy in Crohn's disease patients: need for primary prophylaxis. Gut. 53:1363–1365. DOI: 10.1136/gut.2004.040675. PMID: 15306601. PMCID: PMC1774200.
38. Kim YJ, Bae SC, Sung YK, et al. 2010; Possible reactivation of potential hepatitis B virus occult infection by tumor necrosis factor-alpha blocker in the treatment of rheumatic diseases. J Rheumatol. 37:346–350. DOI: 10.3899/jrheum.090436. PMID: 20008922.
39. Alameel T, Al Sulais E. 2021; Risk of HBV reactivation among IBD patients with occult hepatitis B virus infection. Clin Gastroenterol Hepatol. 19:621–622. DOI: 10.1016/j.cgh.2020.04.089. PMID: 33248086.
40. Loras C, Gisbert JP, Mínguez M, et al. 2010; Liver dysfunction related to hepatitis B and C in patients with inflammatory bowel disease treated with immunosuppressive therapy. Gut. 59:1340–1346. DOI: 10.1136/gut.2010.208413. PMID: 20577000.
41. Lee JM, Wei SC, Lee KM, et al. 2022; Clinical course of hepatitis B viral infection in patients undergoing anti-tumor necrosis factor α therapy for inflammatory bowel disease. Gut Liver. 16:396–403. DOI: 10.5009/gnl210081. PMID: 34593670. PMCID: PMC9099383.
42. European Association for the Study of the Liver. 2017; EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 67:370–398. DOI: 10.1016/j.jhep.2017.03.021. PMID: 28427875.
43. Terrault NA, Lok ASF, McMahon BJ, et al. 2018; Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 67:1560–1599. DOI: 10.1002/hep.29800. PMID: 29405329. PMCID: PMC5975958.
44. Farraye FA, Melmed GY, Lichtenstein GR, Kane SV. 2017; ACG clinical guideline: preventive care in inflammatory bowel disease. Am J Gastroenterol. 112:241–258. DOI: 10.1038/ajg.2016.537. PMID: 28071656.
45. World Health Organization. 2019; Hepatitis B vaccines: WHO position paper, July 2017 - Recommendations. Vaccine. 37:223–225. DOI: 10.1016/j.vaccine.2017.07.046. PMID: 28743487.
46. Melmed GY, Ippoliti AF, Papadakis KA, et al. 2006; Patients with inflammatory bowel disease are at risk for vaccine-preventable illnesses. Am J Gastroenterol. 101:1834–1840. DOI: 10.1111/j.1572-0241.2006.00646.x. PMID: 16817843.
47. Kochhar GS, Mohan BP, Khan SR, et al. 2021; Hepatitis-B vaccine response in inflammatory bowel disease patients: a systematic review and meta-analysis. Inflamm Bowel Dis. 27:1610–1619. DOI: 10.1093/ibd/izaa353. PMID: 33393585.
48. Coates T, Wilson R, Patrick G, André F, Watson V. 2001; Hepatitis B vaccines: assessment of the seroprotective efficacy of two recombinant DNA vaccines. Clin Ther. 23:392–403. DOI: 10.1016/S0149-2918(01)80044-8. PMID: 11318074.
49. Jiang HY, Wang SY, Deng M, et al. 2017; Immune response to hepatitis B vaccination among people with inflammatory bowel diseases: a systematic review and meta-analysis. Vaccine. 35:2633–2641. DOI: 10.1016/j.vaccine.2017.03.080. PMID: 28404358.
50. Gisbert JP, Menchén L, García-Sánchez V, Marín I, Villagrasa JR, Chaparro M. 2012; Comparison of the effectiveness of two protocols for vaccination (standard and double dosage) against hepatitis B virus in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 35:1379–1385. DOI: 10.1111/j.1365-2036.2012.05110.x. PMID: 22530631.
51. Korean Association for the Study of the Liver (KASL). 2019; KASL clinical practice guidelines for management of chronic hepatitis B. Clin Mol Hepatol. 25:93–159. DOI: 10.3350/cmh.2019.1002. PMID: 31185710. PMCID: PMC6589848.
52. Cossio-Gil Y, Martínez-Gómez X, Campins-Martí M, et al. 2015; Immunogenicity of hepatitis B vaccine in patients with inflammatory bowel disease and the benefits of revaccination. J Gastroenterol Hepatol. 30:92–98. DOI: 10.1111/jgh.12712. PMID: 25160690.
53. Pratt PK Jr, Nunes D, Long MT, Farraye FA. 2019; Improved antibody response to three additional hepatitis B vaccine doses following primary vaccination failure in patients with inflammatory bowel disease. Dig Dis Sci. 64:2031–2038. DOI: 10.1007/s10620-019-05595-6. PMID: 30945037. PMCID: PMC6764090.
54. Gisbert JP, Villagrasa JR, Rodríguez-Nogueiras A, Chaparro M. 2013; Kinetics of anti-hepatitis B surface antigen titers after hepatitis B vaccination in patients with inflammatory bowel disease. Inflamm Bowel Dis. 19:554–558. DOI: 10.1097/MIB.0b013e31827febe9. PMID: 23380936.
55. Perrillo RP, Gish R, Falck-Ytter YT. 2015; American Gastroenterological Association Institute technical review on prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology. 148:221–244.e3. DOI: 10.1053/j.gastro.2014.10.038. PMID: 25447852.
56. Loomba R, Liang TJ. 2017; Hepatitis B reactivation associated with immune suppressive and biological modifier therapies: current concepts, management strategies, and future directions. Gastroenterology. 152:1297–1309. DOI: 10.1053/j.gastro.2017.02.009. PMID: 28219691. PMCID: PMC5501983.
57. Lan JL, Chen YM, Hsieh TY, et al. 2011; Kinetics of viral loads and risk of hepatitis B virus reactivation in hepatitis B core antibody-positive rheumatoid arthritis patients undergoing anti-tumour necrosis factor alpha therapy. Ann Rheum Dis. 70:1719–1725. DOI: 10.1136/ard.2010.148783. PMID: 21719446.
58. Aygen B, Demir AM, Gümüş M, et al. 2018; Immunosuppressive therapy and the risk of hepatitis B reactivation: consensus report. Turk J Gastroenterol. 29:259–269. DOI: 10.5152/tjg.2018.18263. PMID: 29755010. PMCID: PMC6284666.
59. Ahn SM, Choi J, Ye BD, et al. 2022; Risk of Hepatitis B virus (HBV) reactivation in patients with immune-mediated inflammatory diseases receiving biologics: focus on the timing of biologics after anti-HBV treatment. Gut Liver. 16:567–574. DOI: 10.5009/gnl210204. PMID: 34840146. PMCID: PMC9289826.
60. Ting SW, Chen YC, Huang YH. 2018; Risk of hepatitis B reactivation in patients with psoriasis on ustekinumab. Clin Drug Investig. 38:873–880. DOI: 10.1007/s40261-018-0671-z. PMID: 29968197.
61. Reddy KR, Beavers KL, Hammond SP, Lim JK, Falck-Ytter YT. American Gastroenterological Association Institute. 2015; American Gastroenterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy. Gastroenterology. 148:215–e17. DOI: 10.1053/j.gastro.2014.10.039. PMID: 25447850.
62. Madonia S, Orlando A, Scimeca D, Olivo M, Rossi F, Cottone M. 2007; Occult hepatitis B and infliximab-induced HBV reactivation. Inflamm Bowel Dis. 13:508–509. DOI: 10.1002/ibd.20035. PMID: 17206687.
63. Axiaris G, Zampeli E, Michopoulos S, Bamias G. 2021; Management of hepatitis B virus infection in patients with inflammatory bowel disease under immunosuppressive treatment. World J Gastroenterol. 27:3762–3779. DOI: 10.3748/wjg.v27.i25.3762. PMID: 34321842. PMCID: PMC8291024.
64. Millman AJ, Nelson NP, Vellozzi C. 2017; Hepatitis C: review of the epidemiology, clinical care, and continued challenges in the direct acting antiviral era. Curr Epidemiol Rep. 4:174–185. DOI: 10.1007/s40471-017-0108-x. PMID: 28785531. PMCID: PMC5544136.
65. Chevaux JB, Nani A, Oussalah A, et al. 2010; Prevalence of hepatitis B and C and risk factors for nonvaccination in inflammatory bowel disease patients in Northeast France. Inflamm Bowel Dis. 16:916–924. DOI: 10.1002/ibd.21147. PMID: 19885908.
66. Harsh P, Gupta V, Kedia S, et al. 2017; Prevalence of hepatitis B, hepatitis C and human immunodeficiency viral infections in patients with inflammatory bowel disease in north India. Intest Res. 15:97–102. DOI: 10.5217/ir.2017.15.1.97. PMID: 28239319. PMCID: PMC5323314.
67. Korean Association for the Study of the Liver. 2016; KASL clinical practice guidelines: management of hepatitis C. Clin Mol Hepatol. 22:76–139. DOI: 10.3350/cmh.2016.22.1.76. PMID: 27044763. PMCID: PMC4825161.
68. Ghany MG, Morgan TR. AASLD-IDSA Hepatitis C Guidance Panel. 2020; Hepatitis C guidance 2019 update: American Association for the Study of Liver Diseases-Infectious Diseases Society of America recommendations for testing, managing, and treating hepatitis C virus infection. Hepatology. 71:686–721. DOI: 10.1002/hep.31060. PMID: 31816111.
69. European Association for the Study of the Liver. 2020; EASL recommendations on treatment of hepatitis C: Final update of the series. J Hepatol. 73:1170–1218. DOI: 10.1016/j.jhep.2020.08.018. PMID: 32956768.
70. Cardona AM, Horta D, Florez-Diez P, et al. 2022; Evaluation of the safety and effectiveness of direct-acting antiviral drugs in the treatment of hepatitis C in patients with inflammatory bowel disease: national multicenter study (ENEIDA registry). MIC project. Journal of Crohns & Colitis. 16(Suppl 1):i321–i322. DOI: 10.1093/ecco-jcc/jjab232.416.
71. Korean Association for the Study of the Liver (KASL). 2018; 2017 KASL clinical practice guidelines management of hepatitis C: treatment of chronic hepatitis C. Clin Mol Hepatol. 24:169–229. DOI: 10.3350/cmh.2018.1004. PMID: 30092624. PMCID: PMC6166104.
72. Morisco F, Castiglione F, Rispo A, et al. 2013; Effect of immunosuppressive therapy on patients with inflammatory bowel diseases and hepatitis B or C virus infection. J Viral Hepat. 20:200–208. DOI: 10.1111/j.1365-2893.2012.01643.x. PMID: 23383659.
73. Papa A, Felice C, Marzo M, et al. 2013; Prevalence and natural history of hepatitis B and C infections in a large population of IBD patients treated with anti-tumor necrosis factor-α agents. J Crohns Colitis. 7:113–119. DOI: 10.1016/j.crohns.2012.03.001. PMID: 22464811.
74. Loras C, Gisbert JP, Saro MC, et al. 2014; Impact of surveillance of hepatitis b and hepatitis c in patients with inflammatory bowel disease under anti-TNF therapies: multicenter prospective observational study (REPENTINA 3). J Crohns Colitis. 8:1529–1538. DOI: 10.1016/j.crohns.2014.06.009. PMID: 25052345.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download