증 례
83세 남자가 내원 약 10일 전부터 시작된 기력 저하 및 복부 불편감을 주소로 타 병원을 내원하여 시행한 복부 CT에서 간문부 담관암이 의심된다며 전원되었다. 환자는 고혈압, 당뇨, 결핵, 전립선암 수술력, 뇌경색, 심근경색 스텐트 시술, 위선종으로 내시경 점막하 절제술을 받은 과거력이 있었다. 과거 50갑년의 흡연력 및 주 2-3회 소주 1-2병의 음주력이 있고, 평소 지팡이 보행을 유지하며 일상 생활에 크게 지장이 없었다. 발열이나 체중 감소는 없었으며, 입원 시 활력 징후는 혈압 114/69 mmHg, 심박수 61회/분, 체온 36.5℃였고, 신체진찰에서 키 163.1 cm, 체중 53.6 kg, BMI 20.2 kg/m2였다. 입원 당시 혈액 검사에서 총 빌리루빈, 아스파테이트아미노전달효소, 알라민아미노전달효소 등은 정상이었으나, 감마글루탄산탈수효소 186 U/L (11-75 U/L), 알칼리인산분해효소 266 U/L (35-105 U/L) 및 종양표지자 CA 19-9 34.8 U/mL, CEA 2.90 ng/mL가 확인되었다.
한림대학교성심병원에서 복부 CT (
Fig. 1) 및 자기공명영상 및 자기공명담췌관조영술(
Fig. 2)을 시행하였고 좌측 간문맥의 침범이 동반된 간문부 담관암이 의심되었고 비스무스 타입 II로 진단하였다. 그 외 췌장 미부에 3.4 cm 크기의 낭성 병변이 관찰되었다.
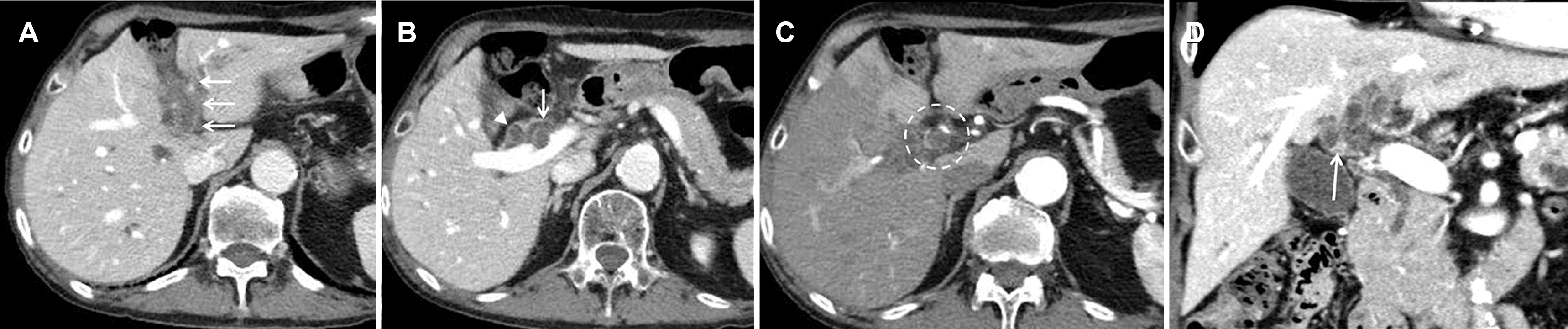 | Fig. 1Computed tomography scan shows (A, B) extensive left portal vein thrombosis (arrows) with bile duct dilatation (arrowhead of B). (C) Microvasculatures were noted around the bile duct on the arterial phase (dotted circle). (D) Coronal reformatted image shows hilar bile duct wall thickening with stenosis (arrow). 
|
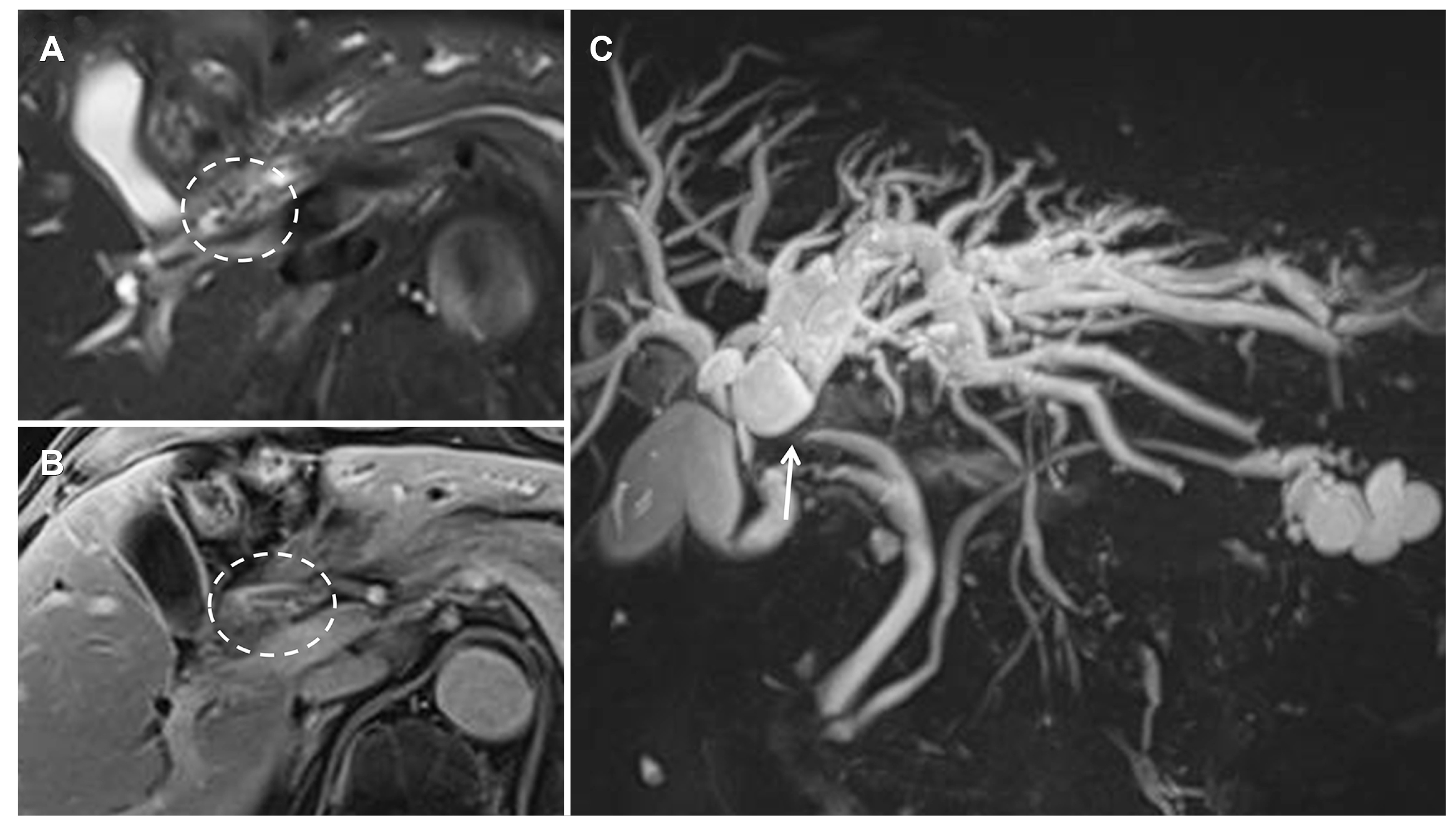 | Fig. 2Magnetic resonance imaging. (A) On the T2-weighted image, the venous collaterals are shown as dark signal voids (dotted circle). (B) On the contrast-enhanced image, the bile duct wall thickening with collaterals is shown as a linear enhancing lesion (oval dotted circle). (C) Magnetic resonance cholangiopancreatography shows hilar bile duct stricture (arrow) with proximal duct dilatation. 
|
내시경역행담췌관조영술(ERCP)을 시행하였고, 간문부 담관의 협착 소견이 확인되었다. ERCP 시술 중 겸자 생검(forceps biopsy) 및 솔세포진 검사(brush cytology) 시행 후 내시경적 경비 담도 배액술(endoscopic nasobiliary drainage)을 시행하였다. ERCP 시술 중 얻어진 검체에 대한 병리 검사에서 악성 세포는 관찰되지 않았으며 염증세포만 관찰되었다. 양전자 컴퓨터단층촬영(PET-CT)에서는 CT, MRI의 소견과 동일하게 간문부에 대사 증가를 보이는(maximum standard unit value=3.17) 악성 종괴를 의심하였고, 원격 전이를 의심할 만한 소견은 없었다(
Fig. 3).
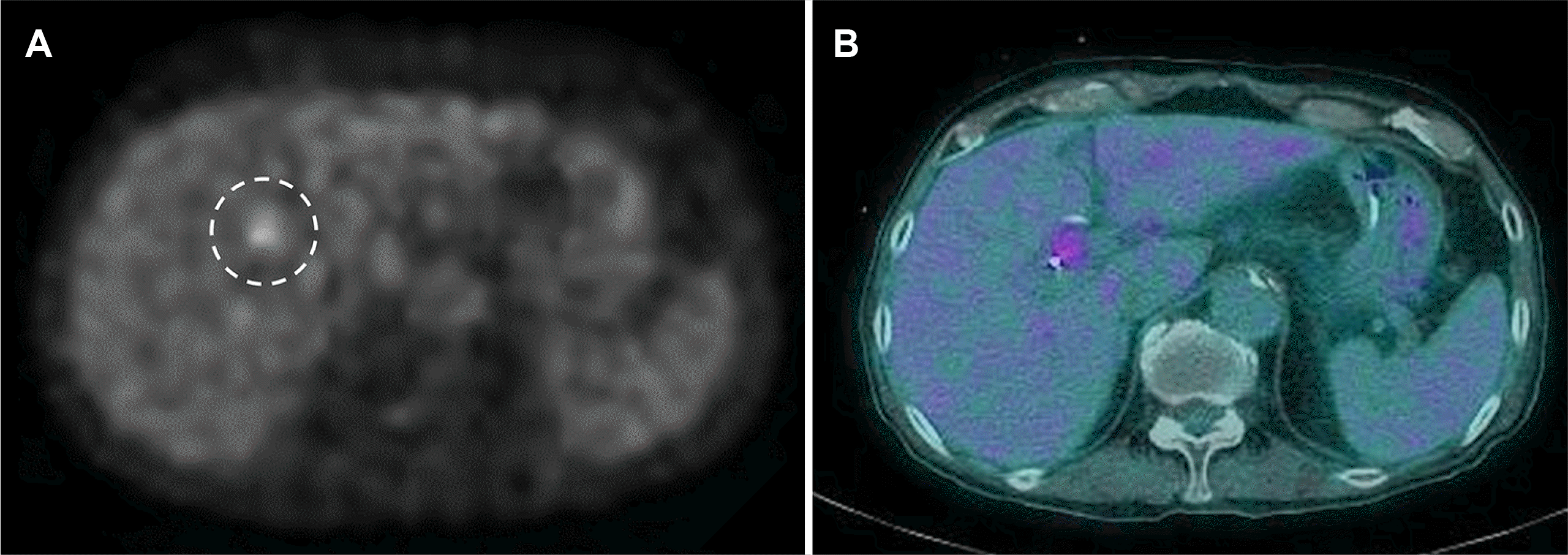 | Fig. 318F-flourodeoxyglucose positron emission tomography/computed tomography shows (A, B) mild FDG uptake lesions (dotted circle of A) in the hepatic hilar and left intrahepatic duct area (maximum standard unit value=3.17), suggesting a malignant tumor. 
|
병리 검사에서 악성종양의 증거는 명확하지 않았지만, 영상의학적으로 간문부 담관암의 가능성을 배제할 수 없어 외과로 의뢰하여 좌간절제술과 미상엽 절제, 담관 절제술, 담낭절제술을 시행하였다. 수술 후 최종 병리 소견에서 악성종양의 근거는 확인되지 않았으며, 혈관 이형성이나 간문맥의 해면상 변형에 따른 섬유아세포 증가로 인한 미만성의 담관벽 비후가 발생한 것으로 진단되었다(
Fig. 4). 수술 후 시행한 추가 검사에서 IgG4 subclass는 63.0 mg/dL로 정상 범위였다. 환자는 수술 후 회복되어 퇴원하였고, 이후 외래에서 1년째 특이사항 없이 추적 중이다.
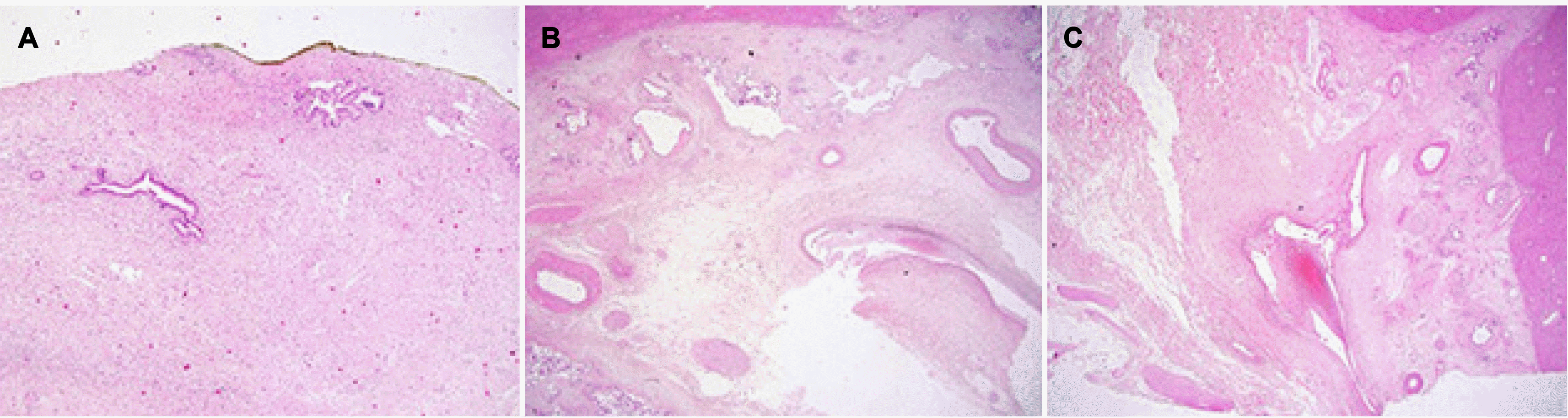 | Fig. 4(A) Increasing fibroblasts with mixed inflammatory cells. There is no increase in lymphoplasma cells (hematoxylin and eosin stain [H&E], ×40). (B, C) Some thinning of the ectatic vessel is observed. (B) H&E, ×2.5 (scan view). (C) H&E, ×2.5. 
|
Go to :

고 찰
문맥담도병증(portal biliopathy)은 간외문맥폐쇄로 인해 발생하는 간 내외의 담관에서 발생하는 이상 소견을 나타내는 용어이다. 문맥담도병증은 담관의 일부 폐쇄나 근위부의 확장, 혹은 담관과 담낭의 모양 변화 등으로 나타날 수 있다.
4 문맥압항진증 환자에서 관찰될 수 있는 간외문맥폐쇄는 담관 주위의 정맥계를 발달시켜 해면상 변형(cavernous transformation)을 유도하고, 이로 인해 발생하는 담관의 외부압박, 허혈성 손상, 섬유화반흔 등이 담관의 이상을 초래하는 것으로 알려져 있다. 간외문맥폐쇄에 동반된 담관의 이상은 ERCP 혹은 경피경간담도조영술에서 경화성 담관염 혹은 담관암으로 오인될 수 있다.
5
담관의 변화를 초래할 수 있는 담관 주변 혈관의 변화는 간문맥혈전으로 인해 서서히 진행되는 경과를 주로 보인다. 담관암은 수술 후에도 재발률이 60-90%에 달하는 예후가 불량한 질환이기 때문에 담관에서 관찰되는 이상 소견의 원인이 영상 소견만으로 양성과 악성의 명확한 구분이 어려운 상황에서 악성을 배제할 수 없고, 수술적 치료가 가능한 병기로 진단이 된다면 단순 추적 관찰보다는 내시경적 조직 검사 또는수술을 통한 적극적인 진단과 치료를 선택한다.
6 담관의 병변은 조직 검사나 세포진 검사를 통한 진단에 제한이 있다. 이증례의 환자처럼, 대규모 수술적 연구에서 간문부 담관암 진단 하에 수술을 받은 환자의 약 24%에서 양성 질환이 진단된것으로 보고되고 있다.
7 2001년 Stewart 등
8이 406명의 환자들을 대상으로 얻은 448개의 세포진 검사에 대한 분석에 따르면 특이도는 98%인 반면 민감도는 59.8%로 낮았는데, 낮은민감도에 대한 원인을 크게 2가지로 나누어 분석하였다. 종양이 점막 하에 위치하거나 상피에 이상 소견이 없을 경우, 혹은임파선 전이 등에 의한 외부 압박으로 인해 채취한 조직 내에는 종양의 침범이 없는 채취 상의 오류가 발생할 수 있고, 조직이 제대로 얻어졌다고 하더라도, 세포학적 변화가 적은 분화도가 좋은 선암이나, 유두상 혹은 점액성암 등을 병리학자가 제대로 찾아내지 못하여 발생할 수 있는 해석의 오류 역시언급이 되었다.
7 본 증례의 환자는 간문부 조직 검사에서는 만성 염증 소견, 세포진 검사에서는 별 다른 특징이 없는 담관 세포 무리가 확인되었다. 최근 Yoon 등
9의 메타분석 연구에 따르면 담도암 진단에 있어서 ERCP를 통한 솔세포진 검사와 겸자 생검의 통합 민감도(pooled sensitivity)는 각각 56%와 67%로 높지 않다. 그러므로 담도암이 의심되지만 ERCP를 통한 병리 검사에서 악성종양의 증거가 없는 경우, 환자의 치료를 위해서는 영상 검사 및 환자의 임상 양상을 자세히 확인해 볼 필요가 있다. 또한 ERCP 이외에 악성종양을 진단할 수 있는 방법인 초음파 내시경 유도하 세침 흡인 검사나, 경피적 경관 생검을 고려해 볼 필요가 있다.
10
문맥담도병증을 유발할 수 있는 간문맥혈전은 급성 혹은 만성으로 발생한다. 간경화나 간담도의 원발성 혹은 전이성 악성종양, 복부 내 감염이나 염증성 질환, 골수증식성 질환 등의 위험 인자가 1가지 이상 존재하고, 이로 인해 이차적으로 간문맥혈전이 발생하는 경우가 대부분으로, 선천적인 혈관 이상에 의한 간문맥혈전증은 증례가 많지 않고 어린 나이에 발생하는 편이다.
11 간문맥혈전증은 무증상으로 영상 검사상 우연하게 발견되기도 하나 복통, 오심, 열, 장 허혈, 혈변, 폐쇄성 황달, 비장비대, 상부위장관 출혈 등의 증상을 유발할 수 있다. 간문맥혈전으로 인한 해면상 변형은 만성적으로 진행하여 환자의 약 77-100%에서 문맥담도병증이 나타나지만, 담관 관련 증상을보이는 환자는 이 중 5-38%에 불과하며, 급성 양상으로 담즙정체나 담석 형성 등으로 인한 황달이나 담관염, 담낭염, 복통등을 주로 호소하며,
12 본 증례의 환자는 황달 등의 증상은없었으나 10일 이상 지속되는 복통 및 전신 위약감을 주소로내원하였다.
본 증례의 환자는 과거 전립선암 수술력 및 심근경색 및 뇌경색 과거력이 있던 환자로 간문맥혈전의 위험인자로 혈전 생성 질환을 먼저 고려해 볼 수 있다. 환자는 10년 전 급성 심근경색으로 스텐트 삽입술을 받았으며, 스텐트 시술 3개월 뒤 우측 다리뇌(pons)경색이 발생하였고, 시술 9개월 뒤에는 급성경막하출혈이 발생한 적이 있다. 뇌경색 발생 시 시행한 검사에서 혈액응고장애나 homocysteine 농도에서는 이상이 확인되지 않았으나,
CYP2C19 genotyping 검사에서 *2,*2가 확인이 되었다.
CYP2C9*1 동형접합 야생형에 비해
CYP2C9*2 또는
CYP2C9*3 대립 유전자를 갖는 환자는 와파린 대사 속도를 저하시켜 출혈 위험도를 높이기 때문에 상대적으로 적은 용량을 복용해야 하며 PT INR이 안정되기까지 더 많은 시간이 요구된다. 또한
CYP2C19 의 활성이 낮을수록 clopidogrel 사용시 혈중 활성 대사물이 감소하여 혈소판 응집에 대한 억제 효과가 감소하여 주요 심혈관 부작용의 위험이나 스텐트 내 혈전증이 증가하는 것으로 보고되고 있으나, 심방세동, 뇌졸중, 안정협심증과 같은 질환에서
CYP2C19 유전자 변이에 따른 활성도 감소가 심혈관 부작용 위험도에 미치는 영향은 아직 정립되지 않은상태이다.
13 본 증례의 환자는 순환기내과, 신경과에서 외래추적 관찰을 유지하며 clopidogrel 75 mg 하루 1회, cilostazole 100 mg 하루 2회로 두 종류의 항혈소판제제 복용을 10년 이상유지해 왔으나, 복용을 시작한 이후 내시경 시술 및 발치 관련시술, 출혈 발생 관련하여 최소 5일 이상 약제를 중단한 기록이여러 차례 확인이 되었다. 두 종류의 항혈소판제를 모두 중단하게 된다면 중단 기간이 7일 내라도 스텐트 내 혈전증이 발생한다는 보고가 있으며,
14 증례의 환자의 유전자 검사 결과와의 연관성을 고려하였을 때 여러 차례에 있었던 항혈소판제의 단기간중단으로 인해 생성된 미세 혈전이 점차적으로 진행되어 간문맥혈전을 유발하였을 가능성을 고려해 볼 수 있다.
본 증례의 환자는 수술 후 최종 병리에서 악성종양을 시사하는 소견은 관찰되지 않았으나 섬유아세포의 증가와 정맥의 확장 및 담관 내 혈관벽이 얇아진 소견이 확인되었으며, 만성 담낭염 및 주변 임파선 10개의 반응성 증식이 확인되었는데, 이는 간문맥혈전으로 인해 초래된 이차적 소견으로 생각해 볼 수가 있다. 간문맥의 혈전이 일단 생성이 되면 부분적으로 재관류가 진행되더라도 약 6-20일 후에 간문맥의 해면상 변형이 발생할 수 있으며,
15 유전자형에 문제가 없었다고 하더라도 고용량의 항혈소판제제를 유지해야 되는 상황의 환자에게서 5-7일간의 항혈소판제제 중단은 미세 혈전 형성의 가능성을 높일 수 있을 것으로 생각된다. 영상에서 간 실질의 이상 소견이나 간기능 검사에서 이상 소견이 확인되지는 않았으나, 꾸준하게 음주를 지속해왔으며, 이로 인한 알코올성 간질환의 가능성 및 이로 인한 혈전 생성의 위험도가 증가되었을 가능성 역시 고려해 볼 수 있다.
본 증례는 문맥담도병증이 간문부 담관암으로 오인된 경우인데, 이전의 문헌 보고에 의하면 양성 질환 중 간문부 담관암으로 오인되어 수술이 시행되었던 질환은 IgG4 연관 경화성 담관염이 가장 많았고, 그 외에 원발성 경화성 담관염, 담석 질환, 비특이적 경화성 질환 등이 있었다(
Table 1). 담관 협착 환자를 진료할 때에는 양성과 악성을 감별하는 것이 가장 중요하며, 혈액 검사나 영상 검사, 조직 검사를 시행하더라도 본 증례의 환자처럼 진단이 되지 않아 약 20%에서는 수술을 통한 진단과 치료를 시행하는 경우가 있다. 임상 의사는 환자의 현재 임상 상황 외에도 과거에 앓았던 기저 질환이나 복용 약제 등을 함께 확인하여 담관 협착을 유발할 수 있는 원인을 분석하고, 이에 따른 정확한 진단과 치료를 통해 환자에게 불필요한 침습적 검사 및 치료를 최소화할 수 있을 것이다.
Table 1
Etiologies of Benign Pathology in Presumed Malignant Biliary Stricture Based on Surgical Resection Series
|
Study |
Country |
Setting |
Incidence and major etiologies of benign pathology |
|
Clayton et al.7 (2003) |
U.K. |
Hepatic resection for suspected malignancy |
18/250 (7.2%), inflammatory pseudotumor, sclerosing cholangitis, reactive inflammatory change |
|
Corvera et al.16 (2005) |
U.S.A. |
Surgery for presumed hilar cholangiocarcinoma |
22/275 (8.0%), LPSPC (2), PSC (3), nonspecific fibroinflammatory change (8), granulomatous process (3), stone disease (6) |
|
Wakai et al.17 (2012) |
Japan |
Surgery for preoperative diagnosis of biliary malignancy |
5/153 (3.3%), non-specific fibrosis/inflammation (3), IgG4-SC (2) |
|
Roos et al.18 (2018) |
Netherlands |
Surgery for presumed perihilar cholangiocarcinoma |
50/323 (15.5%), IgG4-SC (21), unclassified sclerosing inflammation (24), cystadenoma (1), sclerosed hemangioma (1) |

이번 증례는 영상 검사에서 간문부 담관암으로 오인되어 간절제술을 시행하였고 수술 후 문맥담도병증으로 진단된 예이다. 문맥압항진증이 있는 환자에서 동반된 담관의 변화는 영상학적으로 악성종양과의 감별이 어렵고, 조직 검사를 통한 진단에도 제한이 있어 수술을 통한 진단과 치료까지 고려할 수도 있다. 담관암 진단 목적의 수술은 필요시 간 일부 절제 및 담낭 절제까지 시행하는 등 수술 위험도 및 이에 따른 환자의 부담이 높은 만큼, 혈전 형성의 위험이 높다고 판단되는 환자에 있어서는 과거력, 복용 약물 및 순응도의 철저한 확인과 진단의 정확도를 높일 수 있는 추가적 검사를 고려해야 할 것으로 생각된다.
Go to :







 PDF
PDF Citation
Citation Print
Print





 XML Download
XML Download