This article has been
cited by other articles in ScienceCentral.
Abstract
Paneth cell carcinoma is a rare carcinoma composed predominantly or purely of malignant Paneth cells. An 83-year-old woman presented for evaluation of an elevated lesion in the stomach. On endoscopy, a 15 mm, discolored, elevated lesion with a central depression was found on the greater curvature of the gastric lower body. Endoscopic forceps biopsy revealed chronic gastritis with intestinal metaplasia. Magnifying endoscopy revealed an irregularly oval/tubular microsurface pattern and an irregular loop microvascular pattern with a demarcation line, suggestive of early gastric cancer. Therefore, endoscopic submucosal dissection was performed. Histopathological examination revealed a well-differentiated tubular adenocarcinoma limited to the muscularis mucosae and the tumor cells contained coarse eosinophilic granules in the cytoplasm. These tumor cells were diffusely and strongly stained for lysozyme, confirming the tumor diagnosis as Paneth cell carcinoma. Herein, we report a rare case of Paneth cell carcinoma and its endoscopic and histopathologic findings.
Go to :

Keywords: Gastric cancer, Endoscopic submucosal dissection, Lysozyme, Paneth cell carcinoma
서 론
위암은 전통적으로 Lauren 분류법에 따라 장형(intestinal type)과 미만형(diffuse type)의 두 가지 조직형으로 분류되며,
1 암세포의 샘 형성 경향에 기초한 Nakamura 분류법에 의해서는 분화형(differentiated type)과 미분화형(undifferentiated type)으로 구분한다.
2 분화형과 미분화형 위암은 성장 패턴, 침습성, 전이 및 예후와 같은 특성이 다르기 때문에, 내시경 절제의 적응증에 포함되는 기준도 다르다.
3,4
파네트세포(Paneth cell)는 정상 소장 및 근위부 결장의 Lieberkühn샘에 위치하는 특수형태의 분비 상피 세포로, lysozyme 및 phospholipase A2 등의 효소뿐만 아니라 HD5와 HD6과 같은 항균성 alpha defensin peptide를 분비하여 광범위한 장내 미생물에 대한 방어와 숙주 면역 조절에 중요한 역할을 한다.
5 파네트세포화생(Paneth cell metaplasia)은 만성 염증성 위장관 질환에서 종종 발견되고 있는데, 이는 염증의 만성화 징후로 생각되며 손상된 상피의 수복과 재생과 연관이 있다.
6 이러한 파네트세포 형태의 종양이 위장에서도 드물게 보고되고 있는데,
7 이 중 주로 악성 파네트세포로만 구성된 암종을 파네트세포암종(Paneth cell carcinoma)으로 정의한다. 파네트세포암종 세포는 특징적으로 H&E 염색에서 분화형 선암종 세포질 내에 호산성 과립(eosinophilic granules)을 가지며, phosphotungstic acid-hematoxylin 염색과 lysozyme 염색에 양성을 보이는데, 이는 다른 질환과의 감별 진단에 도움이 된다.
8 따라서 파네트세포암종은 Lauren 분류법에서는 장형, Nakamura 분류법에서는 분화형으로 분류되고 있다.
저자들은 검진으로 우연히 발견된 위 상피성 병변에 대해 내시경 점막하 박리술(endoscopic submucosal dissection, ESD) 시행 후 최종적으로 파네트세포암종으로 진단된 1예를 문헌고찰과 함께 보고하는 바이다.
Go to :

증 례
83세 여자가 검진으로 시행한 내시경 검사에서 우연히 발견된 위 융기성 병변에 대하여 추가 평가를 위해 내원하였다. 이 당시 내시경 생검 결과는 장상피화생이 동반된 만성위염소견이었다. 과거력으로는 고혈압, 당뇨로 약물 복용 중이었고, 음주력과 흡연력은 없었다. 가족력에서는 언니의 위암 병력이 있었다. 환자는 내원 당시 전신 상태는 양호하였으며,신체 진찰에서도 특이 사항은 없었다. 검사실 소견에서 말초혈액검사는 백혈구 8,750/mm3, 혈색소 11.9 g/dL, 혈소판 173,000/mm3였고 생화학 검사는 모두 정상이었다.
본원에서 재시행한 내시경 검사에서 위 하체부 대만에 약 15 mm 크기의 퇴색조 융기 병변이 관찰되었고, 중심에는 경한 함몰이 있었다(
Fig. 1A). 협대역 영상 병용 확대내시경(magnifying endoscopy with narrow-band imaging, ME-NBI)에서 주변과의 경계선(demarcate line)은 명확하였으며 중심에 불규칙한 타원형과 관 모양의 미세표면구조와 불규칙한 루프 형태의 미세혈관 소견이 관찰되었다(
Fig. 1B).
Helicobacter pylori (
H. pylori)에 대한 신속요소분해효소 검사는 양성이었고, 내시경 생검 결과는 이전과 동일하게 장상피화생을 동반한 만성위염으로 진단되었다. 하지만 ME-NBI 소견으로는 조기 위암이 강력히 의심되어, 환자와 상의 후에 병변에 대해서 ESD를 시행하기로 결정하였다. 인디고카민 용액 산포 후 병변의 경계 약 5 mm 밖에 dual knife (Olympus, Tokyo, Japan)로 표시한 뒤에 생리식염수와 인디고카민 용액이 혼합된 용액을 점막하에 주입하였다. 이후 dual knife와 IT-nano knife (Olympus)를 사용하여 병변을 완전 절제하였다(
Fig. 2).
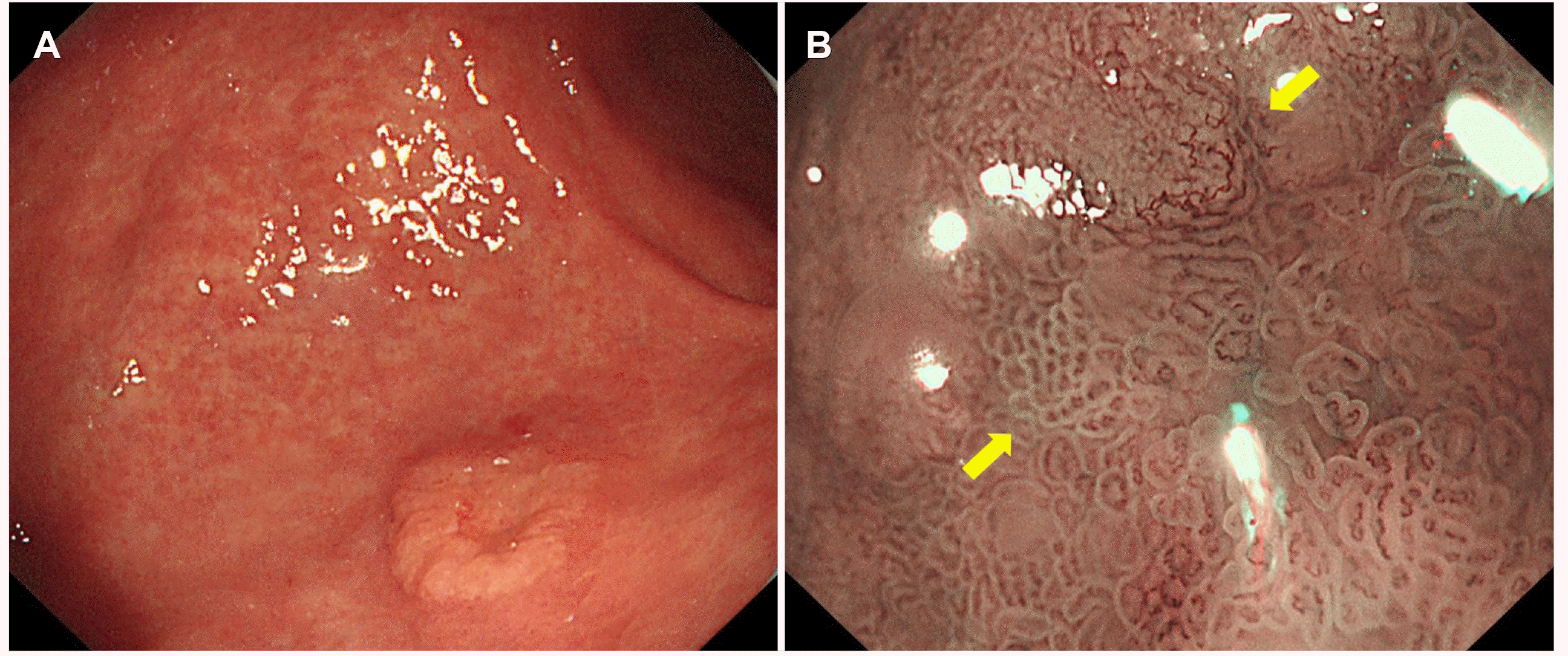 | Fig. 1Endoscopic findings. (A) Conventional endoscopy shows a discolored, elevated lesion with a central depression, measuring approximately 15 mm in diameter, on the greater curvature of the gastric lower body. (B) Magnifying endoscopy with narrow-band imaging reveals irregularly oval and tubular microsurface patterns and an irregular loop microvascular pattern (arrows). 
|
 | Fig. 2Endoscopic submucosal dissection procedure. (A) An approximately 1.5 cm-sized, elevated lesion with central depression is seen on the greater curvature of the gastric lower body. (B) Chromoendoscopy with indigo carmine reveals a clearer lesion. (C, D) Circumferential mucosal incision and submucosal dissection are performed. (E) The lesion is completely removed. (F) The resected specimen. 
|
절제 조직의 병리 소견에서 1.4×1.4 cm 크기의 IIa 병변으로, 종양은 점막근층(muscularis mucosa)에 국한된 분화도가 좋은 관상선암종(tubular adenocarcinoma)이었고 종양세포의 세포질 내에 호산성 과립들이 관찰되었다(
Fig. 3A, B).수직 및 수평 절제면에 암의 침윤 소견은 없었고, 림프관 및혈관 침윤 소견도 없었다. Lysozyme에 대한 면역조직화학적염색에서 호산성 과립을 포함한 다수의 종양세포는 lyso-zyme에 대해 광범위하고 강하게 염색되었다(
Fig. 3C). 상기소견을 토대로 종양은 최종적으로 파네트세포암종으로 진단되었다. 추가적으로 시행한 복부 전산화단층촬영 검사에서 림프절이나 원격 전이는 없었다. 이후
H. pylori 감염에 대한제균 치료를 시행하였고, 시술 후 1년이 지난 현 시점까지 재발 소견은 없었다.
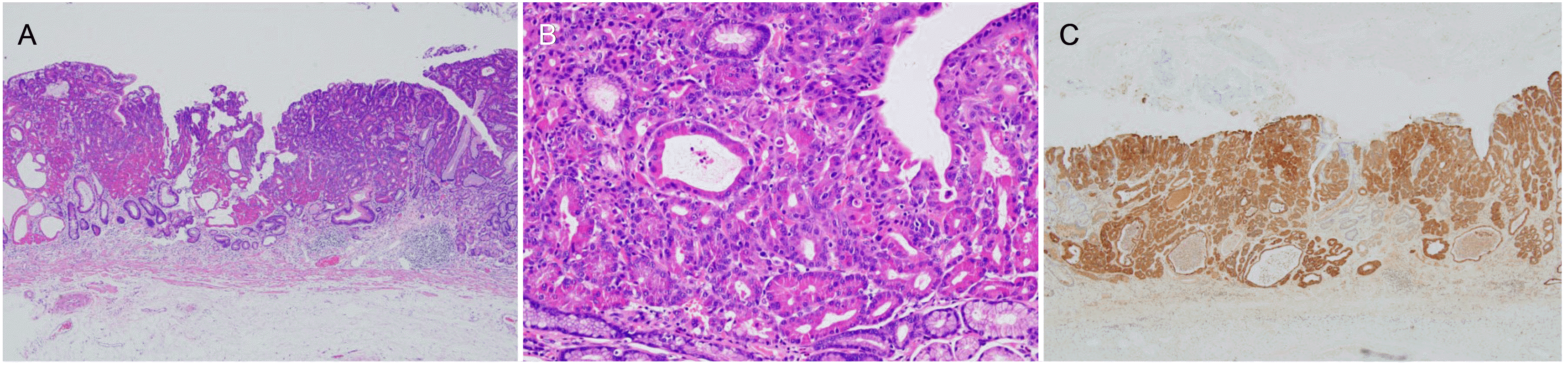 | Fig. 3Histopathologic findings. (A) The tumor is a well-differentiated tubular adenocarcinoma limited to the muscularis mucosae (hematoxylin and eosin stain [H&E], ×40). (B) The tumor cells contain coarse eosinophilic granules in the cytoplasm (H&E, ×200). (C) The tumor cells are diffusely and strongly positive for lysozyme (lysozyme stain, ×40). 
|
Go to :

고 찰
파네트세포는 세포질 내의 큰 호산성 과립을 특징으로 하는 세포로, 정상적으로는 소장의 Lieberkühn 샘의 기저부와 충수, 결장 등에서도 관찰된다. 파네트세포는 염증성 장질환과 같은 만성 비종양성 질환뿐만 아니라 선종이나 암종과 같은 종양성 질환에서도 관찰된다.
9-11 파네트세포암종의 대부분은 선암종으로 주로 위, 대장에서 보고되고 있으며, 이외에도 소장, 담낭, Meckel 게실 등에서 발생한 파네트세포암종도 보고되고 있다.
7
위에서는 완전형(complete type) 장상피화생이나 선종에서 종종 파네트세포가 보이기는 하지만, 파네트세포로 구성된 파네트세포암종은 드물다.
7 위 파네트세포암종의 병인은 아직 명확하게 알려져 있지는 않으나, 장상피화생과 같은 파네트세포가 존재할 수 있는 전암성 병변 상태에서 발생하는 것으로 추정된다. 파네트세포화생이 동반되어 있는 대장 점막에서도 동반되지 않은 대장 점막에 비해
K-ras 돌연변이와 초이성체마커의 이형성 소실(loss of heterozygosity of microsatellite markers)이 좀 더 흔히 발견되었다는 연구 결과가 있어 파네트세포화생은 대장에서도 역시 전암성 병변으로 고려된다.
12
파네트세포의 임상적 의미에 대해서도 역시 잘 알려져 있지 않지만, 전암성 및 암성 병변에서의 파네트세포화생은 좋은 예후와 연관이 있는 것으로 보인다. 바렛식도에서 파네트세포화생이 있는 경우 질병의 진행 정도가 경하였으며,
13 원위부 결장 선종에 파네트세포화생이 있는 경우 타 부위에 선암종과 같은 진행성 병변이 있을 가능성이 낮은 것으로 보고되고 있다.
14
본 증례는 병리조직학적으로 고분화 관상선암종으로, 주로 세포질 내에 호산성 과립을 가진 파네트세포양 종양세포로 이루어져 있었다. 그리고 이러한 종양세포는 lysozyme 염색 양성 소견을 보여 파네트세포암종으로 진단할 수 있었다. 파네트세포암종은 전체 위암의 0.3-4.1% 정도에서 관찰되며, 암이 진행할 경우에는 파네트세포암종 세포가 소실되는 경향이 있어 진행암에서 발견되는 경우는 낮다고 알려져 있다.
15 파네트세포암종은 고분화 관상선암종 형태를 보이며 파네트세포암종의 주위에 완전형 장상피화생이 공존하는 경우가 많아 분화형 위암과 동등한 경과를 보여 분화형 위암의 드문 아형으로 간주되고 있다. 따라서 본 증례도 내시경 절제 후 병리 소견에서 분화형 위암의 근치 절제 범위에 해당되어 추가적인 치료 없이 경과 관찰 중이다.
종종 파네트세포암종은 종양의 분화도가 높기 때문에 내시경 생검 시 본 증례와 같이 종종 양성 병변으로 오인될 수 있다. 그러므로 병변에 대한 내시경 소견이 중요하여, 특히 ME-NBI 검사 시 경계과 명료한 병변이면서 불규칙한 미세표면구조나 미소혈관구조가 보이는 경우에는 위암의 가능성이 높으므로 ESD와 같은 적극적인 내시경 치료가 필요하다.
16 또한 lysozyme 염색과 같은 특수 면역조직화학적 염색이 감별 진단에 유용하다. 종종 신경내분비 분화(neuroendocrine dif-ferentiation)를 보이는 위암도 파네트세포암종과 유사한 병리 소견을 보일 수 있는데, 이는 synaptophysin이나 chromog-ranin과 같은 면역조직화학적 염색에 의해 배제할 수 있다.
요약하면 저자들은 위의 융기성 병변에서 생검 시 장상피화생을 동반한 만성위염으로 진단되었지만, ME-NBI에서 조기 위암이 의심되어 ESD 후 면역조직화학적 염색에 의해 최종적으로 파네트세포암으로 진단된 예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Go to :








 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download