Abstract
Background and Objectives
Papillary thyroid carcinoma (PTC) with lateral neck lymph node metastasis is known as a major risk factor for tumor recurrence after surgical treatment. The aim of this study is to identify risk factors for loco-regional recurrence in patients with PTC with lateral neck lymph node metastasis, which has a high risk of recurrence.
Subjects and Method
This study involved 319 patients who underwent total thyroidectomy, central lymph node (LN) and lateral LN dissection due to PTC. The patients’ demographics and pathological factors, including lymph node metastasis were retrospectively reviewed. Univariate, multivariate and C-index with variable selection analyses were performed to identify factors associated with recurrence-free survival (RFS).
Results
A mean follow-up of 101 months, 35 (10.9%) patients had a loco-regional recurrence. In multivariate analysis according to loco-regional recurrence, patients with a primary tumor of more than 4 cm, multifocality, vascular invasion, and bilateral lateral cervical metastasis were associated with worse RFS. In the variable selection analysis, lateral lymph node metastasis ratio was also statistically significant.
Conclusion
PTC with lateral neck lymph node metastasis included tumors larger than 4 cm. Multifocality, vascular invasion, high lateral lymph node metastasis ratio and bilateral neck lymph node metastasis are predictive factors of loco-regional recurrence, and these risk factors should be carefully followed-up after surgery.
갑상선 유두암(papillary thyroid carcinoma)은 전체 갑상선암 중 가장 흔한 암종이다. 유두암으로 인한 사망률은 매우 낮으나 그 발생률은 전세계적으로 계속해서 증가하고 있다[1]. 대부분의 유두암은 좋은 예후를 보이지만 일부에서는 국소 침범과 림프절 전이와 같은 공격적인 모습을 보이기도 한다[2]. 현재까지 이러한 유두암의 재발 위험인자로는 나이, 성별, 종양의 크기, 종양의 다발성, 피막 외 침범, 림프절 전이 여부 등 매우 다양한 예후 인자들이 보고되고 있다[3]. 특히 림프절 전이는 유두암의 재발 및 원격전이, 사망률의 주요 요인 중 하나로 알려져 있다[4,5]. 림프절 전이 및 재발은 주로 중심경부와 측경부에서 발생한다[6]. 일반적으로 림프절 전이는 중심경부 림프절에서 측경부 림프절로 순차적으로 발생하는 것으로 되어 있고, 림프절의 전이의 개수나 크기에 따라 재발률이 차이가 있다[7]. 유두암의 재발은 수술적 치료를 필요로 한 경우가 많으나, 재수술 시행 시 술기의 어려움이 있고, 이로 인해 합병증 발생과 재수술에 의한 환자의 삶의 질의 저하와 연관성이 있다[8,9].
분화 갑상선암의 재발에 영향을 주는 림프절 전이에 관한 인자로는 전이 림프절의 크기, 개수, 림프절 전이 비율, 림프절 피막 침범 여부 등이 있다[10,11]. 특히 측경부 림프절 전이가 중심경부 림프절 전이에 비해 나쁜 예후를 보인다고 알려져 있다[12,13]. 이에 따라 높은 재발률을 보이는 측경부 림프절 전이 유두암 환자들의 경우 수술적 치료 및 방사성동위원서 치료 후에도 주의 깊은 감시가 필요하다[14]. 측경부 림프절 전이 유두암 환자에서 재발 위험인자들의 분석을 통한 재발 예측은 매우 중요하다. 본 연구에서는 측경부 전이가 있는 갑상선 유두암에서 수술 후 국소 재발과 연관된 위험인자를 분석하고자 한다.
2006년 2월부터 2015년 12월까지 부산대학교병원 이비인후과에서 갑상선암으로 수술을 시행 받은 5155명 중 측경부 전이로 갑상선 전절제술 및 경부 절제술을 시행 받은 환자는 총 579명이었다. 이 환자 중 갑상선 유두암 외 다른 암종(여포암, 수질암, 역형성암)으로 수술을 받은 경우, 수술 전후로 동반암이 있는 경우, 본원 수술 후 타 병원에서 방사선요오드 치료를 받은 경우, 수술방법이 고식적 방법이 아닌 경우(내시경수술, 로봇수술)를 제외한 319명을 대상으로 후향적 분석을 시행하였다. 인증된 연구윤리심의위원회(Institutional Review Board, IRB)의 승인을 받았다(2101-008-099).
모든 환자는 수술 전 초음파 검사, 컴퓨터단층촬영 검사(CT scan), 세침흡인검사를 통한 병리검사에 따라 갑상선 전절제술 및 중심경부, 측경부 림프절제술을 편측 또는 양측으로 시행하였다. 중심경부 림프절제술의 경우 중심경부 림프절에 전이 소견이 없더라도 예방적으로 실시하였고, 측경부의 경우 전이 소견이 확인된 구역에서 최소한 3, 4구역의 치료적 측경부 절제술을 시행하였다. 모든 환자는 수술 후 부산대학교병원 핵의학과 진료 후 방사성 요오드 치료를 시행하였다.
국소 재발에 대한 진단은 본원 내분비내과에서 혈액검사(혈청갑상선글로블린의 상승) 등의 진단의학적 검사, 갑상선 스캔 검사, 초음파검사, 컴퓨터단층촬영 검사(CT scan), 양전자컴퓨터단층촬영(PET-CT) 등의 영상의학적 검사를 통하여 평가되었다.
재발에 연관되는 인자로는 나이(age), 성별(sex), 체질량지수(body mass index, World Health Organization classification), 종양 크기(tumor size), 종양의 절제연(pathologic margin), 종양 다발성(multifocality), 종양의 양측성(tumor bilaterality), microscopic과 gross를 모두 포함한 종양의 갑상선 외 침범 소견(extrathyroidal extension, ETE), 종양의 림프 침범(lymphatic invasion), 종양의 혈관 침범(vascular invasion), 림프절 전이 개수(number of lymph node)에 대해 분석하였다. 종양 크기의 경우 1 cm 이하, 1 cm 초과 및 2 cm 이하, 2 cm 초과 및 4 cm 이하, 4 cm 초과로 4가지 그룹으로 나누었다. 종양 다발성의 경우 1개, 2개, 3개 이상으로 다발성의 정도에 따라 구분하였다. 림프절 전이의 경우 중심경부, 측경부에서 각각 제거한 림프절 수와 전이된 림프절 수로 구분하였으며, Table 1과 같이 림프절 전이 위치에 따라 나누어 분석하였다.
총 319명의 연구 대상자 중 남자는 76명(23.8%), 평균 나이는 48세였다. 종양의 크기는 1 cm 이하가 101예(31.7%), 1 cm 초과 및 2 cm 이하가 128예(40.1%), 2 cm 초과 및 4 cm 이하가 79예(24.8%), 4 cm 초과가 11예(3.4%)였다. 종양의 절제연이 양성인 경우는 45예(14.1%), 종양이 다발성인 경우 중 2개인 경우가 85예(26.6%), 3개 이상인 경우가 65예(20.4%)였으며, 종양이 양측성인 경우가 132예(41.3%)였다. 종양의 림프 침범은 53예(16.6%), 혈관 침범은 40예(12.5%)였다. 38예(11.9%)에서 양측 경부 전이가 있었고, 중심경부 림프절 전이 개수의 평균은 5.1 (±4.3)개, 측경부 림프절 전이 개수는 5.6 (±4.7)개였으며, 중심경부 림프절과 측경부 림프절의 평균 림프절 전이비율(평균 전이림프절 수/평균 제거된 림프절 수)의 경우 각각 0.5 (±0.3), 0.2 (±0.1)였다. 이들 중 경부 2, 3, 4구역 절제술을 시행한 경우는 270예였으며, 3, 4구역을 시행한 경우는 49예였다. 도약전이(skip metastasis)는 39예(12.2%)에서 발견되었다. 방사성 요오드 치료의 경우 총 1회에서 4회까지 실시하였고, 총 용량은 평균 158.6 mCi (30-800)가 사용되었다(Table 1). 갑상선유두암에서 수술 후 역형성암으로의 변화된 경우가 1명이었다. 총 4명의 사망자 중 3명은 유두암의 폐 전이, 1명은 역형성암의 다발성 전이로 사망하였다.
평균 101.7±38.4개월의 경과 관찰 기간 중 총 35명(10.9%)의 환자에서 국소 재발이 발견되었고, 수술 후 평균 34.2개월(8-87개월)에 재발이 발견되었다. 중심경부 림프절에서만 재발한 경우가 18예, 중심경부 림프절과 측경부에서 모두 재발한 경우는 3예였으며, 측경부에서만 재발한 경우가 14예였다. 동측에서 재발한 경우는 14예, 반대편에서 재발한 경우가 3예였다(Table 2). 원격 전이는 총 12명(폐, 뼈)에서 발견되었으며, 국소 재발없이 원격 전이가 있었던 경우는 11명으로, 9명은 폐, 2명은 폐와 뼈에 전이가 동시에 있었다. 원격 전이를 포함할 경우 재발률은 14.4% (46명)이 된다. 본 연구에서는 원격 전이를 제외한 국소 재발에 대해서만 분석을 시행하였다.
수술 전 성대 마비가 있은 경우는 3예였고, 수술 후 후두 내시경으로 확인된 성대 마비는 총 6예였다. 종양의 유착으로 인한 경우는 4예, 수술 중 과도한 견인에 의한 신경 손상인 경우가 2예였다. 이들 중 일시적으로 마비가 1예, 영구적인 마비는 5예였다. 수술 후 출혈은 총 2명에서 발생하였고 모두 지혈술을 시행하였다. 유미관 손상으로 배액관을 통해 유미즙이 확인된 경우는 총 14명에서 발생하였고, 수술적 치료가 필요한 경우는 1예로 대부분에 대증적 치료로 호전되었다. 안면신경(marginal mandibular nerve) 마비는 1예에서 발생하였고 마비 증상은 영구적이었다. 저칼슘혈증의 발생은 83예였으며, 일시적인 경우가 73예, 관찰기간 중 지속적인 저칼슘혈증으로 내분비내과적 치료를 시행한 경우가 10예였다(Table 3).
단변량분석에서 국소 재발과 관련된 인자로는 나이, 종양 크기가 4 cm 초과인 경우, 종양의 절제연 양성, 종양 다발성 3개 이상인 경우, 양측 경부 전이, 총 림프절 전이 비율(전이 림프절 수/제거된 림프절 수), 중심경부 림프절 전이 비율, 측경부 림프절 전이 비율, 측경부 림프절 전이 개수 11개 이상, 방사성요오드치료 전 혈청갑상선글로블린(thyroiglobulin, Tg), 방사성요오드치료 전 혈청항갑상선글로블린항체(antithyroglobulin antibody, anti-Tg Ab), 방사성요오드치료 후 Tg, 방사성요오드치료 후 anti-Tg Ab, 총 방사성요오드치료 용량이 있었다(Table 4).
다변량분석에서는 종양 크기가 4 cm 초과인 경우(hazard ratio [HR], 12.86; 95% confidence interval [CI], 1.594-103.777; p=0.017), 종양 다발성 2개인 경우(HR, 8.099; CI, 1.605-40.855; p=0.011), 종양 다발성 3개 이상인 경우(HR, 17.919; CI, 3.427-93.703; p<0.001), 종양의 혈관침범(HR, 0.02; CI, 0.001-0.303; p=0.005), 양측 경부 전이(HR, 3.797; CI, 1-14.414; p=0.05), 총 방사성요오드치료 용량(p=0.016) 등이 국소 재발과 연관이 있었다(Table 4).
변수선택분석에서는 종양 크기가 4 cm 초과인 경우(HR, 15.662; CI, 3.44-71.314; p<0.001), 종양 다발성 2개인 경우(HR, 7.743; CI, 1.866-32.132; p=0.005), 종양 다발성 3개이 상인 경우(HR, 18.886; CI, 4.159-85.75; p<0.001), 종양의 혈관 침범(HR, 0.015; CI, 0.001-0.188; p=0.001), 양측경부 전이(HR, 4.08; CI, 1.476-11.28; p=0.007), 측경부 림프절 전이비율(p=0.013), 총 방사성요오드치료 용량(p<0.001)이 유의미한 결과를 보였다(Table 5). 적합된 모형의 재발에 대한 예측정도를 파악하기 위해 273명의 환자를 훈련자료(200명)와 검정자료(73명)로 나눈 후 훈련자료를 이용하여 모형을 적합시킨 뒤 검정자료에 적용한 결과 c-index는 0.874로 매우 높은 값을 나타내어 적합된 모형의 예측력이 매우 뛰어남을 알 수 있었다.
갑상선 유두암은 전체 갑상선암 중 가장 흔한 암종으로 알려져 있으며, 수술 후 예후가 좋은 특징을 가지고 있다. 하지만 수술 적 치료 후에도 재발률은 31.5%까지 보고되고 있다[15]. 특히 수술적 치료 후에 발생하는 재발의 경우 수술이 매우 어렵고 결과도 좋지 않기 때문에 환자뿐만 아니라 외과 의사에게도 재발에 영향을 주는 위험인자를 분석하는 것은 매우 중요하다. 본 연구에선 측경부 림프절 전이가 있는 갑상선 유두암 환자에서 수술적 치료 후 발생한 재발의 위험인자에 대해서 분석하였다.
측경부 림프절 전이가 있는 유두암 환자들의 재발률에 대한 연구 결과는 다양하다. 437명을 대상으로 하는 한 Lee 등[16]의 연구에서 83개월의 평균 관찰 기간 중 재발률은 16.9% (74명) 였다. 136명을 대상으로 한 Lee 등[17]의 연구에서는 평균 62개월의 관찰 기간 중 재발률이 19.9% (27명)였다. Ryu 등[18]의 연구에서는 평균 81개월의 관찰 기간 중 21.5% (84/390명)의 재발률을 보고하였다. 본 연구에는 평균 관찰 기간이 101개월이면서 국소 재발은 10.9%, 원격 전이를 포함하는 경우 재발률은 14.4%로, 다른 연구자에 비해 비교적 낮은 재발률을 보인다고 생각된다.
본 연구에서는 측경부 림프절 전이가 있는 갑상선 유두암 환자에서 종양의 크기, 종양의 다발성, 측경부 림프절 전이비율이 국소재발과 연관성이 있었다. 갑상선유두암 환자에서 종양의 크기와 재발 간의 유의성은 여러 연구에서 보고되었다. Park 등[19]은 2.1-4.0 cm와 4 cm를 초과하는 종양의 크기가 무병생존율과 관련있는 인자로 보고하였다. Kim 등[20]이 분석한 연구에서는 갑상선 유두암의 크기가 2-4 cm인 경우 재발률은 13.4%였고, 1-2 cm인 경우에 비해 재발할 위험이 3배나 높다고 보고하였다. 하지만 이 두 연구는 측경부 림프절 전이가 있는 환자에 대해서만 분석한 연구가 아니기에 본 연구와 차이가 있다. 측경부 림프절 전이가 있는 환자들에 대한 연구에서 Ryu 등[18]은 종양의 크기와 재발률은 연관성이 없다고 하였지만, Lee 등[16]은 4 cm를 초과하는 종양에서 재발과 연관성이 있다고 하였다. 본 연구에서는 종양의 크기가 4 cm를 초과하는 경우 단변량분석, 다변량분석 및 변수 선택분석에서 국소 재발과 연관성이 있었다. 이러한 연구 결과는 Lee 등[16]의 결과와 유사하다.
Leboulleux 등[21]은 측경부 림프절 전이 갑상선 유두암 환자에서 종양의 다발성과 재발 간에는 관련성이 크게 없다고 보고하였다. 그러나 Lin 등[22]은 단발성 유두암 환자와 비교하여 다발성 환자는 더 높은 재발률을 가진다고 보고하였다. Kim 등[23]은 종양의 다발성이 종양의 양측성보다 재발의 예측인자로서 더 의미가 있다고 보고하였다. 특히 Lin 등[22]은 종양의 다발성의 개수에 따라 재발률을 비교하였는데, 다발성이 2개인 경우 31명(14.8%), 3-4개인 경우 26명(25.0%), 5개 이상인 경우 11명(45.8%)으로, 개수가 많을 수록 재발률도 증가한다고 보고하였다. 본 연구에서는 1개, 2개, 3개 이상으로 다발성 종양을 나누어 재발률을 비교하였고, 다변량분석 및 변수선택분석결과 2개, 3개 이상의 다발성 종양이 재발과 연관성이 있는 것을 확인하였다. 그리고 3개 이상의 다발성 병변이 2개의 다발성 종양보다 재발에 연관성이 많은 것을 알 수 있었다. 하지만 아직 미국 갑상선학회의 재발 위험성에 대한 위험인자로 종양의 다발성 유무는 제시하였지만 다발성의 정도가 포함되어 있지 않다[14]. 향후 다양한 연구를 통하여 종양의 다발성과 재발률의 연관성을 밝히는 노력이 필요할 것으로 생각된다.
분화 갑상선암에서 경부 전이 여부는 재발 및 생존율에 매우 중요한 인자 중 하나이다. 여러 연구에서 유두암의 측경부 전이가 종양의 재발 및 원인별 생존(cause-specific survival)에 주요한 예측 인자라고 보고하였다[24,25]. Ryu 등[18]은 일측 측경부절제술을 시행한 환자에 비해 양측 측경부절제술을 시행한 환자에서 재발률이 높았다고 보고하였다. 본 연구에서는 양측 경부 전이가 38예 있었으며, 이 중 총 10명 (26.3%)에서 재발이 관찰되었고, 국소 재발과 양측 경부 전이는 연관성이 있었다. 양측 측경부전이의 경우 유두암의 재발 및 생존율에 영향을 미치기 때문에 수술적 치료 후 병리 결과에 따라 적극적인 술후 치료 및 관찰이 필요할 것이다.
제거한 림프절 중 전이 림프절의 비율인 림프절 전이 비율은 갑상선암에서 재발을 예측 가능한 우수한 새로운 예후 지표로 많은 연구가 진행되고 있다[17,18,26]. 림프절 전이 비율의 기준값(cuf-off value)은 0.22-0.7 사이로 다양하게 보고하고 있다[11,17,18,27]. 본 연구에선 측경부 림프절 전이 비율이 높은 경우 국소 재발이 많은 것을 확인하였지만, 림프절 전이 비율의 기준값에 대한 연구를 시행하지는 않았다. 본 연구에서 측경부 수술 시 제거한 림프절 범위는 84.6% (270예)에서 2, 3, 4구역 절제술을 시행하였고, 일부에서 3, 4구역 절제술을 시행하였다. 따라서 환자마다 제거된 림프절 구역의 차이가 있어 측경부 림프절 전이 비율을 얻기에 어려움이 있었다. 향후 추가적인 연구를 통하여 동일구역 수술 결과를 이용한 결과 및 경부의 구역에 따른 림프절 전이 비율의 기준값에 대한 연구가 필요할 것으로 생각된다.
방사성요오드치료는 현재까지 갑상선암에서 표준치료로 사용되어 왔다[28]. Gray 등[29]은 고위험군의 갑상선 유두암 환자에서 고용량의 방사성요오드치료가 중간용량의 치료보다 낮은 재발률을 보인다고 보고하였다. 그러나 Schlumberger 등[30]은 저위험군의 갑상선 유두암 환자에서 고용량(100 mCi) 및 저용량(30 mCi)의 방사성요오드치료에 따른 재발 및 생존율에는 큰 차이가 없다고 보고하였고, Vardarli 등[31]은 고용량 및 저용량 방사성요오드치료에 따른 재발률에 큰 차이가 없다고 보고하였다. 이처럼 아직 방사선요오드치료 용량과 재발이나 생존율에 대한 여러 연구에서 논란이 있다. 본 연구에서는 방사성요오드치료 용량이 높을수록 국소 재발이 많은 것으로 확인되었다. 진행한 암에서 방사선요오드치료 용량이 많을 가능성도 있지만, 재발한 환자에서 반복적인 방사선요오드 치료를 시행하여 방사성요오드치료 용량과 재발에 연관성이 있는 것으로 통계적분석이 이루어졌다고 생각된다.
결론적으로, 측경부 전이가 있는 갑상선유두암 환자에서 4 cm보다 큰 갑상선암, 다발성 갑상선암, 종양의 혈관 침범, 높은 림프절 전이 비율, 양측 경부 전이가 있는 경우 국소 재발과 연관성이 높았다. 이러한 위험인자가 있는 경우 수술 후 보다 세심한 추적 관찰이 필요할 것으로 생각되었다.
Notes
Author Contribution
Conceptualization: Jung Woo Lee. Data curation: Gab-Kyun Lee. Formal analysis: Choong Rak Kim. Investigation: Ji Won Jang. Methodology: Yongil Cheon. Resources: In Ju Kim. Software: Sung-Chan Shin. Supervision: Bo Hyun Kim. Validation: JinChoon Lee. Writing—original draft: Jung Woo Lee. Writing—review & editing: Byung-Joo Lee.
REFERENCES
1. Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021; 71(1):7–33.
2. Gülben K, Berberoğlu U, Celen O, Mersin HH. Incidental papillary microcarcinoma of the thyroid--factors affecting lymph node metastasis. Langenbecks Arch Surg. 2008; 393(1):25–9.
3. Maino F, Forleo R, Pacini F. Prognostic indicators for papillary thyroid carcinoma. Expert Rev Endocrinol Metab. 2017; 12(2):101–8.
4. Gilliland FD, Hunt WC, Morris DM, Key CR. Prognostic factors for thyroid carcinoma. A population-based study of 15,698 cases from the surveillance, epidemiology and end results (SEER) program 1973-1991. Cancer. 1997; 79(3):564–73.
5. Randolph GW, Duh QY, Heller KS, LiVolsi VA, Mandel SJ, Steward DL, et al. The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes, as well as the presence of extranodal extension. Thyroid. 2012; 22(11):1144–52.
6. Mazzaferri EL. Papillary thyroid carcinoma: Factors influencing prognosis and current therapy. Semin Oncol. 1987; 14(3):315–32.
7. Sivanandan R, Soo KC. Pattern of cervical lymph node metastases from papillary carcinoma of the thyroid. Br J Surg. 2001; 88(9):1241–4.
8. Sakorafas GH, Sampanis D, Safioleas M. Cervical lymph node dissection in papillary thyroid cancer: Current trends, persisting controversies, and unclarified uncertainties. Surg Oncol. 2010; 19(2):e57–70.
9. Lee YS, Kim SW, Kim SW, Kim SK, Kang HS, Lee ES, et al. Extent of routine central lymph node dissection with small papillary thyroid carcinoma. World J Surg. 2007; 31(10):1954–9.
10. Kim WW, Lee J, Jung JH, Park HY, Jeong JY, Park JY, et al. Predictive risk factors for recurrence or metastasis in papillary thyroid cancer. Int J Thyroidol. 2020; 13(2):111–7.
11. Park YM, Wang SG, Lee JC, Shin DH, Kim IJ, Son SM, et al. Metastatic lymph node status in the central compartment of papillary thyroid carcinoma: A prognostic factor of locoregional recurrence. Head Neck. 2016; 38(S1):E1172–6.
12. Jeon MJ, Kim TY, Kim WG, Han JM, Jang EK, Choi YM, et al. Differentiating the location of cervical lymph node metastasis is very useful for estimating the risk of distant metastases in papillary thyroid carcinoma. Clin Endocrinol (Oxf). 2014; 81(4):593–9.
13. Park YM, Wang SG, Shin DH, Kim IJ, Son SM, Lee BJ. Lymph node status of lateral neck compartment in patients with N1b papillary thyroid carcinoma. Acta Otolaryngol. 2016; 136(3):319–24.
14. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 2016; 26(1):1–133.
15. Liu FH, Kuo SF, Hsueh C, Chao TC, Lin JD. Postoperative recurrence of papillary thyroid carcinoma with lymph node metastasis. J Surg Oncol. 2015; 112(2):149–54.
16. Lee SH, Roh JL, Gong G, Cho KJ, Choi SH, Nam SY, et al. Risk factors for recurrence after treatment of N1b papillary thyroid carcinoma. Ann Surg. 2019; 269(5):966–71.
17. Lee CW, Roh JL, Gong G, Cho KJ, Choi SH, Nam SY, et al. Risk factors for recurrence of papillary thyroid carcinoma with clinically node-positive lateral neck. Ann Surg Oncol. 2015; 22(1):117–24.
18. Ryu YJ, Cho JS, Yoon JH, Park MH. Identifying risk factors for recurrence of papillary thyroid cancer in patients who underwent modified radical neck dissection. World J Surg Oncol. 2018; 16(1):205.
19. Park SY, Kim HI, Kim JH, Kim JS, Oh YL, Kim SW, et al. Prognostic significance of gross extrathyroidal extension invading only strap muscles in differentiated thyroid carcinoma. Br J Surg. 2018; 105(9):1155–62.
20. Kim MH, Lee JH, Kim YY, Chun YS, Park HK, Choi ST, et al. Management of 2–4 cm papillary thyroid carcinoma: Risk of recurrence compared to 1–2 cm and >4 cm. J Endocr Surg. 2020; 20(4):78–87.
21. Leboulleux S, Rubino C, Baudin E, Caillou B, Hartl DM, Bidart JM, et al. Prognostic factors for persistent or recurrent disease of papillary thyroid carcinoma with neck lymph node metastases and/or tumor extension beyond the thyroid capsule at initial diagnosis. J Clin Endocrinol Metab. 2005; 90(10):5723–9.
22. Lin JD, Chao TC, Hsueh C, Kuo SF. High recurrent rate of multicentric papillary thyroid carcinoma. Ann Surg Oncol. 2009; 16(9):2609–16.
23. Kim HJ, Sohn SY, Jang HW, Kim SW, Chung JH. Multifocality, but not bilaterality, is a predictor of disease recurrence/persistence of papillary thyroid carcinoma. World J Surg. 2013; 37(2):376–84.
24. Yang L, Shen W, Sakamoto N. Population-based study evaluating and predicting the probability of death resulting from thyroid cancer and other causes among patients with thyroid cancer. J Clin Oncol. 2013; 31(4):468–74.
25. Ito Y, Miyauchi A. Prognostic factors and therapeutic strategies for differentiated carcinomas of the thyroid. Endocr J. 2009; 56(2):177–92.
26. Ryu IS, Song CI, Choi SH, Roh JL, Nam SY, Kim SY. Lymph node ratio of the central compartment is a significant predictor for locoregional recurrence after prophylactic central neck dissection in patients with thyroid papillary carcinoma. Ann Surg Oncol. 2014; 21(1):277–83.
27. Schneider DF, Mazeh H, Chen H, Sippel RS. Lymph node ratio predicts recurrence in papillary thyroid cancer. Oncologist. 2013; 18(2):157–62.
28. Silberstein EB, Alavi A, Balon HR, Clarke SE, Divgi C, Gelfand MJ, et al. The SNMMI practice guideline for therapy of thyroid disease with 131I 3.0. J Nucl Med. 2012; 53(10):1633–51.
29. Gray KD, Bannani S, Caillard C, Amanat S, Ullmann TM, Romanov P, et al. High-dose radioactive iodine therapy is associated with decreased risk of recurrence in high-risk papillary thyroid cancer. Surgery. 2019; 165(1):37–43.
30. Schlumberger M, Leboulleux S, Catargi B, Deandreis D, Zerdoud S, Bardet S, et al. Outcome after ablation in patients with low-risk thyroid cancer (ESTIMABL1): 5-year follow-up results of a randomised, phase 3, equivalence trial. Lancet Diabetes Endocrinol. 2018; 6(8):618–26.
31. Vardarli I, Weidemann F, Aboukoura M, Herrmann K, Binse I, Görges R. Longer-term recurrence rate after low versus high dose radioiodine ablation for differentiated thyroid cancer in low and intermediate risk patients: A meta-analysis. BMC Cancer. 2020; 20(1):550.
Fig. 1.
Kaplan-Meier analyses of recurrence-free survival. A: Neck dissection type. B: Pathologic margin. C: Tumor size. D: Multifocality. E: Number of lateral neck lymph node metastasis. Bilateral neck dissection, positive margin, tumor size (>4 cm), Multifocality (≥3), and the number of lymph node (≥11) are factors associated with loco-regional recurrence.
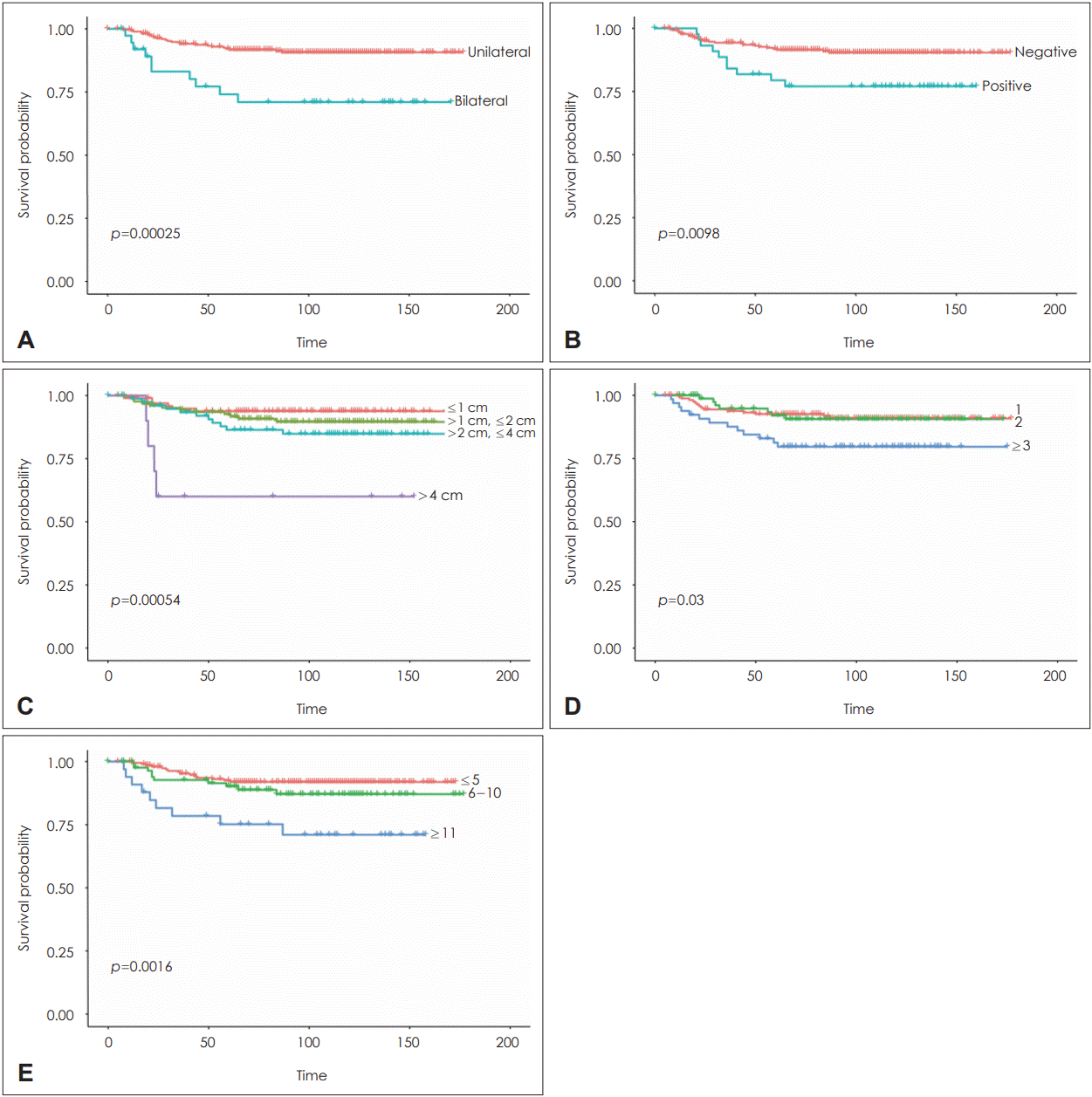
Table 1.
Clinical data of patients included in this study (n=319)
| Variables | Value |
|---|---|
| Age (years) | 48±14.4 |
| Male/female | 76 (23.8)/243 (76.2) |
| Body mass index (kg/m2) | 23.5±3.5 |
| Tumor size (cm) | |
| ≤1 | 101 (31.7) |
| >1, ≤2 | 128 (40.1) |
| >2, ≤4 | 79 (24.8) |
| >4 | 11 (3.4) |
| Pathologic margin | |
| Not involved | 274 (85.8) |
| Involved | 45 (14.1) |
| Multifocality | |
| 1 | 169 (52.9) |
| 2 | 85 (26.6) |
| ≥3 | 65 (20.4) |
| Tumor bilaterality | 132 (41.3) |
| Extrathyroidal extension | |
| Negative | 68 (21.3) |
| Positive | 251 (78.6) |
| Lymphatic invasion | 53 (16.6) |
| Vascular invasion | 40 (12.5) |
| Neck dissection type | |
| Ipsilateral | 281 (88.0) |
| Bilateral | 38 (11.9) |
| Central LN | |
| Harvested | 11.2±6.5 |
| Metastatic | 5.1±4.3 |
| Ratio | 0.5±0.3 |
| Lateral LN | |
| Harvested | 32±16.6 |
| Metastatic | 5.6±4.7 |
| Ratio | 0.2±0.1 |
| Total metastatic LN | |
| ≤5 | 78 (24.4) |
| 6-10 | 100 (31.3) |
| ≥11 | 141 (44.2) |
| Central metastatic LN | |
| 0 | 39 (12.2) |
| 1-3 | 91 (28.5) |
| 4-6 | 97 (30.4) |
| ≥7 | 92 (28.8) |
| Lateral metastatic LN | |
| ≤5 | 198 (62.0) |
| 6-10 | 87 (27.3) |
| ≥11 | 34 (10.7) |
| Skip metastasis | 39 (12.2) |
| Recurrence | 35 (10.9) |
| Total radioactive iodine therapy dose (mCi) | 158.6±74.9 (30-800)* |
Table 2.
Distribution of recurrence sites (n=35)
Table 3.
Postoperative complications
Table 4.
Risk factors for recurrence
Table 5.
Variable selection analysis of risk factors for recurrence




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download