초록
연구배경
본 연구는 ELISA 법을 이용한 중화항체키트와 LFIA 법을 이용한 신속항체 진단키트를 비교하여 COVID-19 백신 접종 후 항체 형성 유무 평가 성능에 대한 임상적 유효성을 검증하고자 하였다.
방법
중화항체시험은 표준 ELISA 법을 이용하여 정성적 방법에 대한 진단용 의료기기의 항체 검출키트를 이용하여 수행하였다. 신속항체 진단키트는 LFIA 방법을 사용하여 COVID-19 바이오키트 IgG/IgM으로 측정되었다. 표준시험 방법의 중화항체측정시험 결과를 바탕으로 신속항체 진단키트의 시험 결과를 비교 분석하여 민감도와 특이도를 확인하였다.
결과
두 검사 방법의 결과를 양성, 음성으로 나누었을 때 118건이 일치하고 2건이 불일치해 98.3%의 일치도를 보였다. 즉, 민감도 98% (95% CI, 0.94-1.00), 특이도 100% (95% CI, 0.63-1.00), 양성 예측 100% (95% CI, 0.97-1.00), 음성 예측 80% (95% CI, 0.44-0.97) 및 분별 정확도는 98% (95% CI, 0.94-1.00)였다.
결론
키트 결과의 항체 양성 반응이 COVID-19에 대한 면역성을 의미하거나, COVID-19 재감염에 대한 확인과 평가를 할 수 없지만, 이미 여러 연구를 통해 항체 형성과 면역 원성사이의 상관관계가 검증되었기 때문에 항체 검사로 실제로 과거 감염 여부나 백신 접종의 유무를 확인할 수 있다. 신속한 항체 진단키트 결과와 ELISA 결과의 높은 상관성은 본 연구에서 사용된 키트가 항체 및 중화항체 반응의 선별 검사로서 이용이 가능함을 시사하며, 이는 추가 예방접종의 필요성을 평가하는데 신속하고 저렴하게 개인의 면역 반응을 데이터화하고 모니터링하는 데 도움이 될 수 있다.
Abstract
Background
This study compared the neutralizing antibody kit using the Enzyme-Linked Immunosorbent Assay (ELISA) method with the rapid antibody diagnostic kit using the Lateral Flow Immunoassay (LFIA) method to evaluate the clinical effectiveness of the COVID-19 Biokit IgG/IgM regarding evaluation of antibody formation after COVID-19 vaccination.
Methods
The neutralizing antibody test was performed with antibody detection kit of diagnostic medical devices for the qualitative method using the standard ELISA method. The rapid antibody diagnostic kit was measured with the COVID-19 Biokit IgG/IgM using the LFIA method. Based on the results of the neutralizing antibody measurement test of the standard test method, the test results of the rapid antibody diagnostic kit are compared and analyzed to confirm its the sensitivity and specificity.
Results
When the consistency was determined as positive and negative for the two test results, 118 cases were matched and two cases were inconsistent, showing a 98.3% consistency rate. That is, sensitivity 98%, specificity 100% and correctly classified proportion 98%.
Conclusions
Although the positive results of antibody formation of this kit would mean that individual has immunity to COVID-19, the result cannot be used to confirm or evaluate for re-infection. But the strong agreement between rapid antibody diagnostic kit results and ELISA results suggests that the kit used in this study is available as a screening test for antibody and neutralizing antibody responses, which could help evaluate the need for additional vaccinations, collect data quickly and cheaply and monitor individual immune responses.
2019년 중국 우한에서 최초로 발견된 신종 코로나바이러스는 발견 이후 빠르게 전 세계로 전파되었다. 신종 코로나바이러스는 중증급성호흡기증후군코로나바이러스 2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)로 명명되었으며, 이에 의한 질병은 coronavirus disease-2019 (COVID-19)로 명명되었다. SARS-CoV-2는 주로 감염자의 호흡기 비말에 의해 전파된다. 임상 증상은 무증상, 경증, 중등도 증상, 중증에 이르기까지 다양하게 나타나며, 주요 증상으로는 37.5℃ 이상의 발열, 기침, 호흡곤란, 두통, 인후통, 후각·미각 손실 등이 있다. 증상이 중증에 이르는 경우 급성호흡기증후군, 중증 폐렴, 신부전 등이 나타나고 사망에 이를 수 있다[1]. 2022년 4월까지 전 세계적으로 4억 9천만 명 이상의 확진자가 발생하였으며 6백 10만 명 이상의 사망자가 발생해 1.24%의 치명률을 보이고 있다[2].
2020년 8월 11일 러시아의 스푸트니크 V SARS-CoV-2 백신이 최초로 등록된 이후 현재까지 화이자, 아스트라제네카, 얀센, 모더나 등의 제약회사들이 백신을 개발하였으며, 전 세계적으로 백신 접종자의 수는 계속해서 늘어나고 있는 추세이다. 백신 접종 후 SARS-CoV-2에 대한 항체가 생성된 경우 항체의 지속 시기에 대해서는 아직 논란이 있으나, 항체 생성 여부가 향후 대중의 전반적인 활동에 큰 영향을 미치고, SARS-CoV-2 백신 접종이 COVID-19의 발병률과 COVID-19에 의한 사망률을 감소시킬 수 있음이 밝혀지면서[3] 항체 형성 여부가 주요한 요점이 되었다.
항체는 감염에 대한 반응으로 면역 체계에 의해 생성되는 단백질로서, 혈청학적 검사를 통해 SARS-CoV-2에 대한 특정 항체를 발견할 수 있으며, 혈청학적 검사에서 발견되는 항체는 이전의 감염력을 나타낸다[4,5]. 혈청학적 검사는 초기 감염 이후 5일에서 10일 이내에 형성되는 IgM 항체와 초기 감염으로부터 7일에서 10일 혹은 그 이후에 형성되는 IgG 항체를 측정한다[6,7]. 백신 접종 또한 이러한 면역 반응을 일으켜 자연 감염되는 경우와 같이 IgM, IgG 항체를 형성한다.
항체 검사는 사람의 혈액검체를 검사하여 COVID-19 원인 바이러스인 SARS-CoV-2에 대한 항체를 측정하는 것이다[8]. 검사 방법으로는 주로 rapid diagnostic test, Enzyme-Linked Immunosorbent Assay (ELISA), 중화 분석 및 화학 발광 면역 분석 등이 있다[9]. 중화 항체는 이러한 자연감염이나 백신 접종의 결과로서 형성되어 면역 반응의 주요 요소로 작용한다. 예를 들어 모더나 사의 mRNA-1273 또는 화이자 사의 BNT162b2와 같은 mRNA 백신은 SARS-CoV-2 스파이크 단백질(S) 및 수용체 결합 도메인(RBD) 단백질을 유도하며, 유도된 단백질인 인체 면역에 의해 결합 도메인(RBD) 단백질을 표적으로 하는 항체가 만들어 지게 되는데 이를 중화항체라고 한다. SARS-CoV-2 중화항체의 직접적인 측정은 실험실적인 한계로 인해 복잡하여 여러 검사법이 이에 대한 대안으로 개발되었다[10]. 백신 접종을 완료한 보건의료인에서 이러한 신속항체 진단키트를 이용하여 항체 형성 여부를 판단하는 국외 연구가 시행된 바 있으며[3], 국내에서는 신속항체 진단키트의 개발과정 및 유용성을 다룬 연구[11,12]와 2021년 의료진을 대상으로 BNT162b2 백신 접종 1, 2주 후 SARS-CoV-2 항체 유무에 대한 연구가 진행되었다[13].
본 연구에서는 anti-SARS-CoV-2 IgG와 anti-SARS-CoV-2 IgM을 정성할 수 있는 신속항체 진단키트(COVID-19 Biokit IgG/IgM)를 사용하였으며 RBD가 포함된 스파이크 단백질(S)을 타겟으로 하는 신속항체 진단키트로, 일반 결합항체뿐만 아니라 백신 접종으로 생성된 중화항체까지 측정 가능하다. AZD1222(ChAdOx1), BNT162b2, JNJ-78436735 (Ad26.COV2.S) 백신 접종자를 대상으로 COVID-19 Biokit IgG/IgM의 민감도를 평가하여, COVID-19 백신 접종 후 항체 형성 유무 평가 성능에 대한 임상적 유효성을 검증하고자 하였다.
2021년 11월부터 2021년 12월까지 서울특별시 소재 대학 병원 가정의학과에 내원한 만 19세 이상의 성인 남녀 중 COVID-19 백신 기 접종 120명을 대상으로 하였다. 대상은 COVID-19 확진 후 접종한 자도 포함하였으며, 백신 접종 증명서를 확인하여 백신 접종 후 4주가 경과하였음을 확인하였다. 대상자는 자의로 동의서 서면에 서명하였다.
COVID-19에 확진되어 항바이러스제 치료를 받은 경우, COVID-19 백신을 교차 접종받은 경우, 임산부, COVID-19 백신 중 AZD1222 (ChAdOx1), BNT162b2, JNJ-78436735 (Ad26.COV2.S) 이외의 백신을 접종받은 경우, 백신 접종 후 4주가 지나지 않은 경우, 백신 접종 증명서를 확인할 수 없는 경우, 의사소통에 어려움이 있는 경우, 문맹인 경우는 제외하였다.
BNT162b2 백신 2차 접종 후 4주가 경과한 자 40명, JNJ-78436735 (Ad26.COV2.S) 1차 접종 후 4주가 경과한 자 40명, AZD1222 (ChAdOx1) 백신 2차 접종 후 4주가 경과한자 40명을 모집하였다. 수집된 검체는 익명화(검체 식별코드 사용)하여 단일 눈가림을 실시하였다.
중화항체 검사는 표준시험법인 ELISA 방법을 사용하여 정성하는 체외진단 의료기기(Spark; Tecan, Grödig, Austria) 및 시약(cPass SARS-CoV-2-neutralization antibody detection kit; GenScript, Piscataway, NJ, USA)을 사용하여 분석 대상자의 정맥혈을 채취 후 원심 분리하여 혈청 또는 혈장 50 μL를 사용하여 분석하였다.
신속항체 진단키트는 Lateral Flow Immunoassay (LFIA)법을 사용한 COVID-19 biokit IgG/IgM를 사용하여 측정하였다. 손가락 끝에서 모세혈 20 μL를 채취하여 테스트 스트립에 혈액을 주입 후, 검체전개액을 테스트 스트립 검체 투입구에 3방울을 떨어뜨리고 15-20분 기다린 후, 테스트 스트립의 C, G, M 분홍색 선을 확인하였다. 20분 이상 경과된 결과는 판정에 포함시키지 않았다(Table 1).
표준시험법인 중화항체 측정 검사 결과를 기준으로 하여, 신속항체 진단키트의 시험 결과를 비교 분석하여 민감도와 특이도를 확인한다. 음성은 대조선(C) 위치에 밴드가 나타나는 경우, 양성은 대조선(C)에 밴드가 나타나면서 IgG, IgM 둘 다 밴드가 나타나는 경우, IgG에 밴드가 나타나는 경우는 IgM에만 밴드가 나타나는 경우로 판단하였다(Figure 1). 중화항체 측정 검사 결과를 기준으로 하여 신속 항체 진단키트 결과를 비교하였다.
모든 통계 분석은 R 4.1.3 (R Foundation, Vienna, Austria)을 사용하였다. COVID-19 biokit IgG/IgM의 백신 접종 검체에 대한 임상적 유효성은 SARS-CoV-2 surrogate virus neutralization test kit의 사용설명서에 따른 ELISA 판정 결과와 COVID-19 biokit IgG/IgM의 사용 설명서(instruction for use)에 따른 시험 기기의 판정 결과 비교를 통해 민감도와 특이도 분석을 하였다. 모든 통계 분석에서 P값이 0.05 미만인 경우 유의한 것으로 판정하였다.
두 시험 기기 간 결과 비교를 통해 임상적 민감도와 특이도를 제시하였다. 양성 예측도(%)는 진양성/(진양성+위양성)×100, 음성 예측도(%)는 진음성/(위음성+진음성)×100, 민감도(%)는 진양성/(진양성+위음성)×100, 특이도(%)는 진음성/(진음성+위양성)×100, 분별의 정확성(%)은 (진양성+진음성)/전체×100으로 계산하였다.
모든 연구 대상자들(n=120)은 AZD1222 (ChAdOx1) 또는 BNT162b2 백신을 2차 접종까지 완료하였거나 JNJ-78436735 (Ad26.COV2.S) 백신을 1회 접종 완료하였다. AZD1222 (ChAdOx1) 백신 접종자 40명, BNT162b2 백신 접종자 40명, JNJ-78436735 (Ad26.COV2.S) 백신 접종자 40명이었으며, JNJ-78436735 (Ad26.COV2.S) 백신 접종자 중 22명은 부스터 접종을 완료한 상태였다.
전체 120명 중 남성이 67명, 여성이 53명이었으며, 이들 평균 연령은 전체 36.21±8.18세, 남성 36.31±6.95세, 여성 36.08±9.57세였으며 접종 완료 후 항체 측정까지의 경과 기간은 전체 148.3±62.8일이었다(Table 2).
cPass SARS-CoV-2 neutralization antibody detection kit와 COVID-19 biokit IgG/IgM를 사용한 비교 대상 120건의 검체 테스트 결과는 표 2와 같은 분포를 보였다. 중화항체 키트와 신속항체 진단키트 두 가지 검사 결과를 양성 및 음성 여부로 나누어 일치도를 판정하였을 때 일치하는 경우 118건, 불일치 2건으로 98.3%의 일치율을 보였다(Table 3).
백신 접종자 중 37명은 접종 후 1-3개월 경과하였으며, 3-5개월 경과한 자 8명, 5-7개월 경과자 44명, 7개월 경과한 사람은 31명이었다. 이에 따라 최종적으로 민감도 98% (95% confidence interval [CI], 0.94-1.00), 특이도 100% (95% CI, 0.63-1.00), 양성 예측도 100% (95% CI, 0.97-1.00), 음성 예측도 80% (95% CI, 0.44-0.97), 분별 정확성 98% (95% CI, 0.94-1.00)였다(Figure 2).
본 연구는 ELISA 법을 이용한 중화항체키트와 LFIA 법을 이용한 신속항체 진단키트를 비교하여 빠르고 간편하게 사용할 수 있는 신속항체 진단키트의 유용성을 규명하기 위해 수행되었다. 연구 결과, ELISA 중화항체 키트와 신속항체 진단키트의 비교 측정 평가 결과 민감도 98.2%, 특이도 100% 분별 정확성 98%을 보였다(95% CI).
SARS-CoV-2 항체가 생성되기 위해서는 1-3주의 시간이 필요하기 때문에 신속항체 진단키트는 현재 SARS-CoV-2를 진단하는 목적으로는 권고하지 않으며[14], 현재 Centers for Disease Control and Prevention은 항체 검사를 진단 목적으로만 사용하도록 권장하고 대상자의 면역 상태의 결정, 모임 참석, 직장 복귀 여부 결정을 위한 사용은 권고되고 있지 않다[15]. 신속항체 진단키트의 결과가 양성으로 나타나더라도, 자연 감염에 의한 항체 형성과 백신 접종에 의한 항체 형성을 구별하기 위해서는 항체가 S 단백질에 대한 항체인지, N 단백질에 대한 항체인지 등에 대한 추가적인 검사가 필요하기 때문이다[16]. 반면 유럽연합 집행위원회는 항체키트의 한계는 분명히 존재하지만 개인 면역 상태를 평가하는데 사용될 수 있을 것으로 강조하였다[17]. 또한 미국임상화학협회(American Association for Clinical Chemistry)는 미국감염학회(Infectious Disease Society of America)와 함께 항체 검사를 통해 환자의 면역 상태를 평가하고 단계적 완화 전략을 안내하도록 권장하였다고 보고하였다[17-19].
백신에 대한 항체 반응은 매우 가변적일 수 있으며, SARS-CoV-2 백신에 대한 항체 역가가 시간이 지남에 따라 어떻게 변하는지, 이러한 변화가 임상적으로 유의미한지 여부에 대해서는 아직 논란이 있다. 하지만 신속항체 진단키트는 긴 시간이 소요되는 ELISA 중화항체 검사에 비하여 간편하고 빠른 시간 내에 항체 형성 여부를 확인할 수 있다는 장점을 가지고 있다.
Wang 등[20]의 연구와 Widge 등[21]의 연구도 백신 접종 후 면역 반응을 평가하였지만 이 연구들은 ELISA만을 이용하여 항체 유무를 평가하였으며 시간적, 비용적인 문제로 대규모 검사가 실시되지 않았지만 ELISA 테스트가 SARS-CoV-2 mRNA 백신 접종에 대한 중화항체 반응 평가에 기준 장비가 되는데 문제없음을 증명할 수 있었다[3].
국내에서도 2021년 의료진을 대상으로 BNT162b2 백신 접종 1, 2주 후 SARS-CoV-2 항체 유무에 대한 연구가 진행되었다. 연구 결과 백신 접종 후 anti-S, anti-N의 민감도는 97.6%, 93.6%, 특이도는 100%, 99.8%로 나타났다[13]. 이는 우리 연구와 유사한 수준의 결과가 도출되었음을 알 수 있다. 이외에도 PRNT assay와 6가지 종류의 키트로 혈청 분석하여 평가한 연구에서도 6가지 방법 모두 민감도가 90% 이상으로 보고하였다[22].
본 연구의 제한점으로는 첫째, 세 종류의 COVID-19 백신 만을 대상으로 하여 타 백신 종류에 대해서 결과의 일반화에 제한이 있을 수 있다는 점, 둘째, COVID-19 확진이 되었던 사람과 확진된 적이 없는 사람을 구분하지 않았다는 점이 있다. 그러나 본 연구에서 다룬 세 종류의 COVID-19 백신, 120명의 연구 대상자에 대하여 COVID-19 Biokit IgG/IgM의 결과와 ELISA의 결과가 민감도 98%, 특이도 100%의 일치율을 보였다는 것은 신속항체 진단키트가 항체 유무를 평가하는 데 임상적 유효성이 있다는 의미를 가진다.
항체가 있음이 바이러스에 대한 면역성을 의미하거나 COVID-19 재감염 유무를 결정할 수 없으며 항체 생성 정도와 실제 면역과의 상관성이 충분히 검증되지 않았기 때문에 일상에서 항체 유무와는 관계없이 정부의 방역 지침을 준수해야 함은 변함없다.
항체 형성과 면역원성의 상관성은 여러 연구에서 검증되었기에 중화항체 여부 확인을 통해 실제로 질환을 앓았다는 증거 또는 접종의 과거력을 확인할 수 있으나 COVID-19에 대한 면역원성을 충분히 가지고 있는지에 대해서는 지속적인 연구가 필요할 것으로 보인다.
본 연구에서 사용된 신속항체 진단키트를 통해 의료진의 도움이 필요한 정맥 채혈이 아닌, 당뇨 환자들이 혈당 체크를 하는 방법과 같은 손끝 모세혈 채취의 방법으로 병원진료시간을 맞추기 어려운 사람이나 의료시설의 접근성이 떨어지는 사람도 간편하게 항체 유무를 확인할 수 있다. 특히 국내에서 접종률이 높은 세 종류의 백신 접종자를 대상으로 진행하였기 때문에 대상자의 다양성을 높였다는 데에 의의가 있으며, 보건의료인뿐만 아니라 일반인을 대상으로 진행하여 신속항체 진단키트가 실제로 개개인의 선별 검사로서의 사용 가능 여부를 규명하였음에 본 연구는 의미 있는 결과를 나타낸다고 할 수 있다.
신속항체 진단키트 결과와 ELISA 결과 사이의 강력한 일치율은 본 연구에서 사용된 신속항체 진단키트가 항체 및 중화항체 반응에 대한 선별 검사로 사용 가능함을 시사하며, 이를 통해 추가 백신 접종의 필요성과 접종 간격에 대한 평가와 집단 면역 감시 지원을 포함한 개별 면역 반응에 대해서 신속하고 비교적 저렴한 데이터화를 할 수 있으며 코로나 항체 모니터링에 도움이 될 수 있을 것이다.
REFERENCES
1. Centers for Disease Control and Prevention (CDC). Coronavirus Disease 2019 (COVID-19) [Internet]. Atlanta: CDC; 2021 [cited Apr 28, 2022]. Available from: https://www.cdc.gov/dotw/covid-19/index.html.
2. World Health Organization (WHO). WHO Coronavirus (COVID-19) Dashboard [Internet]. Geneva: WHO; 2022 [cited Apr 1, 2022]. Available from: https://covid19.who.int/.
3. Heyming TW, Nugent D, Tongol A, Knudsen-Robbins C, Hoang J, Schomberg J, et al. Rapid antibody testing for SARS-CoV-2 vaccine response in pediatric healthcare workers. Int J Infect Dis. 2021; 113:1–6.

4. Johns Hopkins Center For Health Security, COVID-19 Testing Toolkit. Serology tests for COVID-19 [Internet]. Baltimore: Johns Hopkins Center for Health Security, COVID-19 Testing Toolkit; 2022 [cited Apr 28, 2022]. Available from: https://www.centerforhealthsecurity.org/covid-19TestingToolkit/serology/Serology-based-tests-for-COVID-19.html.
5. West R, Kobokovich A, Connell N, Gronvall GK. COVID-19 antibody tests: a valuable public health tool with limited relevance to individuals. Trends Microbiol. 2021; 29(3):214–23.

6. Seow J, Graham C, Merrick B, Acors S, Pickering S, Steel KJA, et al. Longitudinal observation and decline of neutralizing antibody responses in the three months following SARS-CoV-2 infection in humans. Nat Microbiol. 2020; 5(12):1598–607.

7. Post N, Eddy D, Huntley C, van Schalkwyk MCI, Shrotri M, Leeman D, et al. Antibody response to SARS-CoV-2 infection in humans: a systematic review. PLoS One. 2020; 15(12):e0244126.

8. Sullivan PS, Sailey C, Guest JL, Guarner J, Kelley C, Siegler AJ, et al. Detection of SARS-CoV-2 RNA and antibodies in diverse samples: protocol to validate the sufficiency of provider-observed, home-collected blood, saliva, and oropharyngeal samples. JMIR Public Health Surveill. 2020; 6(2):e19054.

9. Gronvall G, Connell N, Kobokovich A, West R, Warmbrod KL, Shearer MP, et al. Developing a national strategy for serology (antibody testing) in the United States. Baltimore: The Johns Hopkins Center for Health Security; 2020.
10. Addetia A, Crawford KHD, Dingens A, Zhu H, Roychoudhury P, Huang ML, et al. Neutralizing antibodies correlate with protection from SARS-CoV-2 in humans during a fishery vessel outbreak with a high attack rate. J Clin Microbiol. 2020; 58(11):e02107-20.

11. Choi DO, Lee KM. Development of COVID-19 neutralizing antibody (NAb) detection kits using the S1 RBD protein of SARS-CoV-2. KJCLS. 2021; 53:257–65.

12. Lee S. The usefulness of the COVID-19 rapid diagnosis kit. Korean J Healthc Assoc Infect Control Prev. 2021; 26(2):134–6.

13. Kim N, Minn D, Park S, Roh EY, Yoon JH, Park H, et al. Positivity of SARS-CoV-2 antibodies among Korean healthy healthcare workers 1 and 2 weeks after second dose of Pfizer-BioNTech vaccination. J Korean Med Sci. 2021; 36(21):e158.

14. Sethuraman N, Jeremiah SS, Ryo A. Interpreting diagnostic tests for SARS-CoV-2. JAMA. 2020; 323(22):2249–51.

15. Centers for Disease Control and Prevention (CDC). Antibody Testing Guidelines [Internet]. Atlanta: CDC; 2022 [cited Apr 28, 2022]. Available from: https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antibody-tests-guidelines.html.
16. Jarrom D, Elston L, Washington J, Prettyjohns M, Cann K, Myles S, et al. Effectiveness of tests to detect the presence of SARS-CoV-2 virus, and antibodies to SARS-CoV-2, to inform COVID-19 diagnosis: a rapid systematic review. BMJ Evid Based Med. 2022; 27(1):33–45.

17. EUROPEAN COMMISSION. Communication from the Commission, Guidelines on COVID-19 in vitro diagnostic tests and their performance. 15th ed. 4. Brussels: EUROPEAN COMMISSION;2020.
18. American Association for Clinical Chemistry (AACC). AACC Recommendations for SARS-CoV-2 Serology Testing [Internet]. Washington, DC: AACC; 2020 [cited Apr 28, 2022]. Available from: https://www.aacc.org/science-and-research/covid-19-resources/statements-on-covid-19-testing/aacc-recommendations-for-sars-cov-2-serology-testing.
19. Infectious Diseases Society of America (IDSA). IDSA COVID-19 Antibody Testing Primer [Internet]. New York: IDSA; 2020 [cited Apr 28, 2022]. Available from: https://www.idsociety.org/globalassets/idsa/public-health/covid-19/idsacovid-19-antibody-testing-primer.pdf.
20. Wang Z, Muecksch F, Schaefer-Babajew D, Finkin S, Viant C, Gaebler C, et al. Naturally enhanced neutralizing breadth against SARS-CoV-2 one year after infection. Nature. 2021; 595(7867):426–31.

Figure 1.
Rapid antibody diagnostic antibody test kit (COVID-19 biokit IgG/IgM) result. (A) Negative. (B) Positive. (C) Positive.
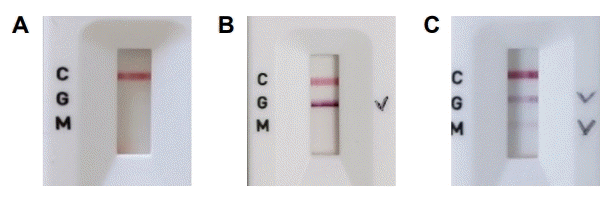
Figure 2.
Receiver operating characteristic curve for a test with a sensitivity and specificity. PV, predictive value.
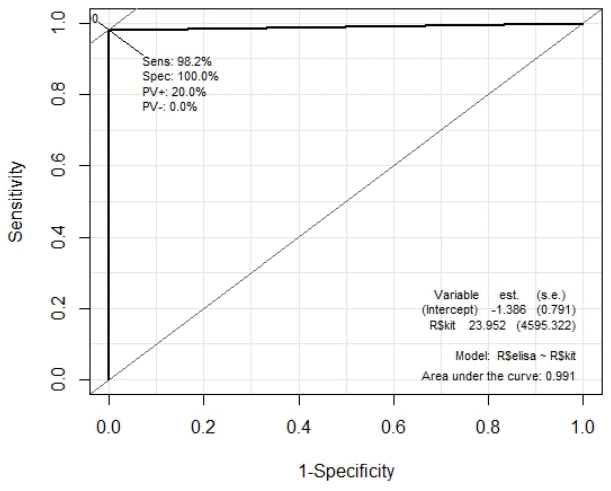
Table 1.
Comparison of specifications for neutralizing antibody test kit and rapid diagnostic antibody test kit
Table 2.
Characteristics of study subjects




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download