Abstract
Background
Carbapenem-resistant Enterobacteriaceae (CRE) emerged in a long-term acute care hospital in 2017. Therefore, this study aimed to examine the reasons for the occurrence of the CRE epidemic, the risk of infection, its spread, and the effects of interventions.
Methods
A total of 149 patients were hospitalised in a long-term acute care hospital, and 15 of 39 patients in the same ward tested positive. A retrospective cohort study was conducted on all patients (n=39) who were hospitalised in the same ward.
Results
The incidence rates of CRE were 50.0% for the intensive care unit, 2.8% for each general ward, and 10.0% for the entire hospital, with a case fatality rate of 53.3%. The risk factors for its spread included antibiotic use (relative risk [RR]=18.12; 95% confidence interval [CI]=2.64-124.5), ventilator use (RR=3.95; 95% CI=1.53-10.22), decubitus (RR=15.56; 95% CI=2.27-106.8), use of tracheostomy tube (RR=2.75; 95% CI=1.06-7.12), and hemodialysis (RR=2.43; 95% CI=1.21-4.89).
Conclusion
Both the incidence and case fatality rates of CRE were increased when it emerged in a long-term acute care hospital. The risk factors for its spread included antibiotic use, decubitus, tracheostomy, ventilator use, and dialysis. Interventions, including intensive infection monitoring, were effective in preventing the spread and relapse of CRE epidemics.
항생제 내성은 새로운 항생제 개발의 지연되는 중에 매우 빠른 속도로 증가하고 있어 공중보건의 중요한 과제이다[1-4]. 그 중 Carbapenem-risistant Enterobacteriacea (CRE)은 시급히 관리해야 하는 내성균으로 알려져 있는데[1] 이는 카바페넴을 포함하여 대부분의 광범위 항생제에 내성을 나타내고 있어 치료에 제약이 있고 높은 사망률과 이환율을 보이며 전파가 서로 다른 종까지 전파될 수 있는 유전적 요소를 가지고 있기 때문이다[1-5].
의료 체계 내에서 CRE전파에 있어 중요한 역할을 하는 곳은 장기입원시설로 Lin 등[6]의 연구에 의하면 급성기 병원 중환자실에 CRE의 집락화는 3.3%인데 반하여 장기요양시설의 집락화는 30.4%로 매우 높게 나타났고 Perez등[7]에 의하면 장기 요양시설에서 전원 된 환자의 50%이상에서 CRE를 발견하였다. 중재에 관한 연구에서는 요양병원을 강력히 중재한 경우에 지역의 의료시설의 5년 누적 CRE 전파를 79%-93% 감소시켜 요양병원의 중재가 지역사회의 CRE 전파를 감소시키는 효율적인 전략이라고 하였다[8].
우리나라의 경우 2010년 국내 최초 보고 후[9] CRE 발생이 매우 빠르게 증가하였으나[10] CRE에 대한 연구는 주로 3차 병원의 중환자실이나 진단검사실 등에서 연구가 이루어졌고[11-14] 요양병원의 CRE의 위험도와 감염 관리 및 중재에 관한 연구는 부족하였다.
이에 2017년 서울의 한 요양병원에 발생한 CRE 유행 역학조사를 통해 유행의 발생 원인과 위험도, 전파 위험 요인을 파악하고 중재를 통한 확산과 재유행 방지의 효과를 알아보고자 하였다.
2017년 6월 7일-6월 9일 동안에 질병보건통합관리시스템에 서울시의 한 요양병원에서 10명의 CRE 환자가 신고 되었다. 분해효소는 Klebsiella pneumoniae carbapenemase (KPC)형이고 균종은 Klebsiella pneumoniae 9명, Citrobacter koseri 1명이었다. 한 병원에서 KPC형의 분해효소가 10명의 환자에서 모두 확인되어 유행을 인지하고 역학조사를 시작하였다.
의무기록조사를 통하여 입원시기 및 검체에 검출된 균과 항생제 내성여부를 조사하였다. 감염경로 조사로 의료진과 직원이 Carbapenemase-producing Enterobacteriaceae (CPE)보균자일 가능성과 획득 환자 발생 후 기구를 통한 2차 전파의 가능성을 조사하였다. 일상 접촉이 가능한 의료진과 돌봄 인력에 대해서 감염 감시배양을 하였다. 의사 4명, 간호조무사 5명, 물리치료사 1인, 방사선사 각 1인을 조사하였다. 간병인은 모두 파견 근무자였고 파견 근무 4인 중 연락 가능한 2인을 검사하였다. 또한 CPE 획득 환자 발생 후 기구와 일상접촉을 통한 2차 전파의 가능성을 확인하기 위하여 환경 검사를 시행하였다. 병원에서 이미 환경 소독을 하였으나 환자가 가장 많이 발생한 병실에서 CRE 환자가 사용한 4개의 침상과 인공호흡기, 문손잡이, 인터폰, 환자 수납장, 투석기, 심전도 모니터링 기구, 운반대에 각각 1개씩 Pipette Swab을 이용하여 총 12개의 환경 배양검사를 시행하였다.
의무기록을 검토하여 사망 여부를 평가하였다. 또한, 항생제 사용, 욕창, 호흡기, 투석, 중심정맥관, 기관절개관 유무 등을 조사한 후 동일한 병실환자를 노출군과 비노출군으로 비교 분석하였다.
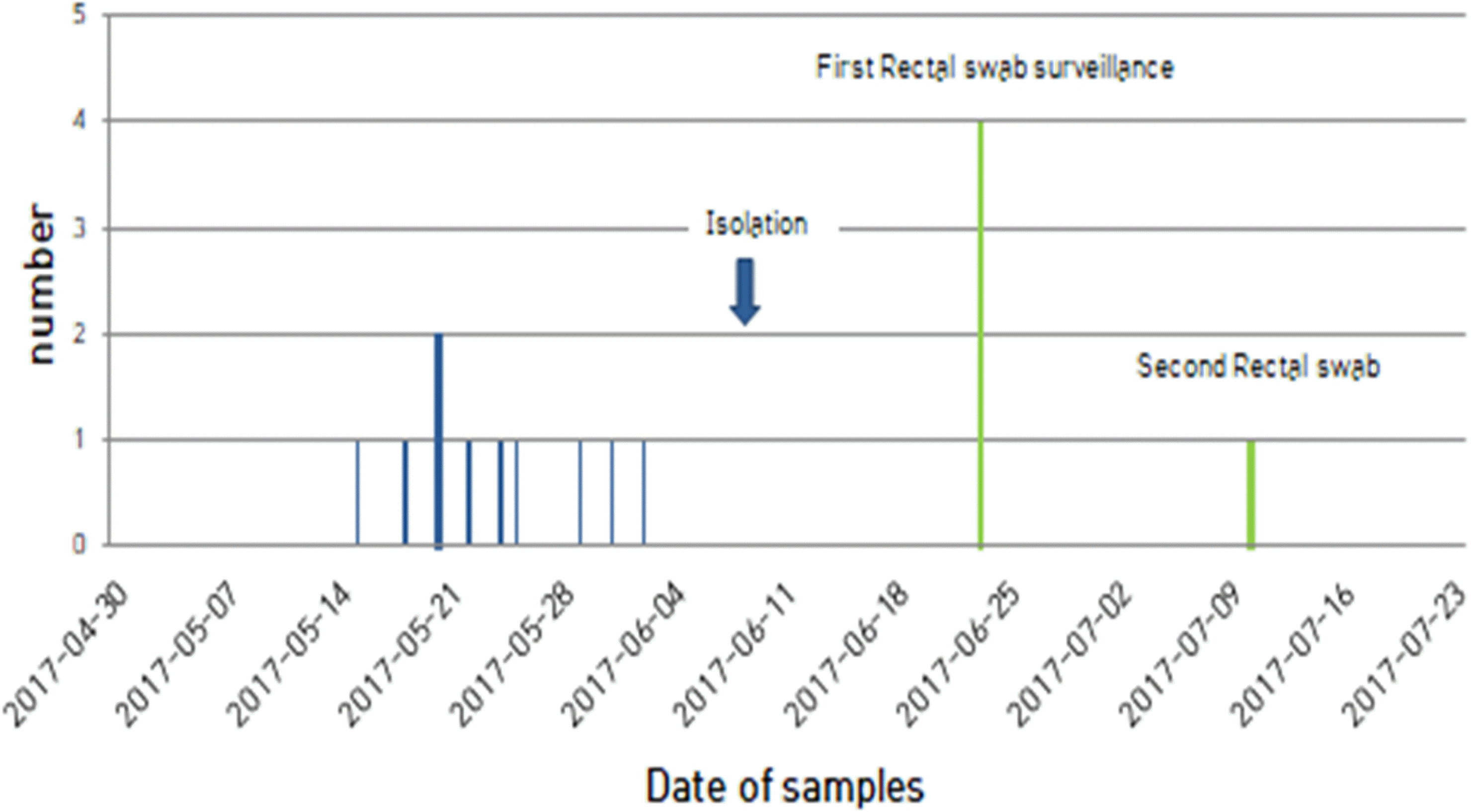
질병관리청의 다제내성균 관리지침[15]에 따라 CRE 환자는 각 병실을 소독한 후 격리하였고 환자 간 이동이나 병실 간 이동하는 물건이 없도록 조치하였다. 격리 후 외부 면회 자제와 손 씻기 교육과 일회용 가운과 장갑 사용, 각 병실의 소모품 및 혈압계, 체온계 등은 환자마다 개별 사용하도록 하였다. 면회 시 가운 착용과 손 씻기를 하도록 하였다. 의료진과의 면담을 통하여 카바페넴 처방 제한을 권고하였다. 중재 활동 평가는 조사 후 3주간 유행이 발생한 병실과 동일한 병실에 입원한 39명의 환자에서 주 1회 직장 도말 검사를 하였고 6개월간 발생 보고를 모니터링 하였다.
감염 감시 배양과 환경 검체의 배양 검사방법으로는 MacConkey 배지와 mSUPERCARBA 선별배지(CHROMagar, France)에 도말한 뒤, 37℃에서 18시간 배양하였다. 분리된 세균 집락들은 MALDI-TOF 질량분석기(Bruker Daltonics, Germany)로 1차 동정한 뒤, 자동화기기 VITEK 2 (bioMerieux, France)로 확인하였다. 카바페넴 항생제 4종(Imipenem, Meropenem, Doripenem, Ertapenem)에 대한 감수성 시험은 미량액체희석법을 이용하였으며 대조군으로 Enterococcus faecalis ATCC 29212를 사용하였다. 항생제 감수성 결과는 Clinical & Laboratory Standards Institute (CLSI) [16] 지침에 따라 판독하였다. 카바페넴 내성 세균을 대상으로, 카바페넴 분해효소 6종(KPC, GES, NDM, IMP, VIM, OXA-48)에 대하여 PCR로 보유 여부를 확인한 뒤, 염기서열분석을 통하여 아형을 결정하였다.
의무 기록 조사에서 5월 이전에 환자의 검체 중 CRE가 검출된 적은 없었기 때문에 이번 요양병원의 CRE 감염 유행기간은 5월-7월로 추정된다. 입원환자는 유행조사 기간 동안 총 149명이었고 신고 된 10명과 1차 감시배양 4건, 2차 감시배양 1건에서 CRE 환자가 추가 발견되어 총 15명의 CRE 감염사례가 발생하였다(Fig. 1). 유행이 발생한 병실과 동일한 병실에 입원한 환자는 총 39명이었다. CRE 환자의 발병 장소는 3층, 5층 일반병실에 각각 1명 그리고 2층 집중치료실에 13명이 발생하였고 병원 전체 발병률은 10%이었으며 장소별 발병률로는 집중치료실 50%, 일반병동 각 2.8%이었다.
대부분의 환자가 와상 환자이며 입원기간은 최소 2개월에서 최대 4년 이상으로 장기 입원하고 있었다. 임상 증상으로는 고열과 가래 증가가 가장 많았고 동시 다발적으로 열이 발생하여 의료진이 비슷한 시기에 객담 검사를 하였다. 환자 군의 특성으로는 같은 병실을 사용한 다른 환자들과 비교할 때 나이, 성별, 기저 질환에서 큰 차이는 없었으나 환자 군에서 항생제 사용(P<0.001), 호흡기 사용(P=0.001), 기관절개관 사용 (P=0.020), 중심정맥관(P=0.007), 욕창(P<0.001), 발생장소(P=0.036) 등에 유의미한 차이를 보였다(Table 1). 의무기록에서 환자 검체는 주로 객담 검사였으며 항생제 감수성 검사 결과 대부분의 항생제에 내성이 있었다(Table 2).
입원 시 CRE 검사가 시행되지 않았고 임상 증상이 동시에 발현되어 감염원이 되는 환자는 찾기 어려웠다. 감염 경로 조사로 시행한 의료진과 직원에 대한 감염 감시 배양은 모두 음성이고 환경배양검사는 투석기 시동 버튼에서 유행 균주와 동일한 카바페넴 내성 K. pneumoniae이 검출되었다. 검출된 카바페넴 내성 K. pneumoniae의 항생제 내성 감수성 검사는 기존의 유행 CRE와 같은 양상을 보였다(Table 2).
CRE 환자 15명 중 8명은 CRE 진단 후 한 달 이내에 사망하였다. 의무기록상 사망원인은 패혈증이 3명, 폐렴이 5명으로 치명률은 53.3% 이었다.
전파위험 요인으로는 항생제(RR=18.12, 95% CI= 2.64-124.5), 인공호흡기(RR=3.95, 95% CI=1.53-10.22), 욕창(RR=15.56, 95% CI=2.27-106.8), 기관절개관(RR=2.75, 95% CI=1.06-7.12), 투석(RR=2.43, 95% CI=1.21-4.89) 여부가 통계적으로 유의하였다(Table 3).
미생물 검사 결과 K. pneumoniae 이외에도 S. marcesens, E. aerogenes, C. koseri 균종에서 KPC 유형의 카바페넴 분해 효소를 보유하고 있었다. P. aeruginosa의 경우 2명에서 Guiana extended spectrum β-lactamase (GES) 24 type의 분해효소가 검출되었다. 또한 한 환자 각각에 다양한 종류의 CRE 및 항생제 다제내성균이 분리되었고 지속적으로 감염이 이루어진 것으로 생각된다(Table 4).
다제내성균의 종류는 CRE 외에도 반코마이신내성장알균(Vancomycin resistant Enterococcus,VRE), 다제내성아시네토박터바우마니균(Multidrug resistant Acinetobacte rbaumannii, MRAB), 다제내성 녹농균(Multidrug resistant Pseudomonas aeruginosa, MRPA)등이 있었다(Table 4).
장기 요양시설은 지역 내 CRE확산과 전파의 매우 중요한 역할을 하는데 이는 장기 요양시설에 입원 환자는 이미 급성기 병원에서 항생제를 사용한 빈도가 높고 여러 침습적 기구를 하고 있으며 입원기간도 길기 때문이다. Lin 등[6]의 연구에 의하면 장기요양시설의 CRE 집락화는 30.4%로 매우 높게 나타났으며 다른 문헌에 의하면 집락화의 16.5%가 CRE 감염으로 이어진다고 보고하였다[17]. CRE 감염 시 사망률이 높은데 문헌에 따르면 30-75%까지 보고 되고 있으며[18-21] K. pneumoniae 혈류감염으로 인한 사망률은 항생제에 감수성이 있는 경우는 17%, Extended-spectrum beta-lactamase에 의한 사망률은 22%, CRE에 의한 사망률은 48%로 다른 항생제 내성보다 CRE로 인한 사망률이 높았다[20]. 본 연구에서도 CRE 진단 후 1개월내 사망이 15명 중 8명으로 치명률이 53.3%으로 매우 높았다.
기존의 알려진 CRE 전파 위험요인으로는 항생제의 사용, 중심정맥관의 삽입과 유치기간, 인공호흡기, 입원기간 등으로 알려져 있다[22,23]. 본 연구의 경우 기존의 위험 요인과 다르게 욕창과 투석, 기관절개관이 위험 요인으로 조사되었다. 투석이 전파의 위험요인으로 조사된 점은 요양병원이 투석을 하는 병원이라는 요인도 있으나 환경 검사에서 투석기의 작동버튼에 유행 균주와 동일한 카바페넴 내성 K. pneumoniae이 검출된 것으로 보아 투석이 이번 유행의 주요한 전파 경로 중의 하나였던 것으로 생각된다. 욕창과 기관절개관이 위험요인으로 조사된 것과 다인실에서 공동 간병인이 여러 명을 간병하는 국내 요양병원의 의료 환경에 의한 것으로 생각된다.
요양병원에 입원한 환자에서 카바페넴 내성 K. pneumoniae외에도 다양한 균종의 CRE와 VRE, MRAB, MRPA도 함께 분리되었는데 각 환자마다 다양한 내성균이 집락화 되어 있고 지속적으로 감염이 이루어지는 것을 확인하였다. 이는 입원기간이 길고 침상거리가 좁은 다인실 요양병원이라는 공간적 특성과 공동 간병인과 의료진의 지속적인 의료행위로 인한 물리적 특성으로 인하여 환자간 혹은 환자-환경 간의 내성균 교차오염이 쉽게 이루어지는 것으로 생각된다.
항생제 내성의 전파를 막기 위한 중재 활동은 적극적인 감시와 코호트 격리, 접촉에 대한 예방, 손위생, 환경소독 등이 있으며 보균자를 막기 위하여 칩습적 기구를 최소화하고 것과 항생제 사용의 스튜어드십 등이 있다[15]. 중재 활동은 확산과 재유행을 막는데 매우 효과적인데 이번 요양 병원내 CRE 유행 시에도 적극적 감염 감시와 감염관리로 환자의 유행의 확산과 재발을 예방할 수 있었다.
이번 연구는 우리나라 요양병원의 CRE 유행에 대하여 최초로 조사한 연구로서 요양병원에서 발생한 CRE 유행은 매우 높은 발병률과 치명률을 가질 수 있음을 확인하였다. 전파 위험 요인도 기존의 3차 병원과 다르게 나타나는 것을 알 수 있었는데 이는 밀접한 다인실 구조와 감염관리가 제대로 이루어지지 않는 요양병원의 진료 환경에 기인한 것으로 보인다. 또한 다양한 항생제 내성균의 감염이 지속적으로 이루어지는 것을 확인하였고 CRE 유행 시 집중 감시와 적극적 감염 관리가 요양병원 내에서도 확산과 재발을 방지하는데 효과적임을 알 수 있었다.
이와 같은 결과에도 본 연구에 많은 제한점이 있는데 첫 번째는 한 요양병원의 환자를 대상으로 한 조사라는 것이고 두 번째는 환자의 기저질환의 상태와 의료 행위에 대한 접촉 정도에 대한 정밀한 평가가 이루어지지 않았다. 세 번째는 만성 환자의 경우 여러 병원을 거쳐 내원한 경우가 많고 대부분 장기 입원으로 내원 시 CRE 검사가 이루어지지 않아 유행의 감염 추정원인을 찾아내는데 어려움이 있었고 역학조사 당시 이미 사망자가 많아 감염 경로를 알아내는데 한계가 있었다.
요양병원에서 CRE 예방 관리는 입원 시 전파의 위험요인이 있는 경우 직장 도말 검사를 통한 적극적 감시로 환자를 조기에 찾아내는 것이 CRE 유행으로 인한 사망률을 줄이고 요양병원뿐만 아니라 다른 의료기관으로의 전파도 예방할 수 있을 것으로 생각된다.
REFERENCES
1. Nordmann P, Naas T, Poirel L. 2011; Global spread of Carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis. 17:1791–8. DOI: 10.3201/eid1710.110655. PMID: 22000347. PMCID: PMC3310682.
2. Gupta N, Limbago BM, Patel JB, Kallen AJ. 2011; Carbapenem-resistant Enterobacteriaceae: epidemiology and prevention. Clin Infect Dis. 53:60–7. DOI: 10.1093/cid/cir202. PMID: 21653305.

3. Centers for Disease Control. 2009; Guidance for control of infections with carbapenem-resistant or carbapenemase-producing Enterobacteriaceae in acute care facilities. MMWR Morb Mortal Wkly Rep. 58:256–60. PMID: 19300408.
4. Centers for Disease Control. 2013. Antibiotic resistance threats in the United States. Centers for Disease Control and Prevention;Atlanta: p. 49–89.
5. Peleg AY, Hooper DC. 2010; Hospital-acquired infections due to gram-negative bacteria. N Engl J Med. 362:1804–13. DOI: 10.1056/NEJMra0904124. PMID: 20463340. PMCID: PMC3107499.

6. Lin MY, Lyles-Banks RD, Lolans K, Hines DW, Spear JB, Petrak R, et al. 2013; The importance of long-term acute care hospitals in the regional epidemiology of Klebsiella pneumoniae carbapenemase-producing Enterobacteriaceae. Clin Infect Dis. 57:1246–52. DOI: 10.1093/cid/cit500. PMID: 23946222. PMCID: PMC8383150.
7. Perez F, Endimiani A, Ray AJ, Decker BK, Wallace CJ, Hujer KM, et al. 2010; Carbapenem-resistant Acinetobacter baumannii and Klebsiella pneumoniae across a hospital system: impact of post-acute care facilities on dissemination. J Antimicrob Chemother. 65:1807–18. DOI: 10.1093/jac/dkq191. PMID: 20513702. PMCID: PMC2904665.

8. Toth DJA, Khader K, Slayton RB, Kallen AJ, Gundlapalli AV, O'Hagan JJ, et al. 2017; The Potential for interventions in a long-term acute care hospital to reduce transmission of carbapenem-resistant Enterobacteriaceae in affiliated healthcare facilities. Clin Infect Dis. 65:581–7. DOI: 10.1093/cid/cix370. PMID: 28472233.

9. Kim MN, Yong D, An D, Chung HS, Woo JH, Lee K, et al. 2012; Nosocomial clustering of NDM-1-producing Klebsiella pneumoniae sequence type 340 strains in four patients at a South Korean tertiary care hospital. J Clin Microbiol. 50:1433–6. DOI: 10.1128/JCM.06855-11. PMID: 22259206. PMCID: PMC3318568.

10. Korea Disease Control. Infectious Disease Portal. http://www.kdca.go.kr/npt/biz/npp/ist/simple/simplePdStatsMain.do. (Updated on 14 June 2022).
11. Kim J, Lee JY, Kim SI, Song W, Kim JS, Jung S, et al. 2014; Rates of fecal transmission of extended-spectrum β-lactamase-producing and carbapenem-resistant Enterobacteriaceae among patients in intensive care units in Korea. Ann Lab Med. 34:20–5. DOI: 10.3343/alm.2014.34.1.20. PMID: 24422191. PMCID: PMC3885768.

12. Kang JS, Yi J, Ko MK, Lee SO, Lee JE, Kim KH. 2019; Prevalence and risk factors of carbapenem-resistant Enterobacteriaceae acquisition in an emergency intensive care unit in a tertiary hospital in Korea: a case-control study. J Korean Med Sci. 34:e140. DOI: 10.3346/jkms.2019.34.e140. PMID: 31074254. PMCID: PMC6509365.

13. Ahn JY, Song JE, Kim MH, Choi H, Kim JK, Ann HW, et al. 2014; Risk factors for the acquisition of carbapenem-resistant Escherichia coli at a tertiary care center in South Korea: a matched case-control study. Am J Infect Control. 42:621–5. DOI: 10.1016/j.ajic.2014.02.024. PMID: 24837112.

14. Lee HJ, Choi JK, Cho SY, Kim SH, Park SH, Choi SM, et al. 2016; Carbapenem-resistant Enterobacteriaceae: prevalence and risk factors in a single community-based hospital in Korea. Infect Chemother. 48:166–73. Erratum in: Infect Chemother 2019;51:435-8. DOI: 10.3947/ic.2019.51.4.435. PMID: 31898429. PMCID: PMC6940368.

15. Korean Centers for Disease Control. Infection control guidelines for multidrug resistant microorganisms in healthcare facilities. https://www.koshic.org/related/%EB%8B%A4%EC%A0%9C%EB%82%B4%EC%84%B1%EA%B7%A0%EA%B0%90%EC%97%BC%EA%B4%80%EB%A6%AC%EC%A7%80%EC%B9%A8.pdf. (Updated on 14 June 2022).
16. Clinical. 2007. Performance standards for antimicrobial susceptibility testing; seventeenth informational supplement. CLSI document M100-S17. Clinical and Laboratory Standards Institute;Wayne: p. 1–362. DOI: 10.1201/9781420014495.ch1. PMCID: PMC2173926.
17. Tischendorf J, de Avila RA, Safdar N. 2016; Risk of infection following colonization with carbapenem-resistant Enterobactericeae: a systematic review. Am J Infect Control. 44:539–43. DOI: 10.1016/j.ajic.2015.12.005. PMID: 26899297. PMCID: PMC5262497.

18. Ben-David D, Kordevani R, Keller N, Tal I, Marzel A, Gal-Mor O, et al. 2012; Outcome of carbapenem resistant Klebsiella pneumoniae bloodstream infections. Clin Microbiol Infect. 18:54–60. DOI: 10.1111/j.1469-0691.2011.03478.x. PMID: 21722257.

19. Bogan C, Kaye KS, Chopra T, Hayakawa K, Pogue JM, Lephart PR, et al. 2014; Outcomes of carbapenem-resistant Enterobacteriaceae isolation: matched analysis. Am J Infect Control. 42:612–20. DOI: 10.1016/j.ajic.2014.02.013. PMID: 24837111.

20. Hussein K, Raz-Pasteur A, Finkelstein R, Neuberger A, Shachor-Meyouhas Y, Oren I, et al. 2013; Impact of carbapenem resistance on the outcome of patients' hospital-acquired bacteraemia caused by Klebsiella pneumoniae. J Hosp Infect. 83:307–13. DOI: 10.1016/j.jhin.2012.10.012. PMID: 23313086.

21. Ben-David D, Kordevani R, Keller N, Tal I, Marzel A, Gal-Mor O, et al. 2012; Outcome of carbapenem resistant Klebsiella pneumoniae bloodstream infections. Clin Microbiol Infect. 18:54–60. DOI: 10.1111/j.1469-0691.2011.03478.x. PMID: 21722257.

22. Borer A, Saidel-Odes L, Eskira S, Nativ R, Riesenberg K, Livshiz-Riven I, et al. 2012; Risk factors for developing clinical infection with carbapenem-resistant Klebsiella pneumoniae in hospital patients initially only colonized with carbapenem-resistant K pneumoniae. Am J Infect Control. 40:421–5. DOI: 10.1016/j.ajic.2011.05.022. PMID: 21906844.

23. Jiao Y, Qin Y, Liu J, Li Q, Dong Y, Shang Y, et al. 2015; Risk factors for carbapenem-resistant Klebsiella pneumoniae infection/colonization and predictors of mortality: a retrospective study. Pathog Glob Health. 109:68–74. DOI: 10.1179/2047773215Y.0000000004. PMID: 25707874. PMCID: PMC4455340.

Table 1
Descriptive characteristics of study population
Table 2
Antimicrobial susceptibility of CRE isolates and environmental culture
Table 3
Risk ratios for factors associated with CRE
Table 4
Distribution of CRE and antibiotic-resistant strains isolated from CRE-positive patients
| Date/case | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| May.15 | K.pneumonia | |||||||||
| May.16 | E. aerogenes* | |||||||||
| May.17 | K.pneumonia | K.pneumonia | ||||||||
| May.18 | K.pneumonia | K.pneumonia | ||||||||
| May.19 | K.pneumonia | K.pneumonia | ||||||||
| May.20 | E. aerogenes | K.pneumonia | ||||||||
| May.21 | E. aerogenes | K.pneumonia | K.pneumonia | C.koseri | K.pneumonia | |||||
| May.22 | E. aerogenes | K.pneumonia | K.pneumonia | |||||||
| May.23 | E. aerogenes | K.pneumonia | K.pneumonia | |||||||
| S. marcesens | ||||||||||
| May.24 | E. aerogenes | K.pneumonia | ||||||||
| May.25 | E. aerogenes | K.pneumonia | K.pneumonia | K.pneumonia | ||||||
| May.26 | E. aerogenes | K.pneumonia | C.koseri | K.pneumonia | K.pneumonia | |||||
| June.1 | VRE | |||||||||
| June.2 | E. aerogenes | K.pneumonia | K.pneumonia | K.pneumonia | C.koseri | K.pneumonia | C. koseri | |||
| MRAB | ||||||||||
| June.3 | C. koseri* | MRPA | ||||||||
| June.4 | Expired | Expired | Expired | K.pneumonia | ||||||
| C. koseri | ||||||||||
| June.5 | K.pneumonia | K.pneumonia | ||||||||
| C. koseri | ||||||||||
| June.6 | K.pneumonia | S.marcecescens | K.pneumonia | MRAB | ||||||
| June.7 | K.pneumonia, | k.pneumonia | ||||||||
| June.8 | E. aerogenes | K.pneumonia | K.pneumonia | |||||||
| C.koseri |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download