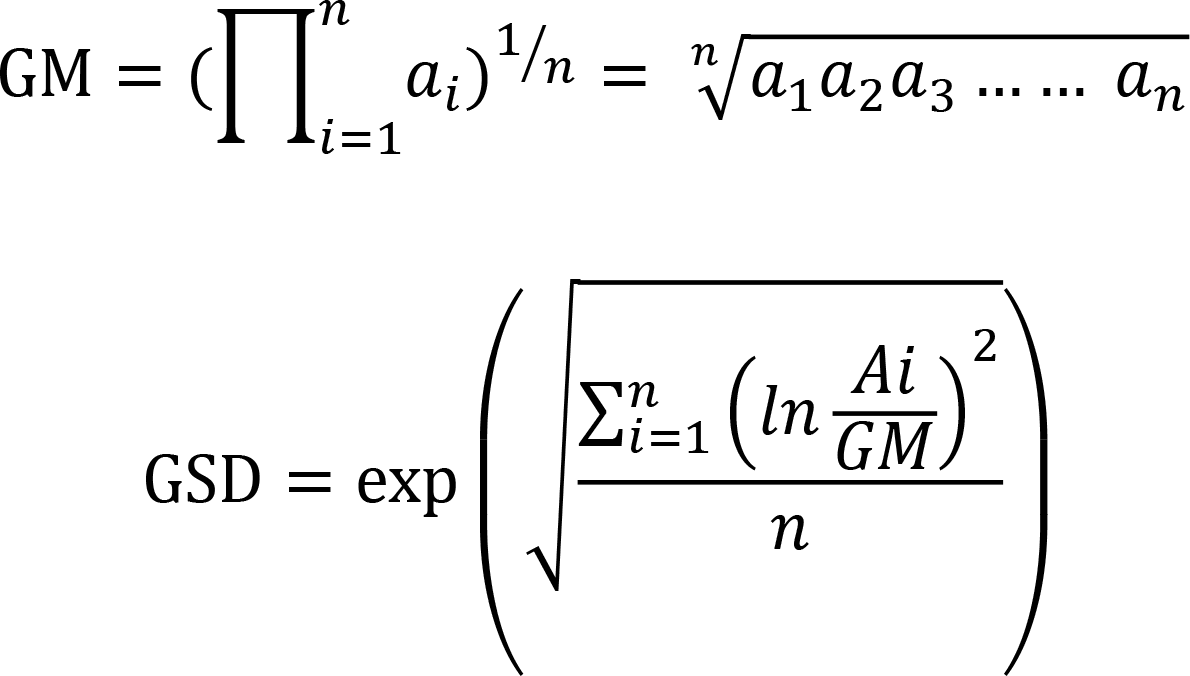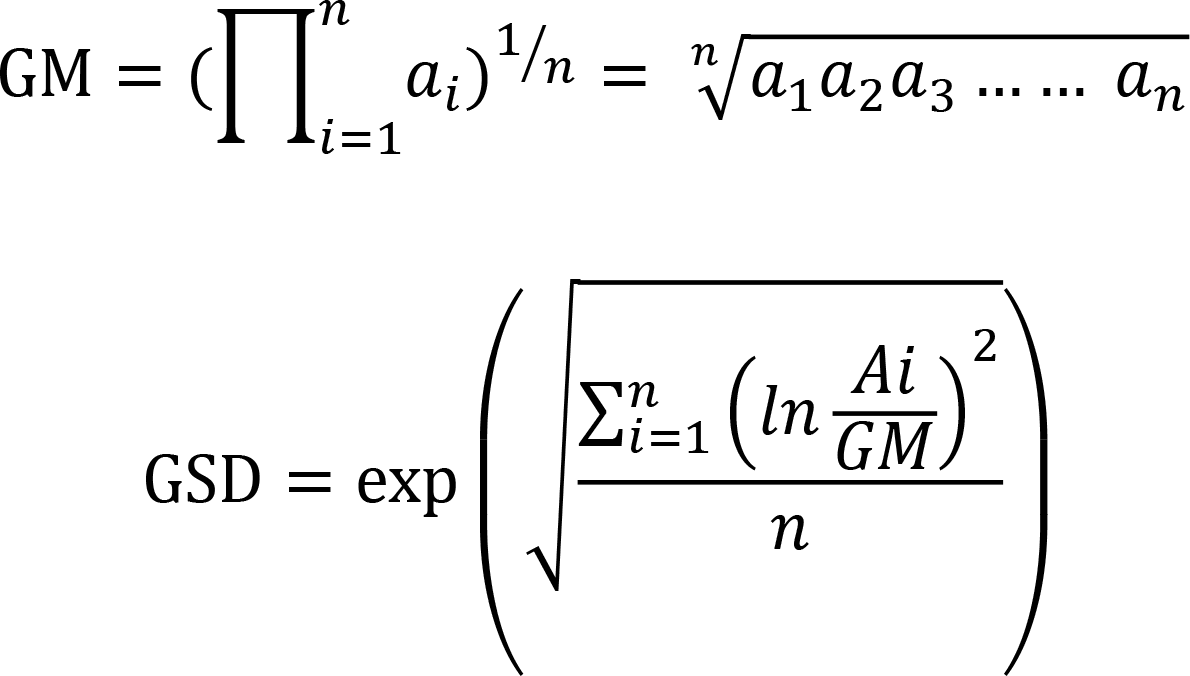This article has been
cited by other articles in ScienceCentral.
Abstract
Background
The geometric mean criteria (GC) is an alternative for assessing proficiency testing (PT) acceptability. A recent study applied GC to the PT results provided by the College of American Pathologists. We assessed the feasibility of using GC for anti-blood group antibody titration testing (ABT) in the Korean PT program.
Methods
The results of the ABT performed in 2019 were reviewed using GC. GC was calculated as geometric mean (GM)±multiples of geometric standard deviation (GSD). The number of acceptable results obtained using GC was compared to that of the conventional mode criteria (MC, mode±1 second). Only the results with 30 or more peer group responses were included in the analyses.
Results
A total of 27 PT results (anti-A 13, anti-B 14) were analyzed. The acceptable proportions from MC were 82.9%–100.0% for anti-A and 76.2%–100.0% for anti-B. The GC criteria yielded acceptable results of 46.9%–97.6% (1 GSD), 88.6%–100.0% (2 GSD), and 97.3%–100.0% (3 GSD) for anti-A. For anti-B, 1 GSD, 2 GSD, and 3 GSD criteria resulted in 44.7%–90.6%, 90.6%–100.0%, and 97.4%–100.0%, respectively. In general, acceptable results using MC were found to be distributed between 1 GSD and 2 GSD.
Conclusions
The GC can be used as an alternative assessment criterion with a more robust statistical rationale. While conventional MC struggles with representing the central tendency of data, GC provide better visualization of the central tendency.
Keywords: Laboratory proficiency testing, Geometric mean, Mode, Acceptability
서론
혈액형항체 역가검사는 태아신생아용혈성 질환의 진단 및 모니터링, ABO 불일치 조혈모세포 이식 후 모니터링, 또는 ABO 불일치 고형장기 이식의 시기 결정 및 이식 후 모니터링 등에 이용되는 검사이다[
1-
3]. 그러나 역가검사는 표준화가 잘 되어있지 않아 검사법에서 시험관법(tube)을 이용하는 경우와 원주응집법(column agglutination technique, CAT)을 이용하는 경우가 있고 항글로불린(anti-human globulin, AHG)을 이용하는지 아니면 즉시 원침(immediate spin, IS)하는지 등 다양한 방법을 사용하고 있으며, 이로 인해 검사자 간, 검사실 간 변이가 크다는 점이 잘 알려져 있다[
4]. 이러한 한계를 극복하고자 College of American Pathologists (CAP)에서는 혈액형항체 역가검사 방법의 통일화를 위한 uniform procedure를 제시한바도 있으나, uniform procedure의 도입으로 혈액형항체 역가검사의 변이를 줄이려는 노력은 거의 성과가 없는 실정이다[
5,
6].
현재 대한임상검사정도관리협회에서는 1년에 2차례 혈액형항체 역가검사에 대한 외부정도관리를 시행하고 있으며, 그 판정기준은 일반적인 반정량검사의 원칙에 의거하여 최빈값(mode)±1 titer 이내일 경우 ‘acceptable’로 판정하고 있다. 수혈의학에서 반정량검사의 평가는 intended response와의 일치 여부로 판단하며, intended response의 최빈도±1 grade로 하여 이 값이 80% 미만이 되는 경우 80%가 될 때까지 주변 결과 중 빈도가 높은 값을 추가하도록 하고 있다. 그러나 이러한 기준은 검사결과의 분포가 10 titer 이상에 걸쳐 분포하는 혈액형항체 역가검사에 적용하면 지나치게 좁게 판정이 된다는 이의가 꾸준히 제기되고 있으며, 최빈값이 동수로 나올 때, 또는 단 1개 기관 차이로 최빈값이 결정되는 경우 등의 여러 상황에 따라 판정이 곤란한 경우가 적지 않다. 본 연구진에서는 이러한 한계를 극복하기 위하여 CAP의 혈액형항체 역가검사 결과를 대상으로 최빈값을 기준으로 하지 않고, 기하평균(geometric mean, GM)을 기준으로 한 새로운 판정기준의 적용 가능성을 제시한 바 있다[
7]. GM은 자료의 중심성(central tendency)을 나타내는 방법 중 하나로, 일반적인 산술평균에 비하여 극단적인 값에 영향을 덜 받는 장점이 있다. 또한 정량값에 간단하게 로그를 취함으로써 계산할 수 있는 장점이 있으며, 최종 결과에 로그를 역으로 취해주면 정량값으로 재환산할 수 있는 장점이 있다. GM을 사용할 때에 발생할 수 있는 단점으로는 일반적인 산술평균과 같이 자료의 정규분포를 가정하는 모수적 접근방법이라는 점이다. 따라서 자료의 분포가 정규분포에서 많이 벗어나는 경우 그 적용이 쉽지 않을 수 있다. 이에 대해서는 일반적인 정량검사와 마찬가지인 상황으로 추후 더 연구가 필요한 지점이라고 할 수 있다. 아직 임상검사실에 GM 개념을 이용한 사례는 거의 없는 실정이다[
8]. 본 연구에서는 동일한 기준을 국내 외부정도관리에 적용할 수 있을지 그 가능성을 타진해보고자 한다.
재료 및 방법
2016년부터 2020년까지 대한임상검사정도관리협회의 외부정도관리 결과 중, 혈액형항체(항-A 항체, 항-B 항체) 역가검사에 참가한 기관들의 결과를 대상으로 분석을 하였다. 다양한 검사방법 가운데 가장 많이 활용된 AHG 활용 원주응집법(CAT–AHG), 실온식염수(room temperature saline) 원주응집법(CAT–RT) 그리고 튜브 즉시원침법(tube–IS) 결과에 대해 분석을 시행하였다.
동일 검사방법을 사용하는 집단(peer group)의 참가기관 수가 30개 미만인 경우와 최빈값이 2개 이상으로 나타나는 경우는 제외하고, 기존의 최빈값을 이용한 판정기준을 적용할 때와 GM을 이용한 판정기준을 적용할 경우, 각각 적합(acceptable)으로 판정되는 기관 수와 부적합(unacceptable)으로 판정되는 기관 수를 계산해보았다. 판정기준을 기존의 mode±1 titer 이내로 정했을 때와 GM±1 geometric standard deviation (GSD)부터 시작해서 3 GSD까지 기준을 넓혀가면서 각각 적합/부적합으로 판정되는 기관의 분율을 계산해보았다. 기관의 분율은 분석에 포함된 기관 수를 분모로 하여 적합 또는 부적합 기관의 수를 분자로 나누어 계산하였다. 합격률의 경우 ‘(적합기관 수/분석기관 수)×100%’로 계산하였다. 적합기관 수 GM 및 GSD의 계산식은 다음과 같다[
7].
적합 기관 분율의 비교는 McNemar test를 이용하여 비교하였다. 통계분석은 MedCalc Statistical Software ver. 20.008 (MedCalc Software Ltd., Ostend, Belgium)을 이용하여 수행하였다.
결과
연구기간 동안 총 10차례 혈액형항체 역가검사에 대한 외부정도관리가 이루어졌다(
Table 1). 참가기관의 응답 수는 117개에서 142개로 점차적으로 증가하는 양상을 보여주었으며, 특히 CAT–AHG법과 CAT–RT법의 증가가 두드러지게 보였다. 10회의 외부정도관리 중 연구의 기준에 부합하는(참가기관 수 30개 이상) 경우는 CAT–AHG 방법과 tube–IS 방법이었다. 최빈값이 두 개 이상으로 동수가 나온 경우를 제외하고 총 anti-A에서 13회, anti-B에서 14회 외부정도관리 결과가 조건을 충족하는 것으로 파악되어 연구에 포함되었다.
각각의 결과에 대하여 최빈값을 기준으로 하였을 때 적합기관 분율과 GM을 기준으로 하였을 때 분율을
Table 2 (anti-A)와
Table 3 (anti-B)에 각각 나타내었다. 최빈값±1 titer를 기준으로 하였을 때에 합격률은 82.9%–100.0% (anti-A), 76.2%–100% (anti-B) 수준이었다. GM±1 GSD, 2 GSD, 3GSD를 기준으로 하였을 때에는 anti-A의 합격률은 46.9%–97.6%, 88.6%–100.0%, 97.3%–100.0%였으며, anti-B의 합격률은 각각 44.7%–90.6% (GM±1 GSD), 90.6%–100.0% (GM±2 GSD), 97.4%–100.0% (GM±3 GSD) 수준이었다. 전반적으로 최빈값±1 titer의 합격률은 GM±1 GSD의 합격률과 GM±2 GSD의 합격률 사이에 위치하는 것으로 파악되었다.
Tables 2,
3에 나타난 모든 anti-A, anti-B에 대한 결과를 방법에 상관없이 합격 또는 불합격으로 판정하여 계산해보았을 때, 최빈값±1 titer의 합격률은 92.5% (921/1,017)였으며, GM을 기준으로 하였을 때의 합격률은 69.9% (711/1,017, GM±1 GSD), 95.4% (970/1,017, GM±2 GSD), 99.4% (1,011/1,017, GM±3 GSD)로 계산되었다.
고찰
외부정도관리는 임상검사실에서 환자의 정확한 진단, 치료방향 결정 및 치료반응 평가 등을 이루기 위한 가장 기본적인 요소이다. 외부정도관리 결과의 올바른 해석을 위한 많은 통계적 기법들이 개발되어왔으나 대부분의 방법은 정량적 검사결과에 적용하기 위한 방법으로, 정성 또는 반정량검사에 대한 판정은 아직도 국제적으로 통일된 기법을 적용하기 어려운 상황이다. Clinical Laboratory Standards Institute에서 발간하는 외부정도관리 결과 해석을 위한 가이드라인에서도 정성/반정량검사에 대한 해석에 대해서는 뚜렷한 가이드를 주고 있지 못하는 실정이다[
9].
반정량검사에서 일반적인 정량검사에 적용하는 통계적 기법을 적용하기 어려운 이유 중 하나는 반정량 단계별로 일정한 정량적 관계를 가지고 있다고 보기 어렵기 때문이다. 대표적인 반정량검사인 요시험지봉 검사의 경우 정량적 검사결과와 비교하여 보았을 때 각 단계별로 간격이 매우 불규칙하며 겹치는 구간도 많아 일정한 정량적 관계를 띄고 있다고 보기 어렵다[
10,
11]. 그러나 혈액형항체 역가검사는 다른 반정량검사와는 다르게 각 단계별 간격이 일정한 정량적 관계, 즉 배수를 띄는 특징이 있다[
12]. 이를 이용하여 본 연구진에서는 CAP 외부정도관리 결과를 이용하여 GM, GSD를 이용한 외부정도관리 판정이 가능할지 분석한 결과를 발표한 바 있다[
7]. 본 연구에서는 동일한 방법을 국내 외부정도관리 결과에도 적용할 수 있을지 알아보는 것을 목적으로 하였다.
분석결과 현재 사용 중인 최빈값±1 titer의 기준은 대략 GM±1 GSD와 GM±2 GSD 사이 정도에 분포하는 합격률을 보인 것으로 나타났다. 또한 흥미로운 점은 GM±1 GSD, 2 GSD, 3 GSD를 기준으로 하였을 때의 전체 합격률이 각각 69.9%, 95.4%, 99.4%로, 일반적인 정규분포에서 평균±1 SD, 2 SD, 3 SD 안에 포함되는 범위인 68.3%, 95.4%, 99.7%와 거의 일치한다는 점이다. 즉 반정량검사 중에서도 역가를 기반으로 하는 검사는 정량적 검사에서 사용하는 통계적 기법을 응용할 수 있는 여지가 있다는 점을 알 수 있다.
정량적 검사에 대한 외부정도관리에서 가장 많이 사용하는 방법은 동일 집단 내에서 평균 및 표준편차를 구하여 standard deviation index로 기관별 데이터를 나타내는 방법이다. 이는 전체 집단의 데이터 분포를 반영하기 위하여 분포의 대표값과 산포도를 반영하는 두 가지 지표를 이용하는 방법이라고 할 수 있다. 그러나 최빈값을 이용한 외부정도관리 결과 판정의 경우, 결과 분포의 산포는 판정에 반영되지 못하는 한계가 있다. 또한 최빈값을 이용한 결과 판정 적용에 어려움을 겪는 경우는 최빈값이 동수로 2개 이상 나오는 경우이다. 이렇게 판정이 곤란한 경우 개별 건수별로 판정기준을 임의로 조정하여 사용하고 있는 것이 현실이다. 또한 최빈값이 단 1개 기관의 차이로 갈리는 경우도 있다. 2019년 1회차 anti-A에 대하여 tube–RT 방법을 사용한 기관의 답변을 보면 1:32로 답한 기관이 10기관, 1:64로 답한 기관이 9기관으로 나타나 최빈값은 1:32로 계산되었다. 이에 따라 1:32로 답한 기관은 정답으로, 1:128로 답한 기관은 오답으로 최종 판정할 수밖에 없었다(
Fig. 1A). 또한 일부 경우에서는 최빈값이 분포의 중앙이 아니라 한 극단에 치우친 경우도 있다. 2019년 1회차 anti-A에 대하여 CAT–RT 방법을 사용하는 기관의 답변 분포를 보면 1:16, 1:32, 1:64로 답한 기관이 각각 2, 4, 7기관으로, 가장 높은 값인 1:64가 최빈값으로 판정될 수밖에 없는 상황도 있다(
Fig. 1B). 이렇듯 최빈값은 그 근본적인 한계로 인하여 외부정도관리 판정기준을 정하는 데에 있어서 참가기관들의 실제적인 결과 분포를 제대로 반영하기 어려운 경우가 발생할 수 있다. 반면, GSD를 적용할 경우
Fig. 1A와 1B 예시에서 자료의 중심성을 잘 나타냄을 확인할 수 있다.
Fig. 1B 예시에서 ±2 GSD 기준에서 허용범위가 더 넓어지지 않는 것은 분산(dispersion)이 GSD에 반영되어 있기 때문으로 해석할 수 있으며, 이는 중심성과 분산을 동시에 반영할 수 있는 GSD의 장점이다. 연구에 포함된 총 27회의 외부정도관리 결과 중에서 단 1회차(2017년, tube–IS, anti-B)를 제외한 모든 경우에서 최빈값±1 grade 결과가 80% 이상의 참가기관을 포함하였기 때문에 반정량검사에서 최빈값±1 grade 결과가 80% 미만일 경우 시행되는 분석은 필요하지 않았다. 또한 최빈값이 동수로 나온 결과를 포함 시 최빈값 기준의 합격 여부를 판정할 수 있는 기준이 없었기 때문에 최빈값이 2개 이상으로 나타난 경우는 본 연구에서 제외되었다.
향후 혈액형항체검사에 대한 외부정도관리 개선을 위하여, 다른 정량검사와 유사하게 표준화의 개념을 도입할 필요는 없을지에 대해서도 고민할 필요가 있을 것으로 생각된다. 혈액형항체검사에 대한 검사실 간 변이를 줄이기 위하여 CAP에서는 uniform procedure 도입을 제시한 바 있으나 실제로 검사실 간 변이를 줄이는 데에는 별 도움이 되지 못하였다[
5,
6]. 이는 검사법만의 일치화뿐만 아니라 결과의 일치화를 위한 표준물질이 부재하기 때문으로 생각되며, 이를 위하여 World Health Organization에서 anti-A, anti-B reference material을 제시한 바 있으나, 아직 이 물질이 검사실 간 변이를 줄이는 데에 도움을 줄 수 있을지는 보고된 바 없다[
13]. 향후 표준물질을 통한 외부정도관리가 가능해진다면 일부 정량적 검사들에서와 마찬가지로 혈액형항체검사에서도 정확도 기반 외부정도관리가 가능할 수도 있을 것으로 기대되며, 이에 대하여 추가적인 연구가 지속적으로 이루어져야 할 것으로 생각된다.
결론적으로, GM을 이용한 외부정도관리 결과 판정은 반정량검사 중 역가를 바탕으로 하는 검사법의 판정에 유용하게 이용할 수 있는 통계적 기법이라고 판단된다. 향후 정성 및 반정량검사의 외부정도관리 판정기법 향상을 위한 연구가 계속적으로 이루어져야 할 것으로 생각된다.
감사의 글
이 연구는 대한임상검사정도관리협회의 2021년도 학술연구과제 연구비 지원으로 수행되었다(과제번호: 2021-04).
References
1. de Haas M, Thurik FF, Koelewijn JM, van der Schoot CE. 2015; Haemolytic disease of the fetus and newborn. Vox Sang. 109:99–113. DOI:
10.1111/vox.12265. PMID:
25899660.

2. Booth GS, Gehrie EA, Bolan CD, Savani BN. 2013; Clinical guide to ABO-incompatible allogeneic stem cell transplantation. Biol Blood Marrow Transplant. 19:1152–8. DOI:
10.1016/j.bbmt.2013.03.018. PMID:
23571461.

3. Kim H, Choe W, Shin S, Kim YH, Han DJ, Park SK, et al. 2020; ABO-incompatible kidney transplantation can be successfully conducted by monitoring IgM isoagglutinin titers during desensitization. Transfusion. 60:598–606. DOI:
10.1111/trf.15672. PMID:
31957888.

5. AuBuchon JP, de Wildt-Eggen J, Dumont LJ. Biomedical Excellence for Safer Transfusion Collaborative; Transfusion Medicine Resource Committee of the College of American Pathologists. 2008; Reducing the variation in performance of antibody titrations. Vox Sang. 95:57–65. DOI:
10.1111/j.1423-0410.2008.01043.x. PMID:
18479347.

6. Bachegowda LS, Cheng YH, Long T, Shaz BH. 2017; Impact of uniform methods on interlaboratory antibody titration variability: antibody titration and uniform methods. Arch Pathol Lab Med. 141:131–8. DOI:
10.5858/arpa.2015-0351-OA. PMID:
27681333.

7. Yang JJ, Chung Y, Kim H, Ko DH, Hwang SH, Oh HB. 2020; Retrospection of anti-blood group antibody proficiency testing data using the geometric mean and standard deviation. Am J Clin Pathol. 153:530–6. DOI:
10.1093/ajcp/aqz187. PMID:
31844892.

8. McPherson RA, Pincus MR. 2017. Henry's clinical diagnosis and management by laboratory methods. 23rd ed. Elsevier;St. Louis (MO):
9. Clinical Laboratory Standards Institute. 2007. Using proficiency testing to improve the clinical laboratory; approved guideline: CLSI document GP27-A2. 2nd ed. Clinical Laboratory Standards Institute;Wayne (PA):
10. Asberg A, Johnsen H, Mikkelsen G, Hov GG. 2016; Using probit regression to disclose the analytical performance of qualitative and semi-quantitative tests. Scand J Clin Lab Invest. 76:515–9. DOI:
10.1080/00365513.2016.1202446. PMID:
27385434.

11. Chung Y, Ko DH, Hyun J, Kim HS, Park MJ, Shin DH. 2018; Establishing cut-offs for urine erythrocyte and leukocyte dipstick tests. Scand J Clin Lab Invest. 78:301–4. DOI:
10.1080/00365513.2018.1463559. PMID:
29667904.

13. Thorpe SJ, Fox B, Sharp G, White J, Milkins C. 2016; A WHO reference reagent to standardize haemagglutination testing for anti-A and anti-B in serum and plasma: international collaborative study to evaluate a candidate preparation. Vox Sang. 111:161–70. DOI:
10.1111/vox.12399. PMID:
27007982.

Fig. 1
Two examples of inadequate representation of data when applying mode criteria. Bottom arrow (Mode) indicate the range of acceptability using mode criteria. Upper three arrows (GSD) indicate the range when applying geometric standard deviation (GSD) criteria. In both examples, inadequate representation of the data distribution resulted in the exclusion of eligible responses of their acceptability. (A) An example of skewed distribution where mode cannot represent the central tendency while GSD demonstrates the central tendency of the data set. (B) An example where mode value is determined by the difference of just one participant. The use of GSD criteria correctly represents the range where most responses are included.
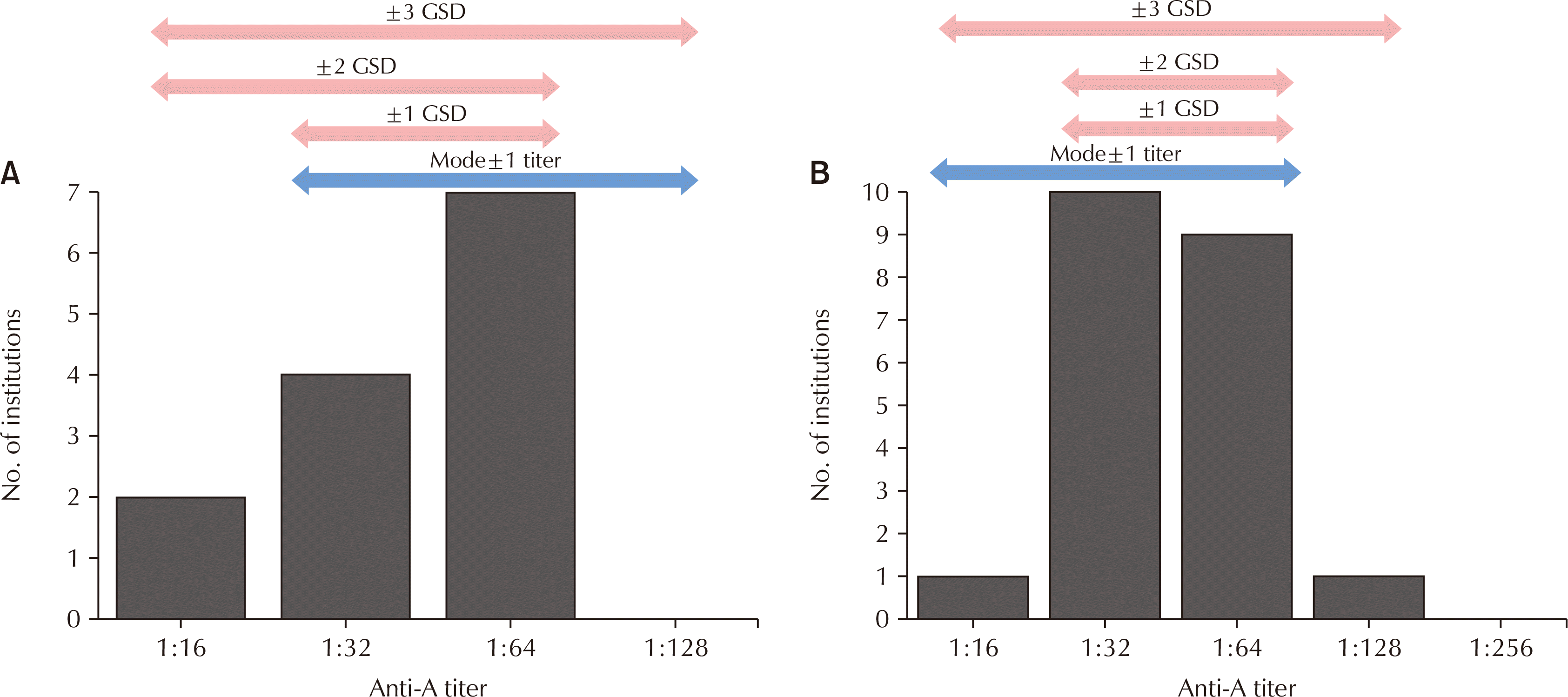
Table 1
Summary of 10 proficiency testing programs on anti-blood group antibody testing of the test methods utilized
|
Tests |
Methods |
Proficiency testing |
|
|
2016 1st |
2016 2nd |
2017 1st |
2017 2nd |
2018 1st |
2018 2nd |
2019 1st |
2019 2nd |
2020 1st |
2020 2nd |
|
Anti-A titer |
Tube, AHG |
18 |
18 |
16 |
17 |
17 |
17 |
20 |
20 |
21 |
21 |
|
Tube, AHG and DTT |
6 |
5 |
5 |
5 |
5 |
4 |
5 |
5 |
5 |
5 |
|
Tube, RT |
15 |
17 |
16 |
17 |
19 |
20 |
21 |
20 |
22 |
25 |
|
Tube, IS |
41 |
42 |
42 |
42 |
41 |
37 |
39 |
38 |
38 |
35 |
|
CAT, AHG |
21 |
24 |
25 |
25 |
27 |
28 |
30 |
32 |
33 |
35 |
|
CAT, AHG and DTT |
4 |
5 |
6 |
6 |
5 |
4 |
4 |
4 |
5 |
5 |
|
CAT, RT |
7 |
7 |
12 |
13 |
12 |
12 |
13 |
16 |
15 |
15 |
|
Others |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
Total |
114 |
120 |
123 |
126 |
127 |
123 |
133 |
136 |
140 |
142 |
|
Anti-B titer |
Tube, AHG |
18 |
18 |
16 |
17 |
17 |
17 |
20 |
20 |
21 |
21 |
|
Tube, AHG and DTT |
6 |
5 |
5 |
5 |
5 |
4 |
5 |
5 |
5 |
5 |
|
Tube, RT |
15 |
17 |
16 |
17 |
19 |
20 |
21 |
20 |
22 |
25 |
|
Tube, IS |
41 |
42 |
42 |
42 |
41 |
37 |
39 |
38 |
38 |
35 |
|
CAT, AHG |
21 |
24 |
25 |
25 |
27 |
28 |
30 |
32 |
33 |
35 |
|
CAT, AHG and DTT |
4 |
5 |
6 |
6 |
5 |
4 |
4 |
4 |
5 |
5 |
|
CAT, RT |
7 |
7 |
12 |
13 |
12 |
12 |
13 |
16 |
15 |
15 |
|
Others |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
|
Total |
114 |
120 |
123 |
126 |
127 |
123 |
133 |
136 |
140 |
142 |
Table 2
Comparison of mode and geometric mean criteria for anti-A
|
Year |
Round |
Methods |
No. |
Acceptable (%) |
|
|
Mode±1 titer |
GM±1 GSD |
GM±2 GSD |
GM±3 GSD |
|
2016 |
1st |
Tube, IS |
41 |
34 (82.9) |
34 (82.9) |
39 (95.1) |
40 (97.6)
|
|
2016 |
2nd |
Tube, IS |
42 |
36 (85.7) |
28 (66.7)
|
39 (92.9) |
42 (100.0)
|
|
2017 |
1st |
Tube, IS |
42 |
40 (95.2) |
22 (52.4)
|
40 (95.2) |
42 (100.0) |
|
2017 |
2nd |
Tube, IS |
42 |
37 (88.1) |
34 (81.0) |
40 (95.2) |
42 (100.0) |
|
2018 |
1st |
Tube, IS |
41 |
40 (97.6) |
40 (97.6) |
40 (97.6) |
41 (100.0) |
|
2018 |
2nd |
Tube, IS |
37 |
35 (94.6) |
34 (91.9) |
35 (94.6) |
36 (97.3) |
|
2019 |
1st |
CAT, AHG |
30 |
30 (100.0) |
16 (53.3)
|
28 (93.3) |
30 (100) |
|
2019 |
1st |
Tube, IS |
39 |
35 (89.7) |
29 (74.4)
|
38 (97.4) |
38 (97.4) |
|
2019 |
2nd |
CAT, AHG |
32 |
32 (100.0) |
15 (46.9)
|
32 (100.0) |
32 (100.0) |
|
2019 |
2nd |
Tube, IS |
38 |
34 (89.5) |
27 (71.1)
|
34 (89.5) |
38 (100.0) |
|
2020 |
1st |
Tube, IS |
38 |
37 (97.4) |
35 (92.1) |
35 (92.1) |
38 (100.0) |
|
2020 |
2nd |
CAT, AHG |
35 |
35 (100.0) |
24 (68.6)
|
35 (100.0) |
35 (100.0) |
|
2020 |
2nd |
Tube, IS |
35 |
33 (94.3) |
31 (88.6) |
31 (88.6) |
35 (100.0) |
Table 3
Comparison of mode and geometric mean criteria for anti-B
|
Year |
Round |
Methods |
No. |
Acceptable (%) |
|
|
Mode±1 titer |
GM±1 GSD |
GM±2 GSD |
GM±3 GSD |
|
2016 |
1st |
Tube, IS |
41 |
34 (82.9) |
30 (73.2) |
39 (95.1) |
40 (97.6)
|
|
2016 |
2nd |
Tube, IS |
42 |
34 (81.0) |
26 (61.9)
|
40 (95.2)
|
42 (100.0)
|
|
2017 |
1st |
Tube, IS |
42 |
41 (97.6) |
24 (57.1)
|
41 (97.6) |
42 (100.0) |
|
2017 |
2nd |
Tube, IS |
42 |
32 (76.2) |
29 (69.0) |
39 (92.9)
|
41 (97.6)
|
|
2018 |
1st |
Tube, IS |
41 |
40 (97.6) |
34 (82.9)
|
40 (97.6) |
41 (100.0) |
|
2018 |
2nd |
Tube, IS |
37 |
36 (97.3) |
22 (59.5)
|
36 (97.3) |
37 (100.0) |
|
2019 |
1st |
CAT AHG |
30 |
29 (96.7) |
24 (80.0) |
30 (100.0) |
30 (100.0) |
|
2019 |
1st |
Tube, IS |
39 |
33 (84.6) |
33 (84.6) |
37 (94.9) |
38 (97.4) |
|
2019 |
2nd |
CAT AHG |
32 |
31 (96.9) |
29 (90.6) |
29 (90.6) |
32 (100.0) |
|
2019 |
2nd |
Tube, IS |
38 |
35 (92.1) |
17 (44.7)
|
35 (92.1) |
38 (100.0) |
|
2020 |
1st |
CAT AHG |
33 |
33 (100.0) |
17 (51.5)
|
33 (100.0) |
33 (100.0) |
|
2020 |
1st |
Tube, IS |
38 |
37 (97.4) |
22 (57.9)
|
37 (97.4) |
38 (100.0) |
|
2020 |
2nd |
CAT AHG |
35 |
34 (97.1) |
18 (51.4)
|
34 (97.1) |
35 (100.0) |
|
2020 |
2nd |
Tube, IS |
35 |
34 (97.1) |
17 (48.6)
|
34 (97.1) |
35 (100.0) |