Abstract
Background
In this study, after reporting the urine sediment, the clinical utility of the results was analyzed to broaden the clinical usefulness of urine sediment.
Methods
This study included 114 patients with renal impairment who tested positive for pathological urine sediment at the Catholic Medical Center in Daegu from January 2020 to November 2020. Urine test strips and urine sediment tests were performed, and the estimated glomerular filtration rate (eGFR), blood urea nitrogen, and creatinine were measured. The patient’s clinical diagnosis was confirmed by examining medical records, and the clinical usefulness of the pathological urine sediment was analyzed.
Results
Albumin, red blood cells (RBCs), RBC cast, and broad cast showed a positive rate of 92% or more on urinalysis. In patients with a normal eGFR, albumin, RBC cast, RBC, and broad cast showed a positive rate of 8.8% or more. Broad cast, albumin, RBC cast, and ketone levels were significantly correlated with eGFR. A total of 72.6% of broad casts were found in patients with acute renal disease. The eGFR decreased in 27.8% of the 18 patients with acute kidney injury, and abnormal findings in these patients’ the urine stick and sediment preceded the eGFR results.
Conclusions
The microscopic urine sediment test showed better results than the urine stick test for detecting leukocytes, and 9.6% of patients with normal eGFR were found to be positive. Because urine sediment tests can detect various pathological sediments, it is necessary to activate the urine sediment test.
요침사물에 대한 정확한 판정과 보고는 신장질환을 진단하는 데 매우 유용한 검사법이다[1-3]. 하지만 요침사물에 대한 판정이 이미지 분석장비에 의존하거나 적혈구 및 백혈구에 제한되는 경향이 있다.
2019년도 정도관리 신빙도조사에서 광폭원주에 대한 정답률이 0.4%에 불과하였고, 초자원주로 보고한 기관이 67.8%였다[4]. 이는 병적 침사물을 정상 침사물로 보고한 예로, 각 기관에서 침사물 판정이 제대로 이루어지지 않음을 시사하였다.
또한 신세뇨관 상피세포와 이행 상피세포에 대한 구별이 용이하지 않아, 매년 신빙도조사의 정답률이 60%에 불과하였다[4-6]. 병적 원주나 신세뇨관 상피세포는 신세뇨관 손상을 시사하며, 신장 손상을 막기 위한 응급치료가 필요한 소견이다[1].
요침사물에 대한 정확한 판독을 위해서는 숙련된 임상병리사가 필요하지만, 대부분의 기관에서 요침사물에 대한 경험이 부족한 병리사가 근무하는 경우가 많다. 이는 요경검 분야의 검사결과에 대해 그 임상적 중요성을 간과하는 경향이 있기 때문이다. Tsai 등[7]의 연구에 의하면, 신장학 전문의에 의한 요침사 판독이 병리사에 의한 판독보다 더 정확하다고 보고하였다. 신세뇨관 상피세포, 과립원주, 신세뇨관 상피세포원주 및 이형성 적혈구 등을 신장전문의가 더 잘 판정한다고 하였다. 이는 요침사 판독을 위하여 임상검사실에서 좀 더 많은 관심과 노력을 기울여야 함을 시사하고 있다.
본 연구에서는 보고된 요침사물에 대한 임상적 활용성을 분석하여, 요침사물에 대한 임상적 유용성을 넓히고자 한다. 또한 요침사물에 대한 임상적 중요성을 부각시켜, 요침사물 판정의 동기를 부여하고자 한다.
2020년 1월부터 2020년 11월까지 대구가톨릭의료원에서 병적 요침사 소견이 양성인 신손상 환자 114명을 대상으로 본 연구를 시행하였다. 기 보고된 병적 요침사 소견 88예와, 새롭게 보고되는 병적 요침사 소견 26예에 대한 임상적 활용성을 분석하였다. 기 보고된 병적 요침사 소견 88예의 전산자료를 분석하여, 병적 요침사 소견, blood urea nitrogen (BUN), creatinine 및 estimated glomerular filtration rate (eGFR) 결과를 확인하였다. 의무기록에 의한 진단명을 활용하여 병적 요침사의 임상적 유용성을 분석하였다. 신규 증례인 eGFR 70 mL/min 이상의 급성 신질환자는 병적 요침사 검출 시 주치의에게 보고하여 경과 관찰을 권유하였다. 급성 신손상은 48시간 내에 혈청 creatinine이 0.3 mg/dL 이상 증가하는 경우이며, 혈청 creatinine 1.0 mg/dL에서 1.3 mg/dL으로 변화 시 Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) 수식으로 30 mL/min이 감소한다[8]. 따라서 저자는 eGFR 70 mL/min을 급성 신손상의 기준으로 임의 정의하였다. 신규 증례 26명 중 18명에서 경과 관찰이 진행되었고, 나머지 8명은 퇴원 등으로 경과 관찰이 이루어지지 않았다.
병적 요침사 소견은 적혈구원주, 백혈구원주, 세포원주, 과립원주, 광폭원주 및 납양원주 등 병적 원주가 관찰되는 경우로 정의하였다. 병적 원주 중 광폭원주는 정상원주의 지름(9–15 μm)보다 2배 이상 큰 경우이며[9], 세포 및 과립원주를 포함하였다[10]. 요시험지봉검사는 영동사의 URiScan Super plus (YD Diagnostics, Yongin, Korea)를 사용하였고, 요침사검사는 Olympus 현미경을 이용하여 숙련된 병리사 1명이 판정하였다. 혈액 신장기능검사는 로슈사의 cobas c702 (Roche Diagnostics, Mannheim, Germany)를 사용하였고, eGFR은 creatinine 기반의 체표면 비보정 CKD-EPI 방법으로 산출하였다.
통계분석은 IBM SPSS ver. 19.0 (IBM Corp., Armonk, NY, USA)를 이용하였으며, 소변 시험지봉검사와 침사검사 간의 적혈구 및 백혈구 비교는 χ2 검정을 사용하였고, eGFR과 요검사 소견과의 상관성의 Spearman’s rank 상관분석을 시행하였다.
본 연구는 대구가톨릭대학교 병원 생명윤리위원회의 연구 승인을 받았다(CR-20-151-L).
대상 환자들의 성별, 나이, 임상진단은 Table 1에 요약하였다. 환자들의 평균 나이는 68.6세로 비교적 고령에 속하였다. 신장질환이 있는 환자들은 60예였고 신장 이외의 질환자들은 54예였다. 신장질환 중 33예(28.9%)는 만성 신질환자였고, 27예의 신장질환 및 신장 이외 질환 54예(71.1%)는 급성 신손상 환자였다.
신장 손상 환자들의 요시험지봉, 요침사 및 신장기능검사의 양성률은 Table 2에 요약하였다. 모든 요시험지봉검사 항목에서 1+ 이상의 결과를 양성으로 판정하였다. 요시험지봉검사에서 albumin 100%, 적혈구 93%의 양성률을 각각 나타내었다. 요침사검사에서는 적혈구원주, 적혈구, 광폭원주, 이행상피 등이 각각 99.1%, 98.2%, 93.0%, 92.1%의 양성률을 나타내었다. Fig. 1은 광폭원주로 보고된 다양한 원주를 나타내었다. 요시험지봉검사에 의한 적혈구 및 백혈구보다 현미경검사에 의한 적혈구 및 백혈구가 더 높은 양성률을 나타내었으며, 백혈구의 양성률 차이는 통계적으로 유의하였다(P<0.05).
eGFR이 90 mL/min 이상인 환자에서 albumin, 적혈구원주, 적혈구(검경) 및 이행상피세포는 9.6%의 양성률을 나타내었고, 적혈구 및 광폭원주는 8.8%의 양성률을 나타내었다.
eGFR과 요시험지봉 및 요침사검사 항목의 상관관계는 Table 3에 요약하였다. 요시험지봉 및 요침사검사는 1+, 2+, 3+ 등 반정량법으로 표기하였고 정량값으로 표기된 eGFR 결과와 Spearman 상관관계를 구하였다. 광폭원주, albumin, 적혈구원주 및 ketone에서 각각 –0.362, –0.355, –0.244 및 0.21의 통계적으로 유의한 상관관계를 보였다.
광폭원주가 eGFR과 가장 밀접한 상관관계를 보임에 따라 광폭원주의 임상적 유용성을 분석하였다(Table 4). 환자들의 임상진단을 분석한 결과 만성 신질환자는 27.4%였다. 나머지 72.6%는 급성 신질환에 해당하는 환자였다.
eGFR이 70 mL/min 이상인 환자에서 관찰된 요시험지봉 및 요침사 양성 소견의 임상적 의미를 확인하기 위하여, 26명을 대상으로 eGFR 경과 관찰을 시행하였다. 이 중 8명은 퇴원 등으로 경과 관찰을 시행하지 못하였고 나머지 18명에 대하여 경과 관찰이 시행되었다(Table 5). 18명 중 5명(27.8%)의 환자에서 eGFR이 감소 소견을 보였고, eGFR이 90 mL/min 이상인 6명 중 3명에서 eGFR이 감소하였다.
요침사물의 임상적 활용에 대한 전반적인 연구는 거의 보고되지 않았다. 자동 요침사장비로 판정되는 요침사에 대한 비교 연구는 보고되고 있으나[11-14], 요침사물에 대한 임상적 유용성 연구는 특정 침사물에 대해 부분적으로 보고되었다[1,2,15]. 신장기능에 대한 평가는 BUN, creatinine, eGFR 등 주로 혈액화학 소견으로 이루어지고 있다. 요침사 소견은 임상진단 시 활용도가 낮은데, 이는 객관적이고 신뢰성 있는 결과보고 미흡이 원인이 될 수 있다. 현재 요침사 판정은 현미경 검경 이외 자동화 장비로 많이 이루어져, 객관적이고 정량화된 보고가 가능하다[13,14]. 하지만 현미경 검경에 비하여 자동화 장비는 결과의 정확성이 떨어지므로 현미경 검경은 신장 손상의 조기 검출에 매우 중요한 진단법이다[15,16]. 본 연구는 현미경 요침사 검경에 대한 신손상 조기 검출 유용성을 확인하고, 요침사 소견에 대한 임상적 활용을 넓히고자 시행되었다.
신손상 환자들에서 albumin, 적혈구원주, 적혈구(검경), 적혈구, 광폭원주 등이 90% 이상의 양성율을 나타내었다. Albumin을 제외하면 현미경 검경에 의한 병적소견이 요시험지봉검사 결과보다 민감하므로 현미경 검경의 중요성을 시사하였다. 또한 eGFR에 비하여 요시험지봉 및 검경검사의 민감도가 높아, 신손상의 조기 검출에 요검사의 중요성을 나타내었다.
신손상 표지자로 널리 사용되고 있는 eGFR과 요검사 항목의 상관성 분석에서 광폭원주, albumin, RBC 원주 등이 높은 상관성을 보였다. Albumin은 사구체가 손상되면 소변에 양성으로 나타나므로, eGFR과 밀접한 상관을 보일 것이다. RBC 원주도 사구체 손상 시 소변에서 양성으로 나올 수 있다. 하지만 만성 신장질환 표지자로 알려진 광폭원주가 가장 높은 상관성을 보여 의외의 결과를 보였다. 광폭원주는 원위 집적관의 확장에 의해서 주로 생성되므로 만성신부전을 시사하는 것으로 알려졌다[10]. 전형적인 광폭원주는 과립원주에서 납양원주로의 이행과정에서 나타나며 지름은 20–50 μm이다[17]. 따라서 eGFR과 광폭원주의 상관성이 높게 나타난 것은 의외의 결과이지만 임상적으로는 매우 유용한 소견으로 간주된다.
광폭원주의 임상적 유용성을 확인하기 위하여 임상진단을 분석하였다. 급성 신질환자가 72.6%에 해당하여 만성 신질환의 표지자로만 활용될 수 없었다. Kinn과 Bohman [18]은 토끼를 대상으로 한 요관폐쇄에 의한 신장 손상 실험에서 신장의 손상 순서를 다음과 같이 보고하였다. 신장실질의 부종, 근위세뇨관 위축, 원위세뇨관 확장이 먼저 일어난 뒤, 신장실질의 섬유화, 근위세뇨관 광범위 위축, 집적관의 확장이 발생하였다. Forbes 등[19]은 생쥐를 대상으로 요관폐쇄 후 집적관의 확장이 7일 지나 발생하다고 보고하였다. Ottosen 등[20]은 쥐를 대상으로 리튬 함유 식이에 의한 신손상을 유도하였으며 집적관의 부피 증가가 일주일 후 발생하여, Forbes 등[19]과 유사한 결과를 보였다. 따라서 집적관 확장이 신장의 만성손상에 의해 발생하지만 예상보다 빨리 소변에 광폭원주가 나타날 수 있음을 시사하였다. 또한 본 연구에서는 광폭원주를 정상원주보다 지름이 2배 이상이며 세포 및 과립원주를 포함하여 다소 많이 보고될 수 있었다. 만성 신부전을 시사하는 광폭원주가 본 연구에서는 급성 신질환에 해당하는 환자에서 많이 관찰되어 임상적 의미에 대한 재조명이 필요하였다.
병적 요침사의 임상적 유용성을 확인하기 위해서 급성 신질환자를 대상으로 하였다. 만성 신질환자인 경우 eGFR의 변화가 심하지 않아, 임상적 유용성을 확인하기 어려울 것으로 간주되었다. 급성 신손상 환자 26명을 경과 관찰하여, eGFR 70 mL/min 이상18명 중 5명, eGFR 90 mL/min 이상 6명 중 3명에서 eGFR이 감소하였다. 이는 요시험지봉 및 요침사검사의 비정상 소견이 eGFR 결과가 정상인 사람에서 나타나지만, 비정상 eGFR 결과에 선행하여 나타날 수 있음을 시사하였다. 특히 요침사검사는 신장 생검보다는 민감도와 특이도가 높지 않지만 신장의 변화를 반영하는 가장 우수한 비침습적 검사이다[1,21]. 따라서 자동화에 의한 요침사 분석보다는 경험자에 의한 현미경 검경이 요구된다. 정확한 판독을 위하여 요침사 검경 전문 병리사 양성이 필요하며, 또한 현미경 검경에 의한 요침사검사의 적절한 보험수가가 보장되어야 할 것이다.
본 연구는 요침사가 양성인 환자의 의무기록으로 분석한 결과이다. 그러므로 진단명이 현시점과 완전하게 일치한다고는 볼 수 없다. 이를 보완하기 위하여 전향적 관찰을 진행하였으며 후향적 연구와 유사한 결과를 관찰하였다.
요침사검사는 백혈구 검출에 요시험지봉검사보다 민감하고, eGFR이 정상인 환자의 9.6%에서 양성으로 나타났다. 요침사검사에서 다양한 병적 침사물을 검출할 수 있으므로 현미경 검경에 의한 요침사검사의 활성화가 필요한 실정이다.
References
1. Perazella MA, Coca SG, Kanbay M, Brewster UC, Parikh CR. 2008; Diagnostic value of urine microscopy for differential diagnosis of acute kidney injury in hospitalized patients. Clin J Am Soc Nephrol. 3:1615–9. DOI: 10.2215/CJN.02860608. PMID: 18784207. PMCID: PMC2572284.

2. Fogazzi GB, Garigali G. 2003; The clinical art and science of urine microscopy. Curr Opin Nephrol Hypertens. 12:625–32. DOI: 10.1097/00041552-200311000-00009. PMID: 14564200.

3. Magiorkinis E, Diamantis A. 2015; The fascinating story of urine examination: from uroscopy to the era of microscopy and beyond. Diagn Cytopathol. 43:1020–36. DOI: 10.1002/dc.23370. PMID: 26392002.

4. Jeon CH, Kim SG, Bae YC. 2020; Annual report of the Korean Association of External Quality Assessment Service on urinalysis and fecal occult blood testing (2019). Lab Med Qual Assur. 42:157–65. DOI: 10.15263/jlmqa.2020.42.4.157.

5. Jeon CH, Lee AJ, Kim SG, Suh HS, Bae YC. 2019; Annual report of the Korean Association of External Quality Assessment Service on urinalysis and fecal occult blood testing (2018). J Lab Med Qual Assur. 41:75–81. DOI: 10.15263/jlmqa.2019.41.2.75.

6. Jeon CH, Lee AJ, Kim SG, Suh HS, Bae YC. 2018; Annual report on the external quality assessment scheme for urinalysis and fecal occult blood testing in Korea (2017). J Lab Med Qual Assur. 40:128–35. DOI: 10.15263/jlmqa.2018.40.3.128.

7. Tsai JJ, Yeun JY, Kumar VA, Don BR. 2005; Comparison and interpretation of urinalysis performed by a nephrologist versus a hospital-based clinical laboratory. Am J Kidney Dis. 46:820–9. DOI: 10.1053/j.ajkd.2005.07.039. PMID: 16253721.

8. Molitoris BA, Reilly ES. 2016; Quantifying glomerular filtration rates in acute kidney injury: a requirement for translational success. Semin Nephrol. 36:31–41. DOI: 10.1016/j.semnephrol.2016.01.008. PMID: 27085733. PMCID: PMC4834456.

9. Caleffi A, Lippi G. 2015; Cylindruria. Clin Chem Lab Med. 53 Suppl 2:s1471–7. DOI: 10.1515/cclm-2015-0480. PMID: 26079824.

10. Riley RS, McPherson RA. McPherson RA, Riley RS, editors. 2017. Basic examination of urine. Henry's clinical diagnosis and management by laboratory methods. 23rd ed. Elsevier;St. Louis (MO): p. 466–8. DOI: 10.1016/b978-1-4377-0974-2.00028-2.
11. Zaman Z. 2015; Automated urine screening devices make urine sediment microscopy in diagnostic laboratories economically viable. Clin Chem Lab Med. 53 Suppl 2:s1509–11. DOI: 10.1515/cclm-2015-0476. PMID: 26057217.

12. Li Q, Xu J, Tang Y, Wen X, Guo P, Song Z, et al. 2019; Evaluation of the Sysmex UF-5000 automated urinalysis analyzer. J Biol Regul Homeost Agents. 33:1863–9. DOI: 10.23812/18-159-L. PMID: 31916424.
13. Cobbaert CM, Arslan F, Caballe Martin I, Serra AA, Pico-Plana E, Sanchez-Margalet V, et al. 2019; Automated urinalysis combining physicochemical analysis, on-board centrifugation, and digital imaging in one system: a multicenter performance evaluation of the cobas 6500 urine work area. Pract Lab Med. 17:e00139. DOI: 10.1016/j.plabm.2019.e00139. PMID: 31649991. PMCID: PMC6804654.

14. Becker GJ, Garigali G, Fogazzi GB. 2016; Advances in urine microscopy. Am J Kidney Dis. 67:954–64. DOI: 10.1053/j.ajkd.2015.11.011. PMID: 26806004.

15. Shukuya K, Ogura S, Tokuhara Y, Okubo S, Yatomi Y, Tozuka M, et al. 2016; Novel round cells in urine sediment and their clinical implications. Clin Chim Acta. 457:142–9. DOI: 10.1016/j.cca.2016.04.017. PMID: 27101813.

16. Perazella MA, Coca SG, Hall IE, Iyanam U, Koraishy M, Parikh CR. 2010; Urine microscopy is associated with severity and worsening of acute kidney injury in hospitalized patients. Clin J Am Soc Nephrol. 5:402–8. DOI: 10.2215/CJN.06960909. PMID: 20089493. PMCID: PMC2827582.

17. Akilesh S. McManus LM, Mitchell RN, editors. 2014. Normal kidney function and structure. Pathobiology of human disease: a dynamic encyclopedia of disease mechanisms. Academic Press;Amsterdam: p. 2716–33. DOI: 10.1016/B978-0-12-386456-7.05402-2.

18. Kinn AC, Bohman SO. 1983; Renal structural and functional changes after unilateral ureteral obstruction in rabbits. Scand J Urol Nephrol. 17:223–34. DOI: 10.3109/00365598309180173. PMID: 6612242.

19. Forbes MS, Thornhill BA, Minor JJ, Gordon KA, Galarreta CI, Chevalier RL. 2012; Fight-or-flight: murine unilateral ureteral obstruction causes extensive proximal tubular degeneration, collecting duct dilatation, and minimal fibrosis. Am J Physiol Renal Physiol. 303:F120–9. DOI: 10.1152/ajprenal.00110.2012. PMID: 22535799. PMCID: PMC3431140.

20. Ottosen PD, Nyengard JR, Jacobsen NO, Christensen S. 1987; A morphometric and ultrastructural study of lithium-induced changes in the medullary collecting ducts of the rat kidney. Cell Tissue Res. 249:311–5. DOI: 10.1007/BF00215513. PMID: 3040254.

21. Shukuya K. 2014; How far we can diagnose by urine sediment tests? Rinsho Byori. 62:1098–101. PMID: 27509728.
Fig. 1
Light microscopic examination of various broad casts (all 400×). (A) Typical broad cast. (B) Bilirubin-stained broad cast. (C) Cellular cast. (D) Renal tubular cast.
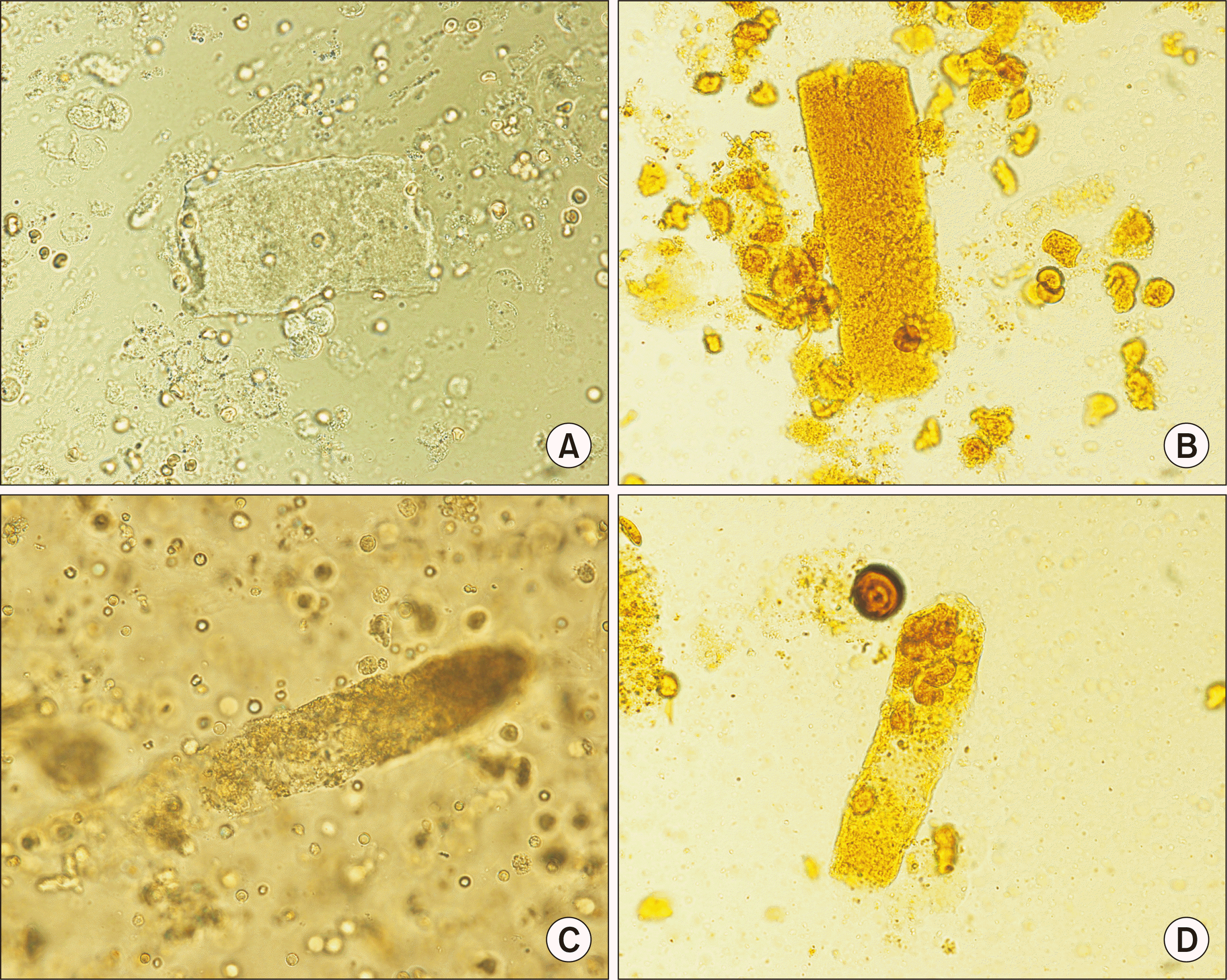
Table 1
Demographic data and diagnosis of the patients
Table 2
Positive rates of urinalysis and blood chemistry (N=114)
| Group | Tests | Positive | Positive with >90 mL/min of eGFR |
|---|---|---|---|
| Urine stick | Albumin | 114 (100.0) | 11 (9.6) |
| Blood | 106 (93.0) | 10 (8.8) | |
| Leukocyte | 56 (49.1) | 4 (3.5) | |
| Bilirubin | 28 (24.6) | 4 (3.5) | |
| Glucose | 20 (17.5) | 1 (0.9) | |
| Urobilinogen | 18 (15.8) | 2 (1.8) | |
| Nitrite | 12 (10.5) | 1 (0.9) | |
| Ketone | 11 (9.6) | 2 (1.8) | |
| Urine microscopy | RBC cast | 113 (99.1) | 11 (9.6) |
| RBC | 112 (98.2) | 11 (9.6) | |
| Broad cast | 106 (93.0) | 10 (8.8) | |
| Transitional epithelial cell | 105 (92.1) | 11 (9.6) | |
| Granular cast | 95 (83.3) | 8 (7.0) | |
| Renal tubular epithelial cell | 78 (68.4) | 8 (7.0) | |
| WBC | 71 (62.3)* | 8 (7.0) | |
| Epithelial cast | 67 (58.8) | 5 (4.4) | |
| Cellular cast | 49 (43.0) | 3 (2.6) | |
| Waxy cast | 16 (14.0) | 0 | |
| WBC cast | 3 (2.6) | 0 | |
| Blood chemistry | eGFR | 103 (90.4) | 30.6±24.6 |
| Creatinine | 70 (69.3) | 3.6±3.0 | |
| Blood urea nitrogen | 69 (63.9) | 48.8±33.2 |
Table 3
Spearman’s coefficient between estimated glomerular filtration rate and urine parameters
Table 4
Diagnosis of patients with positive broad cast
| Diagnosis | No. (%) |
|---|---|
| Chronic kidney disease | 29 (27.4) |
| Acute renal failure | 8 (7.5) |
| Urinary tract infection* | 7 (6.6) |
| Acute pyelonephritis | 7 (6.6) |
| Benign prostatic hyperplasia† | 2 (1.9) |
| Renal infarction | 1 (0.9) |
| Renal transplant | 1 (0.9) |
| Extrarenal infection | 23 (21.7) |
| Other extrarenal diseases | 28 (26.4) |
| Total number | 106 |
Table 5
Follow-up eGFR for the patients with >70 mL/min of eGFR and abnormal urinalysis
Abbreviations: eGFR, estimated glomerular filtration rate; RBC, red blood cell; FU, follow-up; CSF, cerebrospinal fluid; BPH, benign prostate hypertrophy; CML, chronic myelogenous leukemia; DKA, diabetic ketoacidosis; APN, acute pyelonephritis; NT, not tested; DM, diabetes mellitus; LPF, low-power field.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download