초록
Coniochaeta hoffmannii는 이전에 Lecythophora hoffmannii로 명명되었던 균종이며, 토양에 주로 서식하는 Sordariomycete 과에 속한다. Coniochaeta 종은 매우 드문 기회감염 균으로 피하감염, 각막염, 부비동염과 관련한 인체감염이 보고되었다. 이중 C. hoffmannii에 의한 인체감염은 단 3예만 보고되어 있다. 자궁내막암 치료를 위해 입원한 61세 여성이 39.2°C 발열 증상을 호소했다. 흉부 컴퓨터 단층 촬영 결과 양측 폐에서 불규칙한 결절이 관찰되어 전이보다는 감염성 색전증 또는 진균감염이 의심되는 소견이었다. 중심정맥관 혈액 배양에서는 Clostridium baratti와 C. hoffmannii가 검출되었다. 환자는 ceftriaxone을 이틀간 투약 후 중심정맥관을 제거한 뒤 약제 변경하여 piperacillin/taxobactam을 6일간 투약하였다. Ceftriaxone 투약 다음날부터 발열증상이 호전되었고 중심정맥관 말단부 배양 검사에서는 음성 소견이었다. 두 달 뒤 추적 흉부 CT 검사에서 육아종이 의심되는 양성 결절이 큰 변화 없이 지속되는 양상을 보였으며 양측 폐에서 크기가 줄거나 새로 발생하는 결절이 관찰되어 염증성 병변의 가능성을 시사하였다. 이 증례는 C. hoffmannii에 의한 진균혈증의 국내 첫 보고이며, 드문 균사형 진균이지만 면역저하환자에서 중심정맥관 관련 혈류감염을 일으킬 수 있음을 보고하는 바이다.
Abstract
Coniochaeta hoffmannii (formerly, Lecythophora hoffmannii) is a soil-inhabiting plant pathogen in the class of Sordariomycetes. Coniochaeta species are rare and opportunistic and cause subcutaneous infections, keratitis, sinusitis, and peritonitis. Only three cases of human infection by C. hoffmannii have been reported worldwide. A 61-year-old woman with advanced endometrioid adenocarcinoma developed a fever of 39.2°C. Her chest computed tomography (CT) revealed multiple irregular nodules in both lungs, suggesting septic embolism, fungal infection, or less likely, metastasis. Blood cultures performed using a set of blood samples drawn from the central venous catheter showed the presence of Clostridium baratii and C. hoffmannii. Ceftriaxone was administered for 2 days and piperacillin-tazobactam was administered for 6 days after removing the central line. Her fever subsided the next day after febrile onset. Cultures obtained from the central line tip showed no growth. The follow-up CT performed two months later revealed variable changes in the size of the previous nodules and multiple new nodules accompanying the inflammatory lesions. The central venous catheter or pulmonary fungal infections are the suspected source of this rare case of fungemia; this represents the first reported case of C. hoffmannii fungemia.
Coniochaeta 속은 격벽에 색소가 없으며 이전에 Lecythophora 속으로 명명되었던 균종으로 초자양사상균에 속하며[1], 주로 나무, 물, 토양 그리고 음식에 광범위하게 분포하는 Sordariomycetes 과이다[2]. 이 중 Coniochaeta hoffmannii와 Coniochaeta mutabilis에 의한 인체감염이 드물게 보고되어 있다[3-15]. C. mutabilis는 mitochondrial encephalomyopathy 환자에서 균혈증 1예와 당뇨 환자에서 인공판막의 감염성 심내막염 등 기저질환자에서 드물게 심각한 전신감염을 일으킨 사례가 있다[4, 6, 12, 13] (Table 1). 진균혈증은 광범위한 항생제의 사용, 침습적인 시술의 증가와 기저질환으로 인한 장기적인 스테로이드 혹은 항암치료에 따른 면역저하 환자의 증가에 따라 발생률이 증가하고 있다[16]. 진균혈증의 사망률은 50–80%로 상당히 높기 때문에 빠른 진단과 적절한 항진균성 치료를 위해 원인균을 정확히 동정하여 보고하는 것이 중요하다 할 수 있겠다[16]. 저자들은 국내에서 드문 Coniochaeta hoffmannii에 의한 진균혈증 사례를 경험하였기에 문헌 고찰과 함께 보고하고자 한다.
자궁 내막 선암종으로 전자궁절제술 후 6년간 항암치료 중인 61세 여성환자가 복강 내 전이가 발견되어 새로운 항암치료를 시작하고자 입원하였다. 입원 시 체온은 36.7°C, 맥박수는 98회/분, 혈압은 최고/최저 111/76 mmHg였고, 혈액검사상 백혈구 수치 6.8×103/μL (호중구 61%)이었다. 입원 후 다음날 저녁부터 39.2°C의 고열이 발생하여 혈액배양검사를 시행하였다. 당시 맥박수는 100회/분, 혈압은 107/72 mmHg, 백혈구 수치는 7.98×103/μL (호중구 85%)였으며, C-반응 단백(CRP)은 0.8 mg/dL로 약간 상승하였다. 흉부 컴퓨터 단층 촬영상에서는 양측 폐에 새롭게 발생한 다수의 불규칙한 결절이 관찰되어 감염성 색전증 또는 진균감염의 배제가 필요한 소견이었다(Fig. 1). 말초정맥에서 채취한 2쌍과 중심 정맥관에서 채취한 1쌍의 혈액 검체를 각각 BACTEC Plus Aerobic/F 병과 Lytic/10 Anaerobic/F (Becton, Dickinson and Company, Sparks, MD, USA) 병에 쌍으로 접종하여 BATEC FX 시스템(Becton, Dickinson and company)에서 배양하였다. 말초정맥에서 채취한 2쌍에서는 배양검사결과 음성이었다. 중심 정맥관에서 채취한 혈액배양의 혐기성 병에서만 10.3시간 후에 그람 양성 간균이 관찰되어 Bruker Biotyper Microflex LT (Bruker Daltonics, Bremen, Germany)를 사용하여 matrix-associated laser desorption ionization time of fight (MALDI-TOF) 질량분석으로 동정하였을 때 score 2.141로 Clostridium baratti가 검출되었고, 호기성병에서 80.7시간 만에 곰팡이 균사가 검출되었다. MALDI-TOF 질량분석으로 동정하였을 때 Lecythophora hoffmannii가 score 2.26으로 가장 높았으며, 다음으로는 Chaetomium globosum이 score 0.843이었다. 동정 결과를 확인하기 위해 18S rRNA 유전자의 ITS 1,2 그리고 D1/D2 부위에 대해 PCR 염기서열분석 동정을 시행하였다[17, 18]. ITS 부위 505 bp 염기서열을 BLAST database (http://www.ncbi.nlm.nih.gov/blast/)에서 검색한 결과 Coniochaeta hoffmannii CBS 245.38 (NR_167688.1)과 98.81% (499/505)의 일치도, 차순위인 Coniochaeta rosae TASM 6127 (NR_157509.1)과는 92.86% (468/504)의 일치도를 보였다. 28S rDNA 내의 D1/D2 부위 456 bp 염기서열을 BLAST database에서 검색한 결과는 Coniochaeta hoffmannii CBS 245.38과 99.78% (455/456)의 일치도를 보이고, Coniochaeta simbalensis NFCCI 4236과 97.81% (446/456)의 일치도를 보였다. MALDI-TOF 동정 결과 및 염기서열 분석 결과와 배양 집락의 육안 및 현미경학적 소견을 종합하여 C. hoffmannii로 최종 동정하였다. 해당 균주의 항진균제 감수성시험은 상품화된 Sensititre YeastOne YO10 (TREK Diagnostic System, East Grinstead, West Sussex, UK)을 이용하였다. 그 결과 5-flucytosine, anidulafungin, caspofungin, fluconazole, micafungin의 MIC는 각각 >64 μg/mL, 4 μg/mL, >8 μg/mL, 16 μg/mL, >8 μg/mL이었으며, amphotericin B, itraconazole, posaconazole, voriconazole의 MIC는 각각 ≤0.12 μg/mL, 0.25 μg/mL, 0.5 μg/mL, 0.5 μg/mL이었다.
검출된 곰팡이 균사를 호기성 병인 Sabouraud Dextrose agar (SDA)에서 계대 배양한 결과 2일째에는 효모양의 매우 작은 집락이 관찰되다가 4일째에는 2 mm 정도 흰색 집락에 흰색의 솜털 같은 균사가 덮이고, 주변 배지로 뻗어나가서 직경이 5–6 mm 정도 되는 집락으로 관찰되었다. 배양 7일부터 전면의 집락 말단부위에서 옅은 붉은 색이 관찰되었으며, 14일째에는 전면에서 계피 색깔의 직경 5 cm 정도의 성숙한 집락이 관찰되었다. 집락 표면은 깊게 주름지고 변연부에서 주변 배지로 빽빽하게 균사가 뻗어나가는 것을 볼 수 있었다(Fig. 2A-D). 현미경 동정을 위해 슬라이드 배양법을 실시하였으며, Potato dextrose agar를 이용하여 30°C에서 14일 슬라이드 배양하였다. 14일 배양 후 실시한 습윤 도말에서 격벽이 뚜렷한 초자양 균사가 대부분이고, 일부 연하게 색소가 있는 균사가 섞여 있었다. Periodic acid-Schiff (PAS) 염색을 시행하여 균사에서 직각으로 뻗는 소병자(phialide)에 기저부 격벽이 없고, 플라스크 모양으로 부풀어 있었으며, 상단에 하나 또는 여러 개의 타원형 분생자(conidia, 1.5–2.5×3.0–6.0 μm)가 달려있는 것을 확인하였다. 후막포자는 관찰되지 않았고, 떨어져 나간 분생자의 기저와 소병자의 상단은 분화구 모양의 떨어진 흔적이 있었다(Fig. 2).
환자는 6년 전 자궁내막암으로 항암치료를 시작한 뒤 3개월 째에도 C. albicans 안구내염이 발생하여 fluconazole을 8개월 투여한 병력이 있었다. 중심정맥관 관련 혈류감염을 의심하여 ceftriaxone으로 항균제 치료를 시작하였고, 다음날부터 체온은 37.3–37.6°C로 호전되었다. 입원 3일째 중심 정맥관을 제거하면서 3쌍의 혈액배양과 중심 정맥관 말단부 배양검사를 실시하였으나 이후 모두 음성으로 확인되었다. 입원 3일째 분리되어 보고한 Clostridium baratti 균혈증으로 판단하고 piperacillin/tazobactam으로 항균제를 변경하여 6일간 투약하였다. 진균감염의 가능성을 확인하기 위해 보조적으로 실시한 크립토코쿠스 항원 검사, (1-3)-β-D-glucan 검사 그리고 아스페르길루스 항체 검사 결과 모두 음성이었다. 입원 7일째부터 항암치료를 일정대로 진행했으며 CRP는 입원 4일, 7일, 10일째 추적검사에서 정상이었고, 말초혈액 호중구 수치도 정상이었다. 입원 10일째 진행한 흉부 컴퓨터 단층 촬영 검사상 기존 관찰되었던 다수의 결절의 크기가 줄거나 새로 발생하는 소견을 보였다. 입원 11일째 10일간의 경구용 amoxicillin/clavulanate 처방과 함께 퇴원하였다(Fig. 1). 두 달 뒤 항암 반응성 평가를 위해 진행한 흉부 컴퓨터 단층 촬영 검사에서는 육아종이 의심되는 양성 결절이 큰 변화없이 지속되는 양상을 보였으며 양측 폐에서 여전히 크기가 줄거나, 새로 발생하는 결절이 관찰되어 염증성 결절 소견으로 판단되었다.
이 증례의 C. hoffmannii는 국내에서 임상검체에서 분리된 첫 보고이며 중심정맥관을 유치한 환자의 혈액배양으로부터 분리되었고, 그 이외의 이차 감염부위는 발견되지 않아서 첫 카테터 관련 균혈증 사례이다. 식물의 병원균인 Coniochaeta는 드물게 인체 감염에 대해 보고되어 있으며 병원성에 대해 많이 알려져 있지 않다(Table 1). 분자생물학적으로 Coniochaeta 속에 속하는 균 종은 6가지가 있고[3] 이 중에 인체 감염의 사례가 보고된 것은 C. hoffmannii와 C. mutabilis가 있다. C. mutabilis에 의한 인체 감염은 안구질환과 심내막염에서 주로 보고된 바 있는데, C. mutabilis는 인공판막 수술 후 발생한 심내막염 환자의 판막의 증식물질에서 처음 분리된[12] 이후, 안내염[5, 15], 복막염[10] 그리고 mitochondrial encephalopathy 환자에서 패혈증[6]이 보고되었다. C. hoffmannii에 의한 인체감염은 C. mutabilis보다 드물어서 1982년에 둔부의 농양에서 첫 보고되었고[9], 유양돌기염 등의 원인이 되었던 증례보고가 있다[7]. 이 증례의 환자는 항암치료 중인 면역저하자이며, 중심정맥관을 가지고 있어서 중심정맥관 관련 혈류감염으로 의심되었다. 혈액배양 검사에서 중심정맥관을 통해 채취한 혈액 배양에서는 균이 분리되었으나 항생제 치료 후 진행한 중심정맥관 말단부 및 말초부위 혈액배양에서는 균이 관찰되지 않았다. 그러나 배양이 호기조건이라는 점과 2일째까지만 판독을 한다는 점에서 C. baratti나 C. hoffmannii 등 두 가지 원인 균종을 검출 할 수 있는 배양조건이 아니라서 도관에 집락화되어 있을 가능성을 배제할 수 없다. Clostridium species는 드물게 중심정맥관 관련 균혈증을 일으킨다[19]. C. baratti에 의한 중심정맥관 관련 균혈증은 1예만이 보고되어 있으나[20], 이에 의한 균혈증의 가능성을 배제할 수 없어 Clostridium species에 대한 치료를 진행하였다.
C. hoffmannii가 침입하는 데 중심정맥관이 통로가 되었을 가능성 이외에 진균의 특성상 호흡기를 통한 침입일 수도 있다. 이 환자는 양측 폐의 다발성 결절이 입원 중 추적한 흉부 CT 검사에서도 남아있고 일부 결절의 크기가 작아졌으나 새로 발생하는 것도 관찰되었다. 폐의 만성 염증성 결절이 감염성 병변인지 감별 진단하려면 조직검사나 항진균제 치료를 하는 것이 도움이 되지만, 이 증례에서는 실시하지 못했다. 기존의 광범위한 항생제 및 항진균제 사용에 의해 정상 세균총이 억제되거나 세균-진균 혼합에 의한 바이오 필름을 형성하여 진균에 의한 만성 폐 감염을 발생시킬 수 있다는 보고가 있다[21]. C. hoffmannii는 인체 병원성은 매우 낮지만, 최근 Coniochaeta 진균과 Norcardia가 함께 형성한 바이오필름에 의해 Candida 종의 성장을 억제한 증례가 보고된 바 있다[22]. Clostridium 속 또한 다양한 종과 혼합 바이오필름을 형성하여 호기성 환경에서 성장하였다는 연구가 보고된 바 있는데[23] 특히 본 증례에서 분리된 C. baratti의 경우 부착력이 강하여 바이오필름을 형성하는 데 유리한 조건을 갖추고 있다. 이러한 점들을 감안할 때, 이 환자에서는 C. baratti와 C. hoffmannii로 인한 세균-진균 혼합 바이오 필름이 중심 정맥관에 형성되었을 가능성을 생각해볼 수 있겠다. 특히 중심정맥관을 제거한 후 열이 떨어지고 더 이상 감염의 증후가 없었다는 점은 더욱 중심정맥관 관련 혈류감염을 시사한다. 이 증례에서 중심정맥관 제거 시 시행한 배양검사는 음성 소견을 보였는데, 이는 호기 배양 조건으로 2일째까지 배양하는 조건에서 해당 C. baratti나 C. hoffmannii 두 가지 원인 균종을 검출할 수 있는 배양조건이 아니었기 때문에 여전히 중심정맥관 내 집락 여부를 배제할 수 없을 것이라 사료되었다. 이 증례처럼 기저질환으로 인해 주기적으로 항암요법을 받는 면역억제 환자에서 장기간 중심정맥관을 유치하는 상태가 병원성이 떨어지는 진균에 의한 도관 내 집락을 형성하는 환경을 유도하여 혈류감염이 발생하는 위험요인이 될 수 있다[24].
Coniochaeta는 Fusarium 혹은 Acremonium spp.와 형태학적으로 감별이 어려워서 잘못 동정이 되기도 한다[3]. 슬라이드 배양법을 사용하여 형태학적으로 동정을 시도하여 초자양 균사와 소병자, 병원체의 분생자 등이 Coniochaeta species에 합당한 소견을 관찰하였지만, 현미경적 형태만으로 다른 hyaline hyphomyetes와 종 수준의 감별진단을 할 수는 없었다. 진균을 18S rRNA 염기서열 분석으로 동정하는 방법이 사용되면서 임상검사실에서 균사형 진균류에 대해 정확한 균종 동정이 가능하게 되었다[25]. 이 증례는 MALDI-TOF 질량분석과 염기서열분석 두 가지 방법 모두 C. hoffmannii로 동정할 수 있었다. 이 증례는 임상 검사실에서 흔하지 않은 진균 혈류 감염증의 진단에 있어서 MALDI-TOF를 통해 신속한 동정이 가능함을 보여준다.
이 증례에서 분리된 C. hoffmannii는 최소억제농도로 볼 때 echinocandin 계열에는 내성이고 amphotericin B와 azole 계열에는 감수성으로 판단되었다. 이전 연구에서 C. mutabilis와 C. hoffmannii의 항진균제 감수성 검사를 보고한 증례는 9건에 불과하다. 이중 ketoconazole은 4건의 증례 중 1예[8]에서는 내성을 나타내었으며, amphotericin B는 7예 중 4예[5, 8, 10, 14]에서 내성으로 보고되었다. Voriconazole은 검사를 진행한 4개의 증례에서 모두 감수성이라고 보고했다(Table 1). 이 증례에서 분리된 균 종은 azole 계열에 감수성으로 이전 보고들과 일치하는 소견이다. Coniochaeta 속에 의한 인체감염의 경우 azole계 약물을 단독 또는 병합하여 치료하지 않은 심내막염과 패혈성 쇼크 3예[6, 12, 13]는 사망하였다. 그 외 감염형태에서는 모두 호전되었으며 둔근의 농양은 외과적 배농술로 치료되었다.
이 증례는 항진균제 치료를 하지 않고 중심정맥관 제거 후 발열 증상이 호전되었다. 그러나 이후 진행한 추적 흉부 컴퓨터 단층 촬영 검사에서 육아종성 양성 결절이 지속되며, 양측 폐에서 기존의 결절은 크기와 숫자가 감소하는 반면 새로운 결절이 출현하였다. 이 결절들이 항진균제 감수성 검사결과를 바탕으로 azole계 항균제를 투여하여 반응한다면 C. hoffmannii에 의한 염증성 결절일 것이라는 추정 진단을 지지하는 소견이 될 것이다.
결론적으로 이 증례는 C. hoffmannii에 의한 인체감염의 국내 첫 보고이며 MALDI-TOF 질량분석으로 신속하게 C. hoffmannii가 원인균임을 동정할 수 있었다. 이 증례처럼 균사형 진균이 세균과 혼합 감염이 되는 경우 느리게 자라서 균사형 진균을 놓칠 수 있고, 세균-진균 바이오필름을 형성하여 항진균제 치료에 잘 반응하지 않을 수도 있다. 그러므로 MALDI-TOF 질량분석을 사용하여 원인균을 신속하고 정확하게 동정함으로써 적절한 치료를 실시하는 것이 예후를 향상시키는 데 기여할 수 있을 것이다.
REFERENCES
1. Khan Z, Gené J, Ahmad S, Cano J, Al-Sweih N, Joseph L, et al. 2013; Coniochaeta polymorpha, a new species from endotracheal aspirate of a preterm neonate, and transfer of Lecythophora species to Coniochaeta. Antonie Van Leeuwenhoek. 104:243–52. DOI: 10.1007/s10482-013-9943-z. PMID: 23748934.

2. Larone DH. 2002. Medically important fungi: a guide to identification. 4th ed. Washington, D.C.: ASM Press.
3. Perdomo H, Sutton DA, García D, Fothergill AW, Gené J, Cano J, et al. 2011; Molecular and phenotypic characterization of Phialemonium and Lecythophora isolates from clinical samples. J Clin Microbiol. 49:1209–16. DOI: 10.1128/JCM.01979-10. PMID: 21270235. PMCID: PMC3122869.

4. Drees M, Wickes BL, Gupta M, Hadley S. 2007; Lecythophora mutabilis prosthetic valve endocarditis in a diabetic patient. Med Mycol. 45:463–7. DOI: 10.1080/13693780701386007. PMID: 17654274.

5. Scott IU, Cruz-Villegas V, Flynn HW Jr, Miller D. 2004; Delayed-onset, bleb-associated endophthalmitis caused by Lecythophora mutabilis. Am J Ophthalmol. 137:583–5. DOI: 10.1016/j.ajo.2003.08.037. PMID: 15013895.

6. Taniguchi Y, Taketani T, Moriyama H, Moriki S, Nishimura K, Sato E, et al. 2009; Septic shock induced by Lecythophora mutabilis in a patient with mitochondrial encephalomyopathy. J Med Microbiol. 58:1255–8. DOI: 10.1099/jmm.0.010678-0. PMID: 19528157.

7. Chang CY, Schell WA, Perfect JR, Hulka GF. 2005; Novel use of a swimming pool biocide in the treatment of a rare fungal mastoiditis. Laryngoscope. 115:1065–9. DOI: 10.1097/01.MLG.0000163338.45700.FE. PMID: 15933522.

8. Marriott DJ, Wong KH, Aznar E, Harkness JL, Cooper DA, Muir D. 1997; Scytalidium dimidiatum and Lecythophora hoffmannii: unusual causes of fungal infections in a patient with AIDS. J Clin Microbiol. 35:2949–52. DOI: 10.1128/jcm.35.11.2949-2952.1997. PMID: 9350765. PMCID: PMC230093.

9. Rinaldi MG, McCoy EL, Winn DF. 1982; Gluteal abscess caused by Phialophora hoffmannii and review of the role of this organism in human mycoses. J Clin Microbiol. 16:181–5. DOI: 10.1128/jcm.16.1.181-185.1982. PMID: 7107854. PMCID: PMC272316.

10. Ahmad S, Johnson RJ, Hillier S, Shelton WR, Rinaldi MG. 1985; Fungal peritonitis caused by Lecythophora mutabilis. J Clin Microbiol. 22:182–6. DOI: 10.1128/jcm.22.2.182-186.1985. PMID: 4031032. PMCID: PMC268355.

11. Fintelmann RE, Gilmer W, Bloomer MM, Jeng BH. 2011; Recurrent Lecytho-phora mutabilis keratitis and endophthalmitis after deep anterior lamellar keratoplasty. Arch Ophthalmol. 129:108–10. DOI: 10.1001/archophthalmol.2010.335. PMID: 21220641.

12. Pierach CA, Gülmen G, Dhar GJ, Kiser JC. 1973; Letter: Phialophora mutabilis endocarditis. Ann Intern Med. 79:900–1. DOI: 10.7326/0003-4819-79-6-900_2. PMID: 4796911.
13. Slifkin M, Bowers HM Jr. 1975; Phialophora mutabilis endocarditis. Am J Clin Pathol. 63:120–30. DOI: 10.1093/ajcp/63.3.120. PMID: 803342.
14. Ho RH, Bernard PJ, McClellan KA. 1991; Phialophora mutabilis keratomycosis. Am J Ophthalmol. 112:728–9. DOI: 10.1016/S0002-9394(14)77283-6.

15. Marcus DM, Hull DS, Rubin RM, Newman CL. 1999; Lecythophora mutabilis endophthalmitis after long-term corneal cyanoacrylate. Retina. 19:351–3. DOI: 10.1097/00006982-199919040-00018. PMID: 10458306.

16. Castro LL, Schütze M, Bücker DH, Vasconcellos Lde S. 2016; Prevalence of fungemia in a tertiary hospital: Analysis of the last decade. Rev Assoc Med Bras (1992). 62:315–9. DOI: 10.1590/1806-9282.62.04.315. PMID: 27437675.

17. Singhal N, Kumar M, Kanaujia PK, Virdi JS. 2015; MALDI-TOF mass spectrometry: an emerging technology for microbial identification and diagnosis. Front Microbiol. 6:791. DOI: 10.3389/fmicb.2015.00791. PMID: 26300860. PMCID: PMC4525378.

18. Usyk M, Zolnik CP, Patel H, Levi MH, Burk RD. 2017; Novel ITS1 Fungal Primers for characterization of the mycobiome. mSphere. 2:e00488–17. DOI: 10.1128/mSphere.00488-17. PMID: 29242834. PMCID: PMC5729218.

19. Rechner PM, Agger WA, Mruz K, Cogbill TH. 2001; Clinical features of clostridial bacteremia: a review from a rural area. Clin Infect Dis. 33:349–53. DOI: 10.1086/321883. PMID: 11438901.

20. Iaria C, Stassi G, Salpietro DC, La Mazza A, Silipigni L, Arena A, et al. 2007; Clostridium baratii bacteremia associated with Kawasaki syndrome. First case report. New Microbiol. 30:481–4.
21. Peleg AY, Hogan DA, Mylonakis E. 2010; Medically important bacterial-fungal interactions. Nat Rev Microbiol. 8:340–9. DOI: 10.1038/nrmicro2313. PMID: 20348933.

22. Heydari S, Siavoshi F, Sarrafnejad A, Malekzadeh R. 2021; Coniochaeta fungus benefits from its intracellular bacteria to form biofilm and defend against other fungi. Arch Microbiol. 203:1357–66. DOI: 10.1007/s00203-020-02122-4. PMID: 33386870.

23. Donelli G, Vuotto C, Cardines R, Mastrantonio P. 2012; Biofilm-growing intestinal anaerobic bacteria. FEMS Immunol Med Microbiol. 65:318–25. DOI: 10.1111/j.1574-695X.2012.00962.x. PMID: 22444687.

24. Krcmery V, Barnes AJ. 2002; Non-albicans Candida spp. causing fungaemia: pathogenicity and antifungal resistance. J Hosp Infect. 50:243–60. DOI: 10.1053/jhin.2001.1151. PMID: 12014897.
25. McPherson RA, Pincus MR, editors. 2017. Henry's clinical diagnosis and management by laboratory methods. 23rd ed. St. Louis, MO: Elsevier.
26. Hall-Stoodley L, Stoodley P, Kathju S, Høiby N, Moser C, Costerton JW, et al. 2012; Towards diagnostic guidelines for biofilm-associated infections. FEMS Immunol Med Microbiol. 65:127–45. DOI: 10.1111/j.1574-695X.2012.00968.x. PMID: 22469292.

Fig. 1
Clinical and laboratory findings of the case during hospitalization. Chest computed tomography showed multiple irregular nodules in both lungs on day 2 (indicated using arrow heads) (A), which decreased in size and number (B) on day 10.
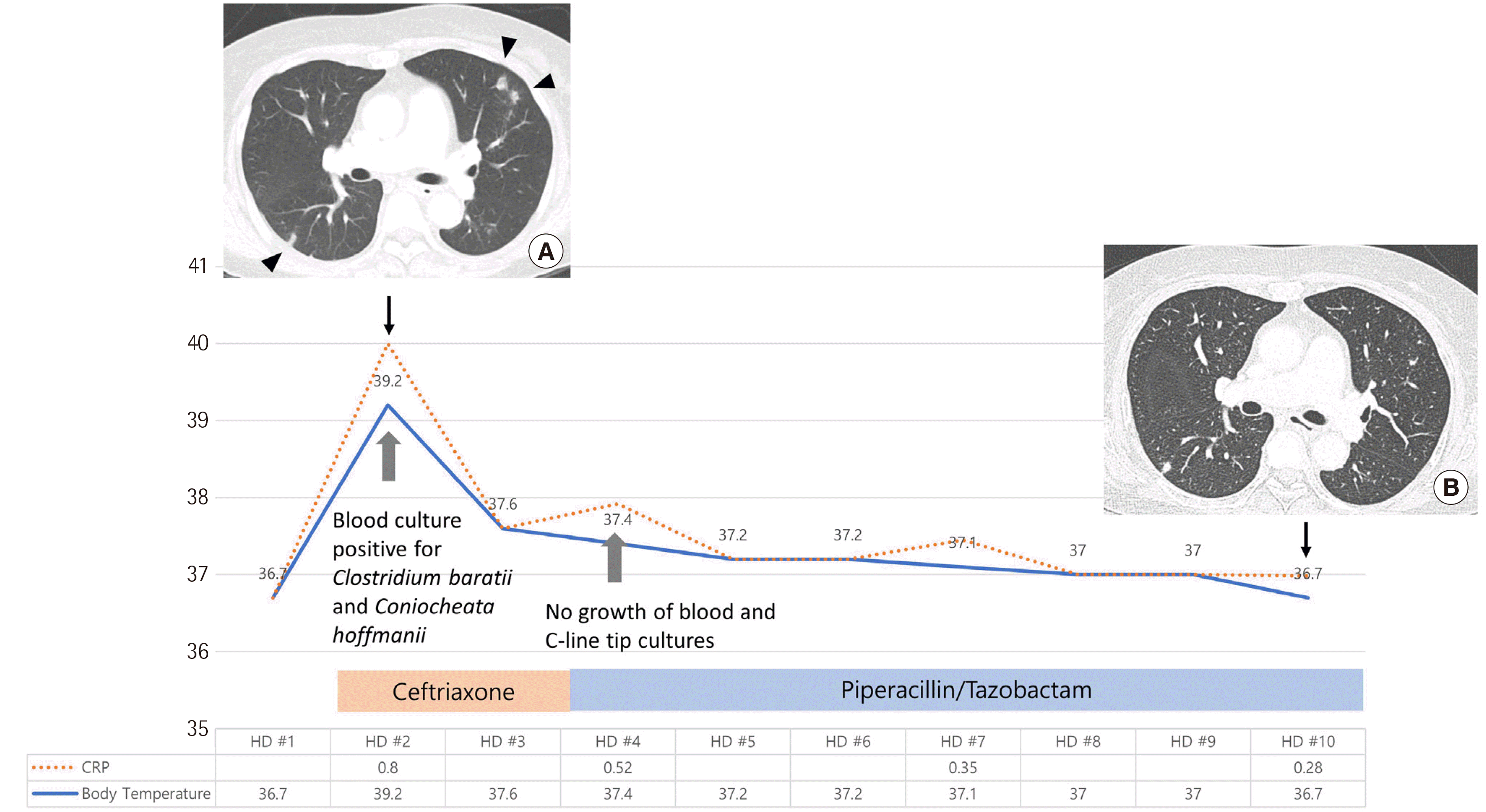
Fig. 2
Microbiological findings of Coniochaeta hoffmannii isolated from this case. Colonies grown on Sabouraud Dextrose agar incubated at 30°C for 2 days (A), 4 days (B), 7 days (C), and 14 days (D). Microscopy analysis of the slide culture of Coniochaeta hoffmannii showed oval conidia (1.5–2.5×3.0–6.0 μm) (E, F) and flask-shaped phialide (indicated using arrows) with an erupted short neck (G, H) (Periodic acid-Schiff stain, ×1,000).
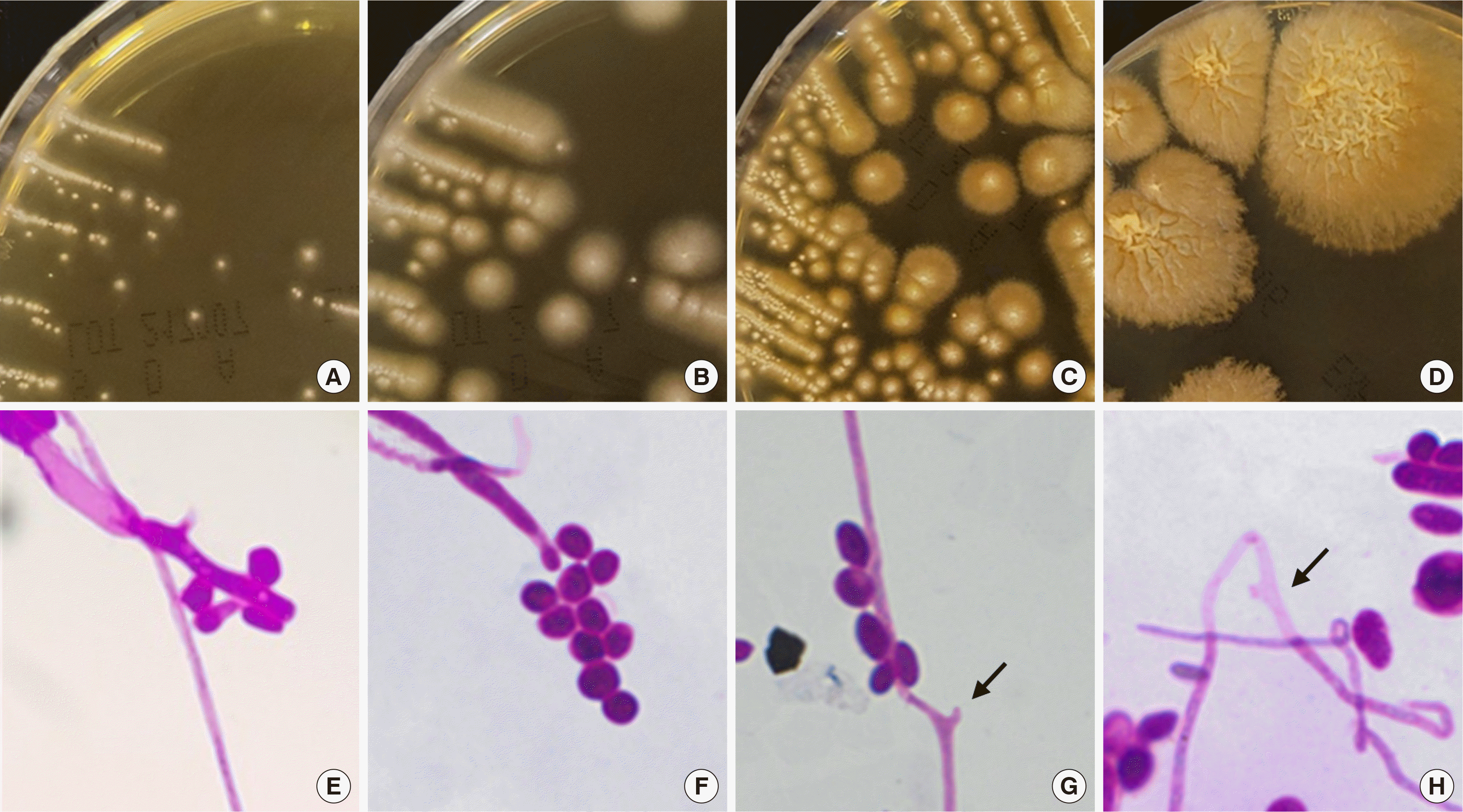
Table 1
Literature review of human cases of infections caused by Coniochaeta spp.
| Case | Species | Year | Age/Sex | Infection type | Underlying disease | Specimen | Treatment and outcome | Reference |
|---|---|---|---|---|---|---|---|---|
| 1 | Lecythophora hoffmannii | 1973 | 56/F | Endocarditis | Prosthetic mitral valve | Vegetation on valve | No antifungal therapy, expired | [12] |
| 2 | Lecythophora hoffmannii | 1975 | 47/M | Endocarditis | Rheumatic fever | Vegetation on valve | No antifungal therapy, expired | [13] |
| 3 | Lecythophora hoffmannii | 1985 | 61/F | Peritonitis | Polycystic kidney disease and Diabetes | Peritoneal fluid | Keto, Mico, imporved | [10] |
| 4 | Lecythophora hoffmannii | 1990 | 36/M | Keratomycosis | None | Corneal biopsy | Keto, improved | [14] |
| 5 | Lecythophora hoffmannii | 1999 | 25/M | Endophthalmitis | Herpes simplex keratitis | Vitreous fluid | Ampho B, improved | [15] |
| 6 | Lecythophora hoffmannii | 2003 | 57/F | Endophthalmitis | Glaucoma | Vitreous fluid | Keto, Vori, improved | [5] |
| 7 | Lecythophora hoffmannii | 2007 | 58/M | Endocarditis | Coronary artery disease, Diabetes | Prosthetic aortic valve | Ampho B, Vori, improved | [4] |
| 8 | Lecythophora hoffmannii | 2009 | 18/M | Septic shock | Mitochondrial encepha- lomyopathy | Blood | Amphotericin B, expired | [6] |
| 9 | Lecythophora hoffmannii | 2011 | 53/F | Keratitis with intra- ocular invasion | Corneal ulcer | Corneal scraping | Ampho B, Vori, improved | [11] |
| 10 | Lecythophora hoffmannii | 1982 | 73/F | Gluteal abscess | None | Abscess aspirate | Debridement | [9] |
| 11 | Lecythophora hoffmannii | 1997 | 44/M | Sinusitis | Acquired immune defi- ciency syndrome | Sinus aspirate | Ampho B, Keto, improved | [8] |
| 12 | Lecythophora hoffmannii | 2005 | ?/M | Mastoiditis | Recurrent otitis media | Drainage | Itra, AmphoB, Imporved | [7] |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download