초록
NGS를 이용한 종양 유전 검사 결과에 대한 설명과 보고서 작성은 국내 유전자 검사실마다 다양하게 수행되고 있다. 따라서 대한진단유전학회에서는 유전성 암 유전자 NGS검사에 대한 결과 설명과 보고서 작성에 대한 권고안을 우선 제안하였다. 우리는 이 권고안이 국내 NGS 결과보고서의 검사실 간 차이를 줄이고 유전 상담의 질을 높일 수 있을 것으로 기대한다.
Abstract
Genetic counseling and reporting on cancer genetic test results using next-generation sequencing (NGS) are practiced in various ways in different Korean genetic laboratories. Therefore, the Korean Society for Genetic Diagnostics has proposed guidelines for genetic counseling and reporting of NGS tests, especially for hereditary cancer-predisposing syndrome. We hope these guidelines will reduce inter-laboratory variations in reporting NGS test results and improve the quality of genetic counseling in Korea.
차세대염기서열분석(next-generation sequencing, NGS)은 기존의 Sanger 염기순서 검사법과 구별되는 새로운 염기서열분석 검사법이며, 다량의 유전 정보를 효율적으로 빠르게 얻을 수 있어서 기존의 Sanger 염기순서 검사법을 이용한 진단의 제한을 극복할 수 있게 해준다[1, 2]. NGS는 전세계적으로 기초과학분야에서부터 임상진단분야에 이르기까지 광범위하게 사용되고 있으며, 국내에서는 2017년 3월부터 NGS기반 유전자검사에 대해 보험급여를 시작한 이래 많은 검사실에서 연구와 임상진단분야에 활발히 이용되고 있다. 하지만 국내에는 아직 NGS기반 유전자검사의 결과보고서에 대한 표준 지침이 없어 각 검사실마다 다양한 형식으로 작성되어 보고되고 있다. 또한 아직 국내 NGS기반 유전자검사의 결과에 대한 설명 지침도 없으므로 각 의료기관에서 다양한 형태로 환자에게 결과 설명이 이루어지고 있는 실정이다.
이에 저자들은 우선 임상에서 활용도가 높은 유전성 암 관련 NGS 유전자패널검사 결과의 설명과 결과보고서에 대한 권고안을 제안하고자 한다. 이 지침 및 권고안은 미국유전상담학회(National Society of Genetic Counselors, NSGC), 미국종합암네트웨크(National Comprehensive Cancer Network, NCCN), 미국의학유전학회(American College of Medical Genetics and Genomics, ACMG), 미국분자병리학회(Association for Molecular Pathology, AMP), 미국병리학회(College of American Pathologists, CAP), 미국식품의약국(Food and Drug Administration, FDA), 유럽임상유전과학회(Association for Clinical Genomic Science, ACGS), EuroGentest, 북유럽임상유전체학회(Nordic Alliance for Clinical Genomics), 경제협력개발기구(Organization for Economic Cooperation and Development, OECD)의 관련 지침 및 권고안들을 참고하여 국내 실정에 맞게 조정하였다[3-19]. 이 권고안을 통한 유전성 암 관련 NGS 유전자패널검사 결과의 설명과 결과보고서의 표준화는 각 검사실, 임상 의사, 환자 간의 원활한 소통에 기여하여 결과적으로 보다 나은 환자 진료에 도움을 줄 수 있을 것으로 기대한다.
다음의 사항들을 유념하여 검사 후 결과 상담에 임할 것을 권고한다. 이 권고안은 유전성 암 유전자검사에 대한 것이므로 암 조직을 이용한 유전자검사에는 해당되지 않음을 유의한다.
검사 전 상담에서도 사전에 보고될 수 있는 모든 종류의 결과에 대한 설명이 미리 이루어져야 한다.
• 병원성 변이(pathogenic 또는 likely pathogenic variant)가 확인된 경우: 알려진 병원성 변이가 확인될 경우 검사를 한 당사자는 위험도에 따른 치료나 예방적 진료가 필요함을 설명하고, 가족에서도 유전상담과 보인자를 찾기 위한 가족 검사가 필요함을 설명한다[2, 20]. 특히 상염색체 열성 질환 관련 유전자(예: MUTYH)에서 두 가지 다른 종류의 병원성 변이가 이형접합체로 발견되고 각 변이가 trans로 존재하는 지 알 수 없을 경우, 이를 확인하기 위해 부모 검사가 반드시 필요하다.
• 병원성 변이가 확인되지 않는 경우: 가족 내에 기존에 알려진 병원성 변이가 없는 경우, 검사 범위 외의 다른 원인 유전자 혹은 변이 형태(예를 들어 복제 수 변이를 검사하지 않는 유전자 패널의 경우 복제 수 변이)가 있을 수 있는 가능성에 대해 설명한다. 이미 확인된 병원성 변이에 대한 가족 검사의 경우(예를 들면 어머니에서 BRCA1 병원성 변이가 확인되었는데 혈연 관계인 딸에서 동일한 변이가 확인되지 않았을 때)는 해당 변이 관련 유전성 암의 위험은 거의 없음을 설명하되, 어떤 경우든 일반적인 인구에서의 암 위험도는 존재함을 설명하여야 한다[2, 5, 20].
• 미분류 변이 결과(variant of uncertain significance, VUS): DNA에서의 변화는 관찰되는데 유전자의 기능에 영향을 미치는지 모르기 때문에 임상적으로는 de novo 여부를 보기 위한 부모 검사를 제외하고는 가족에서의 검사가 권고되지 않는다[3, 20]. 하지만 현재 의학적인 지식 수준에서 미분류 변이 결과라는 사실을 강조해야 하며 추후 변이의 해석이 재분류될 수 있음을 반드시 설명해야 한다. 만약 병원성 변이로 재분류될 경우 환자 및 주치의에게 그러한 정보가 공유되어 재상담이 이뤄질 수 있는 체계가 마련되어 있어야 한다.
NGS를 비롯한 최근의 유전자검사들은 높은 비용이 발생할 수 있으므로 환자들이 이에 대한 거부감이 상당할 수 있다. 따라서 이미 시행한 유전자검사 결과 병원성 변이가 발견되지 않아서 추가적인 유전자검사를 통한 확인이 필요한 경우가 있을 수 있는데, 이 때 필요한 비용과 적용되는 급여 등에 관해 구체적으로 잘 설명해야 한다[3]. 특정 유전자검사나 NGS 검사는 선별급여 지정 및 실시 등에 관한 기준에 따른 요양급여 기준에 따라 안내한다[21]. 특히, 현재 NGS 검사는 검사에 포함되는 유전자 개수와 유전자의 총 길이에 따라 검사 비용이 결정되며, 선택 급여이므로 환자가 검사 금액의 50%를 부담함을 설명할 필요가 있다. 환자에게 병원성 변이가 발견되었을 경우, 환자에게서 발견된 특정 변이 여부를 확인하기 위하여 가족에게 유전자검사를 시행하게 된다. 이때 해당 변이에 대한 검사만 시행할 경우 가족 유전자검사에 해당하여 전체 유전자검사에 비해 낮은 검사 비용으로 검사가 가능함을 안내하는 것이 권고된다.
검사 전 상담에서 피검사자의 결과에 대한 반응에 대해 미리 평가하고 그것을 고려하여 검사 시행 시기, 가족에 대한 이슈, 결과 통보에 준비하도록 한다. 평가가 잘못될 경우 검사 후 감정적 어려움이 지속될 수 있으므로 이 부분을 미리 잘 평가하는 것이 중요하며, 결과 상담 시 위기 개입이 필요할 경우 곧바로 의뢰할 수 있도록 정신건강의학과와의 협진 체계를 미리 잘 구축할 것이 권장된다[3].
유전 상담은 반드시 독립적인 공간에서 진행하여 환자의 비밀을 유지하여야 하며, 항상 본인(혹은 검사 전 상담을 받은 법정대리인)에게 직접 결과를 통보하도록 한다[3].
암 위험도를 낮추기 위한 임상적인 결정은 유전자의 종류, 가족력, 병력 등에 따라 달라지므로 관련 의료진과 함께 상의해야 한다(Tables 1-4)[3-5, 22]. 특히 중등도 이하의 침투도를 보이는 유전자들이 포함된 유전자 패널에서 그러한 유전자들의 병원성 변이가 확인될 경우, NCCN 가이드라인이나 한국유방암 진료권고안 등과 같은 신뢰할 만한 국내외 유전성 암 관련 진료 지침들을 반드시 확인하도록 한다[4, 5, 22]. 만약 구체적인 의료적 처치 방침이 확립되어 있지 않은 유전자들의 경우 그러한 유전자들의 병원성 변이에 대해 섣불리 과도한 의료적 처치가 들어가지 않도록 주의하여야 한다[4, 5, 22].
다음의 사항들을 유념하여 결과보고서를 작성할 것을 권고하며 결과보고서 양식(Figs. 1-3)을 참조하도록 한다. 이 권고안은 개별 기관의 특성 및 다양한 의료 현장의 실정을 반영하여 일부 변형 또는 보완하여 적용할 수 있다. 이 권고안 또한 유전성 암 유전자검사에 대한 것이므로 암 조직을 이용한 유전자검사에는 적용되지 않음을 유의한다.
결과 보고서는 분석 결과뿐만 아니라 검사의 방법, 검사 목적(적응증) 및 제한점에 이르기까지 방대하고 포괄적인 내용을 다루고 있다. 따라서 결과 보고서의 첫 페이지에 명확하고 확연하게 눈에 띄는 요약 내용을 요약 보고서 형태로 제공하는 것이 권장된다. 결과 보고서 요약 페이지는 의학적 결정을 위한 가장 핵심적인 정보들이 포함되도록 구성해야 한다.
• 환자 등록번호, 이름, 나이 및 성별
• 인종정보
• 검사 적응증(검사 목적)
• 결론
• 주요 검사 결과 및 해석
• 유전 상담에 대한 정보
• 검사방법, 범위 및 제한점 (요약)
• 별도 확인 검사(Sanger sequencing 등) 시행 유무
• 본인 또는 가족구성원에 대한 유전 상담 및 후속 추가 검사에 대한 권장
주요 검사 결과 및 해석에는 환자의 상태와 관련이 있을 수 있는 병원성 변이에 대한 기술이 포함되어야 한다[26]. 결과 보고서 요약 페이지에서 분석방법 및 제한점에 대한 기술은 간략하게 작성되어야 하며 검사결과를 이해하고 해석하는데 필수적인 정보와 분석결과의 유효성을 뒷받침하는 가장 중요한 정보만 포함해야 한다.
임상의가 결과를 이해하는데 필수적이지 않은 정보는 결과 보고서 요약 페이지 이후에 배치되도록 구성한다. 다음의 내용들이 해당된다[11].
• 의뢰한 의료 전문가에 대한 정보
• 기본 샘플 유형
• 검사접수일, 결과보고일
• 보고서를 승인하는 개인의 신원
• 검사방법, 범위 및 제한점(자세히)
변이는 HGVS (Human Genome Variation Society) 명명법[10, 13, 14, 25-28]을 사용하여 기술되어야 한다. 결과보고서에는 HUGO (Human Genome Organization)에서 승인한 공식 유전자 이름을 사용하여야 하며 변이의 염색체 상 위치와 참조 염기서열의 정보(MANE 혹은 RefSeq/Ensembl-GENCODE accession numbers 및 genome build)를 함께 제공해야 한다[10, 14-16, 25]. 임상의의 이해에 도움이 되는 경우에 한하여 관행적으로 사용되고 있는 명명법을 HGVS 명명법에 추가하여 제공할 수 있다[25].
검출된 변이들은 ACMG가 제안한 근거 및 변이분류 지침[15-17]에 따라 분류해야 한다. ACMG 가이드라인 외에 전문가 컨소시엄에서 특정 질병이나 유전자에 대해 자체적으로 변이 분류 시스템을 만들고 데이터베이스를 구축하는 경우가 있는데 이를 변이 분류에 적용한다면 이에 대한 정보가 임상의에게도 제공되어야 한다.
결과보고서에는 검출된 모든 병원성 변이가 보고되어야 한다. 미분류 변이는 개별 기관의 방침에 따라 보고 여부를 결정할 수 있으며 일반적으로 미분류 변이가 검사 적응증과 관련된 유전자에서 발견되는 경우 보고하는 것이 권장된다[13, 26]. 비병원성 변이(benign 또는 likely benign 변이)는 일반적으로 보고하지 않도록 권장되나 이를 보고하고자 하는 경우 미분류 변이 또는 병원성 변이와 명확하게 구별될 수 있어야 한다.
변이의 분류를 뒷받침하는 근거는 명확하고 이해할 수 있는 형태로 보고서에 기술되어야 한다. 변이의 분류에 적용된 다양한 근거들을 제시하고 변이 분류를 뒷받침해줄 수 있는 문헌이 있다면 요약하여 인용해야 한다. 검출된 변이와 관련된 표현형이 환자의 표현형과 일치하는지 여부에 대해 확인이 가능하다면 이를 변이 분류에 근거로 적용한다[13].
NGS 기반의 진단, 특히 엑솜염기서열검사 및 전장유전체염기서열검사를 통해 발견된 변이의 대다수는 병원성이나 비병원성으로 분류하기 위한 증거가 충분하지 않은 경우가 많다.
만약 명백한 병원성 변이가 발견되지 않았고, 환자의 표현형과 잠재적인 관련성이 있는 경우에는 이를 결과보고서에 포함하는 것이 중요할 수 있다. 미래의 의학 지식의 발전으로 이들 미분류 변이가 재분류될 수 있다. 하지만, 미분류 변이에 대해 보고하는 것은 환자들이 그 의미를 오해할 경우 위험을 초래할 수 있으며, 병원성 변이와 미분류 변이를 나란히 보고하는 경우 보고서의 가독성이 떨어질 수 있다[18].
미분류 변이에 대한 데이터 관리 및 보고는 검사실마다 미묘한 차이를 보일 수 있기 때문에, 적절한 미분류 변이에 대한 관리지침을 세워야 한다. 높은 sequencing depth를 가진 작은 NGS 패널의 경우는 검출된 모든 미분류 변이를 보고할 수도 있지만, 엑솜염기서열검사 및 전장유전체염기서열검사의 경우에는 수천에서 수백만 개의 미분류 변이가 나올 수도 있으며, 검출된 모든 미분류 변이에 대한 광범위한 보고는 처방 의사의 이해도를 감소시킬 수 있으며 그로 인한 부정적인 결과를 야기할 수 있다. 미분류 변이가 검사 또는 환자 표현형에 대한 1차적인 적응증과 관련된 유전자에 있는 경우[13], 특히 원인의 가능성이 있는 변이가 발견되지 않은 경우에는 미분류 변이를 보고할 것을 권장한다. 또한 미분류 변이에 대한 보고서 포함 여부에 관계없이 향후 변이의 분류가 바뀔 경우를 대비하여 검사실에서 검출된 미분류 변이의 목록을 보관할 것이 권장된다[18].
만약 한 유전자에 두 가지의 병원성 변이가 이형접합체로 존재한다면, trans 유무를 알 수 없을 경우 이를 알기 위해 부모 검사를 반드시 해야 함을 결과지에 기록해야 한다. 하지만 상염색체 열성 질환 관련 유전자(예: MUTYH)에서 하나의 병원성 변이만이 이형접합체로 발견되었다면, 이것을 결과지에 어떻게 작성, 보고할 것인지에 대해서는 다음의 사항들이 고려되어야 한다[18].
• 만약 환자의 표현형이 해당 유전자와 부합하지 않거나, 다른 유전자에서 표현형을 설명할 수 있는 병원성 변이가 발견이 된 경우라면 이러한 유전자를 병원성 변이로 보고하는 것은 권장되지 않는다. 왜냐하면 누구나 여러 가지 드문 상염색체 열성 질환의 병원성 변이 보인자일 수 있으며, 그러한 보인자 상황을 모두 병원성 변이를 가진 것으로 보고할 경우 그러한 부분들이 정확히 전달되기 보다는 오해의 소지가 더 많기 때문이다.
• 만약 환자의 표현형이 해당 유전자와 부합된다면, 패널의 사이즈, 검사의 민감도, 다른 검사 방법으로 검사할 수 있는 다른 변이 형태의 추가적인 존재 가능성 등을 고려하여 어떻게 보고할 것인지 결정해야 한다.
(Secondary findings)
우연히 발견된 이차적 결과는 유전자검사의 1차적인 적응증과 관련이 없는 임상적으로 중요한 변이다. 유전성 암 유전자로만 구성된 NGS 패널에서는 우연히 발견된 이차적 결과를 발견할 가능성이 매우 낮으나 검사실은 우연히 발견된 이차적 결과가 있을 때 이를 어떻게 다룰 것인지에 대한 지침을 가지고 있어야 한다[14, 25, 27]. 이 지침에는 우연히 발견된 이차적 결과로 검사하는 유전자 목록과 그 근거, 우연히 발견된 이차적 결과에 대한 동의서, 우연히 발견된 이차적 결과에 대한 유전상담 의뢰와 같은 내용이 포함되어야 한다[13]. ACMG에서는 임상적으로 중요한 우연히 발견된 이차적 결과에 대한 보고 유전자 목록을 제시하였으며 그 중엔 유전성 암 관련 유전자들도 포함되어 있다(Table 5)[12, 19].
결과보고서에는 핵산 추출부터 시작하여 분석 절차 전반에 대한 간략한 설명이 기술되어야 한다[11, 16]. 또한 분석에 적용된 방법(라이브러리 준비 방법과 염기서열분석 방식, 염기서열분석 플랫폼)과 분석 범위에 대한 정보도 함께 제공되어야 한다. 기술적으로 분석에 제한점이 발생하는 특정 부위나 특정 유전자가 존재하는 경우 이에 대한 정보도 함께 제공되어야 한다[9, 14, 26].
결과보고서에는 데이터 분석 파이프라인에 대한 정보가 제공되어야 한다[24]. 데이터 분석 파이프라인의 경우 참조 게놈 버전(reference genome version), 사용된 소프트웨어의 버전 및 설정, 변이를 필터링하고 우선 순위를 지정하는 데 사용된 방법과 시스템에 대한 내용이 포함되어야 한다[13, 16, 27]. 병원성 변이는 독립적인 다른 분석방법을 통해 재확인(confirmatory testing)하는 것이 권장된다. 검사실에서 이러한 확인 검사를 수행하는 경우 이에 대한 정보와 결과도 결과보고서에 함께 포함되어야 한다[14, 26].
분석 데이터의 질을 나타내는 측정 항목들(quality metrics)은 분석 데이터의 질이 목표에 맞게 충족되어 신뢰할 수 있음을 나타내 주는 유용한 지표들이다. 그러나 이는 전문기술의 영역으로 검사결과지의 앞부분 또는 요약 페이지에는 기재하지 않는 것이 권장된다. 질 관리 측정 항목들은 결과보고서의 뒷부분에 배치하여 분석 결과의 유효성에 대한 지표로서 참조할 수 있도록 한다[14].
이러한 제한 사항으로는 검출 한계, 구조적 변이 또는 복제 수 변이와 같은 특정 변이 유형에 대한 검출 불가, 생물정보학적 한계, GC 풍부 영역에서의 단일염기다형성 검출 제한과 같은 게놈 구조로 인한 한계 혹은 염기서열 분석 방법 자체의 한계, 그리고 민감도 및 특이도와 같은 것들이 포함된다[11, 13, 14]. 또한 그 외 일반적으로 검사실 검사에서 맞닥뜨릴 수 있는 함정에 관한 면책조항을 포함할 수 있으며, 특히 엑솜염기서열검사 및 전장유전체염기서열검사에서는 검사 특성상 위음성 발생 가능성에 대한 면책조항을 포함할 수도 있다[16].
Trio검사 보고서의 경우, 치료와 관련이 있는 경우가 아니라면 변이가 발견된 부모의 이름 혹은 관계를 포함하지 않아야 하며(예를 들어, ‘어머니’ 대신에 ‘부모’라고 언급), 임상적 맥락에서 소견을 이해하는 데 필요한 정보만을 포함해야 한다. 이는, 추가적으로 가계도 내의 다른 혈연에 대한 유전자검사를 시행할 때도 해당된다[13].
REFERENCES
1. National Cancer Institute. NCI dictionary of cancer terms. https://www.cancer.gov/publications/dictionaries/cancer-terms. Last accessed on Oct 2021.
2. Metzker ML. 2010; Sequencing technologies - the next generation. Nat Rev Genet. 11:31–46. DOI: 10.1038/nrg2626. PMID: 19997069.

3. Riley BD, Culver JO, Skrzynia C, Senter LA, Peters JA, Costalas JW, et al. 2012; Essential elements of genetic cancer risk assessment, counseling, and testing: updated recommendations of the National Society of Genetic Counselors. J Genet Couns. 21:151–61. DOI: 10.1007/s10897-011-9462-x. PMID: 22134580.

4. National Comprehensive Cancer Network. Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic Version 2.2022. https://www.nccn.org/professionals/physician_gls/pdf/genetics_bop.pdf. Last accessed on May 2022.
5. National Comprehensive Cancer Network. Genetic/Familial High-Risk Assessment: Colorectal Version 2.2021. https://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf. Last accessed on May 2022.
6. EuroGentest Network of Excellence. Recommendations for genetic counselling related to genetic testing. https://www.verbrauchergesundheit.gv.at/gentechnik/humanm/anhang_6_eurogentest.pdf?8bgalo. Last accessed on Oct 2021.
7. EuroGentest Network of Excellence. Summary of the guidelines for genetic counselling. https://www.verbrauchergesundheit.gv.at/gentechnik/humanm/anhang_6_eurogentest.pdf?8bgalo. Last accessed on Oct 2021.
8. Nordic Alliance for Clinical Genomics. Clinical reporting of NGS data. https://nordicclinicalgenomics.org/assets/resources/2018-nacg-paper-clinical-reporting-benchmarking.pdf. Last accessed on Oct 2021.
9. U.S. Department of Health and Human Services Food and Drug Administrations. Considerations for Design, Development, and Analytical Validation of Next Generation Sequencing (NGS)-Based In Vitro Diagnostics (IVDs) Intended to Aid in the Diagnosis of Suspected Germline Diseases. Docket No. FDA-2016-D-1270. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-design-development-and-analytical-validation-next-generation-sequencing-ngs-based. Last accessed on Oct 2021.
10. Smith K, Martindale J, Wallis Y, Bown N, Leo N, Creswell L, et al. General Genetic Laboratory Reporting Recommendations. https://www.acgs.uk.com/media/10758/acgs_general_genetic_laboratory_reporting_recommendations_2015.pdf. Last accessed on Oct 2021.
11. Organisation for Economic Co-operation, Development. OECD Guidelines for Quality Assurance in Genetic Testing. https://www.oecd.org/sti/emerging-tech/oecdguidelinesforqualityassuranceingenetictesting.htm. Last accessed on Oct 2021.
12. Green RC, Berg JS, Grody WW, Kalia SS, Korf BR, Martin CL, et al. 2013; ACMG recommendations for reporting of incidental findings in clinical exome and genome sequencing. Genet Med. 15:565–74. DOI: 10.1038/gim.2013.73. PMID: 23788249. PMCID: PMC3727274.

13. Rehm HL, Bale SJ, Bayrak-Toydemir P, Berg JS, Brown KK, Deignan JL, et al. 2013; ACMG clinical laboratory standards for next-generation sequencing. Genet Med. 15:733–47. DOI: 10.1038/gim.2013.92. PMID: 23887774. PMCID: PMC4098820.

14. Deans Z, Watson CM, Charlton R, Ellard S, Wallis Y, Mattocks C, et al. Practice guidelines for targeted next generation sequencing analysis and interpretation. https://www.acgs.uk.com/media/10789/bpg_for_targeted_next_generation_sequencing_-_approved_dec_2015.pdf. Last accessed on Oct 2021.
15. Aziz N, Zhao Q, Bry L, Driscoll DK, Funke B, Gibson JS, et al. 2015; College of American Pathologists' laboratory standards for next-generation sequencing clinical tests. Arch Pathol Lab Med. 139:481–93. DOI: 10.5858/arpa.2014-0250-CP. PMID: 25152313.

16. Richards S, Aziz N, Bale S, Bick D, Das S, Gastier-Foster J, et al. 2015; Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 17:405–24. DOI: 10.1038/gim.2015.30. PMID: 25741868. PMCID: PMC4544753.

17. Wallis Y, Payne S, Mcanulty C, Bodmer D, Sistermans E, Robertson K, et al. Practice guidelines for the evaluation of pathogenicity and the reporting of sequence variants in clinical molecular genetics. https://www.acgs.uk.com/media/10791/evaluation_and_reporting_of_sequence_variants_bpgs_june_2013_-_finalpdf.pdf. Last accessed on Oct 2021.
18. Ellard S, Baple EL, Callaway A, Berry I, Forrester N, Turnbull C, et al. ACGS Best Practice Guidelines for Variant Classification in Rare Disease 2020. https://www.acgs.uk.com/media/11631/uk-practice-guidelines-for-variant-classification-v4-01-2020.pdf. Last accessed on Oct 2021.
19. Miller DT, Lee K, Chung WK, Gordon AS, Herman GE, Klein TE, et al. 2021; ACMG SF v3.0 list for reporting of secondary findings in clinical exome and genome sequencing: a policy statement of the American College of Medical Genetics and Genomics (ACMG). Genet Med. 23:1381–90. DOI: 10.1038/s41436-021-01172-3. PMID: 34012068.

20. Peshkin BN, Isaacs C. Genetic testing and management of individuals at risk of hereditary breast and ovarian cancer syndromes. https://www.uptodate.com/contents/genetic-testing-and-management-of-individuals-at-risk-of-hereditary-breast-and-ovarian-cancer-syndromes. Last accessed on Oct 2021.
21. Health Insurance Review & Assessment Service. 2022 National Health Insurance Corporation Medical Fee. https://www.hira.or.kr/ebooksc/ebook_688/ebook_688_202203170916571660.pdf. Last accessed on May 2022.
22. Korean Breast Cancer Society. The 9th Korean Clinical Practice Guideline for Breast Cancer, 2021. https://www.kbcs.or.kr/journal/file/211104_2.pdf. Last accessed on Oct 2021.
23. National Comprehensive Cancer Network. NCCN Guidelines Kidney Cancer. https://www.nccn.org/professionals/physician_gls/pdf/kidney.pdf. Last accessed on Oct 2021.
24. VHL Alliance. VHLA Suggested Active Surveillance Guidelines. https://www.vhl.org/wp-content/uploads/2020/10/Active-Surveillance-Gui-delines-2020.pdf. Last accessed on Oct 2021.
25. Li MM, Datto M, Duncavage EJ, Kulkarni S, Lindeman NI, Roy S, et al. 2017; Standards and guidelines for the interpretation and reporting of sequence variants in cancer. J Mol Diagn. 19:4–23. DOI: 10.1016/j.jmoldx.2016.10.002. PMID: 27993330. PMCID: PMC5707196.

26. Matthijs G, Souche E, Alders M, Corveleyn A, Eck S, Feenstra I, et al. 2016; Guidelines for diagnostic next-generation sequencing. Eur J Hum Genet. 24:2–5. DOI: 10.1038/ejhg.2015.226. PMID: 26508566. PMCID: PMC4795226.

27. Claustres M, Kožich V, Dequeker E, Fowler B, Hehir-Kwa JY, Miller K, et al. 2014; Recommendations for reporting results of diagnostic genetic testing (biochemical, cytogenetic and molecular genetic). Eur J Hum Genet. 22:160–70. DOI: 10.1038/ejhg.2013.125. PMID: 23942201. PMCID: PMC3895644.

28. den Dunnen JT, Dalgleish R, Maglott DR, Hart RK, Greenblatt MS, McGowan-Jordan J, et al. 2016; HGVS recommendations for the description of sequence variants: 2016 update. Hum Mutat. 37:564–9. DOI: 10.1002/humu.22981. PMID: 26931183.

29. Need AC, Shashi V, Schoch K, Petrovski S, Goldstein DB. 2017; The importance of dynamic re-analysis in diagnostic whole exome sequencing. J Med Genet. 54:155–6. DOI: 10.1136/jmedgenet-2016-104306. PMID: 27899421.

30. Wenger AM, Guturu H, Bernstein JA, Bejerano G. 2017; Systematic reanalysis of clinical exome data yields additional diagnoses: implications for providers. Genet Med. 19:209–14. DOI: 10.1038/gim.2016.88. PMID: 27441994.

31. Costain G, Jobling R, Walker S, Reuter MS, Snell M, Bowdin S, et al. 2018; Periodic reanalysis of whole-genome sequencing data enhances the diagnostic advantage over standard clinical genetic testing. Eur J Hum Genet. 26:740–4. DOI: 10.1038/s41431-018-0114-6. PMID: 29453418. PMCID: PMC5945683.

Fig. 2
유전성 암 유전자 패널검사 결과보고서 양식 – 상염색체 열성 질환 관련 유전자에서 하나의 병원성 변이만이 이형접합체로 발견 및 우연히 발견된 이차적 결과가 검출된 경우의 예(요약페이지).
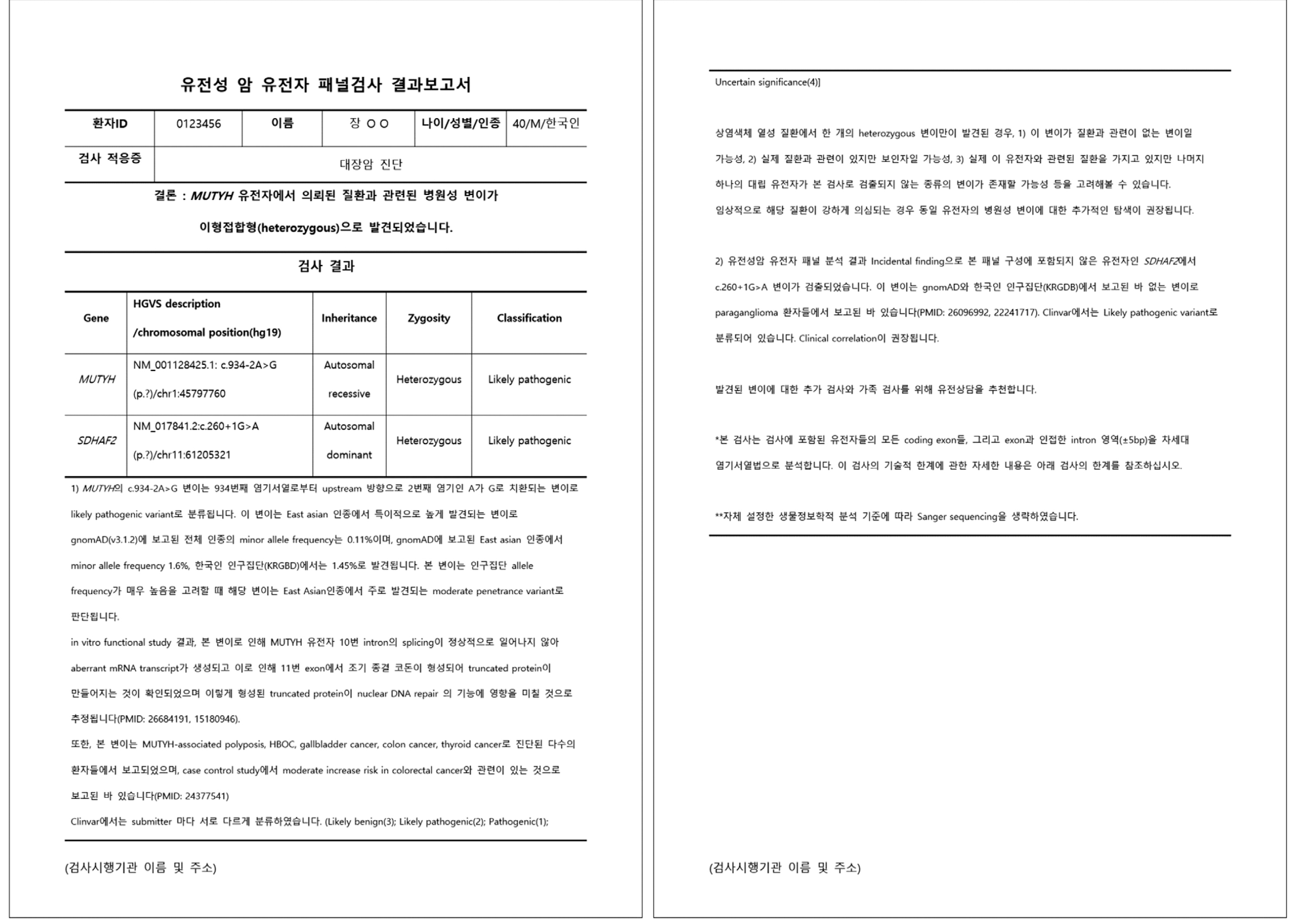
Table 1
Table 2
Table 3
린치 증후군 유전자들(MLH1, MSH2, MSH6, PMS2, EPCAM)에서 병원성 변이가 확인된 보인자에 대한 진료 지침 예[5]
Table 4
| 신세포암의 관리[23,24] | 다른 암의 관리[24] |
|---|---|
| ᆞ15세부터 65세까지 2년 간격의 자기공명영상(권장)이나 컴퓨터단층촬영 시행 |
ᆞ1세부터 매년 신경학적인 검사를 포함한 전신 신체검진 시행 ᆞ2세부터 매년 산동검사 시행 ᆞ5세부터 65세까지 매년 혈장 유리 메타네프린 혹은 24시간 소변 분획 메타네프린 검사 ᆞ11세부터 65세까지 2년 간격의 청력검사 시행 ᆞ11세부터 65세까지 2년 간격의 뇌/척추 자기공명영상 시행 ᆞ15세이후 내이도 자기공명영상 최소1회 시행 |




 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download