This article has been
cited by other articles in ScienceCentral.
Abstract
Objectives
This study aimed to assess the antibacterial, bactericidal, and mouth freshener effects of lysozyme hydrochloride 0.01%, sodium fluoride 0.02%, and cetylpyridinium chloride 0.05%.
Methods
Eight oral disease-related bacteria were cultivated anaerobically. Four samples were prepared with or without 0.5% cetylpyridinium chloride, 0.2% sodium fluoride, and 0.1% lysozyme hydrochloride. Antimicrobial activity was tested in 96-well microplates. After assessing the bacterial count, the bacterial suspension was mixed with samples and spread on agar. The bactericidal rate was calculated by counting and comparing treated and untreated colonies.
Results
Lysozyme hydrochloride 0.01%, sodium fluoride 0.02%, and cetylpyridinium chloride 0.05% mouth fresheners sterilized 99.99% of 8 oral bacteria, including Streprococcus mutans. Lysozyme hydrochloride 0.01%, sodium fluoride 0.02%, and cetylpyridinium chloride 0.05% mouth fresheners showed 99.97% bactericidal activity against Lactobacillus acidophilus.
Conclusions
Lysozyme hydrochloride 0.01%, sodium fluoride 0.02%, and cetylpyridinium chloride 0.05% mouth fresheners confirmed the sterilization and antibacterial effects on oral disease-causing bacteria.
Keywords: Anti-bacterial agents, Cetylpyridinium chloride, Fluorides, Mouthwashes, Sterilization
서 론
치아우식증과 치주질환은 대표적인 구강질환으로 구강 내 세균의 직·간접적인 영향에 의해 발생된다. 구강 내 세균의 조절은 대표적인 구강질환 예방법으로, 병원체요인 조절을 통하여 구강질환을 예방할 수 있다
1). 구강질환 예방을 위한 병원체요인 조절법으로 과거부터 치면세균막 관리법이 주로 사용되었으나, 최근에는 향균효능 성분을 이용한 병원체 요인 조절법이 늘어나는 추세이다
2).
치아우식증은 치면세균막 내 세균에 의해 치아의 성분 및 구조가 파괴되는 질환으로, 치아우식증과 관련한 세균으로는
Streptococcus mutans,
Streptococcus sobrinus 및
Lactobacillus sp. 등으로 알려져 있다
3). 치아우식증이 진행됨에 따라 치수에서 발생된 염증과 그 이후에 진행된 신경괴사로 나타날 수 있고, 치아 주변조직 및 치근단 주위에 확산된 감염이 나타날 수 있는데, 이와 관련한 세균으로는
Enterococcus faecalis가 연관되어 있다
4).
치주질환은 치주조직에 발생하는 만성 염증성 질환으로서, 치주질환의 결과로 발생하는 치조골 파괴는 치아의 상실을 일으키는 대표적인 원인 중 하나이다. 지질다당류(LPS)는 그람음성균의 주요 병독성 인자이며 파골세포 분화를 촉진하고 골조직 손실을 유발한다
5). 치주질환의 대표적인 병원균으로 혐기성 그람 음성세균인
Aggregatibacter actinomycetemcomitans,
Porphyromonas gingivalis,
Prevotella intermedia,
Tannerella forsythia,
Treponema denticola 등 세균과 관련이 있다
6).
구중청량제는 일상 생활중 사용될 수 있는 구강위생용품 중 간단하게 사용될 수 있는 용품으로 널리 이용되고 있다. 과거에는 구취 제거를 위한 구강보조용품으로 간주되었으나, 최근에는 여러 가지 효능성분을 첨가하여 구강질환 예방 및 치료 효과를 나타내는 구중 청량제가 많이 개발되고 있다
7,8). 구중청량제의 구강질환 예방 및 치료 효과를 위한 효능성분으로 클로르헥시딘을 주로 사용하였으나, 구강 내 상주균 변화, 미각이상, 착색 등의 부작용으로 인하여 장기간의 사용이 어려운 문제가 존재하였다
9). 세틸피리디늄염화물은 Quaternary Ammonium Compound로 구중청량제의 양이온성 살균제로 사용되며, 구강질환 병원균의 세포막의 투과성 변화를 통하여 항균작용을 한다고 보고되었다
10).
본 연구의 목적은 리소짐염산염 0.01%, 플루오르화나트륨 0.02%, 세틸피리디늄염화물 0.05% 구중 청량제의 항균 및 살균효능을 연구하여 구중 청량제의 효과를 연구하였다.
연구재료 및 방법
1. 세균 및 배양
본 실험에 사용된 세균 중 치아우식증 관련 세균으로는 그람양성 세균인 Streptococcus mutans ATCC 25175, Streptococcus sobrinus ATCC 27607 및 Lactobacillus acidophilus ATCC 9224를 이용하였으며, 치수 관련 세균으로는 치근단 치주염 관련 있는 그람양성 세균인 Enterococcus faecalis ATCC 29212를 이용하였다. 치주질환 관련 세균으로는 그람양성 세균인 Actinomyces israelii ATCC 12103과 그람음성 세균인 Aggregatibactger actinomycetemcomitans ATCC 43718, Prevotella intermedia ATCC 25611, Prevotella nigrescens ATCC 33536, Porphyromonas gingivalis ATCC 33277를 실험에 사용하였다.
S. mutans와 S. sobrinus는 tryptic soy 액체배지(TSB; BD biosciences, San Jose, CA, USA)를 이용하여 섭씨 37도 호기 상태에서 배양하였으며, L. acidophilus는 deMan Rogosa and Sharpe 액체배지(MRS;BD biosciences)를 이용하여 섭씨 37도 호기 상태에서 배양하였다. E. faecalis, A. israelii 및 A. actinomycetemcomitans는 brain heart infusion 액체배지(BHI; BD biosciences)를 이용하여 섭씨 37도 혐기 상태(H2 5%, CO2 10%, N2 85%)에서 배양하였다. P. intermedia, P. nigrescens 및 P. gingivalis는 BHI 액체배지에 hemin (0.5 μg/ml; sigmaaldrich Co., St. Louis, MO, USA), 비타민 K (0.2 μg/ml; sigmaaldrich Co.,)을 포함시켜 섭씨 37도 혐기 상태(H2 5%, CO2 10%, N2 85%)에서 배양하였다.
2. 실험 대상 시료 준비
실험에 사용할 구중 청량제를 50 ml 원추 튜브에 10 g씩 분배하여 넣은 후, 멸균 증류수를 40 ml까지 채운 상태에서 1분간 vortex 믹서를 이용하여 혼합하였다. 이후 10,000 × g 에서 10분간 원심분리하였고, 상층액을 깨끗한 튜브에 옮겨 구강 세균에 대한 항균력 및 살균력 실험에 사용하였다.
실험에 사용될 시약은 네 가지 군으로 나누어 준비하였다. 세틸피리디늄염화물, 플루오르화나트륨, 리소짐염산염의 비율을 다르게 하여
Table 1과 같이 준비하였다.
A, B군은 세틸피리디늄염화물과 플루오르화나트륨이 없이 리소짐염산염의 농도를 다르게 하여 준비하였으며, C, D군은 0.05% 세틸피리디늄염화물과 0.02% 플루오르화나트륨을 기초로 하여 리소짐염산염 농도를 다르게 하였다.
3. 살균력 시험
각각의 세균이 배양된 특정 액체배지에 배양된 세균을 4,000 × g에서 5분간 원심분리하고 깨끗한 액체배지를 넣고 세균 측정 챔버 (Bacterial counting chamber; Marienfeld, Lauda-Königshofen, Germany)를 이용하여 세균 양을 측정하였다. 측정된 세균 부유액에 다시 각각 세균 배양에 해당하는 깨끗한 배지를 이용하여 통성혐기성 세균은 1×107 cell/ml, 편성혐기성 세균은 1.5×107 cell/ml이 되도록 조정하여 시험에 사용한다. 50 ml 원주형튜브(SPL LifeSciences, Gyeonggido)에 준비된 4군의 시료를 10 ml 넣고 100 μl의 세균 부유액을 넣고 1분 동안 반응시키고 나서, 40 ml의 각 세균의 배지를 넣고, 각각의 세균에 해당하는 배양 배지를 적용하여 10에서 105까지 연속적으로 희석을 시행하고, 각각의 희석된 세균 부유액을 고체배지에 접종하였다. S. mutans 및 S. sobrinus는 Mitis-salivarius 고체배지(BD Bioscience, San Jose, CA, USA)에 접종하였으며, L. acidophilus는 MRS 고체배지를 섭씨 37도에서 36시간 동안 배양을 진행하고, 집락 수를 측정하였다. 또한 E. faecalis, A. israelii 및 A. actinomycetemcomitans는 BHI 고체배지에 접종하고 섭씨 37도 혐기 환경에서 36시간 동안 배양을 진행하고 집락 수를 측정하였다. P. intermedia, P. nigrescens 및 P. gingivalis는 Blood agar base (BD biosciences)에 5% 면양혈액, hemin, 비타민 K를 넣은 혈액고체배지에 접종하고 섭씨 37도 혐기 환경에서 5일간 배양하고 집락 수를 측정하였다. 생균수 계산 및 살균감소율은 아래의 결정에 따라 결정하였다.
진행되는 실험 중 처음을 진행되는 희석 단계에서는 각각의 적용 배지를 이용하여 중화 과정을 진행하고 시험을 시행하다. 그리고, 배지에서 세균이 증식이 나타난 경우, 배지상에서 보이는 균의 수에 희석 배수를 곱하여, 계산하였고, 배지에서 세균이 증식이 나타나지 않은 경우에는 중화단계에서 이루어진 희석배수를 곱하여 [10 미만 (<10)]으로 표시하였다. 모든 단계의 세균 수의 측정과정은 고체배지를 사용하여 진행되었다.
4. 향균력 시험
민감도 시험은 Clinical & Laboratory Standard Institute의 방법을 이용하였다. 우선 액체배지에서 배양된 세균을 4,000 × g에서 5분간 원심분리를 진행하였으며, 이후 각각 세균에 대한 특정 액체배지를 넣고나서, 세균 측정 챔버를 이용하여 세균 양을 측정 후 기록하였다. 측정된 세균 부유액에 깨끗한 배지를 이용하여 S. mutans, S. sobrinus 및 L. acidophilus는 1.0×106 cell/ml, 혐기성 세균은 1.5×106 cell/ml이 되도록 조정을 시행하였으며, 이후 시험에 사용하였다. 시료에 대한 민감도의 측정을 하기 위해서 96-well plate에 각각의 배지 180 μl를 적용하고, 첫 번째 열에 준비된 구중 청량제를 넣고 2배씩 연속 희석법을 사용하여 희석을 진행하였다. 이후 세균 부유액을 20 μl씩 넣고 혐기배양기에서 12시간 내지 24시간 동안 배양하였다. 세균 성장 여부를 측정하기 위해, 분광광도계(BioTek, Winooski, VT, USA)를 이용하여 660 nm 파장에서 흡광도를 측정하여 조사하고 기록하였다.
5. 통계학적 분석
통계학적 유의성 검사는 IBM SPSS Statistics 24.0 (IBM Inc., Armonk, New York, USA)을 사용하여 군간 비교는 2-sample t-test 및 Mann-Whitney test로 분석하였으며, 군내 비교는 paired t-test, Wilcoxon’s signed rank test로 분석하였다. 유의수준은 0.05로 하였다.
실험 결과
1. S. mutans에 대한 시험
1.1. S. mutans에 대한 살균력 검사
S. mutans에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [1.01×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.52×10
6 CFU/ml]로 48.51%의 살균력이 나타났으며, 실험군 2에서는 [0.41×10
6 CFU/ml]로 59.41%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99%이상의 살균력을 보였다(
Table 2).
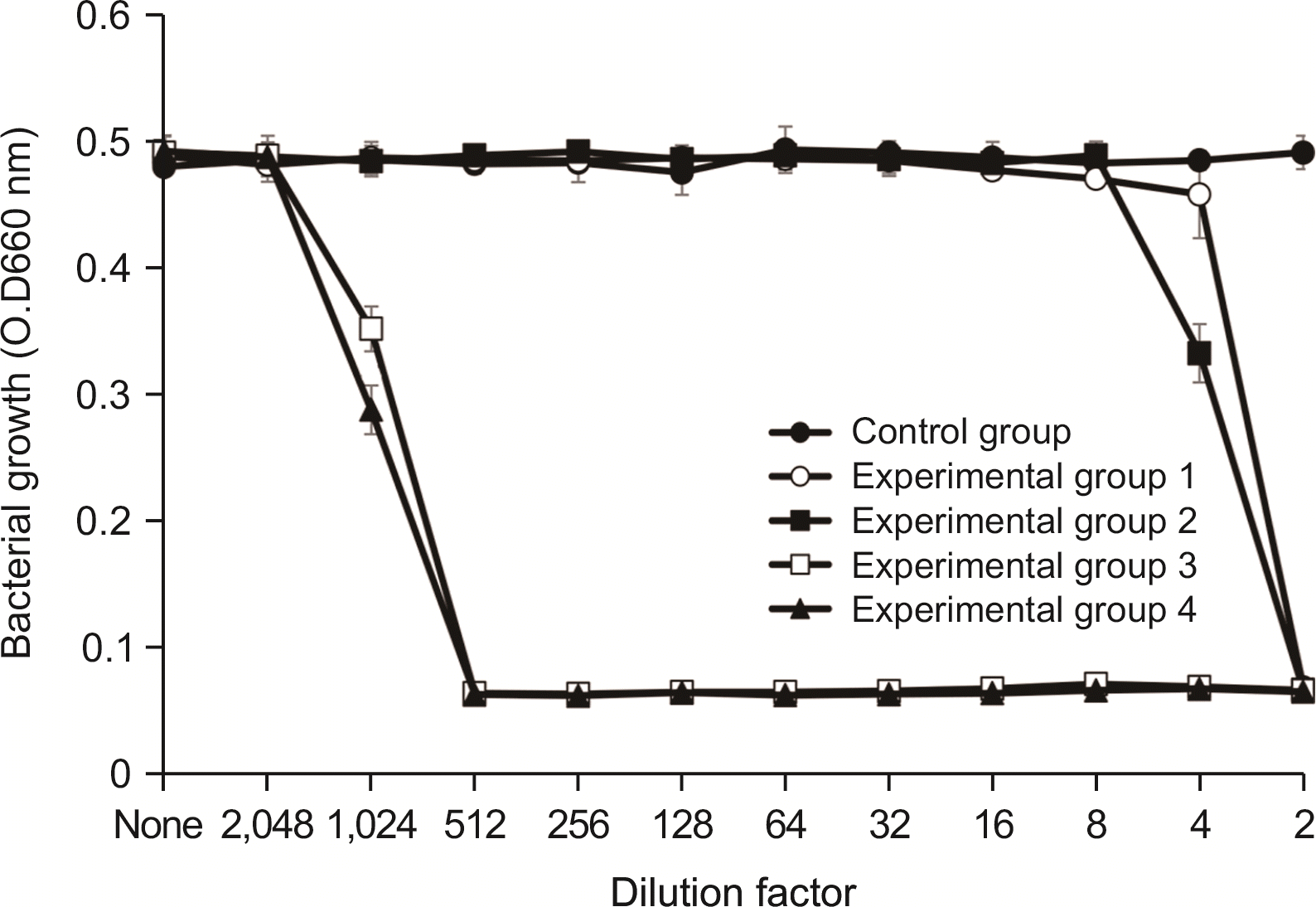
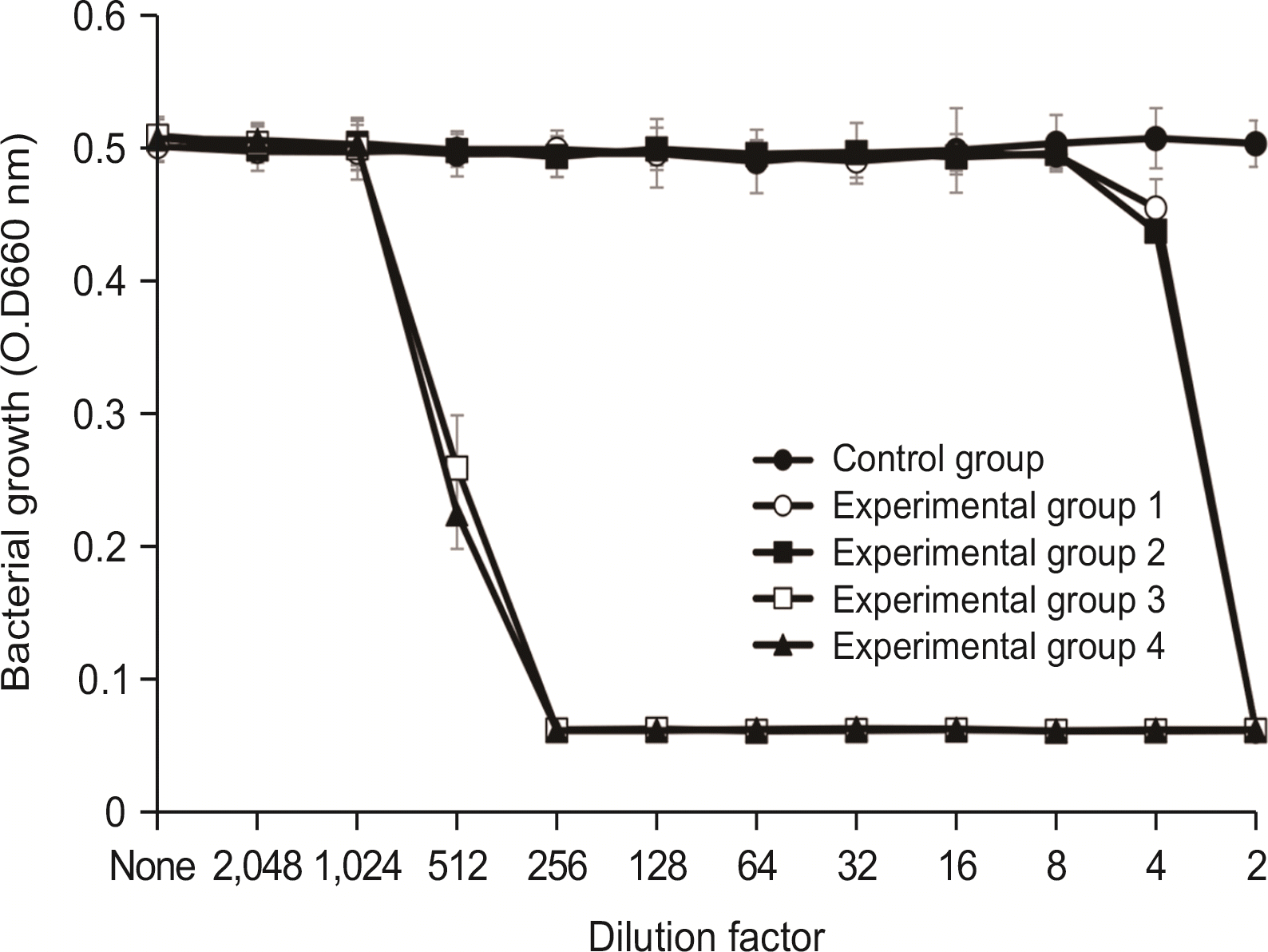
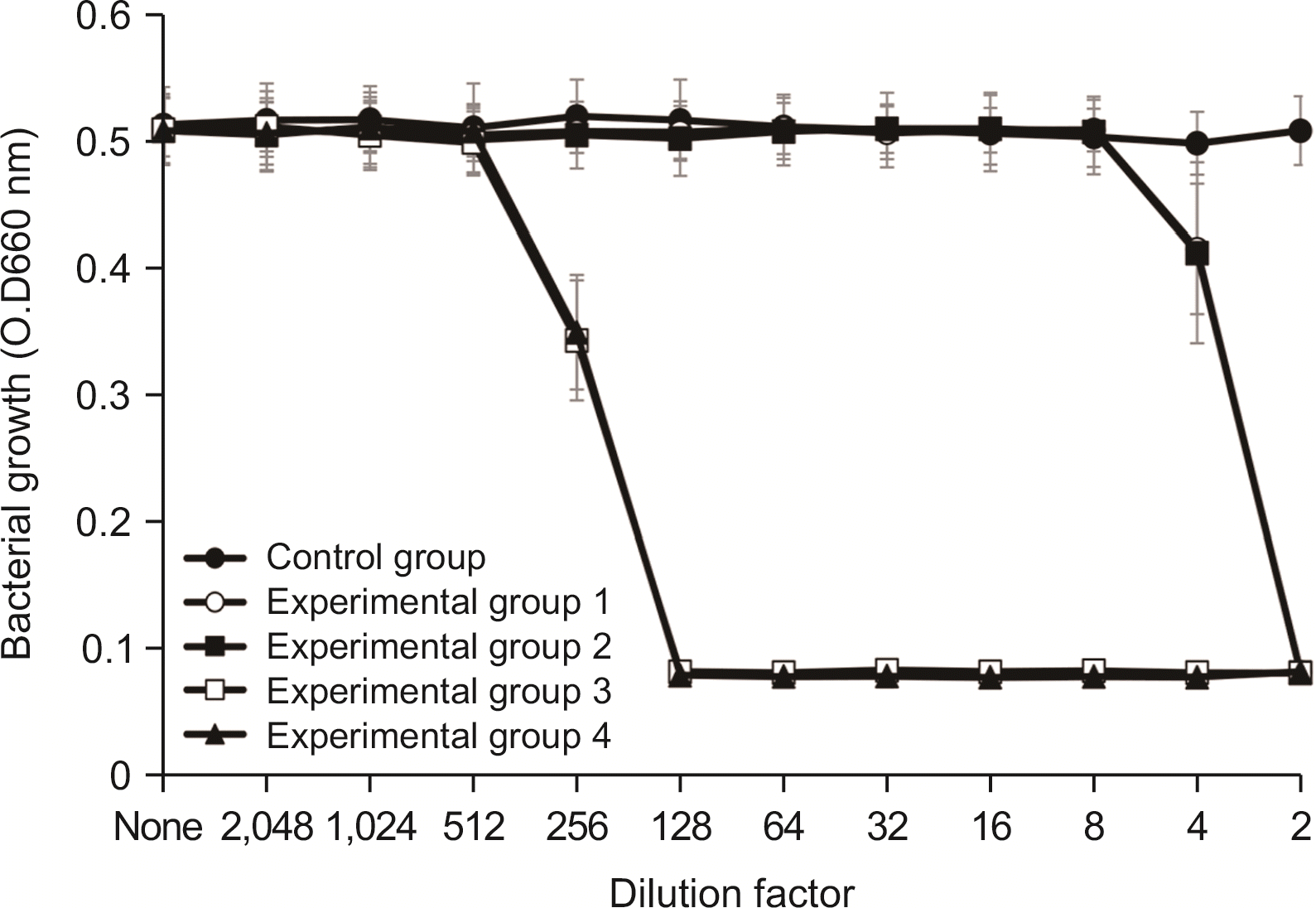
1.2. S. mutans에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 512배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 1,024배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 1).
2. S. sobrinus에 대한 시험
2.1. S. sobrinus에 대한 살균력 검사
S. sobrinus에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [1.03×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.77×10
6 CFU/ml]로 34.95%의 살균력이 나타났으며, 실험군 2에서는 [0.54×10
6 CFU/ml]로 47.57%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 3).
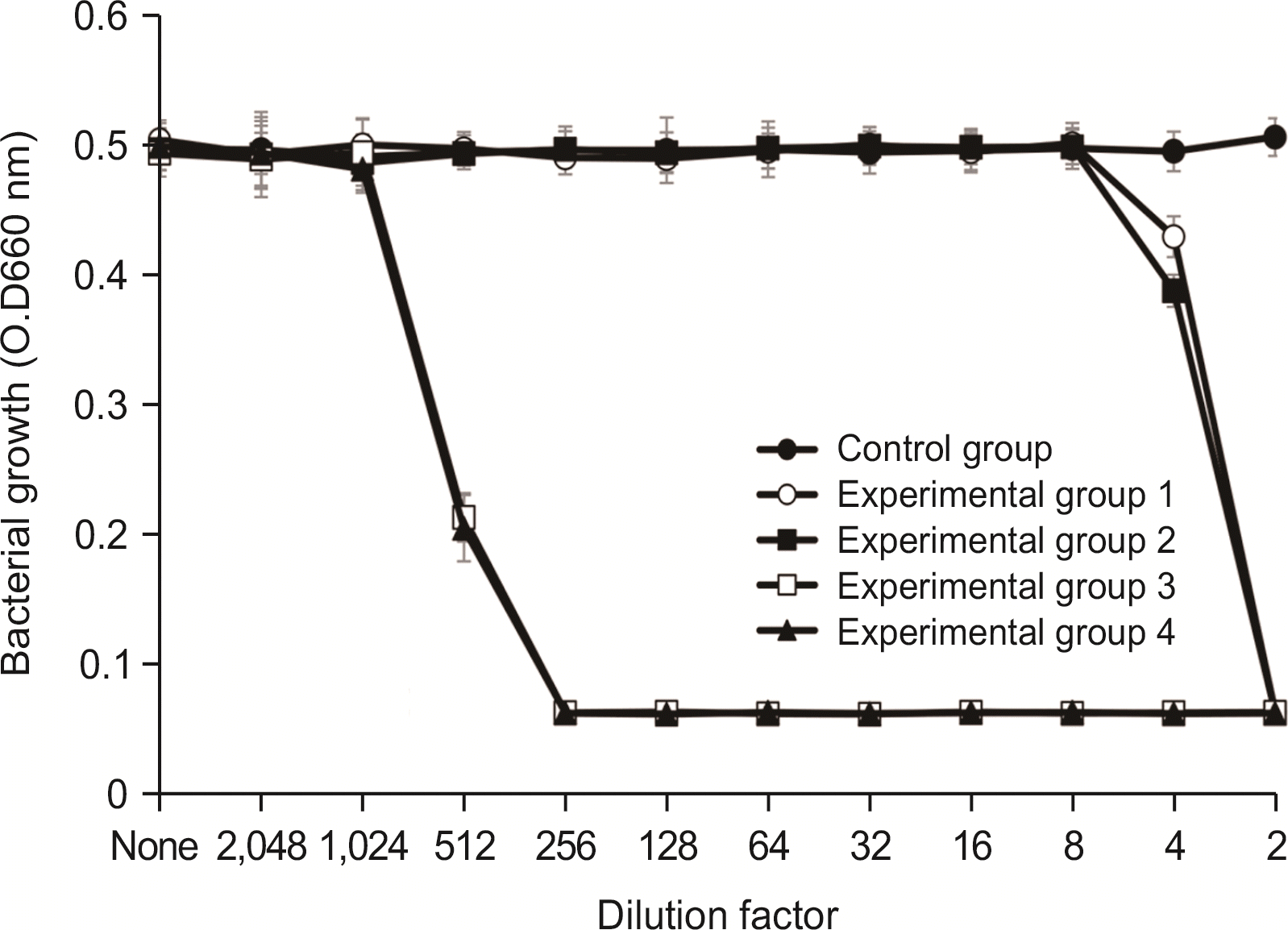
2.2. S. sobrinus에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 512배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 1,024배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 2).
3. L. acidophilus에 대한 시험
3.1. L. acidophilus에 대한 살균력 검사
L. acidophilus에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [0.95×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.72×10
6 CFU/ml]로 24.21%의 살균력이 나타났으며, 실험군 2에서는 [0.71×10
6 CFU/ml]로 25.26%의 살균력이 나타났다. 실험군 3에서는 [3.25×10
4 CFU/ml]로 99.65% 및 실험군 4에 대해서는 [2468 CFU/ml]로 99.97%의 살균력을 보였다(
Table 4).
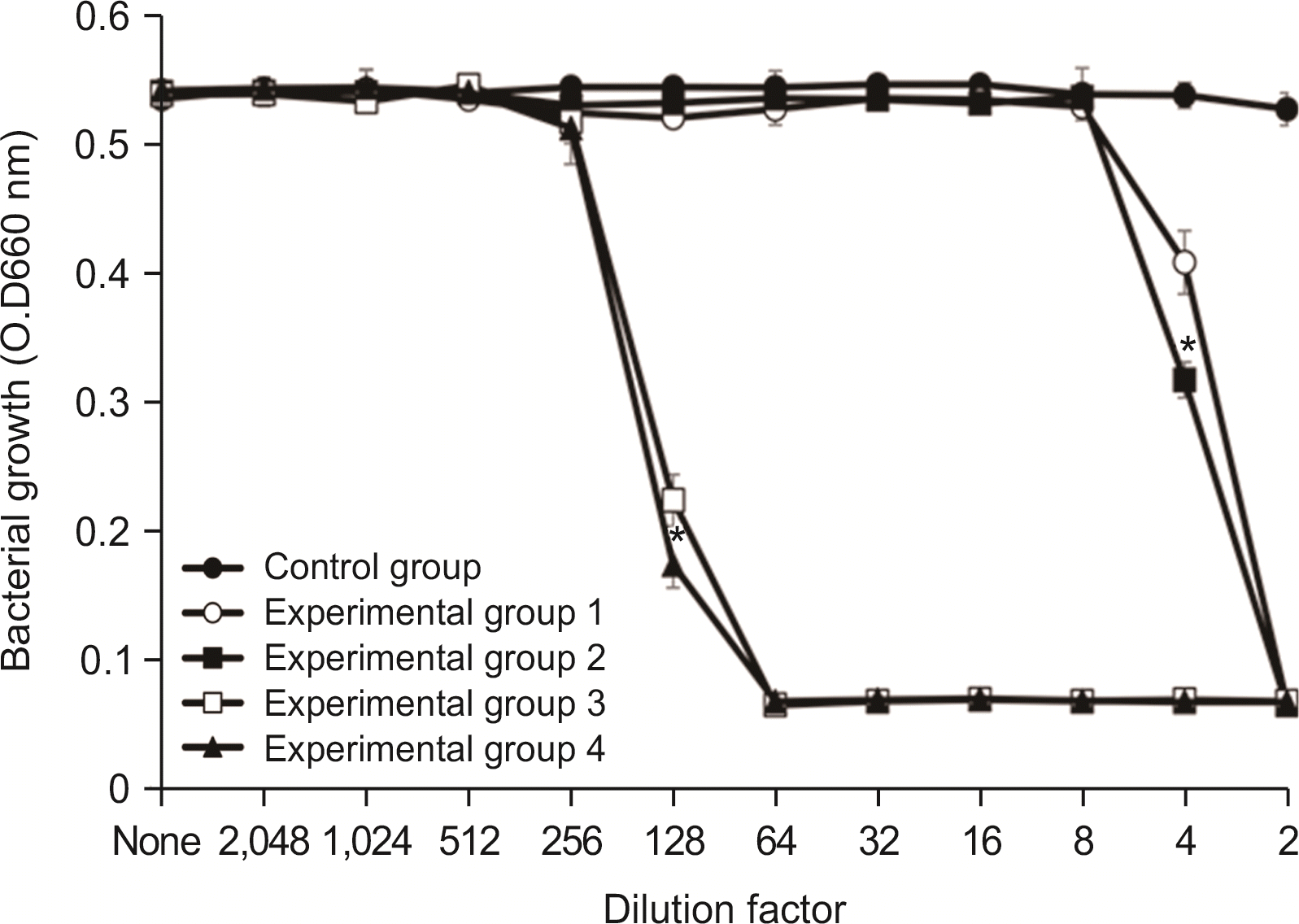
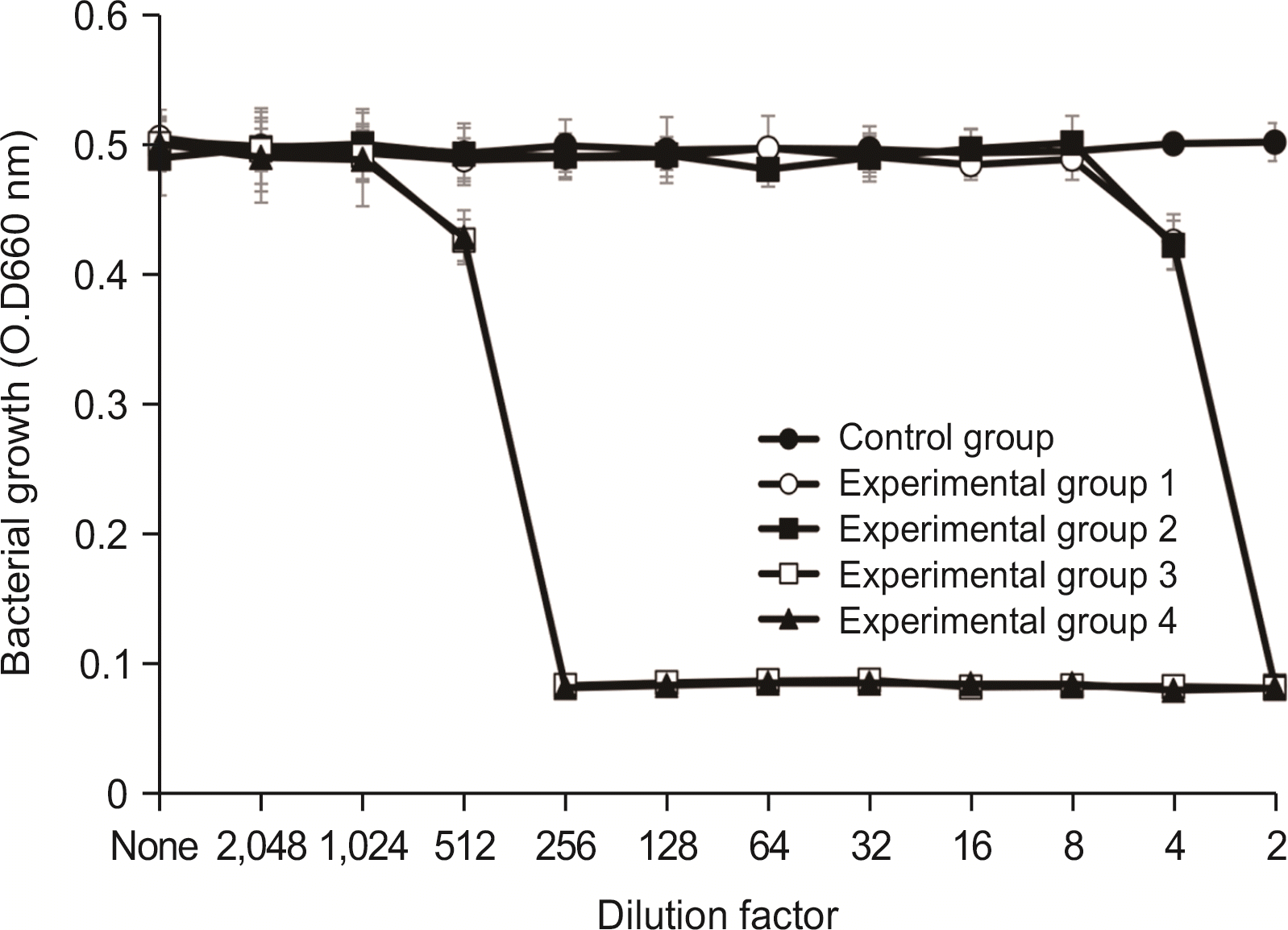
3.2. L. acidophilus에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 64배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 128배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 3).
4. E. faecalis에 대한 시험
4.1. E. faecalis에 대한 살균력 검사
E. faecalis에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [0.92×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.91×10
6 CFU/ml]로 1.08%의 살균력이 나타났으며, 실험군 2에서는 [0.73×10
6 CFU/ml]로 20.65%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 5).
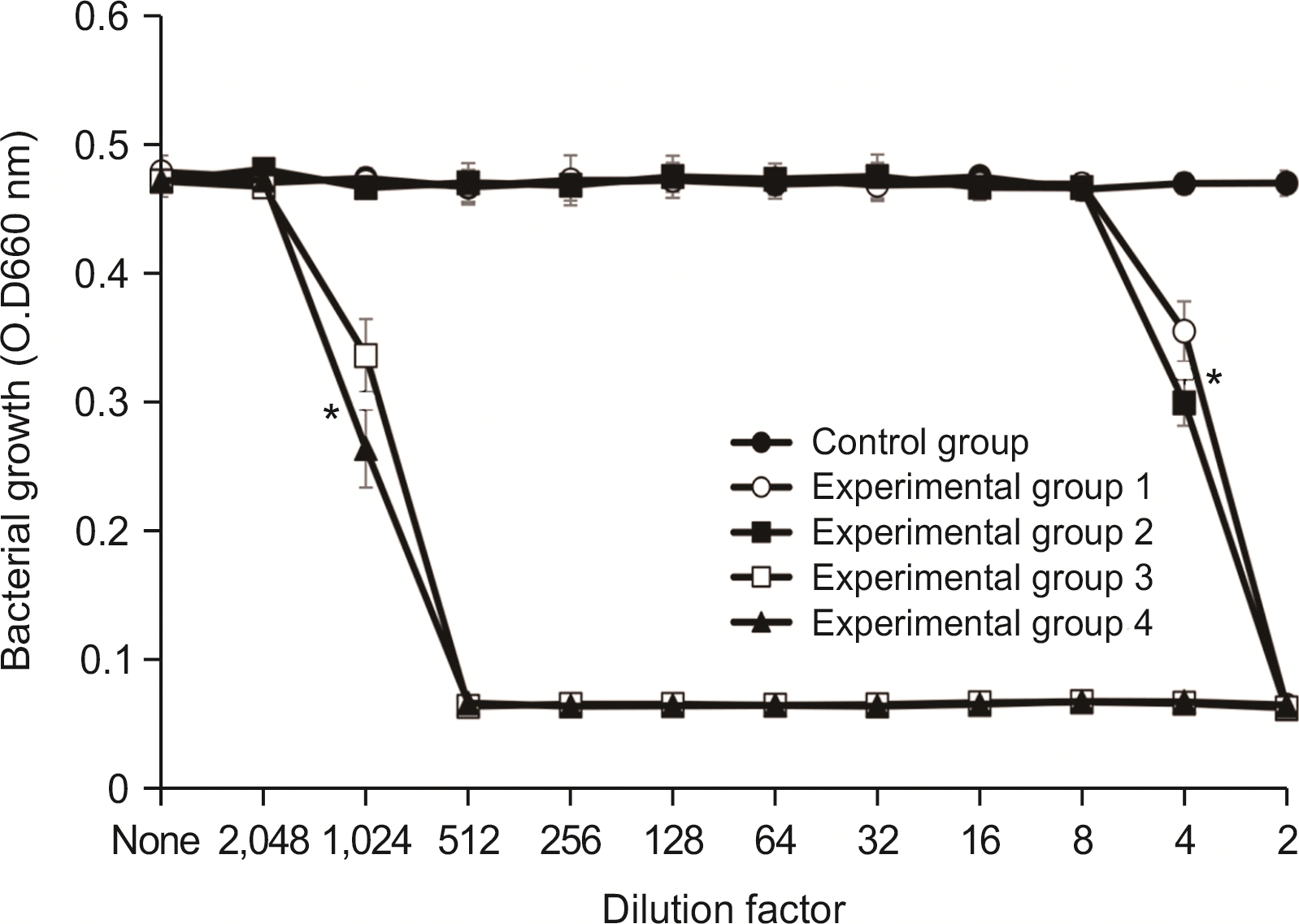
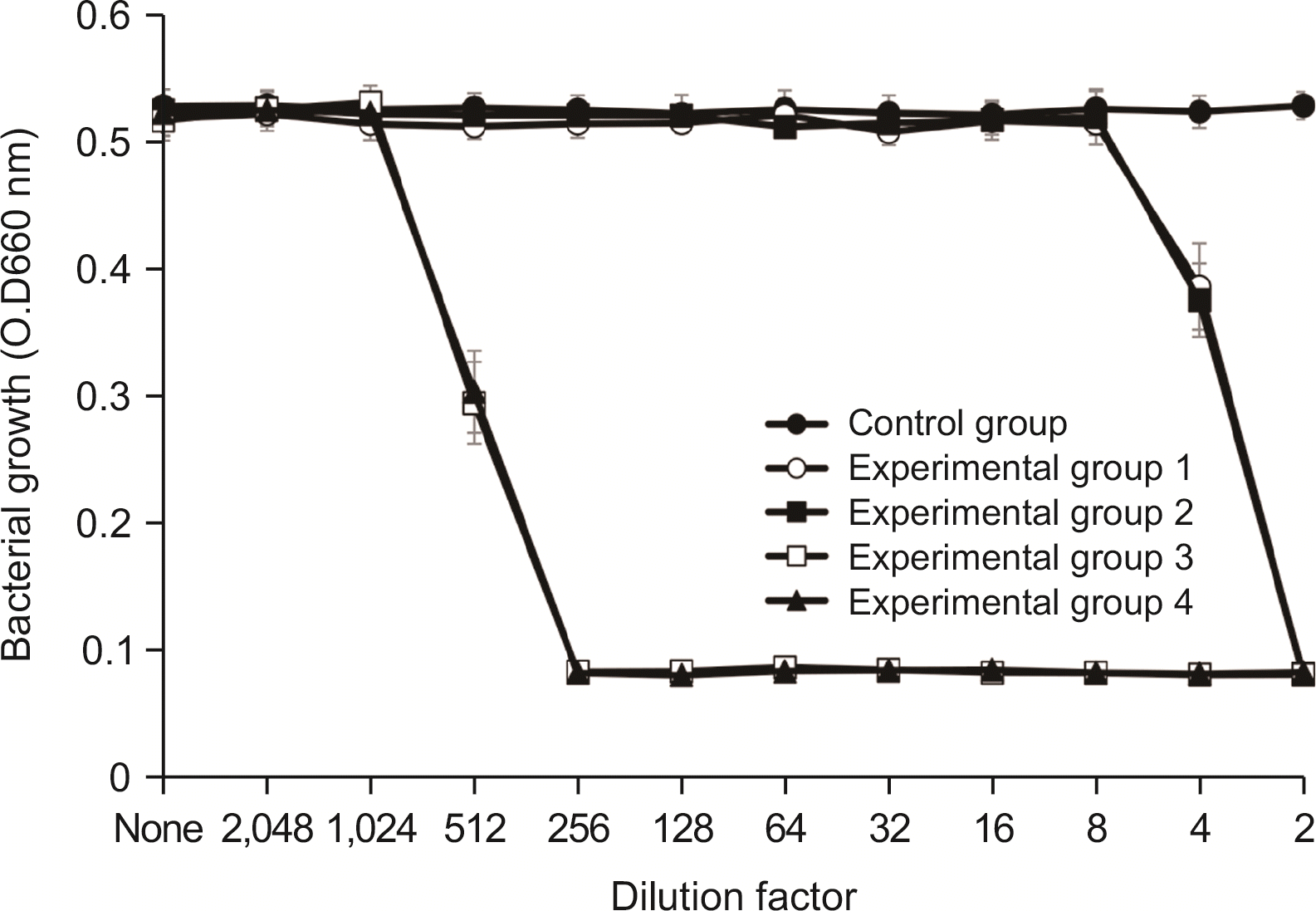
4.2. E. faecalis에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 128배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 256배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 4).
5. A. israelii에 대한 시험
5.1. A. israelii에 대한 살균력 검사
A. israelii에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [0.87×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.57×10
6 CFU/ml]로 34.48%의 살균력이 나타났으며, 실험군 2에서는 [0.62×10
6 CFU/ml]로 28.73%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 6).
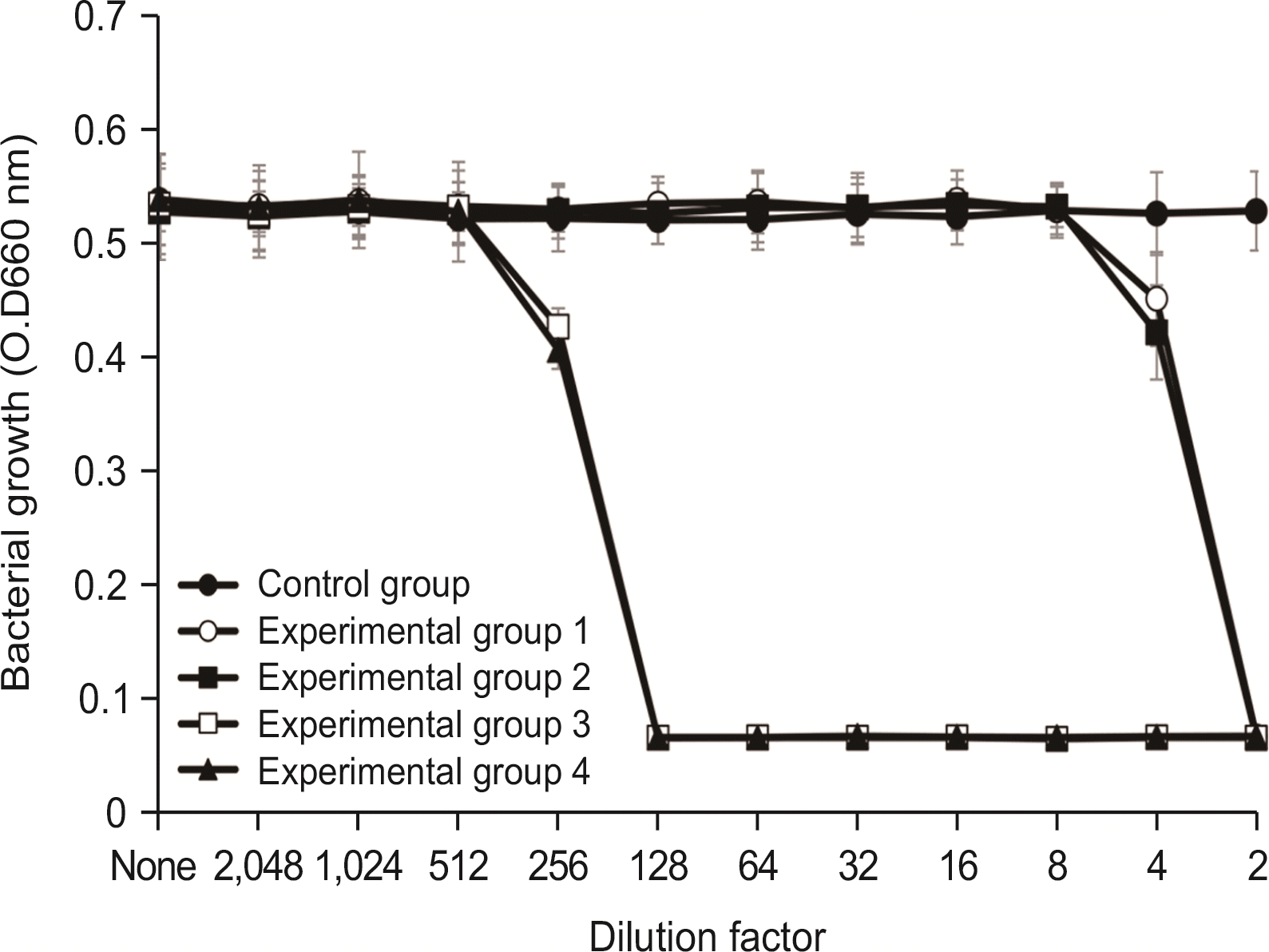
5.2. A. israelii에 대한 항균력 검사
A. israelii에 대한 항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 256배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 512배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 5).
6. A. actinomycetemcomitans에 대한 시험
6.1. A. actinomycetemcomitans에 대한 살균력 검사
A. actinomycetemcomitans에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [1.21×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [1.19×10
6 CFU/ml]로 1.65%의 살균력이 나타났으며, 실험군 2에서는 [1.11×10
6 CFU/ml]로 8.26%의 살균력이 나타났다. 실험군 3과 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 7).
6.2. A. actinomycetemcomitans에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 256배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 512배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 6).
7. P. intermedia에 대한 시험
7.1. P. intermedia에 대한 살균력 검사
P. intermedia에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [1.21×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [1.01×10
6 CFU/ml]로 16.53%의 살균력이 나타났으며, 실험군 2에서는 [1.08×10
6 CFU/ml]로 10.74%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 8).
7.2. P. intermedia에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 256배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 512배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 7).
8. P. nigrescens에 대한 시험
8.1. P. nigrescens에 대한 살균력 검사
P. nigrescens에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [0.94×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.84×10
6 CFU/ml]로 10.64%의 살균력이 나타났으며, 실험군 2에서는 [0.83×10
6 CFU/ml]로 11.70%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 9).
8.2. P. nigrescens에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 256배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 512배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 8).
9. P. gingivalis에 대한 시험
9.1. P. gingivalis에 대한 살균력 검사
P. gingivalis에 대한 살균시험 결과, 대조군인 배지를 이용하여 처리하고 배양한 세균수는 [0.73×10
6 CFU/ml]로 측정되었으며, 실험군 1에서는 [0.45×10
6 CFU/ml]로 38.35%의 살균력이 나타났으며, 실험군 2에서는 [0.47×10
6 CFU/ml]로 35.61%의 살균력이 나타났다. 실험군 3 및 실험군 4에 대해서는 [10< (10미만) CFU/ml]로 감소되어 99.99% 이상의 살균력을 보였다(
Table 10).
9.2. P. gingivalis에 대한 항균력 검사
항균력 시험에서 실험군 1과 실험군 2에서는 2배 희석한 시료에서 세균의 성장이 완전히 억제되었으며, 4배 희석한 시료에서 항균력이 있는 것으로 나타났다. 실험군 3 및 실험군 4는 128배 희석한 시료에서 세균의 성장을 완전히 억제시켰으며, 256배 희석한 시료에서 세균의 성장억제 효과를 보였다(
Fig. 9).
총괄 및 고안
구강질환은 구강 내 세균의 대사산물과 독소에 의해 발생한다. 이러한 세균의 활동을 제거하기 위하여 다양한 효능성분이 포함된 구강위생용품이 개발되고 있다
11). 구강질환 유발 세균에 대한 항균제로 클로르헥시딘이 대표적으로 사용되었으나, 구강 내 착색 및 미각장애 등의 여러 가지 부작용으로 인하여 장기간 사용이 어려우며
9), 양이온성 항균물질인 염화세틸피리디늄은 다양한 부작용을 가진 클로르헥시딘과 비교하여 부작용이 적고 초기 치주질환 완화 효과를 가진다
12). Sakata 등(1986)은 리소짐염산염이 클로르헥시딘과 비교하여 치주질환을 완화효과를 가지고 있다고 하였으며
13), Ishikawa 등(1992)은 치면세마를 동반하는 경우 리소짐염산염의 치은염 완화에 효과적이라고 보고하였다
14).
실험군 1, 2, 3, 및 4 시료에 대한 살균력 및 항균력 평가를 일반적인 살균, 항균 시험방법으로 수행하였을 때, 실험군 3과 4 시료에서 S. mutans 등 8종의 구강 유해균에 대해서 99.99% 이상의 살균력을 나타내었으며, L. acidophilus에 대해서는 99.97% 이상의 살균력을 보이는 것으로 관찰되었다. 실험군 1 및 실험군 2에 대해서는 상대적으로 낮은 살균력을 보이는 것으로 관찰되었다. 이는 세틸피리디늄염화물의 살균효과가 리소짐염산염의 효과와 비교하였을 때 강력한 살균력을 가지고 있다고 확인할 수 있었다.
항균력 평가에서는 L. acidophilus, S. mutans 및 S. sobrinus 균에 대해서 실험군 1과 실험군 2에서 유의적인 차이를 나타냈으며, 실험군 3과 실험군 4에 대해서도 유의적인 차이를 보였다. 전체적인 경향을 보면 항균력에 대해서는 실험군 1<실험군 2<실험군 3<실험군 4 순서로 항균력이 강한 것으로 나타났다. 시험에 사용된 모든 세균에 대해서 실험군 1 및 2 시료보다 실험군 3 및 4 시료가 더 강한 항균력을 보이는 것으로 관찰되었다.
이상의 연구결과를 근거로 비록 실험실에서 배양을 통한 실험결과로 실제 리소짐염산염 0.01%, 플루오르화나트륨 0.02%, 세틸피리디늄염화물 0.05% 구중 청량제의 항균 및 살균효능을 평가하기 위하여서는 임상 연구가 필요하다고 판단된다. 또한 리소짐염산염의 살균 및 항균효과에 대한 추가적인 연구가 필요하며, 구강 세균에 대한 평가 뿐만 아니라 치면세균막 내의 세균에 대한 추가적인 연구가 필요하다고 사료된다.
결 론
본 연구는 리소짐염산염 0.01%, 플루오르화나트륨 0.02%, 세틸피리디늄염화물 0.05% 구중 청량제의 항균 및 살균효능을 규명하기 위해 구강질환 유발 세균과 관련하여 항균 효능을 실험실적 시험으로 평가하여 보고자 실험을 시행한 결과 다음과 같은 결론을 얻었다.
1) 리소짐염산염 0.01%, 플루오르화나트륨 0.02%, 세틸피리디늄염화물 0.05% 구중 청량제는 S. mutans 등 8종의 구강 유해균에 대해서 99.99% 이상의 살균력을 나타내었다.
2) 리소짐염산염 0.01%, 플루오르화나트륨 0.02%, 세틸피리디늄염화물 0.05% 구중 청량제는 L. acidophilus에 대해서는 99.97% 이상의 살균력을 보이는 것으로 관찰되었다.
3) 항균력 평가에서는 L. acidophilus, S. mutans 및 S. sobrinus 균에 대해서 실험군 1과 실험군 2에서 유의적인 차이를 나타냈으며, 실험군 3과 실험군 4에 대해서도 유의적인 차이를 보였다.
이를 토대로 리소짐염산염 0.01%, 플루오르화나트륨 0.02%, 세틸피리디늄염화물 0.05% 구중 청량제의 구강질환 유발 세균에 대한 살균 및 항균효과를 확인할 수 있었다.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download