Abstract
Thyroid hormones have an important physiological role in maintaining adult bone structure and strength. Therefore, thyroid dysfunction is inevitably associated with various degrees of skeletal consequences. Endogenous overt hyperthyroidism is an established cause of high bone turnover with accelerated bone loss, resulting in osteoporosis and an increased risk of fractures. Hyperthyroidism induced by thyroid stimulating hormone suppression therapy in patients with differentiated thyroid cancer also has emerged as a contributing factor to osteoporosis and fragility fractures. While, there is lack of evidence that hypothyroidism negatively affects bone health. Although there is growing clinical evidence of the importance of bone health in hyperthyroidism, clinical guidelines on how to evaluate and manage bone health in these diseases have not yet been published worldwide. The Task Force from the Korean Thyroid Association Committee of Clinical Practice Guideline has developed this position statement for the evaluation and management of bone health in patients with thyroid diseases, particularly focused on endogenous hyperthyroidism and thyroid stimulating hormone suppression therapy-associated hyperthyroidism in patients with differentiated thyroid cancer.
갑상선기능저하증이 골다공증 및 골절의 위험도를 증가시킨다는 증거는 충분하지 않다. 따라서, 갑상선기능저하증 환자에서는 일반적인 골다공증 진료지침에 근거하여 골건강을 평가하고 관리해야 한다(E).
1.1. 폐경 후 여성에서는 진단 시 중심골(요추, 대퇴) DXA (dual energy X-ray absorptiometry, 이중에너지방사선흡수계측)를 이용하여 골건강을 평가해야 한다(A). 정량적 초음파측정법(quantitative ultrasound)을 비롯한 말단골(중심골이 아닌 부위; 손목, 발목, 발뒤꿈치) 골밀도검사는 DXA에 비해 간편하게 시행할 수 있으나 T-값이 DXA에서 측정된 수치에 비해 낮게 측정되는 경향을 보이고 정밀도가 낮아 추적 검사에 이용할 수 없다는 제한점이 있으므로 중심골 DXA가 우선 권고된다(E).
1.2. 폐경 전 여성과 70세 미만 남성에서 갑상선기능항진증은 골다공증을 유발할 수 있는 질환이므로 DXA를 이용한 골건강 평가를 고려할 수 있다(E). 70세 이상 남성에서는 일반적인 골다공증 진료지침에 근거할 때, 진단 시 DXA를 이용하여 골건강을 평가해야 한다(E).
1.3. 추적 DXA는 일반적인 골다공증 진료지침의 권고 간격에 따라 시행되어야 한다(E).
2.1. 골표지자를 이용한 골건강 평가는 일반적으로 권고되지 않는다. 단, 골다공증으로 진단된 환자에서는 치료 반응 평가를 위해 진단 시 및 추적 골표지자 검사가 권고된다(E).
2.2. 소주골 점수, 대퇴골 형태 구조 및 고해상도 CT를 포함한 영상학적 골질 평가법으로 DXA를 대체하여 골건강을 평가하는 것은 권고되지 않지만 DXA에 보조적인 검사로 활용할 수 있다(E).
3.1. 칼슘과 비타민 D 보충은 폐경 후 여성과 50세 이상의 남성에서 고려되며, 특히 DXA상 골감소증 또는 골다공증으로 진단된 경우 보충이 권고된다(E).
3.2. 폐경 전 여성과 50세 이하의 남성에서는 정상 골밀도를 보이는 경우 칼슘과 비타민 D 보충요법의 득과 실에 대한 근거는 없다(E). 폐경 전 여성과 50세 이하의 남성에서 DXA상 Z-값이 연령 기대치 이하인 경우 보충이 권고된다(E).
4.1. 폐경 후 여성과 50세 이상의 남성에서 DXA상 골다공증으로 진단되었거나 임상적으로 골절의 위험도가 높게 평가되는 경우 골다공증 약물치료가 권고된다(C).
4.2. 폐경 전 여성과 50세 미만의 남성에서 DXA상 Z-값이 연령 기대치 이하인 경우에는 갑상선기능항진증을 우선 치료하면서 골밀도의 호전 여부를 재평가해볼 수 있다(E). 그러나 골절 위험도가 높은 환자에서는 진단 시 골다공증 약물치료를 바로 고려해볼 수 있겠다(E).
4.3. 골다공증 약물치료는 비스포스포네이트를 포함한 골흡수억제제가 권고되며, 골절의 위험도가 높게 평가되는 경우 골형성촉진제를 고려할 수 있다(E).
5.1. 폐경 후 여성과 70세 이상 남성에서는 일반적인 골다공증 진료지침에 따라 DXA를 이용하여 골건강을 평가해야 한다(E). 폐경 전 여성과 70세 미만 남성에서 무증상 갑상선기능항진증 자체가 골다공증을 유발한다는 증거는 부족하지만 갑상선자극호르몬(thyroid stimulating hormone, TSH) 수준이 0.1 mU/L 미만이라면 골절의 위험이 증가하므로 DXA를 이용한 골건강 평가를 고려할 수 있다(E).
5.2. 칼슘과 비타민 D 보충은 DXA에서 골감소증과 골다공증으로 진단된 환자에서 권고된다(E).
5.3. 골다공증 약물치료는 DXA에서 골다공증과 골감소증으로 확인된 환자에서 고려해볼 수 있다(E).
1.1. 폐경 후 여성에서는 TSH 억제요법을 시작할 때 DXA를 이용한 골건강 평가가 권고된다(A).
1.2. 폐경 전 여성과 70세 미만 남성에서는 골다공증 골절 위험이 높은 경우 TSH 억제요법을 시작할 때 DXA를 이용한 골건강 평가를 고려할 수 있다. 70세 이상 남성에서는 일반적인 골다공증 진료지침에 근거할 때, 치료 시작 시 DXA를 이용하여 골건강을 평가해야 한다(E).
1.3. TSH 억제요법을 지속하고 있는 폐경 전 여성에서 폐경이 확인되거나 남성의 경우 70세 이상이 되면 DXA를 이용하여 골건강을 평가해야 한다(E).
1.4. 추적 DXA는 일반적인 골다공증 진료지침의 권고 간격에 따라 시행되어야 한다(E).
2.1. 골표지자를 이용한 골건강 평가는 일반적으로 권고되지 않는다. 단, 골다공증으로 진단된 환자에서는 치료 반응 평가를 위해 진단 시 및 추적 골표지자 검사가 권고된다(E).
2.2. 소주골 점수, 대퇴골 형태 구조 및 고해상도 CT를 포함한 영상학적 골질 평가법으로 DXA를 대체하여 골건강을 평가하는 것은 권고되지 않지만 DXA에 보조적인 검사로 활용할 수 있다(E).
3.1. 칼슘과 비타민 D 보충은 폐경 후 여성과 50세 이상의 남성에서 고려되며, 특히 DXA상 골감소증 또는 골다공증으로 진단된 경우 보충이 권고된다(E).
3.2. 폐경 전 여성과 50세 이하의 남성에서는 정상 골밀도를 보이는 경우 칼슘과 비타민 D 보충요법의 득과 실에 대한 근거는 없다(E). 폐경 전 여성과 50세 이하의 남성에서 DXA상 Z-값이 연령 기대치 이하인 경우 보충이 권고된다(E).
갑상선호르몬은 골 성장, 발달 및 재형성(remodeling)에 관련되어 있다.1) 갑상선호르몬은 조골세포의 갑상선호르몬수용체 α를 통해 작용하고 조골세포 매개 사이토카인 신호전달을 통해 파골세포의 골흡수를 자극한다.2,3) 갑상선호르몬은 또한 성인의 골 구조와 강도를 유지하는 데 중요한 생리학적 역할을 한다. 따라서 갑상선기능장애는 필연적으로 다양한 정도의 골격계 이상을 초래할 수 있다. 그러나 갑상선호르몬이 뼈에 작용하는 세포 및 분자 메커니즘에 대해서는 여전히 논란의 여지가 있으며 아직 잘 알려져 있지 않다.
현성(overt) 갑상선기능저하증에서는 조골세포를 통한 골형성이 감소하고 파골세포를 매개로 한 골흡수도 함께 감소하면서 낮은 골교체율을 보인다.4) 이를 통해 골재형성 주기가 지연되면서 골 부피의 변화 없이 골 무기질화 및 골밀도의 순 증가(net increase)가 초래된다. 그러나 현재까지 발표된 임상 연구들을 살펴보면 연구 수가 적고, 결과가 상이하여, 갑상선기능저하증과 골밀도 또는 골절의 유의한 상관성을 입증하기 어렵다. 일부 연구에서 골절의 증가가 관찰되었으나 이는 레보티록신 치료와 관련한 것으로, 치료되지 않은 갑상선기능저하증 환자에 대한 장기간의 전향적 추적 관찰 연구가 없어 실제로 갑상선기능저하증 자체가 골격계에 어떻게 영향을 미칠지는 결론 내리기 어렵다.5-7)
현성 갑상선기능항진증은 높은 골교체율로 인해 골소실이 가속화되어 골다공증과 골절의 위험을 증가시킬 수 있다.5) 갑상선기능저하증에 대한 과도한 레보티록신 치료와 관련된 TSH 억제에 의해 유발되는 무증상(subclinical) 갑상선기능항진증도 골건강(bone health)에 해로운 영향을 미친다. TSH를 억제하는 레보티록신 요법은 폐경 후 여성에서 골소실을 초래하며,8) 이러한 효과는 소주골보다 피질골에서 더 컸다.9)
갑상선기능항진증 외에도 TSH 억제요법을 받는 갑상선암 환자에서 골다공증 및 취약 골절에 대한 우려가 증가하고 있다. 갑상선전절제술을 받은 갑상선분화암(differentiated thyroid cancer, DTC) 환자에서는 TSH 억제를 위해 고용량 레보티록신 치료가 필요한 경우가 많다. TSH 억제요법은 갑상선분화암에서 수술 후 재발을 줄이기 위한 치료의 핵심이다. 그러나 이로 인한 갑상선기능항진 상태는 특히 폐경 후 여성에서 골다공증의 위험 증가와 관련이 있다.10) TSH 억제 치료는 갑상선분화암 환자에서 자극된 조골세포 및 파골세포 활성을 통한 골흡수의 위험 증가와 관련이 있지만,11) 이러한 환자에서 골다공증 약물의 치료 효능에 대한 연구는 아직까지 부족한 실정이다. 골다공증과 취약 골절은 갑상선분화암 환자의 삶의 질과 사망률에 잠재적으로 해로운 영향을 미친다.11,12) 따라서 미국갑상선학회 최신 가이드라인에서 골건강은 갑상선분화암 환자의 TSH 억제치료에 있어 중요한 결정 인자로 부각되었다.13)
갑상선기능항진증에서 골건강의 중요성에 대한 임상 증거가 증가하고 있음에도 불구하고 이러한 질환에서 골건강을 평가하고 관리하는 방법에 대한 임상 권고안은 아직 전세계적으로 발표되지 않았다.14-16) 특히 갑상선암의 유병률이 높고 건강검진을 통해 발생률이 증가하고 있는 우리나라에서는 이러한 문제에 대한 이해와 적절한 대처가 특히 필요하다.
이러한 맥락에서 대한갑상선학회 진료지침제정위원회는 갑상선질환, 특히 갑상선기능항진증에 초점을 맞추어 골건강 평가 및 관리를 위한 권고안을 제정하였다. 이 가이드라인은 갑상선기능항진증에서 골건강의 평가 및 관리에 대한 최근 문헌을 요약하고 이를 바탕으로 골건강 유지를 위한 권고안을 제시하고 있다.
이 권고안은 대한갑상선학회 진료지침제정위원회 산하에 구성된 Task Force 팀에 의해 제정되었다. 이 가이드라인은 이전 연구 결과를 바탕으로 갑상선 질환에 연관된 골건강의 평가 및 관리에 대한 내용을 담고 있으며, 특히 갑상선 질환 중에서 갑상선기능항진증과 갑상선분화암에서의 TSH 억제요법과 관련된 갑상선기능항진증을 중심으로 한다. 갑상선기능항진증과 갑상선분화암에서 TSH 억제요법으로 인한 갑상선기능항진증은 다른 방식으로 뼈에 영향을 미친다. 갑상선기능항진증은 항갑상선제로 치료를 시작하면 정상 갑상선기능의 회복을 통해 골소실 완화를 기대할 수 있다. 반면에 갑상선분화암 환자에서 TSH 억제요법은 종양 억제를 목적으로 일정 기간 갑상선기능항진증 상태가 지속되기 때문에 보다 장기간 뼈에 해로운 영향을 미칠 수 있다. 따라서 이 가이드라인은 갑상선기능항진증과 갑상선분화암에서 TSH 억제요법에 의한 갑상선기능항진증을 나누어서 각각에 대한 권고 사항을 제정하였다.
갑상선기능저하증이 골다공증 및 골절의 위험도를 증가시킨다는 증거는 충분하지 않다. 따라서, 갑상선기능저하증 환자에서는 일반적인 골다공증 진료지침에 근거하여 골건강을 평가하고 관리해야 한다(E).
1.1. 폐경 후 여성에서는 진단 시 중심골(요추, 대퇴) DXA를 이용하여 골건강을 평가해야 한다(A). 정량적 초음파측정법(quantitative ultrasound)을 비롯한 말단골(중심골이 아닌 부위; 손목, 발목, 발뒤꿈치) 골밀도검사는 DXA에 비해 간편하게 시행할 수 있으나 T-값이 DXA에서 측정된 수치에 비해 낮게 측정되는 경향을 보이고 정밀도가 낮아 추적 검사에 이용할 수 없다는 제한점이 있으므로 중심골 DXA가 우선 권고된다(E).
갑상선기능항진증은 주로 그레이브스병, 중독성 다결절성 갑상선종, 중독성 선종을 포함한다. 현성 갑상선기능항진증은 가속화된 골재형성과 골소실을 통해,19,20) 이차성 골다공증의 원인이 된다.21) 특히 폐경 후 여성에서 현성 갑상선기능항진증이 골밀도 감소와 3-4배 정도의 골절 증가와 관계 있다는 여러 연구 결과가 보고되었다.5,22-24) 갑상선기능항진증의 과거력이 고령 환자에서 골절의 위험과 연관이 있다는 일부 보고도 있다.25,26) Vestergaard 등27)은 25개의 연구를 포함한 메타분석을 발표하였는데, 정상 갑상선기능에 비해 갑상선기능항진증에서 고관절 골절이 증가하고 특히 50세 또는 그 이상에서 나이가 증가할수록 골절 위험도가 증가하였다. 미국에서 시행한 한 코호트 연구는 65세 또는 그 이상의 고령에서 TSH 수준이 0.1 mU/L 미만일 때 고관절 골절이 3배, 척추 골절이 4배 증가함을 보고하였다.23) 한 종단 연구에 따르면 갑상선기능항진증 치료 후에는 이로 인한 골 손실이 회복되는 결과를 보였다.28)
DXA는 골다공증을 진단하는 표준 방법으로 골절 위험도를 예측하는데 매우 유용하다.29,30) 따라서, 대한골대사학회 진료지침을 포함하여 골다공증과 관련한 대부분의 진료지침에서는,31-33) 65세 또는 그 이상의 폐경 후 여성에서 DXA를 시행하도록 권고하고 있다. 또한, 65세 미만의 폐경 후 여성에서도 갑상선기능항진증을 포함하여 이차성 골다공증의 위험인자가 있는 경우에는 DXA를 통해 골밀도 측정 및 골다공증 여부를 확인하도록 권고한다. 따라서, 현성 갑상선기능항진증을 진단받은 폐경 후 여성에서는 DXA로 골밀도를 측정하여 골다공증 여부를 평가하는 것이 반드시 필요하다.
정량적 초음파측정법(quantitative ultrasound)을 비롯한 말단골(중심골이 아닌 부위; 손목, 발목, 발뒤꿈치) 골밀도 측정은 DXA에 비해 간편하게 시행할 수 있고 기기 가격이 저렴하다는 장점이 있다. 그러나, 말단골 골밀도 측정을 통해 얻은 T-값이 DXA에서 측정된 수치에 비해 낮게 측정되는 경향을 보여 골다공증을 과잉 진단할 우려가 있고 원칙상 T-값을 진단에 적용할 수 없다는 단점이 있다. 또한 대부분의 말단골 골밀도는 정밀도가 낮아 추적 검사에 이용할 수 없다. 따라서 갑상선기능항진증 환자에서 골건강을 평가할 시 중심골 DXA를 이용하는 것이 바람직하다.
1.2. 폐경 전 여성과 70세 미만 남성에서 갑상선기능항진증은 골다공증을 유발할 수 있는 질환이므로 DXA를 이용한 골건강 평가를 고려할 수 있다(E). 70세 이상 남성에서는 일반적인 골다공증 진료지침에 근거할 때, 진단 시 DXA를 이용하여 골건강을 평가해야 한다(E).
폐경 전 여성과 남성에서 갑상선기능항진증이 골밀도 감소 또는 골절 위험도의 증가와 연관 있다는 일부 보고가 있다.34-36) 한 소규모 단면적 연구에서는 폐경 전 여성에서, 정상 갑상선기능에 비해 갑상선기능항진증이 유의한 골밀도 감소를 보여주었다.37) 현재까지의 연구 결과들을 토대로 폐경 전 여성과 남성에서 갑상선기능항진증이 골건강에 유의하게 해로운 영향을 미친다는 결론을 내리기는 어려우나 충분한 잠재적 가능성이 있다. 따라서, 폐경 전 여성과 70세 미만 남성에서는 갑상선기능항진증을 골다공증을 유발할 수 있는 질환으로 간주하여 DXA를 이용한 골건강 평가를 고려할 수 있다. 70세 이상 남성에서는 갑상선기능항진증으로 인한 골소실의 증거가 충분하지 않으나 고령으로 인해 골다공증 및 골절 위험이 증가되므로 현재 국내 보험 기준 및 골다공증 진료지침에서는 70세 이상 남성에서 DXA 시행을 권고하고 있다. 따라서, 갑상선기능항진증으로 진단된 70세 이상 남성에서는 DXA를 통한 골건강 평가가 필요하다.
1.3. 추적 DXA는 일반적인 골다공증 진료지침의 권고 간격에 따라 시행되어야 한다(E).
현성 갑상선기능항진증으로 인한 골소실은 자명하나 이로 인해 정상 갑상선기능에서보다 자주 골밀도 평가가 필요하다는 증거는 충분하지 않다. 현재 한국 보험기준에서는 추적 검사의 실시간격을 1년 이상으로 하되, 골밀도 결과가 정상인 경우는 2년 이상 지나야 추적 검사가 가능하다. 예외적으로 적극적인 골밀도 평가가 필요한 상황은 스테로이드를 3개월 이상 복용하거나 부갑상선기능항진증으로 약물치료를 받는 경우로 명시하고 있다. 따라서, 현성 갑상선기능항진증을 진단받고 추적 관찰을 하는 환자의 경우, DXA는 일반적으로 권고되는 골다공증 진료지침 수준에 따라 시행되어야 한다.
2.1. 골표지자를 이용한 골건강 평가는 일반적으로 권고되지 않는다. 단, 골다공증으로 진단된 환자에서는 치료 반응 평가를 위해 진단 시 및 추적 골표지자 검사가 권고된다(E).
현성 갑상선기능항진증에서 골표지자의 유용성을 평가한 여러 연구들이 있다.38-45) 한 연구에서 갑상선기능항진증 환자는 정상 갑상선기능을 가지고 있는 동일 연령과 비교하여 골형성표지자와 골흡수표지자의 증가를 보였는데, 변화 정도는 골흡수표지자에서 두드러졌다.38) 따라서 골흡수표지자가 골형성표지자보다는 골교체 상태를 평가하는데 더 민감할 수 있다.38,42) 남성 갑상선기능항진증 환자에서만 시행된 연구에서도 골표지자의 유의한 증가가 확인되었다.45) 일부 골표지자 수치는 혈청 유리 T3와 유의한 상관관계를 보여주기도 하였다.38,41) 증가된 골표지자는 갑상선기능항진증 치료 후에 회복되는데,38,41,43) 골흡수표지자가 골형성표지자보다 더 빠른 회복을 보였다.41) 그러나, 골표지자의 절대적 수치나 치료 이후의 변화가 DXA보다 뼈 상태를 더 잘 반영한다고 보기에는 근거가 아직 부족하다. 따라서, 골다공증이 동반된 현성 갑상선기능항진증이 아닌 경우, 골표지자만을 통한 골건강 평가는 권고되지 않는다. 그러나 갑상선기능항진증 환자에서 골다공증으로 진단된 경우에는 일반적인 골다공증 진료지침에 따라 골표지자 검사 시행이 권고되며, 골다공증 약물치료 시작 후에는 골표지자를 치료 반응 평가에 유용하게 사용할 수 있다.
2.2. 소주골 점수, 대퇴골 형태 구조 및 고해상도 CT를 포함한 영상학적 골질 평가법으로 DXA를 대체하여 골건강을 평가하는 것은 권고되지 않지만 DXA에 보조적인 검사로 활용할 수 있다(E).
DXA는 골량을 평가하여 골절 위험을 예측하는 훌륭한 도구이다. 그러나 DXA는 골강도에 또 다른 중요한 기여 요인인 골 미세구조나 대퇴골 형태 구조를 평가할 수 없다. 따라서 최근 골대사 연구에서 소주골 점수(trabecular bone score, TBS), 대퇴골 형태 구조(femur geometry), 고해상도 CT (high-resolution quantitative CT, HR-QCT)를 포함하여 골질을 평가하는 영상학적 방법이 도입되었다.
그러나 아직까지 현성 갑상선기능항진증에서 이러한 골질 평가법의 유용성을 분석한 연구는 거의 없다. 갑상선기능항진증에서 소주골 점수가 낮고 항갑상선제 투여 후 회복된다는 사실이 보고된 바 있으나,36-46) 폐경 전 여성과 남성에서 시행된 소규모 연구들로 결과의 일반화는 어렵다. 최근에 발표된 한 연구에서 고해상도 CT를 이용하여 분석 시 갑상선기능항진증에서 정상 갑상선 대비 용적 골밀도와 골강도 감소, 그리고 요추 피질골 구조의 변화가 보였다. 이러한 변화는 정상 갑상선기능 회복 후 유의하게 호전되었다.47) 현재까지 현성 갑상선기능항진증에서 대퇴골 형태학적 구조를 이용하여 골건강을 평가한 연구는 보고되지 않았다. 따라서, 갑상선기능항진증에서 골건강 평가에 골질 분석법이 골밀도를 평가하는 DXA보다 우수하다는 증거는 아직 충분하지 않으나, 골건강 평가에 보조적으로 활용할 수 있겠다.
3.1. 칼슘과 비타민 D 보충은 폐경 후 여성과 50세 이상의 남성에서 고려되며, 특히 DXA상 골감소증 또는 골다공증으로 진단된 경우 보충이 권고된다(E).
3.2. 폐경 전 여성과 50세 이하의 남성에서는 정상 골밀도를 보이는 경우 칼슘과 비타민 D 보충요법의 득과 실에 대한 근거는 없다(E). 폐경 전 여성과 50세 이하의 남성에서 DXA상 Z-값이 연령 기대치 이하인 경우 보충이 권고된다(E).
갑상선기능항진증에서 칼슘과 비타민 D 보충요법이 골밀도와 골절 위험도에 미치는 영향을 분석한 직접적인 연구는 현재까지 없다. 다만, 일반적인 골다공증 진료지침에 따르면 골밀도 감소가 있는 경우에는 칼슘과 비타민 D 보충이 골건강을 향상시키는 데 도움을 줄 수 있다. 따라서, 현성 갑상선기능항진증 환자 중에서 골다공증 또는 골절의 위험이 높은 폐경 후 여성과 50세 이상의 남성은 특히, DXA를 통해 골감소증 또는 골다공증이 확인된 경우에 일반 인구에 준하는 용량의 칼슘과 비타민 D 보충요법이 권고된다.31-33) 폐경 후 여성과 50세 이상의 남성이면서 골밀도가 정상이라고 하더라도, 우리나라는 식이를 통한 칼슘과 비타민 D 섭취량이 평균적으로 낮은 집단에 속하므로 칼슘과 비타민 D 보충을 고려할 수 있다.48,49) 폐경 전 여성과 50세 이하의 남성은 T-값 대신에 Z-값을 사용하여 평가하며, Z-값이 −2.0 이하면 ‘연령기대치 이하(below the expected range for age)’라고 정의한다. 폐경 전 여성과 50세 이하의 남성에서 DXA상 연령 기대치 이하의 골밀도가 확인되면 칼슘과 비타민 D 보충이 권고된다. 다만, 폐경 전 여성과 50세 이하의 남성이면서 DXA에서 골밀도가 정상인 갑상선기능항진증 환자에서 칼슘과 비타민 D 보충 요법이 골건강에 이로운 영향을 미칠 지에 대해서는 아직까지 연구가 이루어지지 않았다. 이 부분에 대해서는 추후 연구를 통해 근거 창출이 필요하겠다.
4.1. 폐경 후 여성과 50세 이상의 남성에서 DXA상 골다공증으로 진단되었거나 임상적으로 골절의 위험도가 높게 평가되는 경우 골다공증 약물치료가 권고된다(C).
4.2. 폐경 전 여성과 50세 미만의 남성에서 DXA상 Z-값이 연령 기대치 이하인 경우에는 갑상선기능항진증을 우선 치료하면서 골밀도의 호전 여부를 재평가해볼 수 있다(E). 그러나 골절 위험도가 높은 환자에서는 진단 시 골다공증 약물치료를 바로 고려해볼 수 있겠다(E).
4.3. 골다공증 약물치료는 비스포스포네이트를 포함한 골흡수억제제가 권고되며, 골절의 위험도가 높게 평가되는 경우 골형성촉진제를 고려할 수 있다(E).
현성 갑상선기능항진증에서 골다공증 약물치료의 효능을 평가한 연구는 소규모로 진행된 일부 보고가 있다. 한 연구에서는 폐경 여부에 상관없이 40명의 여성 갑상선기능항진증 환자를 대상으로 12개월간 비스포스포네이트 계열인 알렌드로네이트를 투여하였을 때 유의한 골밀도의 증가를 보고하였다.50) 갑상선기능항진증과 골다공증을 모두 가지고 있는 26명의 고령 남성을 대상으로 한 연구에서는 12개월간 알렌드로네이트와 항갑상선제를 함께 사용했을 때 항갑상선제 단독보다 더 큰 골밀도 증가 효과를 보였다.51) 그레이브스병과 골감소를 동반한 27명의 환자를 대상으로 한 일본 연구에서는, 리제드로네이트와 항갑상선제를 함께 투여한 14명에서 항갑상선제만 투여한 13명에서보다 더 큰 골밀도 증가와 골표지자 감소가 확인되었다.52) 현성 갑상선기능항진증에서 골다공증 약물치료가 골절에 미치는 영향에 대한 연구는 아직 없다.
기존 연구 결과들과 일반적인 골다공증 진료지침을 고려할 때, 현성 갑상선기능항진증 환자 중 골다공증 및 골절의 위험이 높은 폐경 후 여성과 50세 이상의 남성에서는 DXA상 골다공증으로 진단되었거나 FRAXⓇ (fracture risk assessment tool)로 평가하였을 때 골절의 고위험군인 경우 골다공증 약물치료가 권고된다.31-33,53) FRAXⓇ를 이용한 골절 위험도를 계산했을 때 골다공증 치료가 권고되는 고위험군은 10년 주요 골다공증 골절 위험도가 20% 이상이거나 고관절 골절 위험도가 3% 이상인 경우이다. 그러나 우리나라에서는 아직 FRAXⓇ가 보험 적용을 받지 못하여 실제 활용이 제한적이다. 따라서 환자가 가지고 있는 골절 위험 요인들을 고려하여 골다공증 약물치료에 대한 개별적인 접근이 필요하다. 연령과 성별, 폐경 여부를 제외하고 추가로 고려해야 하는 골절 위험 요인으로는 기존의 골절 병력, 대퇴골절의 가족력, 저체중, 스테로이드 사용력, 류마티스관절염, 흡연, 음주, 낙상 등이 있다.
폐경 전 여성과 50세 미만 남성의 경우 일반적으로 골절의 위험이 높지 않으므로 갑상선기능항진증을 우선적으로 치료하며 골밀도가 호전되는지 재평가할 수 있다. 다만, 폐경 전 여성과 50세 미만의 남성 중에서도 골절의 위험도가 높은 경우에는 갑상선기능항진증 진단 시부터 골다공증 약물치료를 바로 고려해볼 수 있겠다.
골다공증을 동반한 현성 갑상선기능항진증 환자에서는 비스포스포네이트를 포함하여 골재형성을 감소시킬 수 있는 골흡수억제제를 사용하는 것이 일반적으로 권고된다. 갑상선기능항진증에서 비스포스포네이트 이외의 골흡수억제제(예: 데노수맙 또는 선택적 에스트로겐 수용체 조절제)나 골형성촉진제의 효과를 보고한 연구는 아직까지 없다. 데노수맙은 RANKL (receptor activator of nuclear factor-κB ligand)에 대한 단클론항체로 최근 미국내분비학회와 미국임상내분비학자협회에서 발표한 골다공증 진료지침에서 골절 고위험군의 일차 약제로 권고되는 골흡수억제제이다.31,32) 갑상선기능항진증이 골건강에 미치는 기전을 고려할 때 향후 갑상선기능항진증에서 데노수맙의 효능에 대한 평가가 필요해 보인다. 또한 최근 여러 골다공증 진료지침에서 골절의 초고위험군에서 골형성촉진제의 우선 치료를 권고하고 있으므로, 폐경 후 여성이나 50세 이상의 남성에서는 골형성촉진제의 사용도 고려할 수 있다.31,32)
5.1. 폐경 후 여성과 70세 이상 남성에서는 일반적인 골다공증 진료지침에 따라 DXA를 이용하여 골건강을 평가해야 한다(E). 폐경 전 여성과 70세 미만 남성에서 무증상 갑상선기능항진증 자체가 골다공증을 유발한다는 증거는 부족하지만 TSH 수준이 0.1 mU/L 미만이라면 골절의 위험이 증가하므로 DXA를 이용한 골건강 평가를 고려할 수 있다(E).
무증상 갑상선기능항진증은 TSH가 기준치 미만으로 감소되어 있으나 T4 및 T3 호르몬은 정상인 상태로 정의하며 연령이 증가할수록 유병률이 증가한다.54) 앞서 언급한대로 현성 갑상선기능항진증은 이차성 골다공증의 원인으로 잘 알려져 있으며 여러 연구에서 골밀도 감소 및 골절 위험의 증가가 확인되었다.21,27,55) 그러나, 무증상 갑상선기능항진증과 골격계 영향에 대한 상관관계는 아직 결론을 내리기 어렵다. 대부분의 이전 연구들은 무증상 갑상선기능항진증을 동반한 폐경 후 여성에서 유의한 골밀도 감소를 보고하였다.56-59) 폐경 후 여성에서는 특히 피질골이 우세한 대퇴골 경부 및 요골에서의 골밀도가 유의하게 감소하였다.60) 폐경 전 여성과 남성에서 무증상 갑상선기능항진증과 골소실의 연관성은 뚜렷하지 않다.61-63) 폐경 전 여성을 분석한 대부분의 연구에서는 골밀도 또는 골절 위험과 무증상 갑상선기능항진증 사이에 유의한 연관성을 보여주지 못하였다.64) 무증상 갑상선기능항진증과 남성의 골 건강에 대한 연구는 드물고, 대퇴부 골절에 대한 연구에 집중되어 있는데, 한 연구에서는 무증상 갑상선기능항진증이 있는 65세 이상 남성에서 대퇴골 골절 위험이 폐경기 여성보다 높았다.65) 따라서, 남성과 폐경 전 여성의 무증상 갑상선기능항진증과 골건강에 대해서는 명확한 연관성을 확인하기 위한 후속 연구가 필요하다.
메타분석에 따르면 무증상 갑상선기능항진증은 정상 갑상선기능에 비해 고관절 골절이 1.5배, 전체 골절이 1.4배, 척추 골절이 1.7배 증가한다.66) 갑상선기능 항진의 정도에 있어서는 TSH 수준이 0.1 mU/L 미만이거나 측정되지 않을 때 골절의 위험이 증가한다.59,66,67)
따라서, 현재까지의 연구 결과들과 골다공증 진료지침을 고려할 때, 무증상 갑상선기능항진증으로 진단된 폐경 후 여성과 70세 이상 남성에서는 DXA를 이용한 골건강 평가가 필요하다. 폐경 전 여성과 70세 미만 남성에서는 무증상 갑상선기능항진증 자체가 골다공증을 유발한다는 증거가 충분하지 않다. 다만, 갑상선기능 항진 정도가 심한 경우에는 골절의 위험이 증가하므로 TSH 수준이 0.1 mU/L 미만이라면 DXA를 이용한 골건강 평가를 고려할 수 있겠다.
5.2. 칼슘과 비타민 D 보충은 DXA에서 골감소증과 골다공증으로 진단된 환자에서 권고된다(E).
외인성(exogenous) 무증상 갑상선기능항진증 환자를 대상으로 한 소규모 연구에서 2년 간 하루 1000 mg의 칼슘을 폐경 후 여성에서 보충 시 대조군에 비해 골소실이 예방되었다.68) 현재까지, 무증상 갑상선기능항진증 환자에서 칼슘 및 비타민 D 보충 후 골밀도 호전, 골표지자 변화 및 골절의 위험 감소에 대한 연구는 시행된 바가 없다. 그러나 골감소증 및 골다공증 환자를 대상으로 한 여러 대규모 연구에서 칼슘 및 비타민 D 보충이 골절을 예방하고 골소실을 감소시킨다는 일치되는 연구 결과를 보이고 있다.69-72) 따라서, 골다공증 일반 치료 원칙에 따라 DXA에서 골감소증과 골다공증으로 진단된 무증상 갑상선기능항진증에서는 칼슘과 비타민 D 보충이 권고된다.
5.3. 골다공증 약물치료는 DXA에서 골다공증과 골감소증으로 확인된 환자에서 고려해볼 수 있다(E).
외인성 무증상 갑상선기능항진증에서 에스트로겐 및 비스포스포네이트(pamidronate) 치료가 골밀도를 증가시킨다는 일부 연구가 있다.73,74) 현재 무증상 갑상선기능항진증 환자에서 골다공증 치료제 효과에 대한 연구는 거의 없다. 따라서, 무증상 갑상선기능항진증에 동반한 골감소증 또는 골다공증에서는 골다공증 치료 일반 원칙에 따라 골다공증 약물치료를 고려해볼 수 있다.
위 협의 권고안을 바탕으로 Fig. 1에 갑상선기능항진증으로 진단받은 환자에서 골건강의 평가와 치료에 대한 알고리즘을 도식화하였다.
1.1. 폐경 후 여성에서는 TSH 억제요법을 시작할 때 DXA를 이용한 골건강 평가가 권고된다(A).
1.2. 폐경 전 여성과 70세 미만 남성에서는 골다공증 골절 위험이 높은 경우 TSH 억제요법을 시작할 때 DXA를 이용한 골건강 평가를 고려할 수 있다. 70세 이상 남성에서는 일반적인 골다공증 진료지침에 근거할 때, 치료 시작 시 DXA를 이용하여 골건강을 평가해야 한다(E).
갑상선분화암 환자에서 TSH 억제요법이 골격계에 미치는 효과는 연구 설계, 환자 유형(폐경 전 여성, 폐경 후 여성, 또는 남성) 및 추적 기간에 따라 상이한 결과를 보여왔으나, 최근 발표된 여러 메타분석에서는 상당히 일치된 결과들이 도출되었다. 메타분석에 의한 골밀도 결과에 따르면, TSH 억제요법은 폐경 후 여성의 골밀도에 해로운 영향을 미치지만 폐경 전 여성에서는 유의한 상관성이 없었다.10,75-80) Faber 등75)은 TSH 억제요법으로 인한 연간 골밀도 손실이 폐경 후 여성에서 1.0%, 폐경 전 여성에서 0.13%라고 보고하였다. Ku 등79)이 가장 최근 발표한 메타분석에서 TSH 억제요법은 폐경 후 여성의 요추뿐 아니라 대퇴골 경부 및 대퇴골 전체 골밀도를 감소시켰다. 연구 수가 적기는 하지만, 남성의 경우에는 TSH 억제요법으로 인한 골밀도 감소 효과가 뚜렷하지 않았다.10,76,78,79)
TSH 억제요법으로 인한 골절의 위험도에 대해서는 상충된 결과를 보였다. 평균 TSH 억제 기간이 5-12년인 5개의 단면적 연구 중 오직 한 연구에서만 골절과의 연관성이 확인되었다.81-85) Mazziotti 등85)이 보고한 해당 연구에서 척추 골절의 발생률은 TSH <0.5 mU/L인 환자에서 높았다. 두 개의 인구기반연구(population-based study)에서 TSH 억제와 골다공증 골절 위험 사이에는 유의한 연관성이 관찰되지 않았다.86,87) 그럼에도 불구하고 이 중 Shin 등87)이 보고한 연구에서, 하루 170 μg 이상의 고용량 레보티록신은 저용량에 비해 골절 위험이 더 높은 것으로 나타났다. 현재까지 골밀도와 TSH 억제 기간 및 정도, 레보티록신 용량, 유리 T4 또는 T3 혈청 수준 사이의 관계는 명확하게 밝혀지지 않았다.
최근의 연구 결과들을 토대로 할 때, 갑상선분화암이 있는 폐경 후 여성에서는 TSH 억제요법을 시작할 때 골밀도 측정을 권고해야 한다. 폐경 전 여성에서는 골밀도 측정이 일반적으로는 권고되지 않으나, 환자가 골다공증 및 취약 골절의 위험이 높은 경우에는 고려할 수 있다. 남성의 경우, 70세 미만에서 TSH 억제요법 시작 시 반드시 DXA를 시행할 필요는 없으나 골다공증 골절 위험이 높은 경우 골밀도검사를 고려할 수 있다. 70세 이상 남성에서는 TSH 억제요법으로 인한 골소실의 증거가 충분하지 않으나 갑상선기능항진증에서와 마찬가지로 고령으로 인한 골다공증 및 골절 위험이 높으므로 치료 시작 시 DXA를 통한 골건강 평가가 필요하다.
1.3. TSH 억제요법을 지속하고 있는 폐경 전 여성에서 폐경이 확인되거나 남성의 경우 70세 이상이 되면 DXA를 이용하여 골건강을 평가해야 한다(E).
폐경은 에스트로겐 감소로 인해 여성에서 발생하는 골다공증의 가장 중요한 원인이다. 따라서 TSH 억제요법을 지속하는 폐경 전 여성에서 폐경이 확인되는 경우에는 골밀도검사를 통해 골다공증 여부를 평가하는 것이 필요하다. 남성의 경우에는 연령이 주요한 골다공증의 원인이므로 현재 국내 보험기준 및 대한골대사학회 골다공증 진료지침에 근거하여 TSH 억제요법을 받는 남성이 70세 이상이 되면 DXA를 통한 골밀도 평가가 필요하다.33)
1.4. 추적 DXA는 일반적인 골다공증 진료지침의 권고 간격에 따라 시행되어야 한다(E).
현성 갑상선기능항진증과 마찬가지로 TSH 억제요법에서 빈번한 추적 관찰의 정당성에 대한 근거가 부족하다. 따라서, 갑상선분화암으로 TSH 억제요법을 받는 환자라 하더라도 일반적으로 권장되는 골다공증 진료지침 및 국내 보험기준에 따라 추적 골밀도검사를 시행해야 한다.
2.1. 골표지자를 이용한 골건강 평가는 일반적으로 권고되지 않는다. 단, 골다공증으로 진단된 환자에서는 치료 반응 평가를 위해 진단 시 및 추적 골표지자 검사가 권고된다(E).
TSH 억제요법을 받는 갑상선분화암 환자에서 골표지자의 역할을 분석한 몇몇 연구가 있다. 일부 연구에서는 대조군에 비해 골흡수 또는 골형성표지자의 혈청 수준이 증가했지만 다른 연구에서는 증가하지 않았다.82,83,88) 또 다른 연구에서는 TSH 억제요법을 받는 94명의 여성 갑상선분화암 환자에서 TSH 및 유리 T4 수준에 따라 골표지자를 평가했는데 골표지자는 TSH 또는 유리 T4 혈청 수준에 영향을 받지 않았다.89) 이를 종합해볼 때, 골표지자가 TSH 억제요법을 받는 갑상선분화암 환자의 골건강을 평가하는 데 유용하다는 증거는 현재 부족하므로 골표지자만을 통한 골건강 평가는 권고되지 않는다. 다만, DXA에서 골다공증이 진단된 환자에서는 일반적인 골다공증 진료지침에 따라 골표지자 검사 시행이 권고되며, 골다공증 약물치료 시작 후 치료 반응 평가에 골표지자 추적 검사가 도움된다.
2.2. 소주골 점수, 대퇴골 형태 구조 및 고해상도 CT를 포함한 영상학적 골질 평가법으로 DXA를 대체하여 골건강을 평가하는 것은 권고되지 않지만 DXA에 보조적인 검사로 활용할 수 있다(E).
골량 외에도 장기간의 TSH 억제는 골 미세구조와 고관절 구조의 악화를 초래할 수 있다. 소주골 점수를 사용한 최근의 여러 연구에서 TSH 억제요법을 받는 갑상선분화암 환자는 대조군보다 소주골 점수가 현저히 낮아 골 미세구조가 악화되었음을 보여주었다.90-92) Moon 등93)은 대조군보다 TSH 억제요법을 받은 갑상선분화암 환자에서 대퇴골 형태 변화를 보여주었다. 갑상선분화암 환자에서 고해상도 CT를 사용하여 골 미세구조를 조사한 연구는 많지 않으나, 이들 연구에서도 TSH 억제로 인한 골질의 변화가 관찰되었다.94,95) 이러한 결과는 골질 평가 방법이 TSH 억제요법을 받는 갑상선분화암 환자에서 약화된 골강도를 파악하는 데 유용함을 보여준다. 그러나 검사의 비용대비 효율성과 접근성을 고려할 때, 갑상선분화암 환자의 골건강을 평가하기 위해 골질 평가 방법의 사용을 일반적으로 권고하기에는 아직 근거가 충분하지 않으며 DXA에 보조적인 검사로서 활용할 수 있겠다.
3.1. 칼슘과 비타민 D 보충은 폐경 후 여성과 50세 이상의 남성에서 고려되며, 특히 DXA상 골감소증 또는 골다공증으로 진단된 경우 보충이 권고된다(E).
3.2. 폐경 전 여성과 50세 이하의 남성에서는 정상 골밀도를 보이는 경우 칼슘과 비타민 D 보충요법의 득과 실에 대한 근거는 없다(E). 폐경 전 여성과 50세 이하의 남성에서 DXA상 Z-값이 연령 기대치 이하인 경우 보충이 권고된다(E).
수술 후 부갑상선기능저하증의 동반없이 TSH 억제요법을 받고 있는 갑상선암 환자에서 칼슘과 비타민 D 보충과 관련한 무작위 대조군 연구는 없다. 칼슘과 비타민 D 보충은 폐경 후 여성, 골절의 고위험군, 또는 이차성 골다공증 유발 가능 동반 질환이 있는 경우에 식이를 통한 칼슘, 비타민 D 섭취가 불충분하다면 보충을 고려할 수 있다. TSH 억제요법은 갑상선기능 항진 상태를 유발하므로 이차성 골다공증의 원인이 될 수 있다. 따라서, TSH 억제요법을 받는 갑상선분화암 환자이면서 DXA에서 골감소증 또는 골다공증이 확인되면 칼슘과 비타민 D 보충이 권고된다. 폐경 후 여성과 50세 이상의 남성에서는 DXA에서 정상 골밀도가 확인된다 하더라도 골절의 위험도가 높은 군이므로 칼슘과 비타민 D 보충을 고려할 수 있다. 다만, 폐경 전 여성과 50세 이하의 남성에서 정상 골밀도를 보이는 경우 칼슘과 비타민 D 보충요법이 골건강에 도움이 될 지는 갑상선기능항진증과 마찬가지로 연구 결과가 없어 결론을 내리기 어렵다.
대한골대사학회 진료지침33)에서는 골다공증 및 골절의 예방과 치료를 위해 폐경 후 여성과 50세 이상 남성에서 하루 평균 800-1000 mg의 칼슘, 800 IU 이상의 비타민 D 보충요법을 권고하고 있다. 칼슘과 비타민 D 보충요법을 시작한 경우에는 적어도 3개월 이후 혈청 25(OH)D를 측정하여 치료효과를 평가해야 한다. 이 때 비타민 D의 치료 목표는 골다공증 예방 시 20 ng/mL 이상, 골절의 예방을 위해서는 30 ng/mL 이상의 혈청 25(OH)D을 유지하는 것이다. 따라서, TSH 억제요법을 받는 갑상선분화암 환자에서 칼슘과 비타민 D 보충요법 시작 후 적어도 혈청 25(OH)D를 20 ng/mL 이상으로 유지하는 것이 필요하다. TSH 억제요법이 종료된 후 정상 갑상선기능을 유지하고 있는 환자에서는 환자의 개별적인 골다공증과 골절의 위험도에 따라 칼슘과 비타민 D 보충요법을 결정해야 한다.
4.1. DXA에서 골다공증으로 진단된 환자에서는 비스포스포네이트를 포함한 골흡수억제제를 통한 골다공증 약물치료가 권고된다(B).
4.2. 골다공증 골절의 고위험군에서는 골형성촉진제를 고려할 수 있다(E).
4.3. 골다공증 약물치료는 DXA 검사를 통해 확인된 골다공증이 아니더라도 골다공증 골절의 위험이 높은 환자에서 고려해야 한다(E).
갑상선암에서 골다공증 약물치료의 효과는 현재까지 두 개의 연구에서 보고되었다.96,97) Panebianco 등97)은 갑상선암 환자에서 비스포스포네이트 계열인 알렌드로네이트가 TSH 억제로 인한 골 손실을 줄이는 데 효과적임을 보여주었다. Panio 등96)은 골전이가 없는 74명의 갑상선분화암에서 알렌드로네이트의 효과를 분석하였다. 이 연구에서 TSH 억제요법의 기간이 3년 이내인 경우 알렌드로네이트 치료에 의해 요추 골밀도가 유의하게 증가하였다(7.88%). 그러나 TSH 억제요법을 6년 또는 9년 정도 받은 경우에는 요추 골밀도의 개선 효과가 크지 않거나 미미하였다(각각 4.63%와 0.86%). 대조군에서는 2년 동안의 알렌드로네이트 치료 후 요추 골밀도가 8.2% 유의하게 증가하였다. 대퇴골 골밀도의 경우에도 TSH 억제요법을 3년 이내로 시행한 경우에는 4.62% 증가하였고, 6년 이내로 받은 경우에는 3.01% 증가하였다. 9년 이내로 받은 경우에는 의미 있는 대퇴골 골밀도 증가가 관찰되지 않았다(0.95%). 반면, 대조군에서는 5.27%의 대퇴골 골밀도 증가가 확인되었다. 이러한 결과는 TSH 억제요법이 3년 이내인 경우에는 비스포스포네이트 치료가 골밀도 증가에 효과적이나 TSH 억제요법 기간이 길어질 수록 치료효과가 감소될 수 있음을 시사한다. 알렌드로네이트 외의 비스포스포네이트나 다른 골흡수억제제에 대한 연구는 아직 없다. 골형성촉진제의 효과를 분석한 연구도 아직 발표된 적은 없다. 그러나 최근 골다공증 진료지침에 근거할 때, 골절의 고위험군에 해당하는 폐경 후 여성 혹은 50세 이상 남성에서는 데노수맙과 같은 골흡수억제제 및 골형성촉진제의 사용도 고려해 볼 수 있겠다.
4.3. 골다공증 약물치료는 DXA를 통해 확인된 골다공증이 아니더라도 골다공증 골절의 위험이 높은 환자에서 고려해야 한다(E).
앞서 언급한대로 장기간의 TSH 억제요법은 장기간의 갑상선기능항진 상태에 의한 이차성 골다공증의 원인으로 생각할 수 있다. 따라서, 갑상선분화암에서 TSH 억제요법을 받는 환자 중 골다공증 골절의 고위험군인 경우 골다공증 치료를 고려해야 한다. 골다공증 골절의 고위험군은 갑상선기능항진증 부분에서 기술한 바와 동일하며, 환자의 골다공증 위험 요인들을 고려하여 골다공증 치료 여부를 결정해야 한다.
5.1. 수술 후 부갑상선기능저하증이 동반된 환자에서 골건강 관리는 수술 후 부갑상선기능저하증이 없는 환자의 일반 원칙을 따른다(B).
5.2. 저칼슘혈증 또는 고칼슘혈증 및 관련 합병증을 예방하고 골건강을 유지하기위해 적절한 칼슘 및 비타민 D 보충이 권장된다(B).
갑상선 수술 후 영구적인 부갑상선기능저하증 발생 빈도는 0-3%로 보고되고 있다.98-100) 수술 후 부갑상선기능저하증은 광범위 침윤 갑상선암 수술 또는 갑상선전절제술과 함께 경부림프절절제술이 시행된 경우 발생 위험이 높은 것으로 알려져 있다.101-103) 부갑상선호르몬은 체내 칼슘 항상성을 유지하는 호르몬이다. 부갑상선호르몬은 골격에서 칼슘 분비를 촉진하고 신장의 칼슘 재흡수 증가, 신장의 칼시트리올 합성 증가를 통한 칼슘의 장흡수를 강화하여 혈중 칼슘 농도를 증가시킨다.104) 부갑상선호르몬은 또한 뼈에서 조골세포, 파골세포, 골세포에 작용하여 골재형성을 촉진시킨다.105) 따라서, 부갑상선기능저하증은 낮은 골교체율을 유발하여,106) 골밀도를 증가시킬 수 있다.107) 이전 연구들에서 TSH 억제요법을 받고 있는 폐경 전과 폐경 후 여성 모두에서 수술 후 부갑상선기능저하증이 동반되면 대조군에 비해 느린 골교체율과 높은 골밀도를 보였다.108-110) 그러나, 골량의 증가에도 불구하고 이것이 수술 후 부갑상선기능저하증에서 골강도를 증가시키거나 골절 위험을 감소시키는지는 아직 확실하지 않다. 따라서, 수술 후 부갑상선기능저하증을 동반한 환자들의 경우, 부갑상선기능저하증 치료 목적으로 사용하는 칼슘과 비타민 D의 용량을 유지해야 한다. 수술 후 부갑상선기능저하증의 관리를 위해서는 칼슘과 활성 비타민 D 사용이 권고된다.111) 수술 후 부갑상선기능저하증의 치료는 혈청 칼슘을 무증상 범위 내로 유지하고, 심각한 저칼슘혈증 또는 고칼슘혈증 및 관련 합병증을 피하면서, 골건강을 보존하는 것을 목표로 한다.111,112)
위 협의 권고안을 토대로 Fig. 2에 갑상선분화암으로 진단받고 TSH 억제요법을 시작하는 환자에서 골건강의 평가와 치료에 대한 알고리즘을 정리하였다.
References
1. Wexler JA, Sharretts J. 2007; Thyroid and bone. Endocrinol Metab Clin North Am. 36(3):673–705. viDOI: 10.1016/j.ecl.2007.04.005. PMID: 17673124.

2. Mundy GR, Shapiro JL, Bandelin JG, Canalis EM, Raisz LG. 1976; Direct stimulation of bone resorption by thyroid hormones. J Clin Invest. 58(3):529–34. DOI: 10.1172/JCI108497. PMID: 182721. PMCID: PMC333209.

3. Kanatani M, Sugimoto T, Sowa H, Kobayashi T, Kanzawa M, Chihara K. 2004; Thyroid hormone stimulates osteoclast differentiation by a mechanism independent of RANKL-RANK interaction. J Cell Physiol. 201(1):17–25. DOI: 10.1002/jcp.20041. PMID: 15281085.

4. Bassett JH, Williams GR. 2016; Role of thyroid hormones in skeletal development and bone maintenance. Endocr Rev. 37(2):135–87. DOI: 10.1210/er.2015-1106. PMID: 26862888. PMCID: PMC4823381.

5. Vestergaard P, Mosekilde L. 2002; Fractures in patients with hyperthyroidism and hypothyroidism: a nationwide follow-up study in 16,249 patients. Thyroid. 12(5):411–9. DOI: 10.1089/105072502760043503. PMID: 12097203.

6. Abrahamsen B, Jorgensen HL, Laulund AS, Nybo M, Bauer DC, Brix TH, et al. 2015; The excess risk of major osteoporotic fractures in hypothyroidism is driven by cumulative hyperthyroid as opposed to hypothyroid time: an observational register-based time-resolved cohort analysis. J Bone Miner Res. 30(5):898–905. DOI: 10.1002/jbmr.2416. PMID: 25431028.

7. Ko YJ, Kim JY, Lee J, Song HJ, Kim JY, Choi NK, et al. 2014; Levothyroxine dose and fracture risk according to the osteoporosis status in elderly women. J Prev Med Public Health. 47(1):36–46. DOI: 10.3961/jpmph.2014.47.1.36. PMID: 24570805. PMCID: PMC3930806.

8. Uzzan B, Campos J, Cucherat M, Nony P, Boissel JP, Perret GY. 1996; Effects on bone mass of long term treatment with thyroid hormones: a meta-analysis. J Clin Endocrinol Metab. 81(12):4278–89. DOI: 10.1210/jcem.81.12.8954028. PMID: 8954028.

9. Ross DS. 1994; Hyperthyroidism, thyroid hormone therapy, and bone. Thyroid. 4(3):319–26. DOI: 10.1089/thy.1994.4.319. PMID: 7833670.

10. Heemstra KA, Hamdy NA, Romijn JA, Smit JW. 2006; The effects of thyrotropin-suppressive therapy on bone metabolism in patients with well-differentiated thyroid carcinoma. Thyroid. 16(6):583–91. DOI: 10.1089/thy.2006.16.583. PMID: 16839260.

11. Cellini M, Rotondi M, Tanda ML, Piantanida E, Chiovato L, Beck-Peccoz P, et al. 2021; Skeletal health in patients with differentiated thyroid carcinoma. J Endocrinol Invest. 44(3):431–42. DOI: 10.1007/s40618-020-01359-6. PMID: 32696339.

12. Notsu M, Yamauchi M, Morita M, Nawata K, Sugimoto T. 2020; Papillary thyroid carcinoma is a risk factor for severe osteoporosis. J Bone Miner Metab. 38(2):264–70. DOI: 10.1007/s00774-019-01053-5. PMID: 31664535.

13. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2016; 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 26(1):1–133. DOI: 10.1089/thy.2015.0020. PMID: 26462967. PMCID: PMC4739132.

14. Moon JH, Yi KH. 2013; The diagnosis and management of hyperthyroidism in Korea: consensus report of the Korean Thyroid Association. Endocrinol Metab (Seoul). 28(4):275–9. DOI: 10.3803/EnM.2013.28.4.275. PMID: 24396691. PMCID: PMC3871036.

15. Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, et al. 2016; 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid. 26(10):1343–421. DOI: 10.1089/thy.2016.0229. PMID: 27521067.

16. Carle A, Andersen SL, Boelaert K, Laurberg P. 2017; Management of endocrine disease: subclinical thyrotoxicosis: prevalence, causes and choice of therapy. Eur J Endocrinol. 176(6):R325–R37. DOI: 10.1530/EJE-16-0276. PMID: 28274949.
17. Chin SO, Ku CR, Kim BJ, Kim SW, Park KH, Song KH, et al. 2019; Medical treatment with somatostatin analogues in acromegaly: position statement. Endocrinol Metab (Seoul). 34(1):53–62. DOI: 10.3803/EnM.2019.34.1.53. PMID: 30912339. PMCID: PMC6435847.

18. Ku EJ, Kim KJ, Kim JH, Kim MK, Ahn CH, Lee KA, et al. 2021; Diagnosis for pheochromocytoma and paraganglioma: a joint position statement of the Korean pheochromocytoma and para-ganglioma task force. Endocrinol Metab (Seoul). 36(2):322–38. DOI: 10.3803/EnM.2020.908. PMID: 33820394. PMCID: PMC8090459.

19. Mosekilde L, Eriksen EF, Charles P. 1990; Effects of thyroid hormones on bone and mineral metabolism. Endocrinol Metab Clin North Am. 19(1):35–63. DOI: 10.1016/S0889-8529(18)30338-4. PMID: 2192868.

20. Mosekilde L, Melsen F, Bagger JP, Myhre-Jensen O, Schwartz Sorensen N. 1977; Bone changes in hyperthyroidism: interrelationships between bone morphometry, thyroid function and calcium-phosphorus metabolism. Acta Endocrinol (Copenh). 85(3):515–25. DOI: 10.1530/acta.0.0850515. PMID: 577336.

21. Bours SP, van Geel TA, Geusens PP, Janssen MJ, Janzing HM, Hoffland GA, et al. 2011; Contributors to secondary osteoporosis and metabolic bone diseases in patients presenting with a clinical fracture. J Clin Endocrinol Metab. 96(5):1360–7. DOI: 10.1210/jc.2010-2135. PMID: 21411547.

22. Garnero P, Sornay-Rendu E, Claustrat B, Delmas PD. 2000; Biochemical markers of bone turnover, endogenous hormones and the risk of fractures in postmenopausal women: the OFELY study. J Bone Miner Res. 15(8):1526–36. DOI: 10.1359/jbmr.2000.15.8.1526. PMID: 10934651.

23. Bauer DC, Ettinger B, Nevitt MC, Stone KL. Study of Osteoporotic Fractures Research Group. 2001; Risk for fracture in women with low serum levels of thyroid-stimulating hormone. Ann Intern Med. 134(7):561–8. DOI: 10.7326/0003-4819-134-7-200104030-00009. PMID: 12803168.

24. Vestergaard P, Rejnmark L, Mosekilde L. 2005; Influence of hyper- and hypothyroidism, and the effects of treatment with antithyroid drugs and levothyroxine on fracture risk. Calcif Tissue Int. 77(3):139–44. DOI: 10.1007/s00223-005-0068-x. PMID: 16151671.

25. Cummings SR, Nevitt MC, Browner WS, Stone K, Fox KM, Ensrud KE, et al. 1995; Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med. 332(12):767–73. DOI: 10.1056/NEJM199503233321202. PMID: 7862179.
26. Wejda B, Hintze G, Katschinski B, Olbricht T, Benker G. 1995; Hip fractures and the thyroid: a case-control study. J Intern Med. 237(3):241–7. DOI: 10.1111/j.1365-2796.1995.tb01172.x. PMID: 7891045.

27. Vestergaard P, Mosekilde L. 2003; Hyperthyroidism, bone mineral, and fracture risk--a meta-analysis. Thyroid. 13(6):585–93. DOI: 10.1089/105072503322238854. PMID: 12930603.

28. Dhanwal DK, Gupta N. 2011; Bone mineral density trends in Indian patients with hyperthyroidism--effect of antithyroid therapy. J Assoc Physicians India. 59:561–2. PMID: 22334969.
29. Marshall D, Johnell O, Wedel H. 1996; Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ. 312(7041):1254–9. DOI: 10.1136/bmj.312.7041.1254. PMID: 8634613. PMCID: PMC2351094.

30. Torgerson DJ, Campbell MK, Thomas RE, Reid DM. 1996; Prediction of perimenopausal fractures by bone mineral density and other risk factors. J Bone Miner Res. 11(2):293–7. DOI: 10.1002/jbmr.5650110219. PMID: 8822354.

31. Camacho PM, Petak SM, Binkley N, Diab DL, Eldeiry LS, Farooki A, et al. 2020; American Association of Clinical Endocrinologists/American College of Endocrinology Clinical Practice Guidelines for the diagnosis and treatment of postmenopausal osteoporosis-2020 update. Endocr Pract. 26(Suppl 1):1–46. DOI: 10.4158/GL-2020-0524SUPPL. PMID: 32427503.

32. Shoback D, Rosen CJ, Black DM, Cheung AM, Murad MH, Eastell R. 2020; Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 105(3):dgaa048. DOI: 10.1210/clinem/dgaa048. PMID: 32068863.

33. Physician's guideline for osteoporosis. The Korean Society of Bone and Mineral Research 2020. DOI: 10.1210/clinem/dgaa048.
34. Udayakumar N, Chandrasekaran M, Rasheed MH, Suresh RV, Sivaprakash S. 2006; Evaluation of bone mineral density in thyrotoxicosis. Singapore Med J. 47(11):947–50. PMID: 17075661.
35. Ale AO, Ogbera AO, Ebili HO, Adeyemo OL, Afe TO. 2018; Prevalence, predictive factors, and characteristics of osteoporosis in hyperthyroid patients. Int J Endocrinol. 2018:3540256. DOI: 10.1155/2018/3540256. PMID: 29849614. PMCID: PMC5907485.

36. Kuzma M, Vanuga P, Binkley N, Sagova I, Pavai D, Blazicek P, et al. 2018; High serum fractalkine is associated with lower trabecular bone score in premenopausal women with Graves' disease. Horm Metab Res. 50(8):609–14. DOI: 10.1055/a-0633-2814. PMID: 29954010.

37. Boonya-Ussadorn T, Punkaew B, Sriassawaamorn N. 2010; A comparative study of bone mineral density between premenopausal women with hyperthyroidism and healthy premenopausal women. J Med Assoc Thai. 93 Suppl 6:S1–5. PMID: 21284134.
38. Garnero P, Vassy V, Bertholin A, Riou JP, Delmas PD. 1994; Markers of bone turnover in hyperthyroidism and the effects of treatment. J Clin Endocrinol Metab. 78(4):955–9. DOI: 10.1210/jcem.78.4.8157727. PMID: 8157727.

39. Harvey RD, McHardy KC, Reid IW, Paterson F, Bewsher PD, Duncan A, et al. 1991; Measurement of bone collagen degradation in hyperthyroidism and during thyroxine replacement therapy using pyridinium cross-links as specific urinary markers. J Clin Endocrinol Metab. 72(6):1189–94. DOI: 10.1210/jcem-72-6-1189. PMID: 2026741.

40. Kisakol G, Kaya A, Gonen S, Tunc R. 2003; Bone and calcium metabolism in subclinical autoimmune hyperthyroidism and hypothyroidism. Endocr J. 50(6):657–61. DOI: 10.1507/endocrj.50.657. PMID: 14709834.

41. Sabuncu T, Aksoy N, Arikan E, Ugur B, Tasan E, Hatemi H. Early changes in parameters of bone and mineral metabolism during therapy for hyper- and hypothyroidism. Endocr Res. 2001; 27(1-2):203–13. DOI: 10.1081/ERC-100107181. PMID: 11428712.

42. Olkawa M, Kushida K, Takahashi M, Ohishi T, Hoshino H, Suzuki M, et al. 1999; Bone turnover and cortical bone mineral density in the distal radius in patients with hyperthyroidism being treated with antithyroid drugs for various periods of time. Clin Endocrinol (Oxf). 50(2):171–6. DOI: 10.1046/j.1365-2265.1999.00626.x. PMID: 10396358.

43. Karunakaran P, Maharajan C, Mohamed KN, Rachamadugu SV. 2016; Rapid restoration of bone mass after surgical management of hyperthyroidism: a prospective case control study in Southern India. Surgery. 159(3):771–6. DOI: 10.1016/j.surg.2015.10.002. PMID: 26582500.

44. Kumeda Y, Inaba M, Tahara H, Kurioka Y, Ishikawa T, Morii H, et al. 2000; Persistent increase in bone turnover in Graves' patients with subclinical hyperthyroidism. J Clin Endocrinol Metab. 85(11):4157–61. DOI: 10.1210/jcem.85.11.6979. PMID: 11095447.

45. Zhong N, Xu B, Cui R, Xu M, Su J, Zhang Z, et al. 2016; Positive correlation between serum osteocalcin and testosterone in male hyperthyroidism patients with high bone turnover. Exp Clin Endocrinol Diabetes. 124(7):452–6. DOI: 10.1055/s-0042-107944. PMID: 27219888.

46. Ock SY, Chung YS, Choi YJ. 2016; Changes in bone mineral density and trabecular bone score in Graves' disease patients after anti-thyroid therapy. Osteoporos Sarcopenia. 2(3):175–9. DOI: 10.1016/j.afos.2016.05.004. PMID: 30775484. PMCID: PMC6372732.

47. Nicolaisen P, Obling ML, Winther KH, Hansen S, Hermann AP, Hegedus L, et al. 2021; Consequences of hyperthyroidism and its treatment for bone microarchitecture assessed by high-resolution peripheral quantitative computed tomography. Thyroid. 31(2):208–16. DOI: 10.1089/thy.2020.0084. PMID: 32703114.

48. Kim KM, Choi SH, Lim S, Moon JH, Kim JH, Kim SW, et al. 2014; Interactions between dietary calcium intake and bone mineral density or bone geometry in a low calcium intake population (KNHANES IV 2008-2010). J Clin Endocrinol Metab. 99(7):2409–17. DOI: 10.1210/jc.2014-1006. PMID: 24684465.

49. Park JH, Hong IY, Chung JW, Choi HS. 2018; Vitamin D status in South Korean population: seven-year trend from the KNHANES. Medicine (Baltimore). 97(26):e11032. DOI: 10.1097/MD.0000000000011032. PMID: 29952942. PMCID: PMC6242298.
50. Lupoli G, Nuzzo V, Di Carlo C, Affinito P, Vollery M, Vitale G, et al. 1996; Effects of alendronate on bone loss in pre- and postmenopausal hyperthyroid women treated with methimazole. Gynecol Endocrinol. 10(5):343–8. DOI: 10.3109/09513599609012821. PMID: 8915664.

51. Lupoli GA, Fittipaldi MR, Fonderico F, Panico A, Colarusso S, Di Micco L, et al. 2005; Methimazole versus methimazole and diphosphonates in hyperthyroid and osteoporotic patients. Minerva Endocrinol. 30(2):89–94. PMID: 15988404.
52. Majima T, Komatsu Y, Doi K, Takagi C, Shigemoto M, Fukao A, et al. 2006; Clinical significance of risedronate for osteoporosis in the initial treatment of male patients with Graves' disease. J Bone Miner Metab. 24(2):105–13. DOI: 10.1007/s00774-005-0655-y. PMID: 16502116.

53. Kanis JA, Hans D, Cooper C, Baim S, Bilezikian JP, Binkley N, et al. 2011; Interpretation and use of FRAX in clinical practice. Osteoporos Int. 22(9):2395–411. DOI: 10.1007/s00198-011-1713-z. PMID: 21779818.

54. Cooper DS, Biondi B. 2012; Subclinical thyroid disease. Lancet. 379(9821):1142–54. DOI: 10.1016/S0140-6736(11)60276-6. PMID: 22273398.

55. Amato G, Mazziotti G, Sorvillo F, Piscopo M, Lalli E, Biondi B, et al. 2004; High serum osteoprotegerin levels in patients with hyperthyroidism: effect of medical treatment. Bone. 35(3):785–91. DOI: 10.1016/j.bone.2004.04.021. PMID: 15336617.

56. Gürlek A, Gedik O. 1999; Effect of endogenous subclinical hyperthyroidism on bone metabolism and bone mineral density in premenopausal women. Thyroid. 9(6):539–43. DOI: 10.1089/thy.1999.9.539. PMID: 10411115.

57. Tauchmanovà L, Nuzzo V, Del Puente A, Fonderico F, Esposito-Del Puente A, Padulla S, et al. 2004; Reduced bone mass detected by bone quantitative ultrasonometry and DEXA in pre- and postmenopausal women with endogenous subclinical hyperthyroidism. Maturitas. 48(3):299–306. DOI: 10.1016/j.maturitas.2004.02.017. PMID: 15207896.

58. Lee WY, Oh KW, Rhee EJ, Jung CH, Kim SW, Yun EJ, et al. 2006; Relationship between subclinical thyroid dysfunction and femoral neck bone mineral density in women. Arch Med Res. 37(4):511–6. DOI: 10.1016/j.arcmed.2005.09.009. PMID: 16624651.

59. Wartofsky L. 2014; Subclinical hyperthyroidism and fracture risk in women. J Clin Endocrinol Metab. 99(8):2654–6. DOI: 10.1210/jc.2014-2951. PMID: 25100111.

60. Földes J, Tarján G, Szathmari M, Varga F, Krasznai I, Horvath C. 1993; Bone mineral density in patients with endogenous subclinical hyperthyroidism: is this thyroid status a risk factor for osteoporosis? Clin Endocrinol (Oxf). 39(5):521–7. DOI: 10.1111/j.1365-2265.1993.tb02403.x. PMID: 8252739.

61. Faber J, Jensen IW, Petersen L, Nygaard B, Hegedüs L, Siersbaek-Nielsen K. 1998; Normalization of serum thyrotrophin by means of radioiodine treatment in subclinical hyperthyroidism: effect on bone loss in postmenopausal women. Clin Endocrinol (Oxf). 48(3):285–90. DOI: 10.1046/j.1365-2265.1998.00427.x. PMID: 9578817.

62. Yan Z, Huang H, Li J, Wang J. 2016; Relationship between subclinical thyroid dysfunction and the risk of fracture: a meta-analysis of prospective cohort studies. Osteoporos Int. 27(1):115–25. DOI: 10.1007/s00198-015-3221-z. PMID: 26223189.

63. Saler T, Ahbab S, Sağlam ZA, Keşkek ŞÖ, Kurnaz S. 2014; Endogenous subclinical hyperthyroidism may not lead to bone loss in premenopausal women. Hippokratia. 18(3):240–4.
64. Nicholls JJ, Brassill MJ, Williams GR, Bassett JH. 2012; The skeletal consequences of thyrotoxicosis. J Endocrinol. 213(3):209–21. DOI: 10.1530/JOE-12-0059. PMID: 22454529.

65. Lee JS, Buzková P, Fink HA, Vu J, Carbone L, Chen Z, et al. 2010; Subclinical thyroid dysfunction and incident hip fracture in older adults. Arch Intern Med. 170(21):1876–83. DOI: 10.1001/archinternmed.2010.424. PMID: 21098345. PMCID: PMC4122328.

66. Blum MR, Bauer DC, Collet TH, Fink HA, Cappola AR, da Costa BR, et al. 2015; Subclinical thyroid dysfunction and fracture risk: a meta-analysis. JAMA. 313(20):2055–65. DOI: 10.1001/jama.2015.5161. PMID: 26010634. PMCID: PMC4729304.
67. Wirth CD, Blum MR, da Costa BR, Baumgartner C, Collet TH, Medici M, et al. 2014; Subclinical thyroid dysfunction and the risk for fractures: a systematic review and meta-analysis. Ann Intern Med. 161(3):189–99. DOI: 10.7326/M14-0125. PMID: 25089863. PMCID: PMC4403766.

68. Kung AW, Yeung SS. 1996; Prevention of bone loss induced by thyroxine suppressive therapy in postmenopausal women: the effect of calcium and calcitonin. J Clin Endocrinol Metab. 81(3):1232–6. DOI: 10.1210/jc.81.3.1232. PMID: 8772604.

69. Grant AM, Avenell A, Campbell MK, McDonald AM, MacLennan GS, McPherson GC, et al. 2005; Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet. 365(9471):1621–8. DOI: 10.1016/S0140-6736(05)63013-9. PMID: 15885294.

70. Tang BM, Eslick GD, Nowson C, Smith C, Bensoussan A. 2007; Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet. 370(9588):657–66. DOI: 10.1016/S0140-6736(07)61342-7.

71. Weaver CM, Fleet JC. 2004; Vitamin D requirements: current and future. Am J Clin Nutr. 80(6 Suppl):1735S–9S. DOI: 10.1093/ajcn/80.6.1735S. PMID: 15585797.

72. Avenell A, Gillespie WJ, Gillespie LD, O'Connell D. Vitamin D and vitamin D analogues for preventing fractures associated with involutional and post-menopausal osteoporosis. Cochrane Database Syst Rev. 2009; (2):CD000227. DOI: 10.1002/14651858.CD000227.pub3. PMID: 16034849.

73. Schneider DL, Barrett-Connor EL, Morton DJ. 1994; Thyroid hormone use and bone mineral density in elderly women. Effects of estrogen. JAMA. 271(16):1245–9. DOI: 10.1001/jama.1994.03510400031027. PMID: 7848399.

74. Rosen HN, Moses AC, Gundberg C, Kung VT, Seyedin SM, Chen T, et al. 1993; Therapy with parenteral pamidronate prevents thyroid hormone-induced bone turnover in humans. J Clin Endocrinol Metab. 77(3):664–9. DOI: 10.1210/jcem.77.3.8370687. PMID: 8370687.

75. Faber J, Galløe AM. 1994; Changes in bone mass during prolonged subclinical hyperthyroidism due to L-thyroxine treatment: a meta-analysis. Eur J Endocrinol. 130(4):350–6. DOI: 10.1530/eje.0.1300350. PMID: 8162163.

76. Papaleontiou M, Hawley ST, Haymart MR. 2016; Effect of thyrotropin suppression therapy on bone in thyroid cancer patients. Oncologist. 21(2):165–71. DOI: 10.1634/theoncologist.2015-0179. PMID: 26659220. PMCID: PMC4746080.

77. Yoon BH, Lee Y, Oh HJ, Kim SH, Lee YK. 2019; Influence of thyroid-stimulating hormone suppression therapy on bone mineral density in patients with differentiated thyroid cancer: a meta-analysis. J Bone Metab. 26(1):51–60. DOI: 10.11005/jbm.2019.26.1.51. PMID: 30899725. PMCID: PMC6416150.

78. Wang MY, Han ZQ, Gong XW, Li Q, Ma J. 2020; TSH-suppressive therapy can reduce bone mineral density in patients with differentiated thyroid carcinoma: a meta-analysis. Eur Rev Med Pharmacol Sci. 24(2):922–9. DOI: 10.26355/eurrev_202001_20077. PMID: 32016999.
79. Ku EJ, Yoo WS, Lee EK, Ahn HY, Woo SH, Hong JH, et al. 2021; Effect of TSH suppression therapy on bone mineral density in differentiated thyroid cancer: a systematic review and meta-analysis. J Clin Endocrinol Metab. 106(12):3655–67. DOI: 10.1210/clinem/dgab539. PMID: 34302730.

80. Kwak D, Ha J, Won Y, Kwon Y, Park S. 2021; Effects of thyroid-stimulating hormone suppression after thyroidectomy for thyroid cancer on bone mineral density in postmenopausal women: a systematic review and meta-analysis. BMJ Open. 11(5):e043007. DOI: 10.1136/bmjopen-2020-043007. PMID: 33986046. PMCID: PMC8126273.

81. Fujiyama K, Kiriyama T, Ito M, Kimura H, Ashizawa K, Tsuruta M, et al. 1995; Suppressive doses of thyroxine do not accelerate age-related bone loss in late postmenopausal women. Thyroid. 5(1):13–7. DOI: 10.1089/thy.1995.5.13. PMID: 7787427.

82. Heijckmann AC, Huijberts MS, Geusens P, de Vries J, Menheere PP, Wolffenbuttel BH. 2005; Hip bone mineral density, bone turnover and risk of fracture in patients on long-term suppressive L-thyroxine therapy for differentiated thyroid carcinoma. Eur J Endocrinol. 153(1):23–9. DOI: 10.1530/eje.1.01933. PMID: 15994742.

83. Reverter JL, Colomé E, Holgado S, Aguilera E, Soldevila B, Mateo L, et al. 2010; Bone mineral density and bone fracture in male patients receiving long-term suppressive levothyroxine treatment for differentiated thyroid carcinoma. Endocrine. 37(3):467–72. DOI: 10.1007/s12020-010-9339-z. PMID: 20960170.

84. Vera L, Gay S, Campomenosi C, Paolino S, Pera G, Monti E, et al. 2016; Ten-year estimated risk of bone fracture in women with differentiated thyroid cancer under TSH-suppressive levothyroxine therapy. Endokrynol Pol. 67(4):350–8. DOI: 10.5603/EP.a2016.0046. PMID: 27387240.

85. Mazziotti G, Formenti AM, Frara S, Olivetti R, Banfi G, Memo M, et al. 2018; High prevalence of radiological vertebral fractures in women on thyroid-stimulating hormone-suppressive therapy for thyroid carcinoma. J Clin Endocrinol Metab. 103(3):956–64. DOI: 10.1210/jc.2017-01986. PMID: 29121201.

86. Lin SY, Lin CL, Chen HT, Kao CH. 2018; Risk of osteoporosis in thyroid cancer patients using levothyroxine: a population-based study. Curr Med Res Opin. 34(5):805–12. DOI: 10.1080/03007995.2017.1378174. PMID: 28884595.

87. Shin DW, Suh B, Lim H, Yun JM, Song SO, Park Y. 2018; J-shaped association between postoperative levothyroxine dosage and fracture risk in thyroid cancer patients: a retrospective cohort study. J Bone Miner Res. 33(6):1037–43. DOI: 10.1002/jbmr.3407. PMID: 29447437.

88. Bin-Hong D, Fu-Man D, Yu L, Xu-Ping W, Bing-Feng B. 2020; Effects of levothyroxine therapy on bone mineral density and bone turnover markers in premenopausal women with thyroid cancer after thyroidectomy. Endokrynol Pol. 71(1):15–20. DOI: 10.5603/EP.a2019.0049. PMID: 31681976.

89. Lee MY, Park JH, Bae KS, Jee YG, Ko AN, Han YJ, et al. 2014; Bone mineral density and bone turnover markers in patients on long-term suppressive levothyroxine therapy for differentiated thyroid cancer. Ann Surg Treat Res. 86(2):55–60. DOI: 10.4174/astr.2014.86.2.55. PMID: 24761409. PMCID: PMC3994597.

90. Moon JH, Kim KM, Oh TJ, Choi SH, Lim S, Park YJ, et al. 2017; The effect of TSH suppression on vertebral trabecular bone scores in patients with differentiated thyroid carcinoma. J Clin Endocrinol Metab. 102(1):78–85. DOI: 10.1210/jc.2016-2740. PMID: 27754806.
91. De Mingo Dominguez ML, Guadalix Iglesias S, Martin-Arriscado Arroba C, Lopez Alvarez B, Martinez Diaz-Guerra G, Martinez-Pueyo JI, et al. 2018; Low trabecular bone score in postmenopausal women with differentiated thyroid carcinoma after long-term TSH suppressive therapy. Endocrine. 62(1):166–73. DOI: 10.1007/s12020-018-1671-8. PMID: 30014437.

92. Hawkins Carranza F, Guadalix Iglesias S, Luisa De Mingo Dominguez M, Martin-Arriscado Arroba C, Lopez Alvarez B, Allo Miguel G, et al. 2020; Trabecular bone deterioration in differentiated thyroid cancer: impact of long-term TSH suppressive therapy. Cancer Med. 9(16):5746–55. DOI: 10.1002/cam4.3200. PMID: 32583973. PMCID: PMC7433843.

93. Moon JH, Jung KY, Kim KM, Choi SH, Lim S, Park YJ, et al. 2016; The effect of thyroid stimulating hormone suppressive therapy on bone geometry in the hip area of patients with differentiated thyroid carcinoma. Bone. 83:104–10. DOI: 10.1016/j.bone.2015.10.015. PMID: 26518742.

94. Tournis S, Antoniou JD, Liakou CG, Christodoulou J, Papakitsou E, Galanos A, et al. 2015; Volumetric bone mineral density and bone geometry assessed by peripheral quantitative computed tomography in women with differentiated thyroid cancer under TSH suppression. Clin Endocrinol (Oxf). 82(2):197–204. DOI: 10.1111/cen.12560. PMID: 25040693.

95. Kim K, Kim IJ, Pak K, Kim SJ, Shin S, Kim BH, et al. 2018; Evaluation of bone mineral density using DXA and cQCT in postmenopausal patients under thyrotropin suppressive therapy. J Clin Endocrinol Metab. 103(11):4232–40. DOI: 10.1210/jc.2017-02704. PMID: 29982711.

96. Panico A, Lupoli GA, Fonderico F, Marciello F, Martinelli A, Assante R, et al. 2009; Osteoporosis and thyrotropin-suppressive therapy: reduced effectiveness of alendronate. Thyroid. 19(5):437–42. DOI: 10.1089/thy.2008.0428. PMID: 19415993.

97. Panebianco P, Rosso D, Destro G, Scarpinato RA, Tropea S, Rizzo A, et al. 1997; Use of disphosphonates in the treatment of osteoporosis in thyroidectomized patients on levothyroxin replacement therapy. Arch Gerontol Geriatr. 25(2):219–25. DOI: 10.1016/S0167-4943(97)00013-7. PMID: 18653109.

98. Asari R, Passler C, Kaczirek K, Scheuba C, Niederle B. 2008; Hypoparathyroidism after total thyroidectomy: a prospective study. Arch Surg. 143(2):132–7. discussion 8DOI: 10.1001/archsurg.2007.55. PMID: 18283137.
99. Pattou F, Combemale F, Fabre S, Carnaille B, Decoulx M, Wemeau JL, et al. 1998; Hypocalcemia following thyroid surgery: incidence and prediction of outcome. World J Surg. 22(7):718–24. DOI: 10.1007/s002689900459. PMID: 9606288.

100. Roher HD, Goretzki PE, Hellmann P, Witte J. 1999; Complications in thyroid surgery. Incidence and therapy. Chirurg. 70(9):999–1010. DOI: 10.1007/s001040050757. PMID: 10501664.
101. Thomusch O, Machens A, Sekulla C, Ukkat J, Brauckhoff M, Dralle H. 2003; The impact of surgical technique on postoperative hypoparathyroidism in bilateral thyroid surgery: a multivariate analysis of 5846 consecutive patients. Surgery. 133(2):180–5. DOI: 10.1067/msy.2003.61. PMID: 12605179.

102. Thomusch O, Machens A, Sekulla C, Ukkat J, Lippert H, Gastinger I, et al. 2000; Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in Germany. World J Surg. 24(11):1335–41. DOI: 10.1007/s002680010221. PMID: 11038203.

103. Testini M, Gurrado A, Lissidini G, Nacchiero M. 2007; Hypoparathyroidism after total thyroidectomy. Minerva Chir. 62(5):409–15. DOI: 10.1001/archsurg.2007.44. PMID: 17947951.
104. Kakava K, Tournis S, Papadakis G, Karelas I, Stampouloglou P, Kassi E, et al. 2016; Postsurgical hypoparathyroidism: a systematic review. In Vivo. 30(3):171–9. DOI: 10.1007/s12020-019-01858-4. PMID: 27107072.
105. Silva B, Kousteni S. Bilezikian J, editor. Cellular actions of PTH: osteoblasts, osteoclasts, and osteocytes. The parathyroids. 3rd ed. San Diego: Elsevier Inc.;2015. p. 127–37. DOI: 10.1016/B978-0-12-397166-1.00008-4.
106. Rubin MR, Dempster DW, Zhou H, Shane E, Nickolas T, Sliney J Jr, et al. 2008; Dynamic and structural properties of the skeleton in hypoparathyroidism. J Bone Miner Res. 23(12):2018–24. DOI: 10.1359/jbmr.080803. PMID: 18684087. PMCID: PMC2686925.

107. Clarke BL. 2014; Bone disease in hypoparathyroidism. Arq Bras Endocrinol Metabol. 58(5):545–52. DOI: 10.1590/0004-2730000003399. PMID: 25166046.

108. Chan FK, Tiu SC, Choi KL, Choi CH, Kong AP, Shek CC. 2003; Increased bone mineral density in patients with chronic hypoparathyroidism. J Clin Endocrinol Metab. 88(7):3155–9. DOI: 10.1210/jc.2002-021388. PMID: 12843159.

109. Amrein K, Dimai HP, Dobnig H, Fahrleitner-Pammer A. 2011; Low bone turnover and increase of bone mineral density in a premenopausal woman with postoperative hypoparathyroidism and thyroxine suppressive therapy. Osteoporos Int. 22(11):2903–5. DOI: 10.1007/s00198-010-1441-9. PMID: 20959964.

110. Takamura Y, Miyauchi A, Yabuta T, Kihara M, Ito Y, Miya A. 2013; Attenuation of postmenopausal bone loss in patients with transient hypoparathyroidism after total thyroidectomy. World J Surg. 37(12):2860–5. DOI: 10.1007/s00268-013-2207-2. PMID: 24045966.

111. Bollerslev J, Rejnmark L, Marcocci C, Shoback DM, Sitges-Serra A, van Biesen W, et al. 2015; European Society of Endocrinology Clinical Guideline: treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol. 173(2):G1–20. DOI: 10.1530/EJE-15-0628. PMID: 26160136.

112. Orloff LA, Wiseman SM, Bernet VJ, Fahey TJ 3rd, Shaha AR, Shindo ML, et al. 2018; American Thyroid Association statement on postoperative hypoparathyroidism: diagnosis, prevention, and management in adults. Thyroid. 28(7):830–41. DOI: 10.1089/thy.2017.0309. PMID: 29848235.

Fig. 1
Evaluation and management of bone health in (A) women and (B) men with hyperthyroidism. 1Ca/D+Osteoporosis Tx, Treatment for osteoporosis is needed in combination with calcium and vitamin D replacement. 2Ca/D±Osteoporosis Tx, Treatment for osteoporosis can be considered in combination with calcium and vitamin D replacement. Anti-osteoporosis treatment includes anti-resorptive agents (e.g., bisphosphonate) and anabolic agents. Certain types of bisphosphonates (i.e., ibandronate) are not available in men. BMD: bone mineral density, Ca/D: calcium and vitamin D, DXA: dual-energy X-ray absorptiometry, Tx: therapy
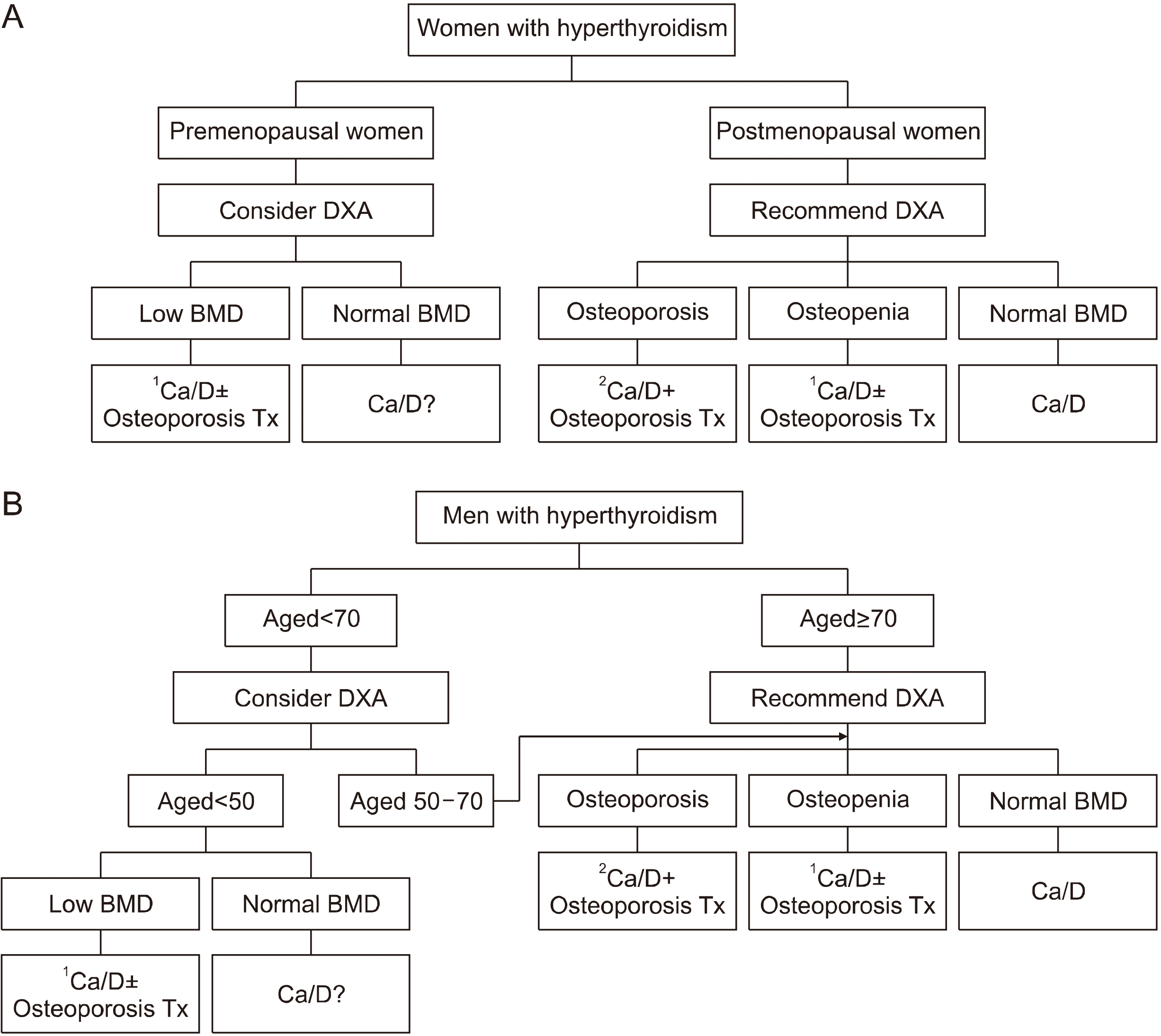
Fig. 2
Evaluation and management of bone health in (A) women and (B) men with differentiated thyroid cancer under TSH suppressive therapy. 1The high-risk group for osteoporosis and fragility fractures includes a previous history of fragility fractures, more than 1 year of amenorrhea in women, having other medical diseases or taking medications that cause osteoporosis. 2Ca/D+Osteoporosis Tx, Treatment for osteoporosis is needed in combination with calcium and vitamin D replacement. 3Ca/D±Osteoporosis Tx, Treatment for osteoporosis can be considered in combination with calcium and vitamin D replacement. Anti-osteoporosis treatment includes anti-resorptive agents (e.g., bisphosphonate) and anabolic agents. Certain types of bisphosphonates (i.e., ibandronate) are not available in men. BMD: bone mineral density, Ca/D: calcium and vitamin D, DTC: differentiated thyroid cancer, DXA: dual-energy X-ray absorptiometry, TSH: thyroid stimulating hormone, Tx: therapy
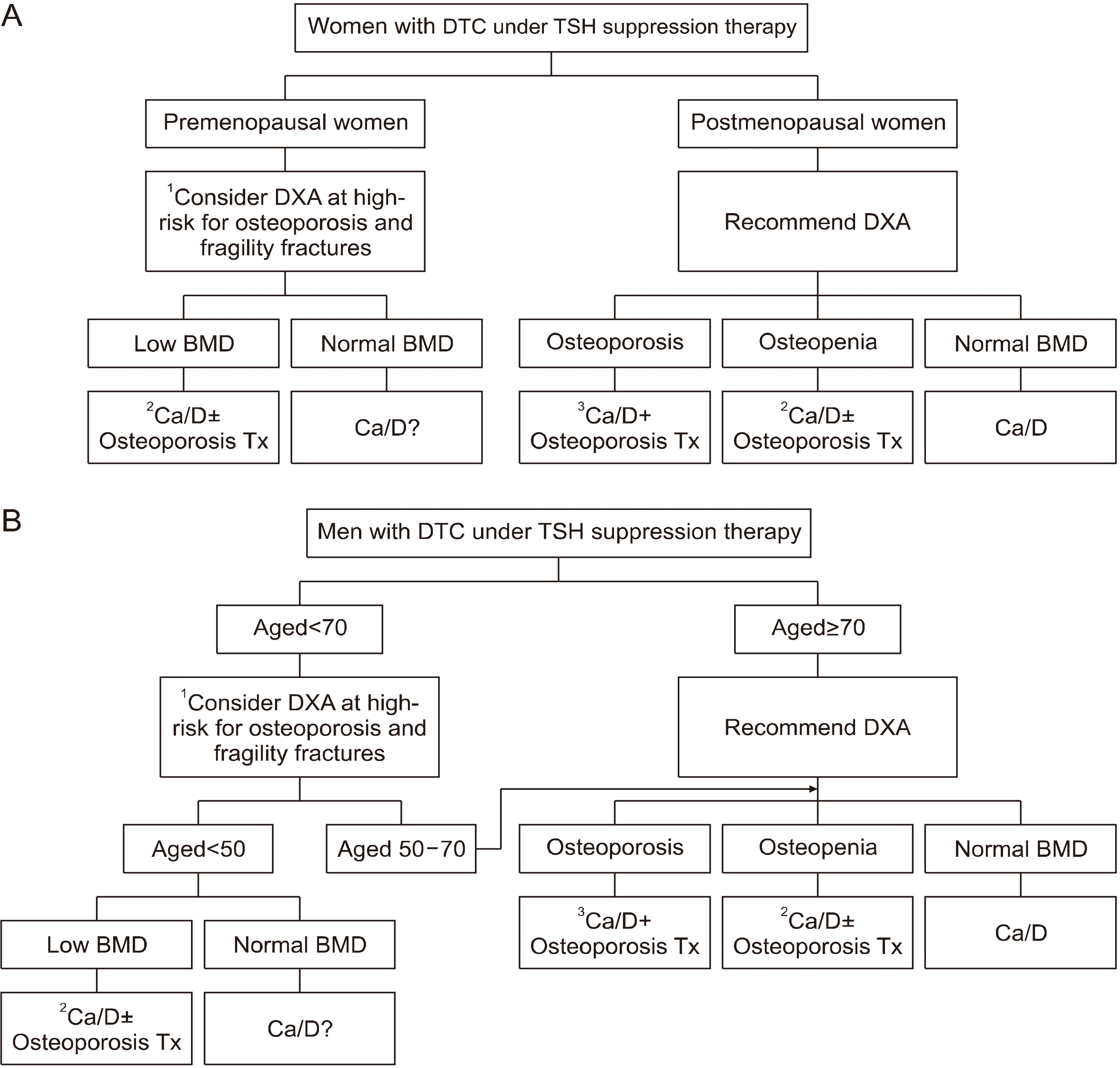
Table 1
Definition of recommendation levels




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download