Abstract
Thyroid cancers are commonly diagnosed worldwide with a continuously increasing incident rate. The ultra-sonography is the gold standard method for triaging thyroid nodules to biopsy. Although it has successfully triaged cancerous nodules, many benign nodules also have been triaged to be taken an invasive biopsy, which leads to the overdiagnosing issue. Photoacoustic imaging is an emerging biomedical imaging technique that can provide molecular functional information of biological tissues. Recently, there have been trials to investigate thyroid nodules by using clinically relevant photoacoustic imaging systems. In this review, the principles and applications of the photoacoustic imaging systems for analyzing thyroid nodules are overviewed. Although this technique still has a lot of ways to go for clinical translation, its initial results show great potential to be used for triaging thyroid nodules in vivo.
American Cancer Society 보고에 의하면 갑상선암은 미국 내 여성의 암 발병률 5위에 해당하는 질병이며,1) 다른 암과 달리 최근 10년간 발병률이 꾸준히 증가하는 추세를 보인다.2,3) 특히 2022년에 이르러 ∼43,800명의 갑상선암 환자가 새롭게 진단될 것으로 예측된다.4) 하지만 이러한 발병률의 증가는 의료영상기술의 발전에 따라 즉각적인 치료가 필요하지 않은 작은 갑상선 결절의 발견 및 과잉진단에 따른 결과라는 문제점이 제기되고 있으며5) 실제로 지난 20년간 약 56만여 명이 과잉진단 되었다는 보고가 있다.6)
현재 갑상선암 진단을 위해 경부 초음파검사(ultrasonography) 및 미세바늘을 이용한 조직검사(fine needle aspiration biopsy, FNAB)가 주로 사용되고 있다. 이는 초음파 영상에서 보이는 갑상선 결절의 크기, 석회화 정도, 경계면, 모양 등을 기반으로 FNAB 실행 여부를 판단하는 방법으로,7) 진단의 정확도에 한계가 있고8) 10-20% 정도는 양성/악성 간의 판단을 할 수 없는 결과를 보이는 문제가 있다.9) 대표적인 초음파 영상을 이용한 갑상선 결절의 수치화 방법인 ATA (American Thyroid Association) guideline,10) BTA (British Thyroid Association) guideline,11) TIRADS (Thyroid Imaging Reporting and Data System)12) 등은 악성 결절을 놓치지 않도록 민감도(sensitivity)를 높이는 방향으로 설정되어 있지만 상대적으로 낮은 특이도(specificity)에 의해 다수의 양성 결절에도 조직검사를 시행하게 되는 단점이 있다.13) 이는 잠재적으로 불필요한 조직검사 및 수술을 야기하기 때문에 환자의 불편함과 사회적 비용의 낭비를 불러오며, 과잉진단 문제와 연결된다. 따라서, 갑상선암의 과잉진단 문제를 경감시키고 진단의 정확성을 높이기 위해 갑상선 결절의 기능적 정보를 제공할 수 있는 추가적인 검사 방법이 필요하다.
광음향 영상은 광학 영상과 초음파 영상의 원리를 융합한 차세대 융합 의료영상기술로 최근 다양한 전임상 및 임상 연구 분야에서 각광받고 있다.14-16) 광음향 영상은 짧은 펄스의 레이저에 의해 발생되는 초음파를 수신하여 생체 조직의 광흡수 성질을 초음파의 해상도로 영상화 하는 원리로 X–ray, CT (X–ray computed tomography)와 달리 이온화 방사선을 사용하지 않고, MRI (magnetic resonance imaging), PET (positron emission tomography)에 비해 빠르고 저렴한 가격에 구현이 가능하며, 광학 영상에 비해 생체 조직 내부 깊은 영역의 영상을 얻을 수 있고, 초음파 영상에서 얻을 수 없는 혈중 산소 포화도 등의 기능적인 정보를 얻을 수 있는 장점이 있다. 특히, 초음파 영상 장비와 결합되어 하나의 영상 플랫폼에 구현이 가능하기 때문에17) 임상으로 적용할 수 있는 가능성이 크다.
본 논문에서는 광음향 영상의 원리와, 초음파 영상장비와 결합된 임상용 광음향–초음파 영상 장비에 대한 소개를 바탕으로 현재까지 수행된 갑상선암 진단 관련 임상연구의 결과를 정리하고자 한다. 광음향 영상의 임상적용은 아직 초기 단계이지만, 선행 연구들의 결과를 바탕으로 시스템의 최적화, 적절한 임상 적용 분야 발굴 등을 통해 성공적인 임상 적용이 가능할 것으로 기대된다.
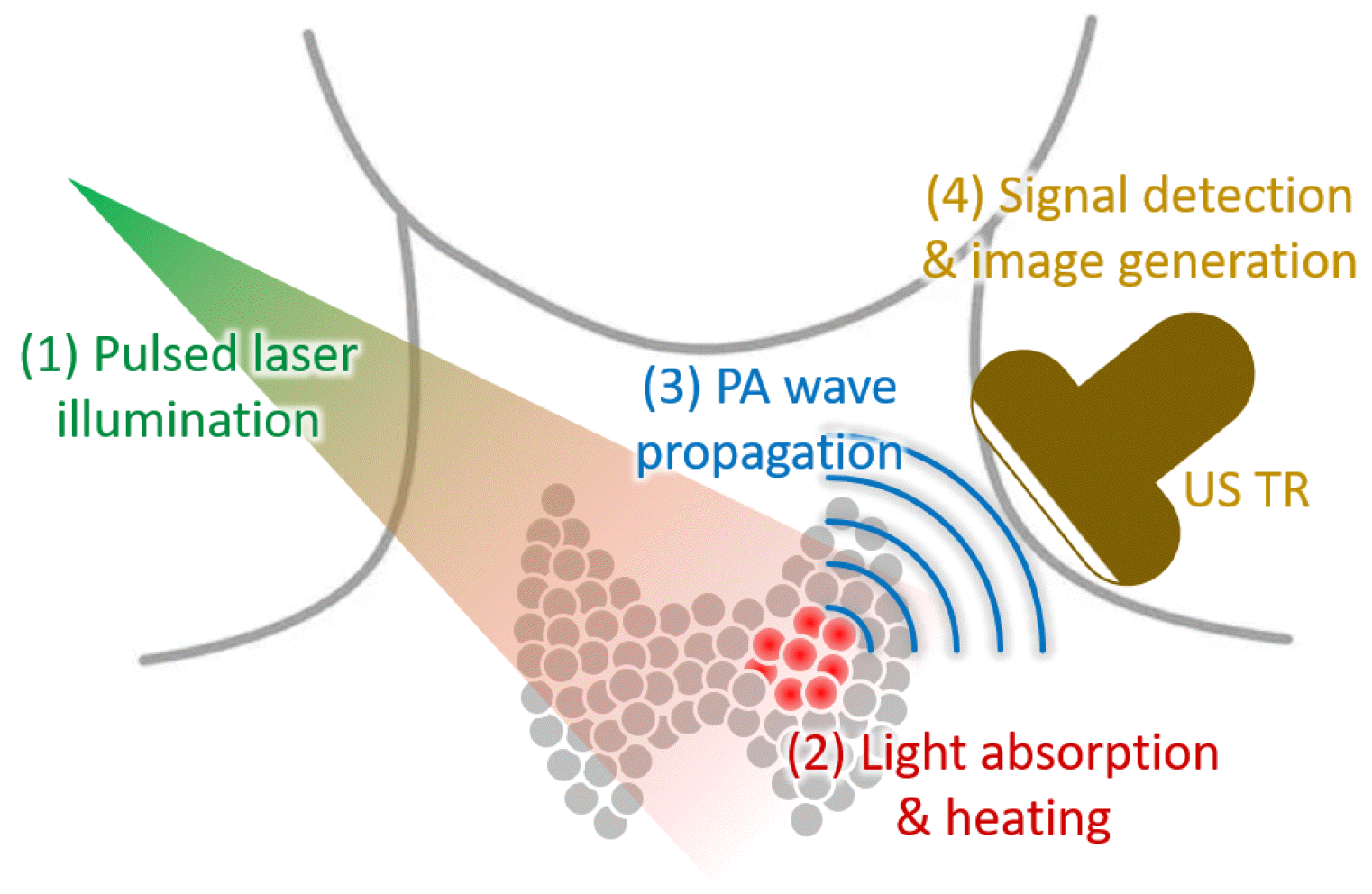
광음향 영상은 광학 영상과 초음파 영상의 원리가 융합된 영상 방법으로, 두 영상의 장점을 바탕으로 서로의 단점을 보완하여 높은 광학 대조비를 초음파의 해상도로 얻을 수 있어 다양한 전임상 소동물 연구 및 임상 연구에서 각광받고 있다.18-20) 광음향 영상은 빛 에너지의 흡수에 의해 발생되는 열팽창을 통한 음파의 생성인 광음향 효과(photoacoustic effect)에 기반한다(Fig. 1).21) 광음향 신호의 생성을 위해서 짧은(폭 ∼10 ns) 펄스 레이저를 생체 조직에 조사하게 되면, 생체 내부의 빛을 흡수하는 물질이 빛 에너지를 흡수하게 되고, 흡수된 빛 에너지가 열 에너지로 변환되면서 순간적인 부피의 팽창과 수축이 일어나게 된다. 이에 따라 주변 조직의 진동이 발생되며, 이는 초음파의 형태로 전달된다. 이렇게 전달된 초음파(광음향파)는 기존 초음파 영상에서 사용되는 초음파 트랜스듀서를 이용하여 감지할 수 있으며, 신호처리 과정을 거쳐 영상으로 구현된다. 특히, 레이저의 파장을 변경하여 조사하면, 생체 내부의 물질의 빛 흡수도가 변하게 되고 결과 영상의 경향이 달라진다. 이렇게 얻은 다파장 영상에 분광학적 분석 방법을 적용하면, 광학 영상에서 얻을 수 있는 기능적 분자영상 정보를 얻을 수 있다. 이를 이용하여, 전임상 소동물 연구에서는 광학적 흡수도가 큰 조영제를 전달하여 향상된 대조비의 영상을 얻거나 약물전달 모니터링 등의 연구를 주로 수행하고 있다.22-24) 하지만 이러한 외부 조영제는 임상에 적용하기 쉽지 않기 때문에 현재 광음향 영상의 임상 연구는 혈관 분포 및 혈중 산소포화도 분석을 기반으로 한 질병 진단이 주된 방법이다.25)
근래에 몇몇 광음향 영상 장비들이 상용화되고 있지만 임상에 적합하지 않은 디자인, 제한적인 이동성, 유방암 전용 등 특정부위 전용의 장비, 또는 동작 수정이 불가능한 인터페이스 등 때문에 실제 임상으로 적용하기에 한계가 있었다. 최근 본 저자의 연구 그룹은 FDA 승인을 받은 초음파 영상 장비와 움직일 수 있는 Nd:YAG 기반의 레이저를 결합하여 임상용 실시간 광음향–초음파 영상 장비를 개발하였다(Fig. 2A).26) 특히, 연구에 사용된 초음파 장비는 기존에 병원에서 사용되어 오던 초음파 장비와 다르게 연구자가 필요에 따라 동작을 수정할 수 있도록 설계가 되어있어, 연구 목적에 따라 장비의 동작을 바꾸어 사용할 수 있다. 이를 이용하여 실시간으로 초음파 영상과 광음향 영상을 동시에 획득할 수 있었으며, 개발된 장비의 성능을 시험하기 위해 혈관모사팬텀, 소동물의 위장관, 사람 팔의 혈관 등의 영상화에 성공하였다(Fig. 2B). 실시간 영상 획득을 위해 모든 영상 구현 과정은 GPU (graphics processing unit) 기반의 병렬 연산으로 구성되었다. 또한, 초음파 프로브와 레이저 전달부를 결합하여 융합 영상 프로브를 디자인하였으며, 최적의 광 전달을 위해 Monte Carlo 시뮬레이션을 이용한 디자인 최적화를 수행하였다.27) 특히, 모든 영상 파라미터를 실시간으로 수정할 수 있고, 임상 연구를 위한 기반을 마련하였다.
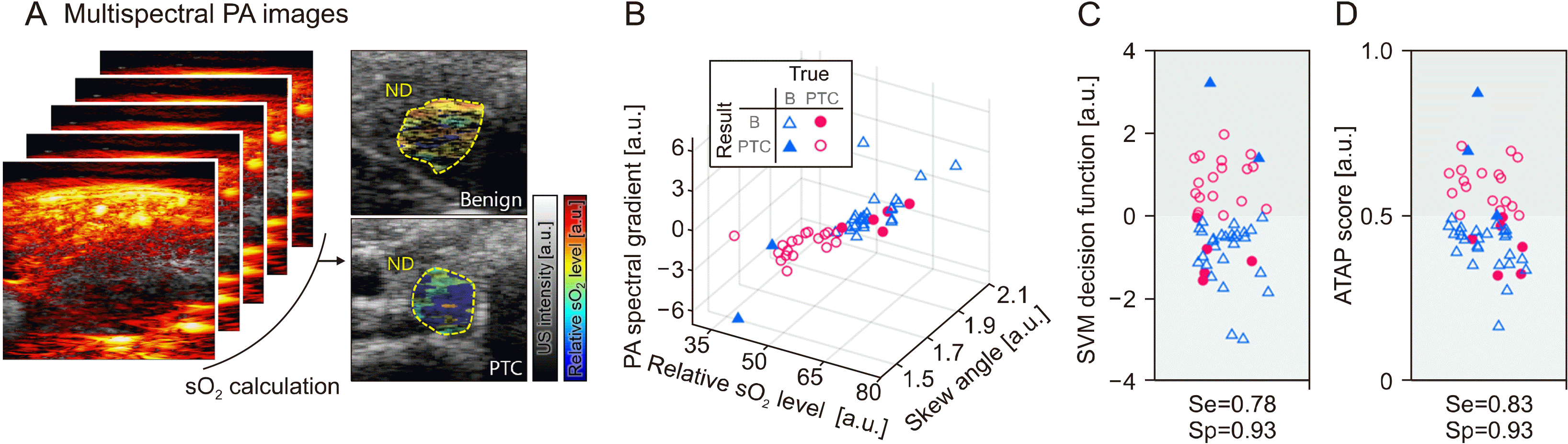
최근 갑상선 결절의 분석을 위해 다파장 광음향 신호를 이용한 임상 시험이 다양하게 시도되었다. University of Rochester의 Dogra 그룹은 수술을 통해 떼어낸 갑상선 결절의 다파장 광음향 신호를 분석하여 양성 결절과 악성 결절의 구분 가능성을 최초로 보였다.28) 광음향 영상 장비를 이용한 갑상선 결절의 in vivo 영상 가능성에 대한 검증에 이어,29) 다파장 광음향 신호 분석을 이용한 갑상선 결절의 분석이 수행되었다.30) 하지만 연구에 모집된 환자의 수가 제한적이었기 때문에 통계적인 분석이 어려웠다. 최근 본 저자의 연구 그룹은 그동안 개발한 임상용 광음향–초음파 영상 장비를 이용하여 갑상선 결절의 양성과 악성을 구분하는 연구를 서울강남성모병원의 임상시험 허가를 받아(NCT 00170196) 수행하였다.31) 이 연구에서는 갑상선유두암(PTC, papillary thyroid cancer) 환자와 양성 결절 환자로부터 갑상선 결절의 다파장 광음향 영상을 얻고, 다중 파라미터 분석을 통한 양성과 악성의 구분 가능성에 대한 검증을 시도하였다. 광음향 분석의 가능성을 확인하기 위해 전체 갑상선암의 약 90%를 이루고,32) 비교적 검증이 쉬운 갑상선유두암 환자의 진단을 목표로 연구를 수행하였다. 총 52명의 환자로부터 데이터를 획득하였으며, 조직검사를 통해 그중 23명은 갑상선유두암, 29명은 양성결절로 진단되었다. 다파장 분석을 위해 5개의 파장을 이용하여 광음향 신호를 획득하고 영상화 하였으며(Fig. 3A), 각 파장에 따른 안전기준 보다 낮은 10.7 mJ/cm2의 광출력을 사용하였다. 다파장 신호 처리를 통해 산소 포화도를 계산하고 이를 기반으로 (1) 갑상선 결절의 산소포화도(sO2, hemoglobin oxygen saturation level), (2) 광음향 신호의 파장 기울기(PA spectral gradient), (3) 산소포화도 분포도의 기울기(skew angle in the sO2 distribution) 등 3개의 파라미터를 정의하여 양성결절과 악성결절의 구분에 이용하였다. 3개의 파라미터를 3차원 공간에 매핑한 후(Fig. 3B), SVM (support vector machine)을 사용하여 3차원 경계를 학습하고 결절의 구분 성능을 평가한 결과 민감도 78%, 특이도 93%의 결과를 얻었다(Fig. 3C). 이는 기존의 초음파 영상 기반의 분류 방법이 민감도가 높고 특이도가 낮은 것과 상반된 결과로, 초음파 영상과 광음향 영상 결과를 융합하여 상호 보완의 결과를 얻을 수 있음을 보인다. 이를 검증하기 위해 초음파 영상 기반의 평가 방법인 ATA guideline 점수와 광음향 신호 기반의 암일 확률을 결합하여, 새로운 평가방법인 ATAP scoring을 제시하였다.
[ATAP score]=γ×[ATA Guideline]+(1−γ)×[PA probability of PTC]
위의 식에서 γ는 0과 1사이의 값으로 0.2의 값을 사용 하였을 때 가장 좋은 결과인 민감도 83%, 특이도 93% 를 획득 하였다(Fig. 3D). 이 결과는 광음향 영상을 이용하여 최초로 수행된 통계적 분석 기반의 갑상선 결절 분석이며, 광음향 영상이 초음파 영상과 결합되어 갑상선 결절의 양성/악성을 성공적으로 분류할 수 있는 가능성이 있음을 보여준다.
광음향 영상은 생체 조직의 빛의 흡수도를 초음파의 해상도로 영상화 하는 융합 의료영상 방법으로, 전임상 소동물 뿐만 아니라 임상 연구에도 적용할 수 있는 가능성이 크다. 최근의 연구결과로부터 실시간 광음향–초음파 융합 영상의 임상 적용 가능성을 확인 할 수 있었으며, 특히 갑상선 결절의 양성/악성 간의 차이를 구분할 수 있는 새로운 정보를 제공하여 갑상선암의 오진율을 감소시키고 불필요한 조직검사 혹은 수술을 방지할 수 있을 것으로 기대되며, 이에 따라 최근 사회적 문제로 불거진 갑상선암의 과잉진단 및 과잉치료 문제를 해소할 수 있을 것으로 기대된다. 또한 갑상선암 이외의 유방암, 전립선암, 피부암 등 다양한 임상연구에 적용할 수 있을 것으로 기대된다.
References
1. Ferlay J, Colombet M, Soerjomataram I, Mathers C, Parkin DM, Pineros M, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019; 144(8):1941–53. DOI: 10.1002/ijc.31937. PMID: 30350310.

2. Davies L, Morris LG, Haymart M, Chen AY, Goldenberg D, Morris J, et al. 2015; American Association of Clinical Endocrinologists and American College of Endocrinology disease state clinical review: the increasing incidence of thyroid cancer. Endocr Pract. 21(6):686–96. DOI: 10.4158/EP14466.DSCR. PMID: 26135963. PMCID: PMC4923940.

3. Horn-Ross PL, Lichtensztajn DY, Clarke CA, Dosiou C, Oakley-Girvan I, Reynolds P, et al. 2014; Continued rapid increase in thyroid cancer incidence in California: trends by patient, tumor, and neighborhood characteristics. Cancer Epidemiol Biomarkers Prev. 23(6):1067–79. DOI: 10.1158/1055-9965.EPI-13-1089. PMID: 24842625. PMCID: PMC4071298.

4. Siegel RL, Miller KD, Fuchs HE, Jemal A. 2022; Cancer statistics, 2022. CA Cancer J Clin. 72(1):7–33. DOI: 10.3322/caac.21708. PMID: 35020204.

5. Welch HG, Black WC. 2010; Overdiagnosis in cancer. J Natl Cancer Inst. 102(9):605–13. DOI: 10.1093/jnci/djq099. PMID: 20413742.

6. Vaccarella S, Franceschi S, Bray F, Wild CP, Plummer M, Dal Maso L. 2016; Worldwide thyroid-cancer epidemic? The increasing impact of overdiagnosis. N Engl J Med. 375(7):614–7. DOI: 10.1056/NEJMp1604412. PMID: 27532827.

7. Moon WJ, Jung SL, Lee JH, Na DG, Baek JH, Lee YH, et al. 2008; Benign and malignant thyroid nodules: US differentiation-- multicenter retrospective study. Radiology. 247(3):762–70. DOI: 10.1148/radiol.2473070944. PMID: 18403624.

8. Frates MC, Benson CB, Charboneau JW, Cibas ES, Clark OH, Coleman BG, et al. 2005; Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement. Radiology. 237(3):794–800. DOI: 10.1148/radiol.2373050220. PMID: 16304103.

9. Gharib H, Goellner JR. 1993; Fine-needle aspiration biopsy of the thyroid: an appraisal. Ann Intern Med. 118(4):282–9. DOI: 10.7326/0003-4819-118-4-199302150-00007. PMID: 8420446.

10. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2016; 2015 American Thyroid Association Management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 26(1):1–133. DOI: 10.1089/thy.2015.0020. PMID: 26462967. PMCID: PMC4739132.

11. Perros P, Boelaert K, Colley S, Evans C, Evans RM, Gerrard Ba G, et al. 2014; Guidelines for the management of thyroid cancer. Clin Endocrinol (Oxf). 81 Suppl 1:1–122. DOI: 10.1111/cen.12515. PMID: 24989897.

12. Kwak JY, Han KH, Yoon JH, Moon HJ, Son EJ, Park SH, et al. 2011; Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk. Radiology. 260(3):892–9. DOI: 10.1148/radiol.11110206. PMID: 21771959.

13. Chng CL, Tan HC, Too CW, Lim WY, Chiam PPS, Zhu L, et al. 2018; Diagnostic performance of ATA, BTA and TIRADS sonographic patterns in the prediction of malignancy in histo-logically proven thyroid nodules. Singapore Med J. 59(11):578–83. DOI: 10.11622/smedj.2018062. PMID: 29774361. PMCID: PMC6250759.

14. Kim C, Favazza C, Wang LV. 2010; In vivo photoacoustic tomography of chemicals: high-resolution functional and molecular optical imaging at new depths. Chem Rev. 110(5):2756–82. DOI: 10.1021/cr900266s. PMID: 20210338. PMCID: PMC2872199.

15. Choi W, Park EY, Jeon S, Kim C. 2018; Clinical photoacoustic imaging platforms. Biomed Eng Lett. 8(2):139–55. DOI: 10.1007/s13534-018-0062-7. PMID: 30603199. PMCID: PMC6208525.

16. Steinberg I, Huland DM, Vermesh O, Frostig HE, Tummers WS, Gambhir SS. 2019; Photoacoustic clinical imaging. Photoacoustics. 14:77–98. DOI: 10.1016/j.pacs.2019.05.001. PMID: 31293884. PMCID: PMC6595011.

17. Kim C, Erpelding TN, Jankovic L, Pashley MD, Wang LV. 2010; Deeply penetrating in vivo photoacoustic imaging using a clinical ultrasound array system. Biomed Opt Express. 1(1):278–84. DOI: 10.1364/BOE.1.000278. PMID: 21258465. PMCID: PMC3005157.

18. Wang LV, Hu S. 2012; Photoacoustic tomography: in vivo imaging from organelles to organs. Science. 335(6075):1458–62. DOI: 10.1126/science.1216210. PMID: 22442475. PMCID: PMC3322413.

19. Kim J, Park S, Lee C, Kim JY, Kim C. 2015; Organic nanostructures for photoacoustic imaging. ChemNanoMat. 2(3):156–66. DOI: 10.1002/cnma.201500171.

20. Park EY, Lee H, Han S, Kim C, Kim J. 2022; Photoacoustic imaging systems based on clinical ultrasound platform. Exp Biol Med (Maywood). 247(7):551–60. DOI: 10.1177/15353702211073684. PMID: 35068228. PMCID: PMC9014524.

21. Bell AG. 1880; The photophone. Science. 1(11):130–4. DOI: 10.1126/science.os-1.11.130. PMID: 17834320.

22. Lee C, Kim J, Zhang Y, Jeon M, Liu C, Song L, et al. 2015; Dual-color photoacoustic lymph node imaging using nanofor-mulated naphthalocyanines. Biomaterials. 73:142–8. DOI: 10.1016/j.biomaterials.2015.09.023. PMID: 26408999.

23. Zhang Y, Jeon M, Rich LJ, Hong H, Geng J, Zhang Y, et al. 2014; Non-invasive multimodal functional imaging of the intestine with frozen micellar naphthalocyanines. Nat Nanotechnol. 9(8):631–8. DOI: 10.1038/nnano.2014.130. PMID: 24997526. PMCID: PMC4130353.

24. Park B, Lee KM, Park S, Yun M, Choi HJ, Kim J, et al. 2020; Deep tissue photoacoustic imaging of nickel(II) dithiolene- containing polymeric nanoparticles in the second near-infrared window. Theranostics. 10(6):2509–21. DOI: 10.7150/thno.39403. PMID: 32194816. PMCID: PMC7052900.

25. Zhang HF, Maslov K, Sivaramakrishnan M, Stoica G, Wang LV. 2007; Imaging of hemoglobin oxygen saturation variations in single vessels in vivo using photoacoustic microscopy. Appl Phys Lett. 90(5):053901. DOI: 10.1063/1.2435697.
26. Kim J, Park S, Jung Y, Chang S, Park J, Zhang Y, et al. 2016; Programmable real-time clinical photoacoustic and ultrasound imaging system. Sci Rep. 6:35137. DOI: 10.1038/srep35137. PMID: 27731357. PMCID: PMC5059665.

27. Kim J, Park EY, Park B, Choi W, Lee KJ, Kim C. 2020; Towards clinical photoacoustic and ultrasound imaging: probe improvement and real-time graphical user interface. Exp Biol Med (Maywood). 245(4):321–9. DOI: 10.1177/1535370219889968. PMID: 31916849. PMCID: PMC7370595.

28. Dogra VS, Chinni BK, Valluru KS, Moalem J, Giampoli EJ, Evans K, et al. 2014; Preliminary results of ex vivo multispectral photoacoustic imaging in the management of thyroid cancer. AJR Am J Roentgenol. 202(6):W552–8. DOI: 10.2214/AJR.13.11433. PMID: 24848849.

29. Dima A, Ntziachristos V. 2016; In-vivo handheld optoacoustic tomo-graphy of the human thyroid. Photoacoustics. 4(2):65–9. DOI: 10.1016/j.pacs.2016.05.003. PMID: 27766210. PMCID: PMC5066088.

30. Roll W, Markwardt NA, Masthoff M, Helfen A, Claussen J, Eisenblatter M, et al. 2019; Multispectral optoacoustic tomography of benign and malignant thyroid disorders: a pilot study. J Nucl Med. 60(10):1461–6. DOI: 10.2967/jnumed.118.222174. PMID: 30850507. PMCID: PMC6785793.

31. Kim J, Park B, Ha J, Steinberg I, Hooper SM, Jeong C, et al. 2021; Multiparametric photoacoustic analysis of human thyroid cancers in vivo. Cancer Res. 81(18):4849–60. DOI: 10.1158/0008-5472.CAN-20-3334. PMID: 34185675.
32. Mao Y, Xing M. 2016; Recent incidences and differential trends of thyroid cancer in the USA. Endocr Relat Cancer. 23(4):313–22. DOI: 10.1530/ERC-15-0445. PMID: 26917552. PMCID: PMC4891202.

Fig. 2
(A) Photograph of the clinical PA and US imaging system. (B) PA images of blood vessel network in the human forearm. FB: fiber bundle, PA: photoacoustic, TR: transducer, US: ultrasound. The images are reproduced with permission from Ref. 26.
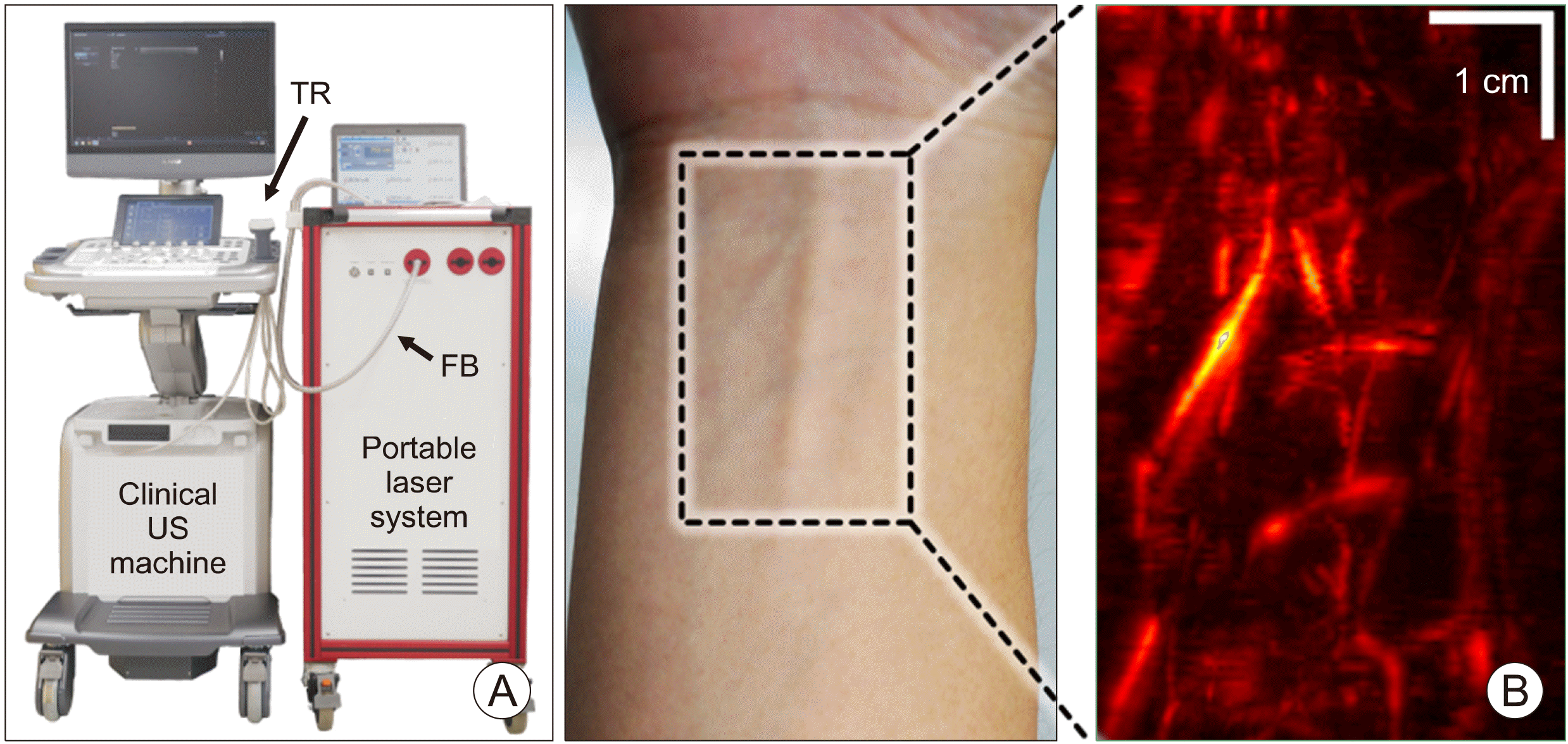
Fig. 3
(A) Multispectral PA analysis of human thyroid in vivo. (B) Three-dimensional illustrations of the multiparametric values with the classification results. (C) Classification results of the thyroid nodules based on the SVM decision function values. (D) Classification results of the thyroid nodules based on the ATAP score. ATAP: the American Thyroid Association and the photoacoustic probability of PTC, B: benign, ND: nodule, PA: photoacoustic, PTC: papillary thyroid cancer, Se: sensitivity, sO2: hemoglobin oxygen saturation, Sp: specificity, SVM: support vector machine, US: ultrasound. The images are reproduced with permission from Ref. 28.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download