Abstract
EUS-guided drainage for gallbladder, bile duct, pancreatic duct, and peripancreatic fluid collection has been performed more frequently in the last decade. The development of dedicated stents and delivery systems for EUS-guided interventions have improved the efficacy and safety of these procedures. Furthermore, the introduction of lumen-apposing metal stents has reduced the complication significantly of endoscopic transmural drainage of pancreatic collections and gallbladder. Recent studies show that EUS-guided drainage of pancreaticobiliary ducts and peripancreatic fluid collection produces good results and low complication rates. This review describes the current position and role of interventional EUS for pancreatobiliary disease in clinical practice.
췌장담도 질환에서 내시경역행담췌관조영술(ERCP)을 통한 췌담도 배액술은 기본적인 치료 방법이다. 그러나 선택적 췌관 또는 담관 삽관에 실패하거나, 수술로 인해 해부학적 구조의 변화, 위장관 폐쇄, 십이지장 주위 악성종양에 의한 십이지장 폐쇄 등으로 십이지장 유두부로의 내시경 진입이 어려운 경우에는 성공적인 ERCP를 수행하기 어렵다. 이를 극복할 수 있는 방법으로 경피경간담도배액술(percutaneous transhepatic biliary drainage, PTBD)이나 수술적 치료가 차선책으로 선택될 수 있다. 그러나 경피적 배액술 관련 합병증이 발생할 수 있고, 체외 배액관으로 인한 환자의 삶의 질이 저하될 수 있다. 또한 수술 고위험군 환자에서는 수술 관련 이환율과 사망률의 증가도 우려되는 부분이다. 이러한 수술이나 경피적 배액술을 대체할 수 있는 치료 방법으로 초음파 내시경(EUS) 유도하 배액술의 사용이 증가하고 있다. 췌장 가성 낭종이나 구역성 괴사의 배액술에도 EUS 유도하 배액술이 널리 사용되고 있으며, 기존의 수술적 및 경피적 배액법을 대체해 나가고 있다.1 최근 EUS 시술을 위한 부속기구와 스텐트의 발전으로 췌관과 담도 배액술의 안전성과 임상적 성과가 점차 높아지고 있다. 특히 바벨 모양의 형태로 장이나 위벽과 담낭벽을 밀착시켜 주어서 스텐트 이탈이나 누출의 위험성을 낮출 수 있도록 개발된 lumen-apposing metal stents (LAMS)는 담낭 배액술과 가성낭종 배액술에 큰 변화를 일으키고 있다.2 또한 EUS 유도하 담도 배액술에 전문화된 여러 가지 금속관들이 개발되면서 위 또는 십이지장에서 담도 배액술이 안전하다는 결과들이 보고되고 있다. 본고에서는 췌장담도 질환에서 EUS 유도하 배액술의 역할과 유용성에 대해 알아보고자 한다.
급성췌장염의 보존적 치료 후 시간이 지남에 따라서 췌장염과 관련된 국소 합병증으로 가성낭종(pseudocyst)과 구역성 괴사(walled off necrosis, WON) 등이 발생할 수 있다. 이 합병증들은 주로 위와 십이지장에 인접한 췌장 주변과 후복막 및 복강 내로 확장되어 다양한 임상 경과를 보일 수 있다. 가성낭종은 단순한 액체를 포함하는 반면 WON은 괴사된췌장실질이나 췌장 주위 지방을 포함한다. 몇몇 무작위 연구들에서 최소 비침습적 치료가 급성 췌장 주위 액체 저류와 구역성 괴사에 있어서 외과적 괴사절제술보다 임상 경과, 입원기간, 치료 경비, 생존율 등에서 더 우월한 결과를 보고하였다.3-6 최소 비침습적 치료 중의 하나로 처음에는 내시경을 이용한 경벽적 배액술(endoscope-guided transmural drainage)이 사용되었다. 그러나 최근에는 합병증 발생이 적은 EUS를 이용한 경벽적 배액술(EUS-guided transmural drainage)이 점차 널리 사용되고 있다. EUS를 사용하는 방식은 가성낭종을 실시간으로 확인하면서 도플러를 이용하여 혈관을피해 낭종과 최단 거리로 안전하게 천자를 할 수 있다. 췌장가성낭종 경벽 배액술에 있어서 전통적으로는 이중돼지꼬리형 플라스틱 스텐트(double pigtail plastic stent)가 주로 사용되었으나, 최근에는 보다 넓은 직경으로 효과적인 배액이가능하고, 스텐트 폐쇄의 위험을 낮출 수 있는 금속 스텐트가많이 사용되고 있다. EUS를 이용한 췌장 가성 낭종 배액술은다른 방법에 비해 안전하다고 알려져 있으나 출혈, 배액관의이동, 천공, 기복증 등의 합병증이 발생할 수 있다.7
금속 스텐트는 스텐트 이탈 방지를 위해 양쪽 선단에 넓은 flare를 가진 원통형(tubular stent; Fig 1)과 LAMS (Fig. 2)가 주로 사용된다. LAMS는 EUS 유도하 경벽 배액술을 위한 스텐트로서 두 구조물을 밀착시켜서 스텐트 이탈이나 누출을 최소화할 수 있도록 개발되었다. 이 스텐트는 10 mm에서 20 mm까지 넓은 직경을 가지고 있어 WON 내 괴사된 조직을 쉽게 배출시킬 수 있고 필요에 따라서는 전방형 내시경을 이 스텐트를 통해 삽입하여 내시경적 괴사 제거술을 시행할 수 있다. 현재 AXIOS™ (Boston Scientific, Marlborough, MA, USA)와 국내에서 개발된 Niti-S SPAXUS™ (Taewoong Medical Co., Ltd., Ilsan, Korea) 등의 LAMS가 국내외적으로 널리 사용되고 있다. 최근 전향적 연구에서 61명의 췌장 주위 액체저류 환자(WON 46명, 가성낭종 15명)에서 AXIOS를 이용한 경벽 배액술의 기술적 성공률과 임상적 성공률은 각각 98%, 93%였으며 중대한 합병증은 천공 1예가 있었다.8 WON 배액술에서 LAMS와 플라스틱 배액관을 비교한 무작위 연구에서는 치료 성공률과 재입원 등에 있어서 두 군 사이에 통계적으로 유의한 차이가 없었다.9 그러나 LAMS는 플라스틱 스텐트에 비해 시술 시간이 통계적으로 유의하게 짧았으나, 스텐트와 관련된 이상반응과 비용은 LAMS군에서 통계적으로 유의하게 높았다. 특히 LAMS는 기계적 외상으로 인한 낭벽 손상과 낭내 감염으로 출혈 위험이 높다는 보고가 있다.10 스텐트 이탈을 최소화하기 위해서 LAMS를 통한 plastic stent 유치가 도움이 될 수 있다. 그 외에도 buried LAMS syndrome, 담도 폐쇄 등 이상반응이 발생할 수 있다.11 유럽 소화기내시경학회(European Society of Gastrointestinal Endoscopy)에서는 스텐트 관련 이상반응을 방지하기 위해 LAMS 삽입 후 4주 이내에 스텐트 제거를 권고하고 있다.1
ERCP로 유두부 접근이나 췌관의 선택적 삽관이 실패한 환자에서 EUS 유도하 췌관 배액술(EUS-guided pancreatic duct drainage, EUS-PD)을 구제요법으로 시행할 수 있다. 2002년에 처음 기술된 EUS-PD는 EUS 유도 췌장 경벽 스텐트 삽입술과 EUS 랑데부(endoscopic ultrasound-guided Rendezvous technique, EUS-RV)가 있다. EUS-PD는 주췌관에 대한 접근을 용이하게 하고 경벽으로 스텐트를 유치할 수 있다. 그러나 십이지장 내시경이 팽대부까지 진행될 수 있다면 EUS-RV를 시도하는 것이 바람직하다. EUS-RV는 위벽을 통해서 주췌관에 유도철선을 삽입한 후, 유도철선을 주췌관에서 주유두 방향으로 조작하여 십이지장까지 전진시켜 ERCP를 시행할 수 있다.
EUS-PD 시술 방법은 담도 배액술과 유사하며, 위 또는 십이지장 구부에서 확장된 췌관을 묘출한 후 췌관을 천자하여 췌액을 흡인하고 조영제를 투여하여 췌관을 확인한다. 이후 누공의 형성 및 확장을 시행하고 플라스틱 배액관을 삽입한다.12 하지만 만성췌장염의 경우 췌장 실질이 단단하고 유도선이 깊게 삽입되지 않아서 담도 배액술에 비해 시술의 난이도가 높은 편이다. 최근 401명을 대상으로 한 분석에 의하면 임상적 성공률과 기술적 성공률은 각각 85%와 88%였고, 합병증 발생률은 25%로 담도 배액술에 비해서 성적이 떨어진다.12 이 시술의 합병증으로는 급성췌장염, 출혈, 천공, 심한 복통 등이 있고, 여러 문헌들에서 합병증 발생률은 12.5-26.7%였다고 보고되었다.13-16 시술 후 출혈은 소작성 cystotome을 사용하였을 때 빈도가 높아 3Fr의 가는 선단을 가진 비소작성 balloon dilator 사용이 보다 안전할 수 있다.12 EUS-PD는 고난도이고 시술에 따른 위중한 부작용이 적지 않으므로 시술 경험이 풍부한 내시경 의사에 의해 시행되어야 한다. 따라서 이 중재시술은 통상적인 ERCP 시술이 실패한 경우에 한해 시행하는 것을 권장되고 있다.17 현재 EUS-PD의 적응증으로는 만성췌장염으로 췌관 내 감압술이 필요한 경우, 췌십이지장 절제수술 후 발생한 췌관과 소장문합 부위의 협착 해소, 괴사성 췌장염이나 외상 환자에서 발생한 주췌관 단절(disconnected pancreatic duct syndrome)로상류 췌관의 배액, 이전 수술로 변형된 해부학 구조 때문에내시경이 유두부에 접근하지 못하는 경우 등에 활용되고 있으며, EUS 유도하 췌관 배액술의 필수 전제조건은 주췌관 확장이동반되어 있어야 한다.18 향후 보다 안전하고 성공률을 높이기위한 많은 시술 경험과 다기관 전향적 연구가 필요할 것으로생각된다.
급성 담낭염의 주된 치료 방법은 수술적 담낭 절제술이다. 그러나 환자의 여러 가지 요인들(예: 고령, 심각한 기저 질환, 동반된 담도염으로 인한 간기능 저하, 혈압저하[쇼크] 등)로 인해 전신 마취의 위험성이 높아 담낭 절제술이 어려운 경우가 있다. 또한 췌장담도 악성종양이나 담도 주위 전이성 림프절 종대로 담낭관 폐쇄가 유발되어 급성 담낭염이 발생하였을 때 수술적 절제가 어렵다. 경피적 담낭 배액술은 시술 성공률이 높지만 시술 관련 합병증 발생률(통증, 담즙 누출, 출혈, 기복증 등)이 높을 뿐만 아니라 배액관으로 인해 환자의 삶의 질 저하와 배액관 이탈 등도 발생할 수 있다. 이러한 합병증을 극복할 수 있는 방법으로 내시경적 배액술, 특히 EUS를 이용한 담낭 배액술(EUS-guided gallbladder drainage, EUS-GBD)이 제시되고 있다. 시술 방법은 다음과 같다(Fig. 3). 먼저 종주형 EUS를 십이지장 구부나 위의 전정부에 위치시킨 후, 19게이지 세침 바늘을 이용하여 확장된 담낭을 천자한다. 이후 유도철선을 삽입하고 여러 가지 부속기구들을 이용하여 위 혹은 십이지장과 담낭 사이의 경로를 확장하고 피막형 자가팽창형 금속 스텐트(fully covered self-expandable metal stent, FCSEMS)나 LAMS를 유치한다. Double pigtailed plastic stent는 복강내 담즙 유출 가능성이 높아 최근에는 FCSEMS나 LAMS 등이많이 이용되고 있다. EUS-GBD 시 금속관 이탈을 방지하기위해서 금속관 양측 선단에 flare를 가진 다양한 FCSEMS가개발되어 사용되고 있다. FCSEMS 중의 하나인 BONA-AL스텐트(Standard Sci Tech Inc., Seoul, Korea)는 니티놀금속사와 실리콘 피막으로 구성되며, 스텐트 전개 후에 양쪽선단이 90도의 각도(외경 22 mm)를 갖도록 설계되어 스텐트이탈을 방지할 수 있도록 하였다(Fig. 1). LAMS는 바벨 모양의형태로 십이지장과 담낭벽을 밀착시켜 주어서 담즙 누출의위험성을 낮출 수 있다. 최근에는 LAMS 전달 시스템의 선단(tip)에 전기소작 기능을 장착한 electrocautery-enhanced LAMS (HOT AXIOS™, HOT SPAXUS™)을 개발하여 확장용부속기구 사용 없이 단일 과정으로 스텐트 삽입을 가능하게하여 시술을 보다 안전하고 신속하게 할 수 있다고 보고하고있지만 향후 전향적 비교 연구가 필요하다.19,20
여러 연구에서 FCSEMS와 LAMS를 이용한 EUS-GBD가 경피적 담낭 배액술에 비해서 높은 기술적 성공률(90-98%)과 임상적 성공률(89-97%)을 보고하였다.21-23 BONA-AL stent를 이용한 EUS-GBD 시술을 받은 56명의 환자들의 장기 추적 관찰 연구에서 급성 담낭염의 재발은 96.4%에서 없었고, 스텐트 이탈 2예와 스텐트 폐쇄로 인한 급성 담낭염 2예가 발생하였다.21 EUS-GBD와 경피적 담낭 배액술을 비교한 무작위 비교 임상 연구에서 양 군 모두 높은 기술적 성공률(97.4% vs. 100%, p=0.494)을 보였지만 EUS-GBD에서 통계적으로 낮은 합병증 발생률을 보고하였다.23 다른 체계적 고찰에서도 EUS-GBD가 경피적 배액술에 비해서 시술 후 통증, 입원 기간, 배액관 폐쇄로 인한 재시술률이 통계학적으로 유의하게 낮았다.24 LAMS를 이용한 담낭 배액술 후 금속관을 제거하는 시기와 플라스틱 배액관으로 교체 필요성에 대하여 아직 의문점으로 남아있다.
ERCP를 통한 담도 배액술은 악성 담도 폐쇄에서 기본적인 치료 방법이다. 그러나 선택적 담도 삽관의 실패, 수술로 인해 해부학적 구조의 변화, 위장관 폐쇄 등으로 십이지장 유두부로의 내시경 진입이 어려운 경우에는 성공적인 ERCP를 수행하기 어렵다. 이러한 경우에 PTBD가 차선책으로 선택될 수 있다. 그러나 PTBD도 다량의 복수가 있는 환자의 경우에는 어려울 수 있고, 배액관 관련 합병증이 발생할 수 있으며, 체외 배액관으로 인해 환자의 삶의 질이 저하될 수 있다.
EUS-BD는 PTBD를 대체할 수 있는 치료 방법으로 2001년 Giovanni 등25에 의해 처음 소개된 이후 전 세계적으로 시행되고 있으며, 약 90%의 성공률과 약 17%의 시술 관련 합병증이 보고되고 있다.26 이 시술을 시행하기 전에는 복부 전산화단층촬영 또는 복부 자기공명영상촬영 등의 검사를 통해 담도폐쇄의 정확한 위치 확인과 함께 담관 및 주변 장기와의 자세한 해부학적 평가가 필요하다. EUS-BD에는 총담관십이지장연결술(EUS-guided choledochoduodenostomy, EUS-CDS),간위연결술(EUS-guided hepaticogastrostomy, EUS-HGS), EUS 유도하 담도 천자 뒤 유도철선을 십이지장 유두부로 내린 후 ERCP를 진행하는 EUS-RV 기법 등이 있다.
EUS-CDS는 ERCP에 실패한 하부 담도 폐쇄 환자에서 주로 시행될 수 있다. Roux-en-Y anastomosis 같은 해부학적 구조의 변형이나 종양으로 인한 십이지장 구부의 폐쇄가 발생한 환자의 경우에는 이 시술의 적절한 적응증에 해당되지 않는다. EUS-CDS에서는 담즙 누출의 위험으로 인해 스텐트 양측 선단에 flare를 장착한 완전 피막형 스텐트나 LAMS가 선호된다. 최근 악성종양으로 총담관 폐쇄를 가진 환자들에서 일차적인 담도 배액술로서 EUS-CDS에 대한 전향적 연구 결과를 보면, ERCP와 유사한 정도의 안전성과 더 적은 빈도의 금속관내 종양증식(tumor ingrowth)이 보고되었다.27,28 그러나 음식물로 인한 스텐트 폐쇄나 스텐트 이탈 등이 EUS-CDS에서 좀 더 많이 나타났다. 향후 다기관 전향적 연구를 통해 본시술의 안전성과 기존의 다른 치료와 우월한지 검토되어야 한다.
EUS-CDS의 시술 방법은 다음과 같다. EUS를 십이지장에 진입하여 확장된 담도를 확인한다. 19게이지 세침바늘을 이용하여 혈관을 피해 확장된 담도를 천자 한 뒤 담즙을 흡인하고, 조영제를 주입하여 담도 영상을 얻는다. 이후 유도철선을 간문부로 향하여 삽입하고, 유도철선을 따라서 누공확장 기구를 삽입하여 누공을 확장한 후 시술자가 선호하는 배액관을 삽입한다. 누공 확장에는 다양한 기구가 사용되고 있는데 끝이 가늘어지는 형태(tapered tip)의 ERCP 도관(cannula), 침형절개도(needle knife)나 cystotome과 같은 전기소작용확장기구(electrocautery dilation device), 3 Fr의 가는 tip을 가지는 풍선도관(balloon catheter)이 이용되고 있다.29 최근 넓은 플랜지를 가진 LAMS와 전기 소작 기능을 탑재한 LAMS가 EUS-CDS도 이용되고 있다. LAMS를 이용한 EUS-CDS에 대한 7개의 논문(284명의 환자)의 체계적 문헌고찰에서 이 시술의 기술적 성공률은 95.7%, 임상적 성공률은 95.9%, 시술 관련 합병증은 5.2%로 보고하였다. 전기 소작 기능을 탑재한 LAMS를 대상으로 한 하위 분석에서도 93.8%의 기술적 성공률, 95.9%의 임상적 성공률, 5.6%의 시술 관련 합병증이라는 우수한 성적을 보고하였다.30 새로운 스텐트 개량에 따라 그 성적이 향상되고 있으나 스텐트 이탈, 기복증, 담즙 복막염 등의 합병증 발생 가능성이 있어 경험 많은 시술자가 신중하게 시술하는 게 바람직하다.
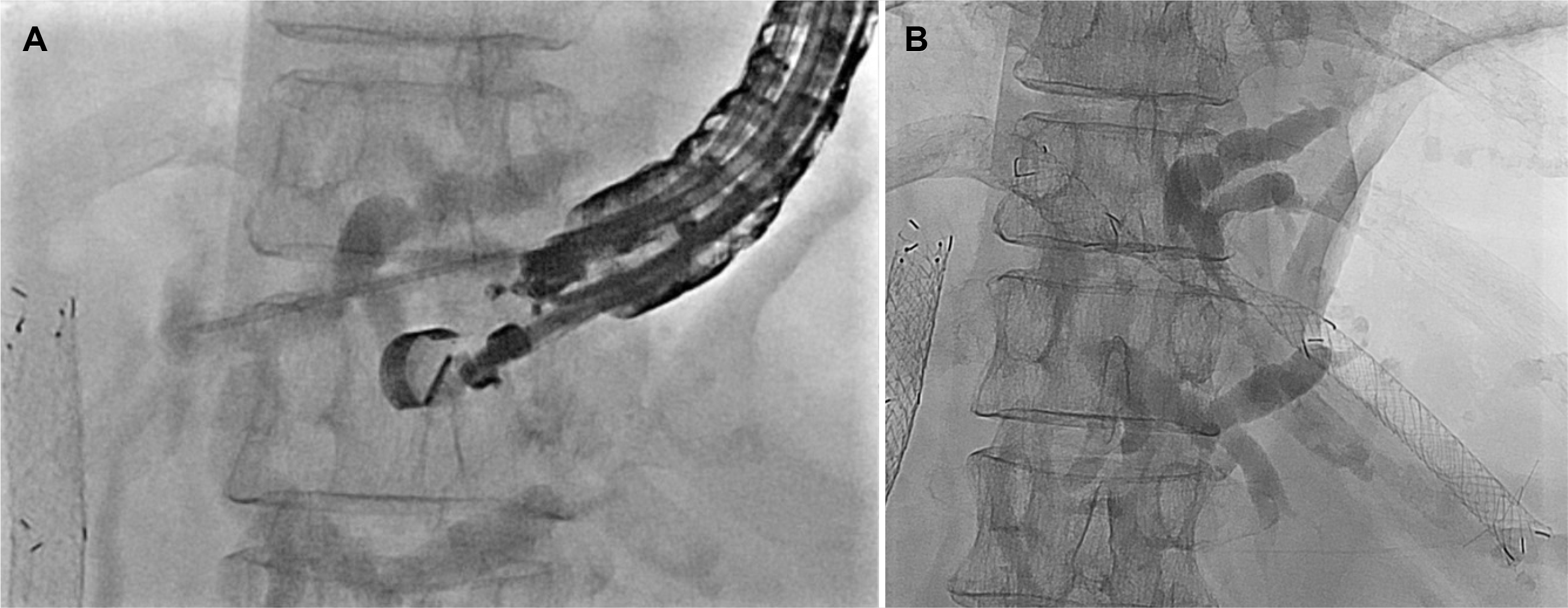
EUS-HGS의 적응증으로는 수술로 인한 위장관의 해부학적 변형, 악성종양 등으로 십이지장 폐쇄, 간문부 담도 협착이 심한 경우, 선택적 담도 삽관 실패한 경우 등이다. EUS 유도하 담도 배액술의 필수 전제조건은 간내 담도 확장이 동반되어 있어야 한다. 그러나 위(stomach)와 간(liver) 사이에 다량의 복수가 있을 경우에는 시술에 어려움이 있을 수 있다. EUS-HGS의 시술 방법은 다음과 같다. 위의 상부에서 EUS로왼쪽 간의 2구역 또는 3구역의 확장된 간내 담도를 확인한다(Fig. 4). 식도를 통한 2구역 간내 담도(B2)가 천자 될 경우 종격동염(mediastinitis)이나 종격동기종(pneumomediastinum)등의 심각한 합병증이 발생할 수 있다. 따라서 3구역의 확장된 간내 담도(B3) 천자가 안전한 시술을 위해 매우 중요하다. 19게이지 세침 바늘로 3구역 간내 담도를 천자 후 담즙을 흡인하고 조영제를 주입하여 담도를 조영한다. 유도철선을 간내담도에 삽입하여 간문부 방향으로 유도철선을 조작하는 기법이 이 시술의 성공에 매우 중요하다. 가능하면 유도철선이간문부 아래 총담관에 위치할 수 있게 조정한 후, 가는 선단을 가진 4 mm balloon catheter를 이용하여 누공을 확장하고 플라스틱 스텐트나 자가 팽창형 금속 스텐트를 삽입한다(Fig. 5). EUS-HGS의 경우 LAMS나 완전 피막형 금속 스텐트는 간내 담도 분지 폐쇄나 금속 스텐트 단축에 의한 스텐트 이탈 발생 가능성 등으로 추천되고 있지 않다. 이러한 점 등을 고려하여 EUS-HGS에는 양방향 고정형 플랜지를 적용한 부분 피막형 스텐트인 hybrid metal stent와 GIOBOR 스텐트 등이 이용되고 있다.31-33 Umeda 등34은 EUS-HGS를 위해 개발된 플라스틱 스텐트인 Through & Pass IT type stent를 이용한 연구를 보고하였다. 686명의 환자를 대상으로 한 메타분석에서 EUS-HGS의 기술적 성공률 96% (95% CI, 93-98%), 임상적 성공률은 84% (95% CI, 80-88%)로 보고하였다.35 그러나 비전문가에 의한 EUS-HGS의 시술의 경우 기술적 성공률이 67.4%로 낮게 보고된 연구 결과도 있다.36 또한 시술 관련 답즙 누출, 스텐트 이탈, 출혈, 복막염 등의 발생이 약 29% 정도로 높게 보고되고 있는 점을 보았을 때 숙련된 전문가에 의해 시술이 이루어져야 하며 향후 시술 관련 기구들의 향상이 필요하다.
EUS-RV는 ERCP에 실패하였고, 내시경으로 십이지장 유두부로의 접근이 가능한 경우 고려해 볼 수 있다. EUS-RV는 위내에서 왼쪽 간내 담도를 천자하는 방법과 십이지장 구부와 제2부에서 간외 담도를 천자하는 방법이 있다. 성공적인 시술을 위해서는 안정적인 위치에 내시경을 유지하는 것과 유도철선을 십이지장 유두부를 지나 십이지장 내로 거치시키는 것이 매우 중요하다. 시술 방법은 다음과 같다. 먼저 EUS를 위 또는 십이지장에 위치시킨 후 확장된 담도를 확인하고 주변 혈관을 피해 19 또는 22게이지 세침 바늘로 천자 후 답즙을 흡인하고 조영제를 주입하여 담도를 조영한다. 이후 유도 철선을 십이지장 유두부를 지나 십이지장 내로 거치 시킨다. 이후 EUS를 회수하고 십이지장경(duodenoscope)으로 바꿔 삽입한 후 십이지장 유두부를 통해 내려온 유도철사를 따라 카테터 등으로 선택적 담도 삽관을 시도한다. 이러한 방법으로 삽관이 어렵다면 겸자나 올가미를 이용하여 유도철사 끝부분을 잡는 과정을 통해 선택적 담도 삽관을 시도해 볼 수 있으나, 유도철선이 이탈되는 경우가 발생할 수 있어 주의가 필요하다. 간내담도 천자할 때, 좌측 간내담도 B3보다는 B2를 천자하는 것이 총담관내로 유도 철선을 거치하는 데 유리하다. 최근 발표된 342명의 환자를 대상으로 한 체계적 문헌 고찰에서 EUS-RV의 기술적 성공률은 86.1% (95% CI, 78.4-91.3%), 임상적 성공률은 80.8% (95% CI, 64.1-90.8), 합병증 발생률은 14% (95% CI, 10.5-18.4)로 보고하였다.37
췌장담도 질환에서 EUS의 역할은 진단적 목적을 넘어 치료적 영역으로 그 범위를 넓혀 가고 있다. ERCP의 중요성은 여전하지만, 다양한 배액관을 이용한 EUS 유도하 배액술은 최소침습시술로 췌장 가성낭종이나 WON 치료에 확고한 자리를 잡아가고 있으며, 담낭과 담도 배액술도 경피적 담낭 배액술이나 PTBD를 대체하는 중요한 시술로 발전하고 있다. 그러나 EUS-BD와 PD의 좋은 임상 연구 결과들은 대부분 한정된 숙련된 내시경 의사들에 의해서 주로 보고되고 있는 한계점이 있다. EUS-BD와 PD는 시술 중이나 시술 후 치명적 합병증이 발생할 가능성이 있어 시술 전 다양한 기구들의 사용법 및 장단점에 대한 충분한 숙지가 필요하고, 시술이 실패하거나 중대한 이상반응이 발생할 경우에는 대처가 가능한 병원에서 시행하는 것이 바람직하다. 앞으로 일부에서는 좀 더 표준화된 방법과 부속기구의 개발이 필요하지만 향후 췌장담도 질환의 여러 분야에서 중재적 EUS 시술의 중요성은 더욱 높아지리라 생각한다.
REFERENCES
1. Arvanitakis M, Dumonceau JM, Albert J, et al. 2018; Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy. 50:524–546. DOI: 10.1055/a-0588-5365. PMID: 29631305.

2. Yang D, Perbtani YB, Mramba LK, et al. 2018; Safety and rate of delayed adverse events with lumen-apposing metal stents (LAMS) for pancreatic fluid collections: a multicenter study. Endosc Int Open. 6:E1267–E1275. DOI: 10.1055/a-0732-502. PMID: 30302385. PMCID: PMC6175687.

3. Varadarajulu S, Bang JY, Sutton BS, Trevino JM, Christein JD, Wilcox CM. 2013; Equal efficacy of endoscopic and surgical cystogastrostomy for pancreatic pseudocyst drainage in a randomized trial. Gastroenterology. 145:583–590.e1. DOI: 10.1053/j.gastro.2013.05.046. PMID: 23732774.

4. van Santvoort HC, Besselink MG, Bakker OJ, et al. 2010; A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med. 362:1491–1502. DOI: 10.1056/NEJMoa0908821. PMID: 20410514.
5. Luckhurst CM, El Hechi M, Elsharkawy AE, et al. 2020; Improved mortality in necrotizing pancreatitis with a multidisciplinary minimally invasive step-up approach: comparison with a modern open necrosectomy cohort. J Am Coll Surg. 230:873–883. DOI: 10.1016/j.jamcollsurg.2020.01.038. PMID: 32251846.

6. van Brunschot S, van Grinsven J, van Santvoort HC, et al. 2018; Endoscopic or surgical step-up approach for infected necrotising pancreatitis: a multicentre randomised trial. Lancet. 391:51–58. DOI: 10.1016/S0140-6736(17)32404-2.
7. Seewald S, Ang TL, Kida M, Teng KY, Soehendra N. EUS 2008 Working Group. 2009; EUS 2008 Working Group document: evaluation of EUS-guided drainage of pancreatic-fluid collections (with video). Gastrointest Endosc. 69(Suppl 2):S13–S21. DOI: 10.1016/j.gie.2008.10.061. PMID: 19179137.

8. Bazerbachi F, Sawas T, Vargas EJ, et al. 2018; Metal stents versus plastic stents for the management of pancreatic walled-off necrosis: a systematic review and meta-analysis. Gastrointest Endosc. 87:30–42.e15. DOI: 10.1016/j.gie.2017.08.025. PMID: 28867073.
9. Bang JY, Navaneethan U, Hasan MK, Sutton B, Hawes R, Varadarajulu S. 2019; Non-superiority of lumen-apposing metal stents over plastic stents for drainage of walled-off necrosis in a randomised trial. Gut. 68:1200–1209. DOI: 10.1136/gutjnl-2017-315335. PMID: 29858393. PMCID: PMC6582745.

10. Puga M, Consiglieri CF, Busquets J, et al. 2018; Safety of lumen-apposing stent with or without coaxial plastic stent for endoscopic ultrasound-guided drainage of pancreatic fluid collections: a retrospective study. Endoscopy. 50:1022–1026. DOI: 10.1055/a-0582-9127. PMID: 29590668.

11. Bang JY, Hasan M, Navaneethan U, Hawes R, Varadarajulu S. 2017; Lumen-apposing metal stents (LAMS) for pancreatic fluid collection (PFC) drainage: may not be business as usual. Gut. 66:2054–2056. DOI: 10.1136/gutjnl-2016-312812. PMID: 27582509. PMCID: PMC5749339.

12. Imoto A, Ogura T, Higuchi K. 2020; Endoscopic ultrasound-guided pancreatic duct drainage: techniques and literature review of transmural stenting. Clin Endosc. 53:525–534. DOI: 10.5946/ce.2020.173. PMID: 32967409. PMCID: PMC7548157.

13. Varadarajulu S, Trevino JM. 2009; Review of EUS-guided pancreatic duct drainage (with video). Gastrointest Endosc. 69(Suppl 2):S200–S202. DOI: 10.1016/j.gie.2008.12.032. PMID: 19179157.

14. Tessier G, Bories E, Arvanitakis M, et al. 2007; EUS-guided pancreatogastrostomy and pancreatobulbostomy for the treatment of pain in patients with pancreatic ductal dilatation inaccessible for transpapillary endoscopic therapy. Gastrointest Endosc. 65:233–241. DOI: 10.1016/j.gie.2006.06.029. PMID: 17258981.

15. Matsunami Y, Itoi T, Sofuni A, et al. 2018; Evaluation of a new stent for EUS-guided pancreatic duct drainage: long-term follow-up outcome. Endosc Int Open. 6:E505–E512. DOI: 10.1055/s-0044-101753. PMID: 29713675. PMCID: PMC5906111.

16. Dalal A, Patil G, Maydeo A. 2020; Six-year retrospective analysis of endoscopic ultrasonography-guided pancreatic ductal interventions at a tertiary referral center. Dig Endosc. 32:409–416. DOI: 10.1111/den.13504. PMID: 31385380.

17. Chandan S, Mohan BP, Khan SR, et al. 2020; Efficacy and safety of endoscopic ultrasound-guided pancreatic duct drainage (EUS-PDD): a systematic review and meta-analysis of 714 patients. Endosc Int Open. 8:E1664–E1672. DOI: 10.1055/a-1236-3350. PMID: 33140022. PMCID: PMC7581476.

18. Shimamura Y, Mosko J, Teshima C, May GR. 2017; Endoscopic ultrasound-guided pancreatic duct intervention. Clin Endosc. 50:112–116. DOI: 10.5946/ce.2017.046. PMID: 28391672. PMCID: PMC5398367.

19. Dollhopf M, Larghi A, Will U, et al. 2017; EUS-guided gallbladder drainage in patients with acute cholecystitis and high surgical risk using an electrocautery-enhanced lumen-apposing metal stent device. Gastrointest Endosc. 86:636–643. DOI: 10.1016/j.gie.2017.02.027. PMID: 28259594.

20. Lisotti A, Linguerri R, Bacchilega I, Cominardi A, Marocchi G, Fusaroli P. 2022; EUS-guided gallbladder drainage in high-risk surgical patients with acute cholecystitis-procedure outcomes and evaluation of mortality predictors. Surg Endosc. 36:569–578. DOI: 10.1007/s00464-021-08318-z. PMID: 33507383. PMCID: PMC7842173.

21. Choi JH, Lee SS, Choi JH, et al. 2014; Long-term outcomes after endoscopic ultrasonography-guided gallbladder drainage for acute cholecystitis. Endoscopy. 46:656–661. DOI: 10.1055/s-0034-1365720. PMID: 24977397.

22. Itoi T, Binmoeller KF, Shah J, et al. 2012; Clinical evaluation of a novel lumen-apposing metal stent for endosonography-guided pancreatic pseudocyst and gallbladder drainage (with videos). Gastrointest Endosc. 75:870–876. DOI: 10.1016/j.gie.2011.10.020. PMID: 22301347.

23. Walter D, Teoh AY, Itoi T, et al. 2016; EUS-guided gall bladder drainage with a lumen-apposing metal stent: a prospective long-term evaluation. Gut. 65:6–8. DOI: 10.1136/gutjnl-2015-309925. PMID: 26041748.

24. Jain D, Bhandari BS, Agrawal N, Singhal S. 2018; Endoscopic ultrasound-guided gallbladder drainage using a lumen-apposing metal stent for acute cholecystitis: a systematic review. Clin Endosc. 51:450–462. DOI: 10.5946/ce.2018.024. PMID: 29852730. PMCID: PMC6182281.

25. Giovannini M, Moutardier V, Pesenti C, Bories E, Lelong B, Delpero JR. 2001; Endoscopic ultrasound-guided bilioduodenal anastomosis: a new technique for biliary drainage. Endoscopy. 33:898–900. DOI: 10.1055/s-2001-17324. PMID: 11571690.

26. Khan MA, Akbar A, Baron TH, et al. 2016; Endoscopic ultrasound-guided biliary drainage: a systematic review and meta-analysis. Dig Dis Sci. 61:684–703. DOI: 10.1007/s10620-015-3933-0. PMID: 26518417.

27. Park JK, Woo YS, Noh DH, et al. 2018; Efficacy of EUS-guided and ERCP-guided biliary drainage for malignant biliary obstruction: prospective randomized controlled study. Gastrointest Endosc. 88:277–282. DOI: 10.1016/j.gie.2018.03.015. PMID: 29605722.

28. Bang JY, Navaneethan U, Hasan M, Hawes R, Varadarajulu S. 2018; Stent placement by EUS or ERCP for primary biliary decompression in pancreatic cancer: a randomized trial (with videos). Gastrointest Endosc. 88:9–17. DOI: 10.1016/j.gie.2018.03.012. PMID: 29574126.

29. Okuno N, Hara K, Mizuno N, et al. 2018; Efficacy of the 6-mm fully covered self-expandable metal stent during endoscopic ultrasound-guided hepaticogastrostomy as a primary biliary drainage for the cases estimated difficult endoscopic retrograde cholangiopancreatography: a prospective clinical study. J Gastroenterol Hepatol. 33:1413–1421. DOI: 10.1111/jgh.14112. PMID: 29424011.

30. Krishnamoorthi R, Dasari CS, Thoguluva Chandrasekar V, et al. 2020; Effectiveness and safety of EUS-guided choledochoduodenostomy using lumen-apposing metal stents (LAMS): a systematic review and meta-analysis. Surg Endosc. 34:2866–2877. DOI: 10.1007/s00464-020-07484-w. PMID: 32140862.

31. Song TJ, Lee SS, Park DH, Seo DW, Lee SK, Kim MH. 2014; Preliminary report on a new hybrid metal stent for EUS-guided biliary drainage (with videos). Gastrointest Endosc. 80:707–711. DOI: 10.1016/j.gie.2014.05.327. PMID: 25053527.

32. Cho DH, Lee SS, Oh D, et al. 2017; Long-term outcomes of a newly developed hybrid metal stent for EUS-guided biliary drainage (with videos). Gastrointest Endosc. 85:1067–1075. DOI: 10.1016/j.gie.2016.09.010. PMID: 27650270.

33. Nakai Y, Sato T, Hakuta R, et al. 2020; Long-term outcomes of a long, partially covered metal stent for EUS-guided hepaticogastrostomy in patients with malignant biliary obstruction (with video). Gastrointest Endosc. 92:623–631.e1. DOI: 10.1016/j.gie.2020.03.3856. PMID: 32278705.

34. Umeda J, Itoi T, Tsuchiya T, et al. 2015; A newly designed plastic stent for EUS-guided hepaticogastrostomy: a prospective preliminary feasibility study (with videos). Gastrointest Endosc. 82:390–396.e2. DOI: 10.1016/j.gie.2015.02.041. PMID: 25936451.

35. Hedjoudje A, Sportes A, Grabar S, et al. 2019; Outcomes of endoscopic ultrasound-guided biliary drainage: a systematic review and meta-analysis. United European Gastroenterol J. 7:60–68. DOI: 10.1177/2050640618808147. PMID: 30788117. PMCID: PMC6374841.

36. Vila JJ, Pérez-Miranda M, Vazquez-Sequeiros E, et al. 2012; Initial experience with EUS-guided cholangiopancreatography for biliary and pancreatic duct drainage: a Spanish national survey. Gastrointest Endosc. 76:1133–1141. DOI: 10.1016/j.gie.2012.08.001. PMID: 23021167.

37. Klair JS, Zafar Y, Ashat M, et al. Effectiveness and safety of EUS Rendezvous after failed biliary cannulation with ERCP: a systematic review and proportion meta-analysis. J Clin Gastroenterol. 2021; Apr. 9. [Epub ahead of print]. DOI: 10.1097/MCG.0000000000001543. PMID: 34009843.
Fig. 1
Tubular metal stents for EUS-guided drainage. (A) BONA-AL (Standard Sci Tech Inc., Seoul, Korea). (B) BONA-SOO stent (Standard Sci Tech Inc.).
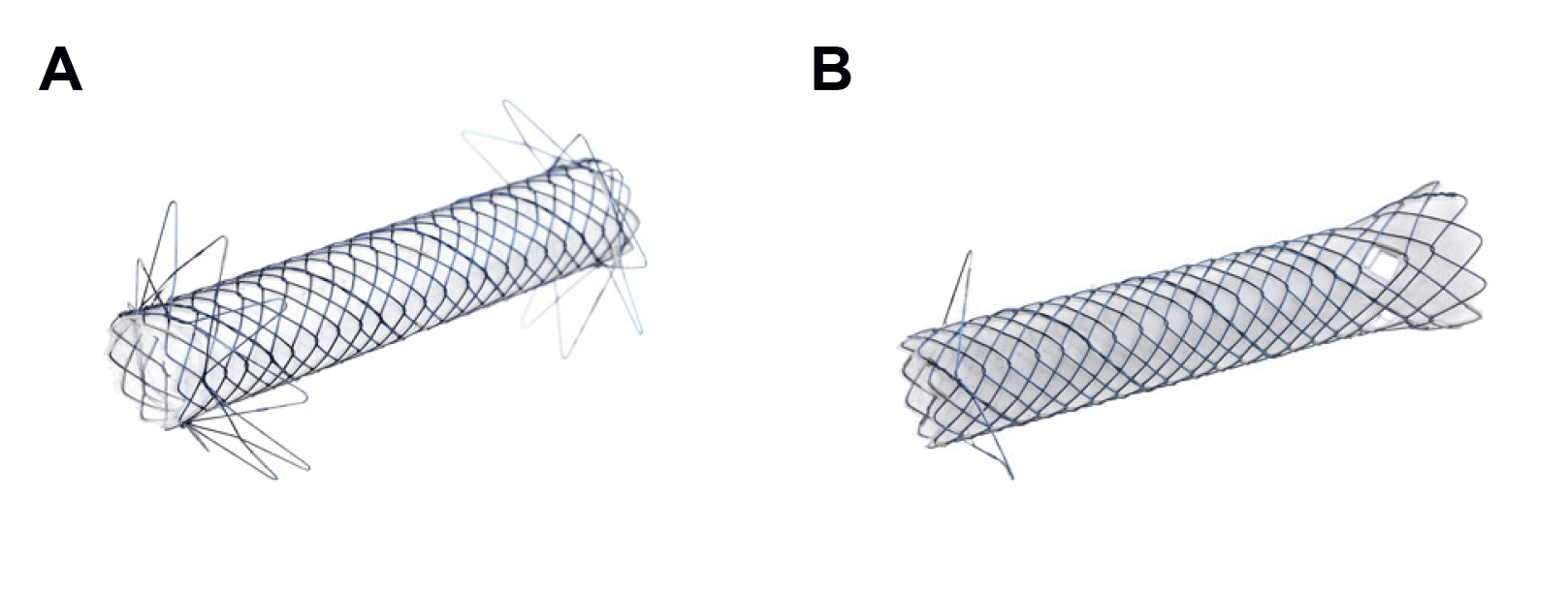
Fig. 2
Lumen-apposing metal stents for EUS-guided drainage. (A) AXIOS stent (Boston Scientific, Marlborough, MA, USA). (B) Niti-S SPAXUS stent (Taewoong Medical Co, Ltd, Ilsan, Korea).
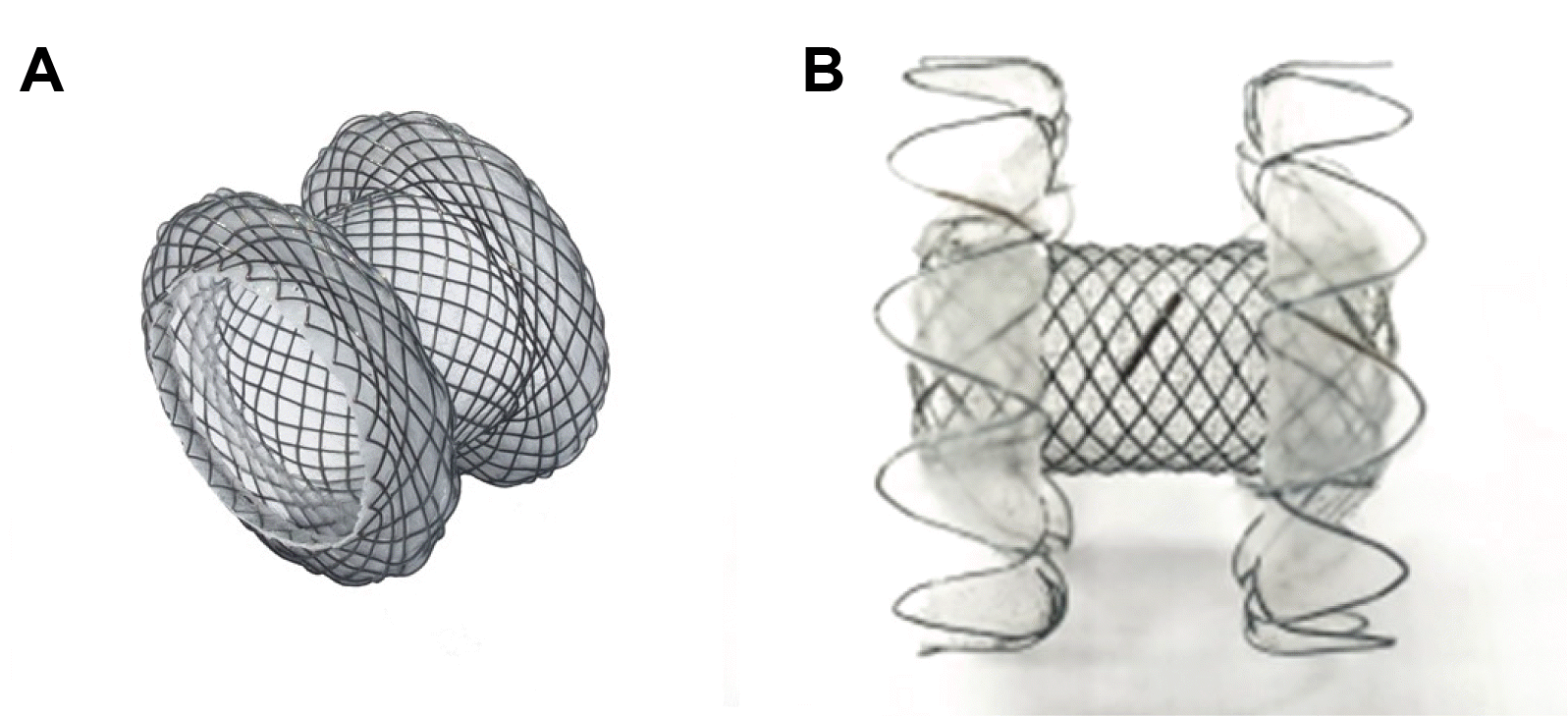
Fig. 3
Endoscopic ultrasound-guided gallbladder drainage with lumen-apposing metal stents (LAMS) in acute cholecystitis. (A) Computed tomography (CT) showing distended gallbladder with stone suggesting acute cholecystitis. (B) Endoscopic ultrasonography showing a markedly dilatated gallbladder with an expanded flare of LAMS. (C) Fluoroscopic image showing the LAMS. (D) CT showing LAMS placed between the gallbladder and duodenal bulb.
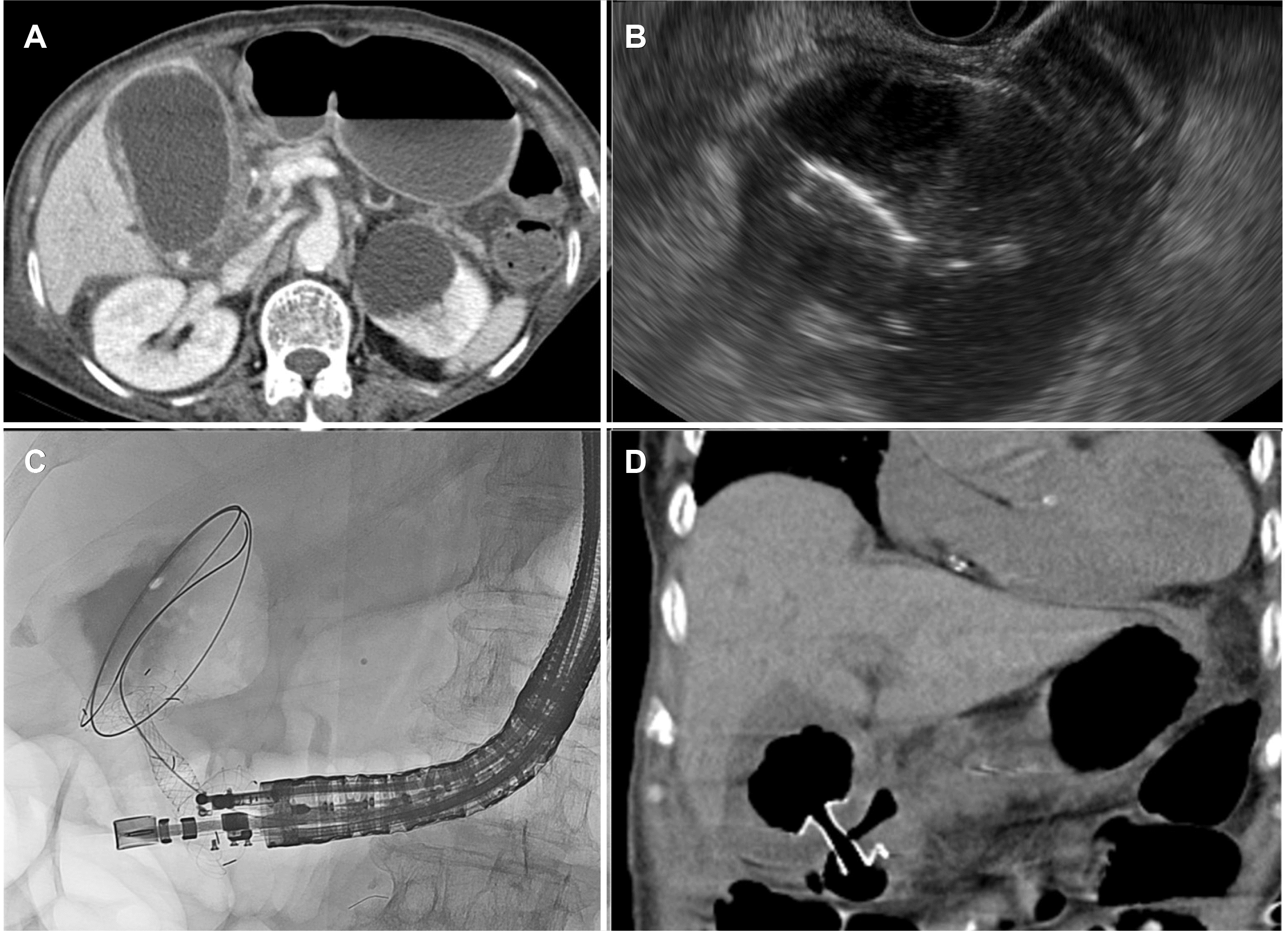
Fig. 4
Puncture site and direction (arrow) on endoscopic ultrasound (EUS) and fluoroscopic image for EUS-guided hepaticogastrostomy. (A) EUS image showing dilatated B3 and B2. (B) Fluoroscopic imaging showing cholangiogram of the left intrahepatic bile ducts.
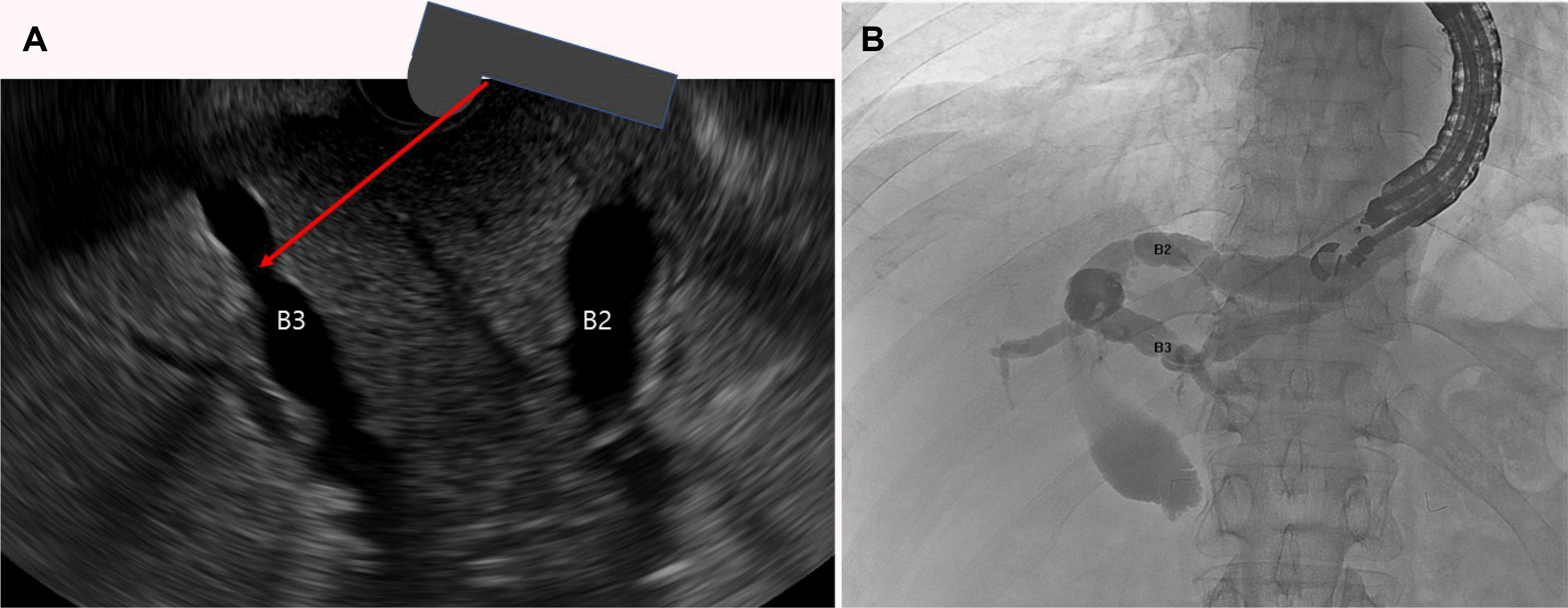
Fig. 5
Endoscopic ultrasound-guided hepaticogastrostomy using the partially covered self-expandable metal stent (PCSEMS) for proximal malignant biliary obstruction. (A) Fluoroscopy image showing the cholangiogram of the left intrahepatic duct by contrast injection after a 19-gauge needle puncture. (B) Fluoroscopy image showing the PCSEMS placed between the stomach and the left intrahepatic duct.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download