Abstract
A biliary anastomotic stricture developed 13 months after living donor liver transplantation in a 19-year-old male with congenital hepatic fibrosis. Endoscopic management with balloon dilation followed by the placement of a 7F plastic stent was performed for the anastomotic stricture. After 6 months of indwelling of the stent, the plastic stent was removed because the stenosis and cholestasis were improved. One month after stent removal, he was admitted for acute liver graft failure owing to cholestatic hepatitis, and required retransplantation secondary to graft loss.
간이식 후 5-25%에서 담도계 합병증이 발생할 수 있으며, 답즙 누출과 담도 협착이 가장 흔한 합병증이다.1 담도 협착은 간 이식의 장기 성적, 삶의 질뿐만 아니라 이식편의 손실이나 사망까지 영향을 줄 수 있어 간이식의 아킬레스 건으로 불린다. 간이식 후 발생한 담도 협착의 치료에는 내시경역행담췌관조영술(ERCP)을 통한 스텐트 삽입이 추천되고 있으며, 내시경 시술의 발전으로 담도 협착으로 인한 재이식률은 1% 미만으로 알려져 있다.2 저자들은 간이식 후 발생한 문합부 담도 협착의 치료를 위해 삽입한 플라스틱 스텐트 제거 후 담즙정체간염으로 인한 이식편 부전으로 재이식을 하였던 증례를 경험하여 보고하는 바이다.
19세 남자가 간기능 수치 이상으로 내원하였다. 발열, 복통 등 자각 증상은 없었으며, 신체검진에서도 특이 소견은 보이지 않았다. 환자는 고혈압 및 당뇨는 없었고, 선천성 간섬유증으로 13개월 전 아버지로부터 생체 간이식을 받은 후 면역억제제로 tacrolimus, prednisolone을 복용 중이었다. 가족력은 없었고, 흡연 및 음주도 부인하였다.
일반혈액검사에서 백혈구 5,280/mm3, 혈색소 15.0 g/dL, 혈소판 59,000/mm3였고, 일반화학검사에서 총단백 7.2 g/dL, 알부민 4.6 g/dL, 총 빌리루빈 2.4 mg/dL, 알카리성 포스파타제(ALP) 227 U/L, 아스파르트산 아미노전이효소(AST) 213 U/L, 알라닌 아미노전이효소(ALT) 389 U/L, 감마 글루타밀전이효소(GGT) 131 U/L, 프로트롬빈 시간(PT) 75%였다. Tacrolimus 농도는 10.9 ng/mL로 조절 범위 내였다. 복부 컴퓨터단층촬영에서 수술 후 관찰되었던 문합부 주위 연조직 침윤 소견은 이전과 차이가 없었고 우측 간내담관의 경도의 확장이 새롭게 관찰되었다(Fig. 1A, B). 이에 문합부 협착 의심하 진단 및 치료를 위해 ERCP 시행하였고, 담도조영술에서 문합부 협착을 확인, 협착부에 대해서 4 mm biliary balloon dilatation cath-eter (Hurricane™ RX, Boston Scientific, Marlborough, MA, USA)로 풍선확장술 시행 후 협착부를 통과하는 7F×13cm 플라스틱 스텐트를 삽입하였다(Fig. 1C-E). 시술 후 간기능 수치는 정상 범위를 유지하였고, 시술 6개월째 시행한 일반화학검사에서 총 빌리루빈 1.2 mg/dL, ALP 175 U/L, AST 24 U/L, ALT 14 U/L였고, 담도조영술에서 문합부 협착 호전되는 소견으로 기존 삽입한 플라스틱 스텐트는 제거하였다(Fig. 1F).
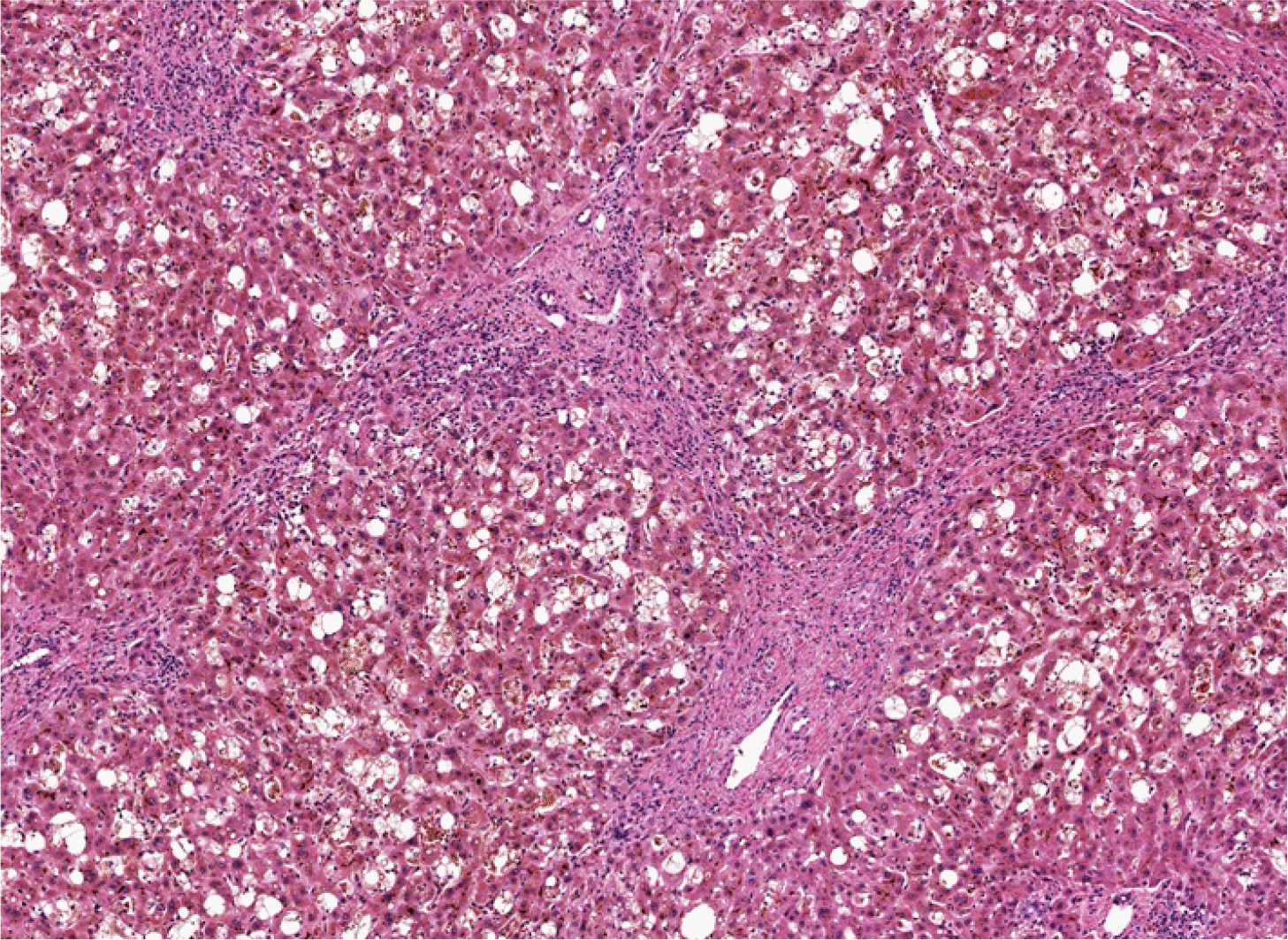
환자는 스텐트 제거 한 달 후, 황달을 주소로 응급실에 내원하였다. 설사가 동반되었으며, 발열이나 복통은 없었다. 신체검진에서 경도의 복부 팽만과 이동탁음이 관찰되었다. 내원 당시 혈압 92/57 mmHg, 맥박 77회/분, 호흡수 17회/분, 체온 37.8℃였다. 일반화학검사에서 총 단백 6.0 g/dL, 알부민 3.7 g/dL, 총 빌리루빈 20.9 mg/dL, 직접 빌리루빈 17.4 mg/dL, ALP 207 U/L, AST 336 U/L, ALT 240 U/L, PT 54%, 크레아티닌 1.38 mg/dL였다. 내원 후 시행한 복부 컴퓨터단층촬영에서 중등도의 복수가 새롭게 관찰되었고, 우측 간내담관의 확장은 처음 스텐트 삽입 전 영상과 비슷하게 관찰되었다(Fig. 2A, B). 복수천자 결과 간경변에 의한 복수로 확인되었고, 바이러스 간염이나 감염을 시사하는 혈액 검사 결과는 확인되지 않았으며, 도플러 초음파에서도 이식편에 대한 혈류 역시 잘 유지되었다. 문합부 협착 재발로 인한 담즙정체간염에 대한 가능성으로 ERCP를 시행하였고, 담도조영술에서 문합부 협착은 심하지 않았으나(Fig. 2C), 풍선확장술 및 플라스틱 스텐트 2개(7F×13 cm)를 통한 담즙배액술을 시행하였다(Fig. 2D, E). 담즙배액술 이후에도 황달, 간기능의 회복을 보이지 않았고, 응급실 내원 2주째 경피적 간생검을 시행하였다. 생검 조직에서는 간문맥과 담도 주위 염증세포 침윤, 간세포 및 담세관의 담즙 침착, 간세포의 깃털 변성 등이 관찰되었으며, 이는 담즙정체간염에 합당한 소견이었다(Fig. 3). 환자는 보존적 치료에도 간기능이 회복되지 않고, 복수 및 간신증후군 진행으로 응급실 내원 한 달째 사체 간이식을 시행하였다. 수술 검체에서도 간의 조직학적 소견은 담즙정체간염 소견을 보였으며, 별도로 절제된 간외 담관 조직에서는 담관벽의 섬유화 소견이 관찰되었다. 이후 회복되어 퇴원 후 황달이나 간기능검사 이상 소견 없이 외래 추적 관찰 중이다.
간이식 후 발생할 수 있는 가장 흔한 합병증인 담도계 합병증으로는 담도 협착과 답즙 누출이 대표적이고, 이외에도 담도 담석, 담도 원주 증후군(biliary cast syndrome), 오디괄약근 기능이상 등이 있다.3 담도 협착의 경우 발생 위치에 따라 문합부 협착(anastomotic stricture)과 비문합부 협착(nonanastomotic stricture)으로 분류가 된다. 문합부 협착은 담도 문합부 주위로 분절 혹은 국소의 협착으로 정의되며, 섬유화 재생 과정의 결과로 발생하는 것으로 알려져 있다.2 문합부 협착은 대개 이식 1년 이내 발생하며 시간에 따라 발생 빈도가 증가하며, 사체 간이식의 5-15%, 생체 간이식의
13-36%에서 확인되어 생체 간이식에서 더 흔하게 발생한다.4문합부 협착의 위험요인으로는 수혜자의 나이, 담즙 누출, 부적절한 수술 기법과 봉합사의 사용, 담도 직경의 차이, 간동맥혈전증 등 다양한 원인이 가능하겠으며, 생체 간이식의 경우기증 장기구득을 위한 박리 과정으로 인한 담도의 허혈성 손상, 기증 간의 비교적 작은 담도 등의 추가적인 위험요소로인하여 사체 간이식보다 높은 유병률을 보인다.5,6
담도 협착의 임상 양상은 담즙 배출 장애와 연관되어 나타날 수 있으며, 황달, 우상복부 통증, 발열 등이 포함된다.2,7 혈액검사에서는 ALP, GGT, 직접 빌리루빈의 상승을 동반하는 담즙정체 간기능검사 이상을 확인할 수 있다.3 영상학적 진단에는 초음파, 복부 컴퓨터단층촬영, 자기공명담췌관조영술, 내시경역행담도조영술, 경피간담도조영술 등 다양한 방법이 가능하겠으나, 직접 담도조영술을 통한 담도 협착 부위 확인이 가능하고 경피간담도조영술보다 덜 침습적인 내시경역행담도조영술이 표준 검사법으로 추천된다.2 간이식 후 발생한 담도 협착의 치료는 내시경역행담도조영술 유도하, 경피간담도조영술 유도하 치료 그리고 재이식을 포함한 수술적 치료가 있겠다. 내시경적 치료가 1차 치료로 추천되며, 내시경적치료가 불가능한 경우 경피적 접근을 고려하며, 수술적 치료까지 필요한 경우는 매우 드물다.8
내시경적 치료를 위해서는 협착 부위를 관통하여 가이드 와이어를 삽입하고, 협착 부위에 대한 풍선확장술 그리고 한 개 이상의 스텐트를 삽입하는 과정이 필요하다.1 풍선확장술에는 직경 4-8 mm balloon catheter가 주로 사용되며, 풍선확장술 단독에 비하여 스텐트 삽입을 병행할 경우 성공률이 유의미하게 향상되어, 풍선확장술 후 스텐트 삽입이 추천된다.1 스텐트는 플라스틱 또는 금속 스텐트 모두 사용 가능하지만, 생체 간이식 후 발생한 문합부 협착의 경우에는 주로 7-11.5F 플라스틱 스텐트를 한 개 혹은 여러 개 삽입하게 되며, 스텐트 폐쇄와 이로 인한 담관염의 예방을 위해 3개월 간격으로 교체하여 평균 치료 기간은 12개월이 추천된다.9 이러한 내시경적 치료의 성공률은 사체 간이식에서 57-90%, 생체간이식에서 60-84%로 비교적 높은 결과를 보여준다.1,2,4,6
본 증례에서는 생체 간이식에서 발생한 문합부 협착에 대해 6개월간 플라스틱 스텐트를 유치 후 문합부 협착의 호전을 확인 후 제거하였음에도 불구하고 급격한 간기능 부전이 발생하였다. 협착의 호전은 담도조영술에서 이전 관찰되었던 협착의 소실, 혹은 8.5 mm 풍선이 협착 부위를 통과하는 것으로 평가할 수 있는데, 이는 다소 주관적인 평가라는 점에서 제한이 있겠으며, 본 증례에서도 스텐트 제거 후 한 달째 시행하였던 복부 컴퓨터단층촬영에서 담관의 확장은 시술 전 영상과비교하여 차이가 없었고, 담도조영술에서도 문합부 협착이 존재하였다는 점에서 담도 협착 평가에 대하여 보다 객관적이면서 협착 호전의 지속성을 평가할 수 있는 방법이 필요하겠다.2
본 증례에서는 시술 전 영상에서 간내 담관 확장이 6번 분절에 국한되어 있으면서 심하지 않았기 때문에, 6개월의 비교적 짧은 스텐트 유지 기간 동안 1개의 스텐트가 사용되었다. 스텐트의 유지 기간에 대해서는 아직 정립된 가이드라인은 없으나 담도 협착이 재발하는 그룹에서 스텐트 유지 기간이 12주 정도로 재발하지 않은 군 29주에 비하여 유의하게 짧았다는 보고가 있어 스텐트 유지 기간이 협착의 재발에 밀접한 연관
이 있을 것으로 기대된다.10 비록 스텐트 유지 기간이 4.6개월으로 비교적 짧았던 연구에서도 88%의 치료 성적율을 보고하였으나,11 본 증례와 같이 6개월 간의 스텐트 유지 기간에도불구하고 담즙 정체에 의한 간기능 부전이 발생한 바 향후간이식 후 문합부 담도 협착에서 적절한 스텐트 유지 기간에대한 추가 연구가 필요하겠다.
생체 간이식에서는 공여자가 주로 간 우엽을 공여하게 되며 공여자 간의 우측 전분절 담도와 우측 후분절 담도 두 군데를 수혜자의 담도와 문합하게 된다. 최근 연구에서 우측 생체 간이식 환자에서 간 문합부 협착이 발생하였을 때 한쪽에만 담도 배액 스텐트를 삽입하는 것보다 전분절과 후분절 담도 양쪽에 스텐트를 삽입하는 것이 더 예후가 좋은 것으로 밝혀졌다.8 본 환자에서는 영상에서 우측 후분절 담도 확장 소견만 관찰되어 한쪽에만 담도 배액 스텐트를 삽입하였으나 시술 시 여러 개의 스텐트를 삽입하여 가능한 많은 분절 담도를 배액하였다면 환자의 담즙정체간염을 예방할 수 있는 가능성도 생각해 볼 수 있겠다.
선천성 간섬유증은 담관 간판 이형성(ductal plate malformation)에 의하여 간 섬유화, 문맥압 항진증을 유발하고 이로 인한, 담관염, 위장관 출혈 등의 증상으로 나타나는 드문 상염색체 열성 질환이다. 대개는 상염색체 열성 다낭신장병을 동반하며 카롤리병과 연관되기도 한다.12 간이식은 간부전 혹은 반복적인 담관염으로 심한 간기능 저하 이전으로 시행되는데, 한 체계적 문헌고찰에서는 선천성 간섬유증 환자의 약 16% (196/1,230명)에서 단독 혹은 신장이식과 병행하여 간이식이 진행되었고, 단독 간이식 환자의 87% (151/173)는 카롤리병과 관련성이 있었으며, 카롤리병으로 간이식을 받은 30명의 환자 중 7명이 이식 후 패혈증으로 사망하였으며, 8명(일차성 기능부전 3명, 원인미상 5명)이 재이식을 받았다.12,13 그러나 본 증례와 같이 선천성 간섬유증과 관련하여 생체 간이식 후 발생한 간외담관 합병증이나 문합부에 대한 평가는 보고되지 않아 향후 선천성 간섬유증 환자에서의 수술 후 발생한 담도계 합병증의 치료 성적 및 예후와 관련된 추가 연구가 필요하겠다.
담도 협착의 치료 후 재발은 10-20%에서 가능하고, 이식 6개월 이후 발생한 협착, 비문합부 협착 등이 위험요인이 될 수 있으며, 더 적극적인 풍선확장술 및 추가 플라스틱 스텐트 삽입 혹은 금속 스텐트 삽입으로 치료해 볼 수 있겠다.14 본 증례에서는 스텐트 제거 후 한 달 만에 급격한 간이식편의 부전이 확인되었고, 담즙정체에 대해서 두 개의 플라스틱 스텐트 삽입을 시행하였지만, 황달 및 간기능이 회복되지 않아 재이식을 받았다. 재이식 후 병리 소견에서도 답즙정체에 의한 간 손상에 합당한 소견을 보여, 재발 혹은 치료 불응성의 담도 협착이 간이식편 부전의 원인으로 판단되는 바이다. 담즙정체간염의 흔한 원인은 담관폐쇄, 약제 또는 독성 유발 간손상, A형 또는 E형 간염바이러스에 의한 급성 간염 등이 있으며 본 증례에서 담관폐쇄 이외에 다른 원인은 모두 배제가 되었다. 또한 재이식 시 적출된 간의 병리 소견에서 이식거부반응의 소견은 없었고 절제된 총담관에서도 벽화 섬유증(mural fibrosis)이 있었으나 협착에서 흔히 보이는 비특이적 소견으로 선천성 간섬유증과 관련된 변화는 아니었다. 간이식 후 재이식을 시행한 경우에서 있어 담도계 합병증을 재이식의 원인으로 보고한 결과는 2.8-56.0%로 기관마다 다양하게 제시된 바 있으나, 최근 내시경 치료의 발전으로 담도 협착으로 재이식이 필요한 경우는 1% 미만으로 드물다는 점 그리고 스텐트 제거 후 한 달 이내에 급격하게 간부전이 진행하였다는 점에서 본 증례를 보고하게 되었다.15,16
결론적으로, 본 증례는 간이식 후 발생한 담도 협착에 대해서 내시경적 풍선확장술 및 스텐트 삽입술로 치료하였으나 스텐트 제거 후 빠른 간이식편의 부전으로 재이식을 시행한 드문 예이다. 재이식이라는 환자에게 치명적인 합병증과 희귀 의료자원의 손실을 막기 위해서, 간이식 후 가장 흔하게 발생하는 합병증인 담도 협착의 적절한 치료 기간, 치료 효과 판정 방법 그리고 치료 실패를 예측하는 위험요인들을 확인하기 위한 다양한 연구들이 더욱 필요할 것으로 사료된다.
REFERENCES
1. Tsujino T, Isayama H, Kogure H, Sato T, Nakai Y, Koike K. 2017; Endoscopic management of biliary strictures after living donor liver transplantation. Clin J Gastroenterol. 10:297–311. DOI: 10.1007/s12328-017-0754-z. PMID: 28600688.

2. Villa NA, Harrison ME. 2015; Management of biliary strictures after liver transplantation. Gastroenterol Hepatol (N Y). 11:316–328.
3. Sharma S, Gurakar A, Jabbour N. 2008; Biliary strictures following liver transplantation: past, present and preventive strategies. Liver Transpl. 14:759–769. DOI: 10.1002/lt.21509. PMID: 18508368.

4. Williams ED, Draganov PV. 2009; Endoscopic management of biliary strictures after liver transplantation. World J Gastroenterol. 15:3725–3733. DOI: 10.3748/wjg.15.3725. PMID: 19673012. PMCID: PMC2726449.

5. Liu CL, Fan ST, Lo CM, et al. 2006; Operative outcomes of adult-to-adult right lobe live donor liver transplantation: a comparative study with cadaveric whole-graft liver transplantation in a single center. Ann Surg. 243:404–410. DOI: 10.1097/01.sla.0000201544.36473.a2. PMID: 16495707. PMCID: PMC1448929.

6. Gómez CM, Dumonceau JM, Marcolongo M, et al. 2009; Endoscopic management of biliary complications after adult living-donor versus deceased-donor liver transplantation. Transplantation. 88:1280–1285. DOI: 10.1097/TP.0b013e3181bb48c2. PMID: 19996927.

7. Ayoub WS, Esquivel CO, Martin P. 2010; Biliary complications following liver transplantation. Dig Dis Sci. 55:1540–1546. DOI: 10.1007/s10620-010-1217-2. PMID: 20411422.

8. You MS, Paik WH, Choi YH, et al. 2019; Optimal biliary drainage for patients with biliary anastomotic strictures after right lobe living donor liver transplantation. Liver Transpl. 25:1209–1219. DOI: 10.1002/lt.25472. PMID: 30980451.

9. Costamagna G, Pandolfi M, Mutignani M, Spada C, Perri V. 2001; Long-term results of endoscopic management of postoperative bile duct strictures with increasing numbers of stents. Gastrointest Endosc. 54:162–168. DOI: 10.1067/mge.2001.116876. PMID: 11474384.

10. Seo JK, Ryu JK, Lee SH, et al. 2009; Endoscopic treatment for biliary stricture after adult living donor liver transplantation. Liver Transpl. 15:369–380. DOI: 10.1002/lt.21700. PMID: 19326412.

11. Pasha SF, Harrison ME, Das A, et al. 2007; Endoscopic treatment of anastomotic biliary strictures after deceased donor liver transplantation: outcomes after maximal stent therapy. Gastrointest Endosc. 66:44–51. DOI: 10.1016/j.gie.2007.02.017. PMID: 17591473.

12. Srinath A, Shneider BL. 2012; Congenital hepatic fibrosis and autosomal recessive polycystic kidney disease. J Pediatr Gastroenterol Nutr. 54:580–587. DOI: 10.1097/MPG.0b013e31824711b7. PMID: 22197937. PMCID: PMC4369775.

13. Habib S, Shakil O, Couto OF, et al. 2006; Caroli's disease and orthotopic liver transplantation. Liver Transpl. 12:416–421. DOI: 10.1002/lt.20719. PMID: 16498655.

14. Alazmi WM, Fogel EL, Watkins JL, et al. 2006; Recurrence rate of anastomotic biliary strictures in patients who have had previous successful endoscopic therapy for anastomotic narrowing after orthotopic liver transplantation. Endoscopy. 38:571–574. DOI: 10.1055/s-2006-925027. PMID: 16802268.

15. Kashyap R, Jain A, Reyes J, et al. 2001; Causes of retransplantation after primary liver transplantation in 4000 consecutive patients: 2 to 19 years follow-up. Transplant Proc. 33:1486–1487. DOI: 10.1016/S0041-1345(00)02563-X.

16. Chen GH, Fu BS, Cai CJ, et al. 2008; A single-center experience of retransplantation for liver transplant recipients with a failing graft. Transplant Proc. 40:1485–1487. DOI: 10.1016/j.transproceed.2008.01.076. PMID: 18589134.

Fig. 1
(A) Computed tomography revealed no change in the subtle soft tissue density around bile duct anastomosis (arrow) with (B) mild intrahepatic dilatation (arrowhead). (C) Endoscopic retrograde cholangiopancreatography revealed anastomotic stricture (arrow). (D) A 4mm balloon dilation of anastomotic stricture was performed, (E) followed by the placement of a 7F plastic stent. (F) Follow cholangiography showed an improved biliary stricture (arrow), and the plastic stent was removed.

Fig. 2
(A) Computed tomography revealed an increased moderated amount of ascites, (B) and mild right intrahepatic dilatation (arrowhead). (C) Cholangiography showed anastomotic stricture (arrow). (D) Two guidewires were passed through the anastomotic stricture (E) then two 7F plastic stents were placed after balloon dilation.
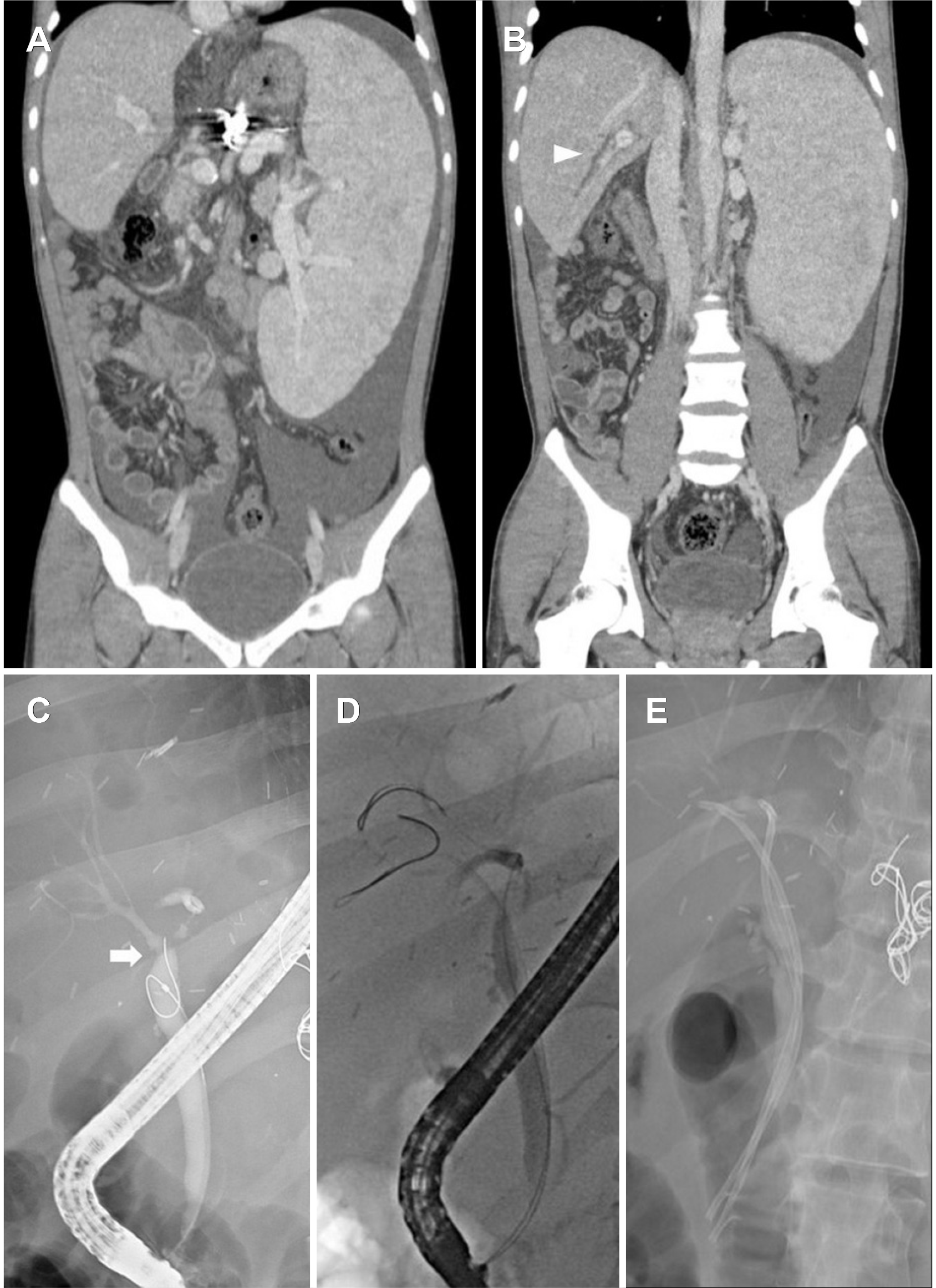
Fig. 3
Microscopic features of the explanted liver specimen. The entire parenchyme demonstrated the features of cholestatic hepatitis, including marked canalicular and hepatocellular cholestasis, feathery degeneration, and lobular inflammation. Biliary-type bridging fibrosis was seen (hematoxylin and eosin stain, ×100).




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download