1. Sauter A, Matharu R, Hörmann K, Naim R. Current advances in the basic research and clinical management of sinonasal inverted papilloma (review). Oncol Rep. 2007; 17(3):495–504.

2. von Buchwald C, Bradley PJ. Risks of malignancy in inverted papilloma of the nose and paranasal sinuses. Curr Opin Otolaryngol Head Neck Surg. 2007; 15(2):95–8.

3. Lawson W, Patel ZM. The evolution of management for inverted papilloma: An analysis of 200 cases. Otolaryngol Head Neck Surg. 2009; 140(3):330–5.

4. Mirza S, Bradley PJ, Acharya A, Stacey M, Jones NS. Sinonasal inverted papillomas: Recurrence, and synchronous and metachronous malignancy. J Laryngol Otol. 2007; 121(9):857–64.

5. Park SK, Lee G, Kim MS, Kim YM, Rha KS. Clinical analysis of 382 sinonasal inverted papilloma cases treated at a single tertiary medical center. J Rhinol. 2020; 27(2):102–7.

6. Barnes L. Schneiderian papillomas and nonsalivary glandular neoplasms of the head and neck. Mod Pathol. 2002; 15(3):279–97.

7. Tanvetyanon T, Qin D, Padhya T, Kapoor R, McCaffrey J, Trotti A. Survival outcomes of squamous cell carcinoma arising from sinonasal inverted papilloma: Report of 6 cases with systematic review and pooled analysis. Am J Otolaryngol. 2009; 30(1):38–43.

8. Yu MS, Lim WS, Lee BJ, Chung YS. Squamous cell carcinoma associated with inverted papilloma of the maxillary sinus: Our experience with 21 patients. Clin Otolaryngol. 2017; 42(5):1048–52.

9. Lobo BC, D’Anza B, Farlow JL, Tang D, Woodard TD, Ting JY, et al. Outcomes of sinonasal squamous cell carcinoma with and without association of inverted papilloma: A multi-institutional analysis. Am J Rhinol Allergy. 2017; 31(5):305–9.

10. Karligkiotis A, Lepera D, Volpi L, Turri-Zanoni M, Battaglia P, Lombardi D, et al. Survival outcomes after endoscopic resection for sinonasal squamous cell carcinoma arising on inverted papilloma. Head Neck. 2016; 38(11):1604–14.

11. Buiret G, Montbarbon X, Fleury B, Poupart M, Pignat JC, Carrie C, et al. Inverted papilloma with associated carcinoma of the nasal cavity and paranasal sinuses: Treatment outcomes. Acta Otolaryngol. 2012; 132(1):80–5.

12. Choi JW, Kim SG, Kim YM, Yoon YH, Kim AY, Rha KS. Clinical and histologic features of inverted papilloma-associated malignancy. Eur Arch Otorhinolaryngol. 2012; 269(11):2349–54.

13. Yu HX, Liu G. Malignant transformation of sinonasal inverted papilloma: A retrospective analysis of 32 cases. Oncol Lett. 2014; 8(6):2637–41.

14. Nudell J, Chiosea S, Thompson LD. Carcinoma ex-Schneiderian papilloma (malignant transformation): A clinicopathologic and immunophenotypic study of 20 cases combined with a comprehensive review of the literature. Head Neck Pathol. 2014; 8(3):269–86.

15. Kim K, Kim D, Koo Y, Kim CH, Choi EC, Lee JG, et al. Sinonasal carcinoma associated with inverted papilloma: A report of 16 cases. J Craniomaxillofac Surg. 2012; 40(4):e125–9.

16. Liang QZ, Li DZ, Wang XL, Huang H, Xu ZG, Wu YH. Survival outcome of squamous cell carcinoma arising from sinonasal inverted papilloma. Chin Med J (Engl). 2015; 128(18):2457–61.

17. Yasumatsu R, Nakashima T, Sato M, Nakano T, Kogo R, Hashimoto K, et al. Clinical management of squamous cell carcinoma associated with sinonasal inverted papilloma. Auris Nasus Larynx. 2017; 44(1):98–103.

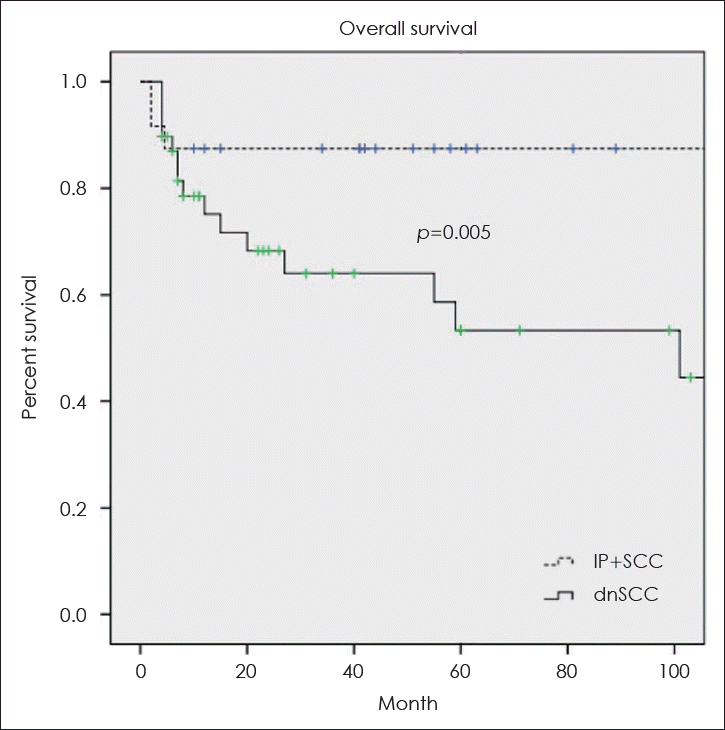
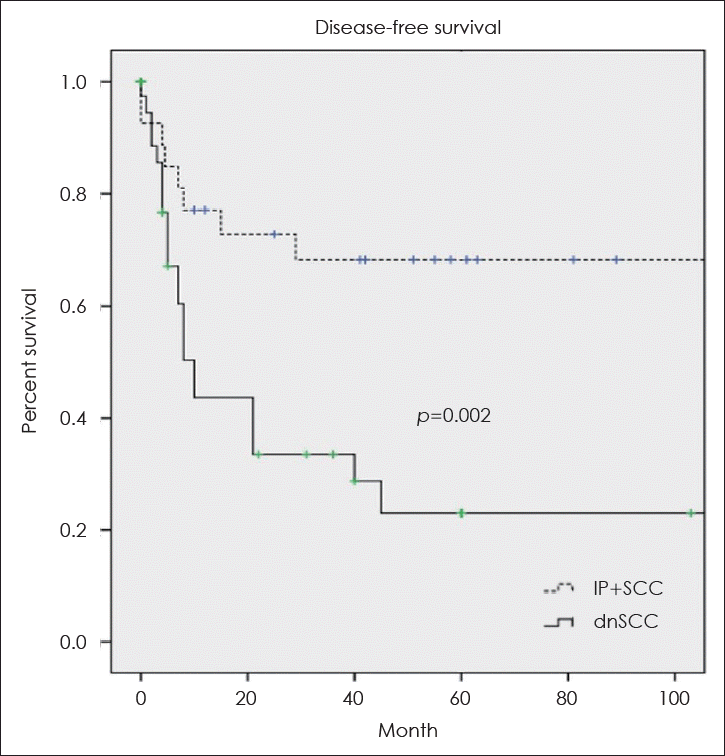
18. Lee JJ, Peterson AM, Embry TW, Wamkpah NS, Kallogjeri D, Doering MM, et al. Survival outcomes of de novo vs inverted papilloma-associated sinonasal squamous cell carcinoma: A systematic review and meta-analysis. JAMA Otolaryngol Head Neck Surg. 2021; 147(4):350–9.

19. Yan CH, Newman JG, Kennedy DW, Palmer JN, Adappa ND. Clinical outcomes of sinonasal squamous cell carcinomas based on tumor etiology. Int Forum Allergy Rhinol. 2017; 7(5):508–13.

20. Amin MB, Edge SB. American Joint Committee on Cancer. AJCC cancer staging manual. 8th ed. Switzerland: Springer;2017.
21. Lund VJ, Stammberger H, Nicolai P, Castelnuovo P, Beal T, Beham A, et al. European position paper on endoscopic management of tumours of the nose, paranasal sinuses and skull base. Rhinol Suppl. 2010; 22:1–143.
22. Miyazaki T, Haku Y, Yoshizawa A, Iwanaga K, Fujiwara T, Mizuta M, et al. Clinical features of nasal and sinonasal inverted papilloma associated with malignancy. Auris Nasus Larynx. 2018; 45(5):1014–9.





 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download