Abstract
Myofibrosarcoma is a rare malignant tumor originating from myofibroblasts. It is classified into low-grade, intermediate-grade, and high-grade according to the histological characteristics. High-grade myofibrosarcoma is reported very rarely worldwide, and its recurrence and metastasis are known to be more common. Myofibrosarcoma is diagnosed by histopathologic examination, and its treatment is complete surgical excision. With a review of literature, we report a case of myofibrosarcoma originating from the right masseter muscle in a 73-year-old male patient who complained of a right chin mass for 4 months. The MRI findings revealed a 4.8 cm-sized heterogeneous contrast-enhancing mass in the right masseter muscle with direct invasion into the ipsilateral medial pterygoid muscle and the mandible body. The patient was treated with margin-free surgical excision, including marginal mandibulectomy, and a highgrade myofibrosarcoma was finally diagnosed as the pathologic finding. Adjuvant radiation therapy was performed as a subsequent treatment, and no recurrence has been observed during follow-up for 1 year.
연조직 육종(soft tissue sarcoma)은 연간 발생률이 10만명당 5명으로 매우 드문 질환이다[1)]. 육종은 두경부에서는 더욱 드물게 발생하는데 두경부에서 발생하는 모든 악성종양의 1% 미만을 차지하는 것으로 알려져 있으며[1,2], 전체 육종 중 두경부에서 발생하는 것은 9%에 불과하다[2]. 연조직 육종 발생의 위험인자로는 Li-Fraumeni 증후군과 같은 유전질환, 상호전위(reciprocal translocation)와 같은 유전체 이상, 그리고 방사선 노출 등이 알려져 있다[1]. 근섬유육종(myofibrosarcoma) 은 연조직 육종의 한 종류이며 근섬유모세포(myofibroblast) 에서 기원하는 악성종양으로, 비교적 최근에 그 존재가 밝혀진 바 있으며 매우 드물게 보고되는 질환이다[3,4]. 이는 주로 두경부와 사지 및 체간의 연조직에서 주로 발생하는 것으로 알려져 있다[5,6].
저자들은 우측 턱의 종괴를 주소로 내원한 73세 남자에서 수술 전 영상의학적 검사 및 조직검사상 악성 방추형 세포 종양(malignant spindle cell tumor) 소견을 보였으며, 이에 하악골 변연절제술(marginal mandibulectomy)을 포함한 외과적 절제 후 조직검사상 고등급(high-grade) 근섬유육종이 최종 진단된 1예를 치험하였기에 문헌 고찰과 함께 보고하는 바이다.
환자는 73세 남성으로 고혈압 및 뇌졸중 과거력 있어 타병원에서 주기적으로 경과 관찰하던 분으로, 4개월 전부터 서서히 커지는 우측 턱의 종괴를 주소로 내원하였다. 신체검진상 우측 턱에 약 4 cm 크기의 압통 없는 단단한 종괴가 촉진되었으며, 경부에 촉진되는 다른 종물은 없었다. 안면근육은 양측이 대칭으로 안면마비의 소견은 관찰되지 않았다. 경부 CT 상 우측 교근(masseter muscle)에 약 3.8 cm 크기의 조영증강되는 종괴가 관찰되었고, 우측 하악골(mandible)의 침범 및 파괴를 동반하였다(Fig. 1). 경부 MRI상 우측 저작공간(masticator space) 내에 우측 교근 및 내측 익상근(medial pterygoid muscle)이 연루된 약 4.8 cm 크기의 불균질하게 조영증강되는 종괴가 우측 하악골 체부(body)를 직접적으로 침범하면서 우측 이하선(parotid gland)과도 인접한 소견을 보였으며, 이외 경부에서 병적 림프절 비대는 관찰되지 않았다. 상기 영상의학적 검사 결과를 종합하였을 때 중간엽(mesenchyme) 기원의 원발성 종양, 전이된 악성종양, 또는 이하선 기원의 종양 등이 의심되었고, 이에 초음파 유도하 중심생검(sono-guided core needle biopsy)을 통한 조직검사를 시행하여 악성 방추형 세포 종양으로 확인되었다. 그 중에서도 면역조직화학검사(immunohistochemistry)상 비멘틴(vimentin) 에서 양성, smooth muscle actin (SMA)에서 국소적으로 양성 소견을 보여 근섬유육종이 의심되었다. 이후 시행한 PET-CT상 우측 저작공간 내에 약 5.1 cm 크기의 과대사성(hypermetabolic) 종괴가 관찰되었고, 최대 표준섭취계수(maximum standard uptake value)는 29.9였다. 종괴는 우측 교근, 내측 익상근 및 하악골 체부를 침범하는 소견을 보였으며, 우측 이하선 및 악하선의 침범 가능성도 있었다. 이 외에 전신 영상에서 악성 병변을 의심할 만한 비정상적인 fluorodeoxyglucose 섭취는 관찰되지 않았다.
이에 해당 병변에 대하여 수술적 절제를 결정하였으며, 환자는 전신마취하 앙와위(supine)에서 경부 신전(extension) 및 고개를 좌측으로 돌리는 자세를 취하였고 안면신경(facial nerve)에 대한 신경감시장치(nerve monitoring system)를 부착하였다. 변형 블레어 절개(modified Blair insicion)에 이어서 경부를 수평으로 절개 후 조직의 박리를 시행하였고 외경정맥(external jugular vein)을 결찰하였다. 우측 교근에서 약 4.5 cm 크기의 종괴가 발견되었고(Fig. 2), 안면신경의 하악분지(marginal mandibular branch)는 종괴의 침범이 확인되어 안전역(safety margin)을 확보한 후 절제하였다. 이후 우측 교근과 익돌교근삼각건(pterigomasseteric sling)을 박리하여 하악골 하부의 골막(periostium)을 노출하였고, 종괴는 하악각(mandible angle) 후연(posterior border)의 피질을 2 cm에 걸쳐 침범하는 양상을 보여 하악골 변연절제술을 시행하였다. 내측 익상근에도 종괴의 침범이 확인되어 이를 절개하며 종괴를 적출하였고, 복수의 절제연(resection margin)에서 시행한 동결절편생검(frozen section biopsy)상 음성 결과를 확인하였다. 이후 스테인리스 강판(stainless steel plate) 및 나사(screw)를 이용하여 하악골을 보강하였고, 환부를 세척 및 봉합 후 수술을 종료하였다. 수술 후 환자의 저작기능은 양호하였으나 우측 하부 소근(risorius muscle)에서 하우 스-브랙만 등급(House-Brackmann grade) V에 해당하는 정도의 마비 소견을 보였으며, 다른 부위의 안면마비는 관찰되지 않았다. 시행한 신경전도검사상(electroneurography) 우측 안륜근(orbicularis oculi muscle)의 진폭은 건측의 56%, 소근은 16.7% 소견을 보였다. 이후 경과 관찰에도 소근의 마비는 지속되는 양상을 보였다.
이후 절제된 종괴의 병리조직검사상 근섬유육종이 최종적으로 진단되었으며, The French F´ed´eration Nationale des Centers de Lutte Contre le Cancer 등급 체계에 따른 조직학적 등급은 고등급으로, 종양의 분화도 점수는 2점, 괴사는 50% 미만에서 존재하여 1점, 세포분열은 10개의 고배율시야(high-power fleid) 중 38개의 세포에서 관찰되어 3점에 해당하였으며 총합 6점이었다. 우측 교근, 내측 익상근 및 하악골의 침범이 확인되었으며(Fig. 3), 림프혈관 침윤(lymphovascular invasion) 및 신경주위 침윤(perineural invasion)은 관찰되지 않았고, 절제연에서 종양 세포는 관찰되지 않았다. 면역조직화학검사상 SMA 및 데스민(desmin)에서 양성, S-100에서 산발적으로 양성, CD68에서 국소적 및 산발적으로 양성 소견을 보였다(Fig. 4). CD34, anaplastic lymphoma kinase, cytokeratin AE1/3, 칼포닌(calponin), smooth muscle myosin heavy chain에서는 음성 소견을 보였으며, Ki-67 표지 지수(labeling index)는 51.7%였고, phosphohistone H3에서 10개의 고배율 시야 중 47개의 세포가 양성 소견을 보였다. 이후 다학제 진료(multidisciplinary clinic) 결과에 따라 환자에게는 수술 후 방사선 치료가 시행되었으며, 총 66 Gy의 선량을 6주 동안 33회에 걸쳐 조사하였다. 방사선 치료 기간 동안 중대한 합병증은 발생하지 않았으며, 수술 후 1년간의 경과 관찰 동안 종양의 재발 소견은 관찰되지 않았다.
1980년대 Ghadially는 근섬유모세포에서 기원하는 악성 종양을 근섬유육종으로 명명하기로 제안한 바 있으며[4], 근섬유육종은 조직학적 특성에 따라 저등급(low-grade), 중등등급(intermediate-grade) 및 고등급의 3가지 등급으로 분류된다. 저등급 및 중등급 근섬유육종은 방추형 세포가 층상(fascicular)으로 배열되어 섬유육종(fibrosarcoma) 또는 평활근육종(leiomyosarcoma)과 유사한 구조로 관찰되며[4], 국소적으로 재발할 수 있으나 원격전이는 흔하지 않은 것으로 알려져 있다[3]. 또한 2002년 세계보건기구(World Health Organization, WHO)에서 발행하는 연조직과 뼈의 종양 분류에서 저등급 근섬유모세포 육종(myofibroblastic sarcoma) 으로 통합하여 분류된 바 있다[6]. 반면 고등급 근섬유육종은 진단 기준의 재현성이 부족한 것으로 판단되어 아직 WHO 분류에는 포함되지 않았으며[7], 원격전이 및 재발이 흔하게 보고된다[3,7]. 고등급 근섬유육종은 매우 드문 질환으로 아직 국내에서 보고된 바는 없으며, 해외에서도 두경부 기원의 고등급 근섬유육종은 상악골 4예 및 하악골 4예[6,8-11]만이 보고되었고(Table 1), 이 외에도 하지에서 7예[7,12], 상지에서 1 예[13] 등이 보고되었다.
근섬유모세포는 1970년대 Gabianni 등에 의해 육아 조직(granulation tissue)에서 처음 발견되었고[4,6], 주로 결절성 근막염(nodular fasciitis), 데스모이드 섬유종증(desmoid fibromatosis), 근섬유종(myofibroma) 등 반응성 병변과 양성신생물의 주된 구성 세포로 알려져 있다[3-6]. 상기 환경에서 섬유모세포(fibroblast)에는 일종의 기계적인 장력이 주어지게 되는데, 이로 인해 초미세구조적(ultrastructural) 변화가 생기면서 근섬유모세포가 형성되는 것으로 알려져 있으며[4], 근섬유모세포에는 조면소포체가 풍부하여 섬유모세포의 특성인 세포외 기질의 분비도 가능하면서 세포질 내에 스트레스 섬유(stress fiber), 즉 액틴(actin)이 함유된 미세섬유(microfilament) 구조가 형성되어 근세포처럼 수축 기능도 가지게 된다[3-5]. 근섬유모세포의 조직학적 소견은 광학 현미경상 성상(stellate) 또는 양극성(bipolar)의 세포 형태를 가지나 그 경계는 명확하지 않으며, 핵은 얇고 길거나 물결 모양이고 그 중심에 작고 명확한 핵소체(nucleoli)가 관찰된다[3,4]. 전자 현미경상 세포질에는 조면소포체(rough endoplasmic reticulum)와 골지체(Golgi complex)가 풍부하게 관찰되며, 세포막 근처에는 스트레스 섬유(stress fiber)로 불리는 얇은 미세섬유 구조가 국소적으로 밀집된 양상으로 존재하며, 이는 세포 외부의 피브로넥서스(fibronexus)와 연결되어 세포가 간질에 부착될 수 있도록 한다[3,4,13]. 면역조직화학검사상 섬유모세포는 비멘틴만을 발현하는 반면, 근섬유모세포는 비멘틴, SMA, 데스민, 미오신(myosin) 등에서 다양하게 양성 소견을 보인다[3,4].
근섬유육종의 진단은 종괴의 적출 후 광학현미경, 면역조직화학검사 및 전자현미경을 이용한 병리조직검사를 통해 이루어지며[1,6], CT 및 MRI 등 영상의학적 검사도 진단 및 치료 계획을 수립하는 데 필요하다[1]. 고등급 근섬유육종은 광학현미경상 비정형의 방추형 및 다각형(polygonal) 세포가 소용돌이 모양(storiform) 또는 층상의 구조를 형성하는 소견을 보이며, 이는 악성 섬유성 조직구종(malignant fibrous histiocytoma)과 조직학적으로 완전히 동일한 소견이다[3,4]. 악성 섬유성 조직구종은 특정한 분화를 보이지 않는 다형성 연조직 육종으로 정의되며, 세포질이 풍부하고 조직구(histiocyte)와 유사한 형태를 지니는 섬유모세포로 구성된다[3,4,7]. 때문에 면역조직화학염색 또는 전자현미경을 통해 근섬유모세포 분화의 소견을 확인하는 것이 필요하며, 이를 통해 악성 섬유성 조직구종과의 감별진단이 가능하다[7].
면역조직화학검사상 비멘틴 염색에서 강하게 양성을 보이면서 SMA, muscle specific actin, 데스민 등 근원성 표지자(myogenic marker) 중 하나에서 양성으로 보이면 근섬유모세포 분화로 간주할 수 있으며, 두경부의 근섬유육종을 진단할 때는 광학 현미경과 면역조직화학검사의 조합만으로 충분한 것으로 알려져 있다[6]. 또한 초미세구조적으로 확인된 고등급 근섬유육종에서 SMA와 데스민 염색 시 각 57%, 43%에서 양성이었던 반면, 악성 섬유성 조직구종에서는 각 29%, 24%에서 양성이었음이 보고된 바 있다[7]. 본 증례의 환자에서도 비멘틴, SMA, 데스민 염색에서 양성 소견을 보여 근섬유육종으로 진단되었다.
Ki-67는 세포분열의 증식기에서 발현되는 단백질 항원으로, 연조직 육종에서 Ki-67 표지지수가 30% 이상으로 높은 경우 나쁜 예후와 연관이 있는 것으로 알려져 있다[14]. 본 증례의 경우 Ki-67 증식 지수는 51.7%로 확인되었으며, 이는 종양 세포의 증식이 활발하게 이루어지고 있음을 의미하여 상대적으로 나쁜 예후를 시사하는 소견이었다.
연조직 육종의 가장 중요한 치료는 수술적 절제이며, 가능한 일괴(en bloc) 절제를 하면서 변연에 종양이 남아있지 않아야 하고, 기능적 및 미용적 합병증을 최소화하도록 해야한다[1,8]. 본 증례의 환자에서는 수술 전 영상의학적 검사 및 수술 중 육안 관찰상 근섬유육종이 우측 교근에서 기원하여 동측의 하악각 및 내측 익상근을 침범하는 양상으로 확인되었다. 종양의 골조직 침범이 심한 경우에는 하악골 분절절제술(segmental mandibulectomy)를 시행하는 것이 바람직하나, 종양이 골피질을 통해 직접적으로 침식하는 양상이면서 영상의학적 검사 또는 골막 박리 후 육안상으로 침범의 범위 및 경계가 명확히 관찰되는 경우 변연 하악골 절제술을 시행하는 것도 가능하다[15]. 이에 환자가 고령이고 이전에 뇌졸중 과거력이 있었다는 점을 고려하여 하악의 외형적, 기능적인 면에서 비교적 보존적 술식인 하악골 변연절제술을 시행하였다. 더불어 본 증례의 환자는 수술 전 시행한 영상의학적 검사상 종괴가 주변 조직을 침범하는 소견을 보여 수술 후 보조 방사선 치료가 시행될 가능성이 높았던 분으로, 방사선 치료의 합병증으로 골괴사(osteonecrosis) 및 이로 인한 골절이 발생하였을 때 예후가 크게 악화될 것으로 예상되었으며, 이에 대한 예방적인 차원에서 스테인리스 강판과 나사로 하악골을 보강하는 술식을 시행하였다.
두경부에서 기원하는 연조직 육종은 림프절 전이율이 7%-10% 정도로 높지 않게 보고되고 있으므로 수술 전 영상의학적 검사에서 경부 림프절 전이 소견이 없다면 예방적 경부절제술은 시행하지 않도록 권고되고 있다[1]. 본 증례에서도 수술 전 영상 검사상 저명한 경부 림프절 전이 소견은 확인되지 않았기에 예방적 경부절제술은 시행하지 않았으며, 이후 외래를 통한 경과 관찰 중 시행한 영상 검사에서도 경부 림프절에 전이 및 재발의 소견은 관찰되지 않았다.
두경부 기원 연조직 육종의 수술적 절제 후 절제연에서 종양 세포가 확인되거나 조직학적 등급이 고등급인 경우 수술 후 방사선 치료를 시행하는 것이 환자의 예후에 도움이 되는것으로 알려져 있다[1,2]. 본 증례의 경우 수술 후 시행한 조직 검사상 조직학적 등급은 고등급으로 확인되었으며, 절제연에서 종양 세포는 발견되지 않았으나 일부 절제연에서 종양까지의 거리가 0.1 cm로 다소 가까운 소견을 보였다. 이에 다학제 진료를 통한 유관 부서의 의견 수렴을 거쳐 수술 후 방사선 치료를 시행하였으며, 이후 경과 관찰에서 종양의 재발 소견은 보이지 않았다.
연조직 육종의 주요 예후 인자로는 조직학적 등급, 크기, 절제연의 종양 침범 여부가 있다[2]. 두경부 연조직 육종의 예후는 5년 생존률이 약 60% 정도로 다른 부위에 비해 나쁜 것으로 알려져 있는데[1], 조직학적 아형의 분포 및 해부학적 위치로 인한 완전한 수술적 절제가 어렵다는 점이 그 요인으로 분석되고 있다[1,2]. 고등급 근섬유육종의 경우에도 좋지 않은 예후를 보이는데, 고등급 근섬유육종 환자의 32%에서 재발하였고 68%에서 원격전이가 발견되었다고 보고된 바 있으며, 이는 악성 섬유성 조직구종과 전반적으로 유사한 결과이다[3].
본 증례는 두경부의 악성종양이 의심될 경우 수술 전 영상 의학적 검사 및 조직검사를 확인하여 수술의 범위를 신중히 결정하되 환자의 전신 상태 및 수술 후 미용적, 기능적인 부분까지도 고려해야 하며, 수술 시에는 절제연을 충분히 확보하여 환자의 예후를 최대한 개선하도록 노력하여야 함을 시사하고 있다.
저자들은 우측 턱의 종괴를 주소로 내원한 환자에서 영상 의학적 검사, 수술적 치료 및 조직검사를 통해 고등급 근섬유육종을 진단한 1예를 치험하였기에 문헌 고찰과 함께 보고하는 바이다.
Notes
Author Contribution
Conceptualization: Jae Seon Park, Sang Hyuk Lee. Data curation: Jae Seon Park. Formal analysis: Jae Seon Park, In Buhm Lee. Investigation: Jae Seon Park. Methodology: Jae Seon Park, In Buhm Lee. Project administration: Sang Hyuk Lee, Sung Min Jin. Supervision: Sang Hyuk Lee, Sung Min Jin. Validation: Sang Hyuk Lee. Visualization: Jae Seon Park. Writing—original draft: Jae Seon Park. Writing—review & editing: In Buhm Lee, Sang Hyuk Lee.
REFERENCES
1. Galy-Bernadoy C, Garrel R. Head and neck soft-tissue sarcoma in adults. Eur Ann Otorhinolaryngol Head Neck Dis. 2016; 133(1):37–42.

2. Tran LM, Mark R, Meier R, Calcaterra TC, Parker RG. Sarcomas of the head and neck. Prognostic factors and treatment strategies. Cancer. 1992; 70(1):169–77.

5. Montgomery E, Goldblum JR, Fisher C. Myofibrosarcoma: A clinicopathologic study. Am J Surg Pathol. 2001; 25(2):219–28.
6. Cai C, Dehner LP, El-Mofty SK. In myofibroblastic sarcomas of the head and neck, mitotic activity and necrosis define grade: A case study and literature review. Virchows Arch. 2013; 463(6):827–36.

7. Montgomery E, Fisher C. Myofibroblastic differentiation in malignant fibrous histiocytoma (pleomorphic myofibrosarcoma): A clinicopathological study. Histopathology. 2001; 38(6):499–509.

8. Smith DM, Mahmoud HH, Jenkins JJ, Rao B, Hopkins KP, Parham DM. Myofibrosarcoma of the Head and Neck in Children. Pediatr Pathol Lab Med. 1995; 15(3):403–18.

9. Bisceglia M, Tricarico N, Minenna P, Magro G, Pasquinelli G. Myofibrosarcoma of the upper jawbones: A clinicopathologic and ultrastructural study of two cases. Ultrastruct Pathol. 2001; 25(5):385–97.

10. Kourelis K, Shnayder Y, Key V, Girod D, Tsue T. Mandibular myofibrosarcoma of childhood: Surgical resection & reconstruction with fibula flap. Braz J Otorhinolaryngol. 2011; 77(3):404.

11. de Albuquerque Jr RLC, Melo SLS, Bastos TS, Rocha RS, Piva MR, de Melo MFB. High-grade myofibroblastic sarcoma of the mandible: Case report in a child and literature review. Oral Surg. 2015; 8(2):91–5.

12. Gonzalez FA, Vazquez AC, Uscanga CC, Cortes IJ, Malagon D. Pleomorphic myofibrosarcoma of the tibia with aneuploid DNA content. Ann Diagn Pathol. 2007; 11(5):340–4.

13. Watanabe K, Ogura G. Fibronexus in “malignant fibrous histiocytoma” of the bone: A case report of pleomorphic myofibrosarcoma. Ultrastruct Pathol. 2002; 26(1):47–51.

Fig. 1.
Preoperative radiologic imaging. A: Axial view of enhanced neck CT shows 3.8 cm sized enhancing mass in right masseter muscle with right mandible bony destruction. B: Axial view of neck MRI shows 4.8 cm sized heterogeneous contrast enhancing mass involving right masseter muscle, medial pterygoid muscle and mandible body. C: Axial view of PET-CT shows 5.1 cm sized hypermetabolic mass involving right masseter muscle, medial pterygoid muscle and mandible body.
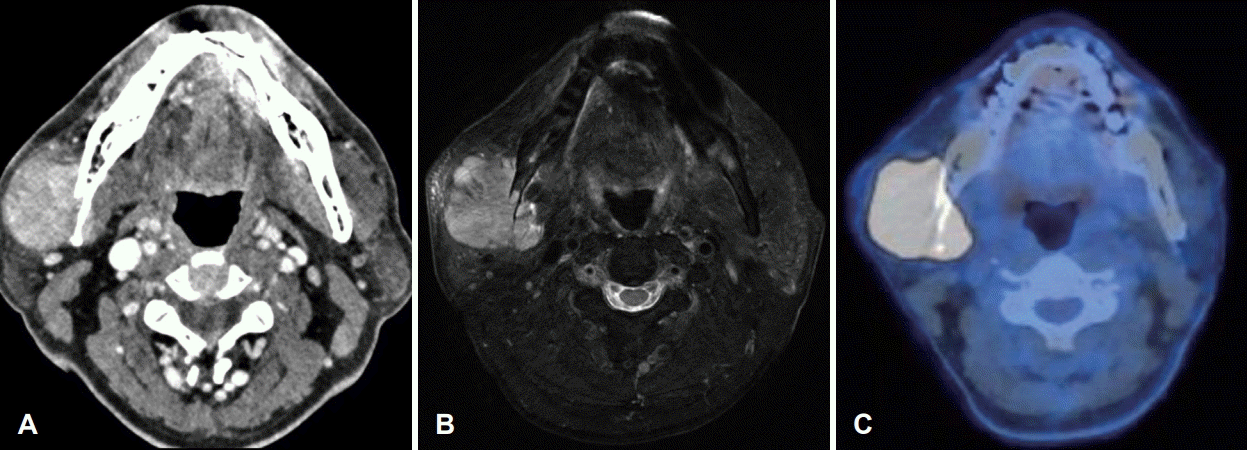
Fig. 2.
Intraoperative photograph. A: About 4.5 cm sized mass (asterisk) was located at right masseter muscle extending to mandiblular angle. B: Marginal mandibulectomy and reinforcement with stainless steel plates and screws was done. C: Specimen after mass excision shows about 6 cm sized lobulated firm mass with bony fragment (arrow).
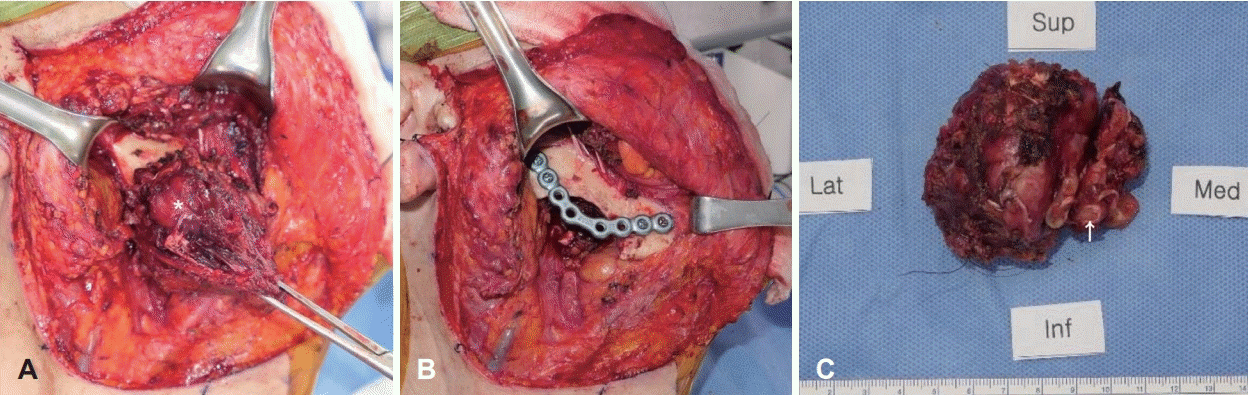
Fig. 3.
Microscopic findings (hematoxylin and eosin stain). A: Tumor cells around muscular (asterisk) and bony (arrow) tissue are identified (×40). B: Atypical spindle cells form a storiform or fascicular pattern (×200).
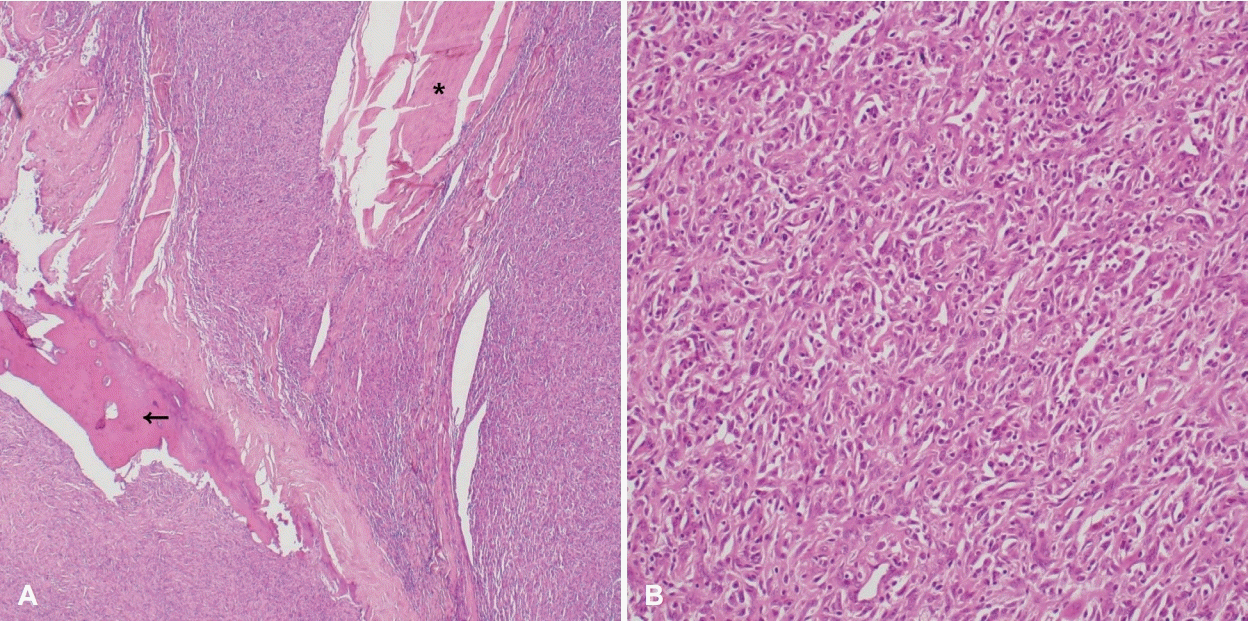
Fig. 4.
Immunohistochemistry findings. A: Smooth muscle actin was positive (×200). B: Desmin was positive (×200). C: A large proportion of tumor cells stained for Ki-67 (×200).
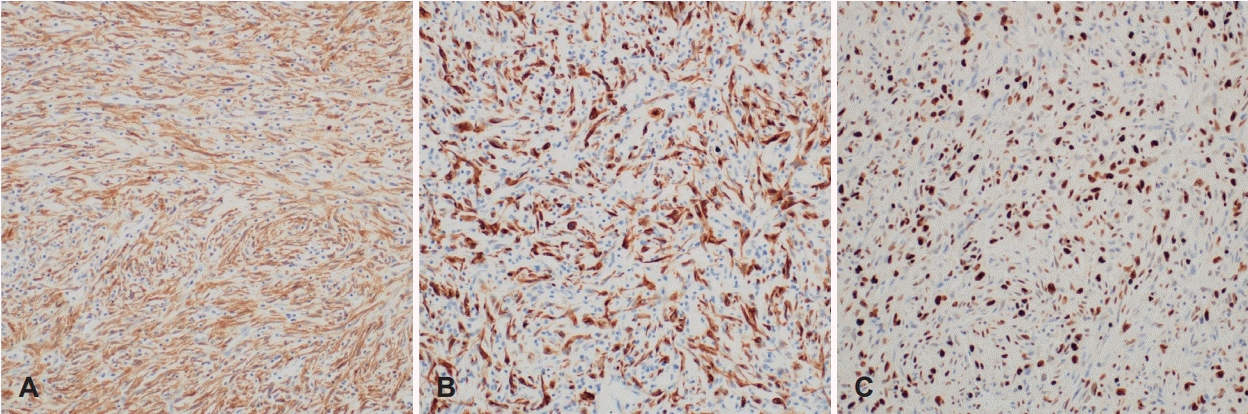
Table 1.
Cases reported as high-grade myofibrosarcoma of head and neck origin
| No. | Author | Year | Age | Sex | Site |
|---|---|---|---|---|---|
| 1 | Smith, et al. [8] | 1995 | 12 | F | Maxilla |
| 2 | Smith, et al. [8] | 1995 | 18 | M | Maxilla |
| 3 | Smith, et al. [8] | 1995 | 9 | F | Mandible |
| 4 | Bisceglia, et al. [9] | 2001 | 49 | M | Maxilla |
| 5 | Kourelis, et al. [10] | 2011 | 11 | F | Mandible |
| 6 | Cai, et al. [6] | 2013 | 74 | F | Mandible |
| 7 | Cai, et al. [6] | 2013 | 14 | M | Maxilla |
| 8 | de Albuquerque Jr, et al. [11] | 2014 | 11 | F | Mandible |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download