Abstract
Background
Axillary ultrasonography is a non-invasive and sensitive method used in the evaluation of breast cancer. We sought to evaluate the value of axillary ultrasonography in the nodal staging of breast cancer patients with axillary lymph node metastases.
Methods
From a retrospective database, we reviewed the electronic medical records of breast cancer patients with axillary lymph node metastases who underwent curative surgery between 2003 and 2020. We collected the relevant clinicopathological data and ultrasonographic images. We performed a binary logistic regression analysis to evaluate the factors associated with a high nodal stage.
Results
A total of 563 patients were included. Total mastectomy, larger tumor size, abnormal axillary ultrasonography, high histologic grade, lymphatic invasion, hormonal receptor negativity, and HER2 receptor positivity were associated with a pN2 or higher nodal stage. A receiver-operator curve analysis revealed that two or more abnormal lymph nodes seen on axillary ultrasonography identified a high nodal stage with a sensitivity of 62.2% and a specificity of 85.3%. Multivariate analysis revealed that patient age less than 50, lymphatic invasion, two or more abnormal lymph nodes, and hilar effacement were independent predictive factors for the high nodal stage.
액와부 림프절 전이를 동반한 유방암 환자에서 액와부 림프절 곽청술은 오랫동안 표준 치료법으로 사용되어 왔다. 액와부 림프절 곽청술은 종양학적으로 안전하고 효과적인 수술 방법이지만, 림프부종, 감각변화 및 근골격계 합병증 등을 빈번하게 일으킨다.(1) 최근에는 액와부 림프절 전이를 동반한 유방암 환자에서 액와부 림프절 곽청술을 생략하기 위한 연구들이 시행되었다.(2) 대표적인 임상연구인 American College of Surgeon Oncology Group (ACOSOG) Z0011 연구에 의하면 다음 다섯가지 조건을 만족시키는 경우에 감시림프절 절제술이 액와부 림프절 곽청술을 대신할 수 있다. 즉, 임상적으로 액와부 림프절 음성이고, T1 또는 T2 병기에 해당하는 환자에서, 유방보존술을 시행하고, 감시림프절 생검 시에 1개 혹은 2개의 림프절만 양성이며, 전체 유방에 방사선 치료를 시행하는 경우에 액와부 림프절 곽청술을 생략할 수 있다.(3)
유방암 치료에 있어서 액와부 림프절에 대한 평가는 매우 중요하다. 전통적으로 액와부 림프절에 대한 평가는 신체진찰에 의존하였다. 그러나, 신체진찰로 평가한 병기는 검사자의 경험과 주관에 의존하며, 병리학적인 병기와 반드시 일치하지 않는다.(4,5) 신체진찰에서 림프절 전이가 의심되는 경우에도 병리소견에서는 음성으로 나올 수 있으며, 액와부 깊숙히 위치한 림프절 전이는 신체진찰로 알기 어렵다. 액와부 초음파는 비 침습적이고 비용 효율적인 검사로, 유방암 환자에 대한 평가 시 유방 초음파와 함께 시행하게 된다. 또한, 액와부 초음파는 신체진찰에서 알기 어려운 구역 림프절에 대한 평가도 할 수 있다.(5)
액와부 림프절 전이의 초음파 소견은 기존의 연구들에서 이미 잘 알려져 있다. 정상적인 액와부 림프절은 경계가 매끈한 타원형의 모양을 나타내며, 피질의 두께는 3 mm 이하로 측정된다. 림프절에 전이가 발생하면 피질이 비대칭적으로 두꺼워지거나, 원형 또는 불규칙적인 모양을 나타내거나, 림프절 문이 일부 또는 전부 폐색된 소견을 보인다.(6)
본 연구에서는 림프절 전이를 동반한 유방암 환자들에서 높은 림프절 병기와 관련된 액와부 초음파 소견에 대하여 알아보고자 하였다.
연구는 후향적 의무기록 분석으로 진행하였고, 2003년부터 2020년까지 한림대학교성심병원에서 침윤성 유방암으로 수술 받은 환자들을 대상으로 하였다. 환자의 전자의무기록을 열람하여 인구통계학적 변수, 영상의학적 소견, 병리결과 등을 확인하였다. 환자들 중 액와부 림프절에 전이가 있는 환자들만을 연구에 포함하였다. 선행항암화학요법을 받은 환자, 재발성 유방암, 잠재성 유방암, T4 병기의 환자들은 연구에서 제외시켰고, 고 화질의 초음파 검사 결과가 없는 환자도 연구에서 제외하였다(Fig. 1).
초음파 검사는 유방을 전공한 영상의학과 의사들이 시행하였으며, 유방 초음파 검사 시에 액와부도 포함하여 시행하였다. 액와부 림프절은 초음파 소견에 따라 정상, 미결정(indeterminate), 비정상(abnormal)으로 분류하였다(Fig. 2). 의심되는 림프절에 대해서는 필요시 초음파 유도 중심 침 생검을 시행하였다. 영상 보고서에는 의심되는 림프절의 개수를 기술하였다. 의심되는 림프절이 있는 경우, 초음파 사진을 후향적으로 분석하여 비정상 림프절의 개수를 기록하였다. 전이로 확인된 림프절에 대해서는 림프절의 장축의 길이, 단축, 림프절 문의 폐색(hilar effacement), 피질의 두께(cortical thickness) 등을 기록하였다.
유방암 환자들은 외과 의사의 결정에 따라 유방 보존술 또는 유방 전절제술을 시행 받았다. 수술 전 림프절 전이가 확인된 환자들에서는 액와부 림프절 곽청술을 시행하였다. 임상적으로 액와부 림프절이 음성인 환자들에서는 감시 림프절 생검술을 시행하였다. 감시 림프절 생검술시 방사성 동위원소와 청색 염색약을 동시에 사용하였다. 수술 중 동결절편조직검사를 통하여 림프절 전이 여부를 확인 하였으며, 림프절 전이가 양성인 경우에는 레벨 1, 2에 대한 액와부 림프절 곽청술을 시행하였다.
병리조직보고서에는 종양의 크기, 조직학적 아형, 림프절 전이의 개수, 조직학적 등급, 림프관 침범 등을 기술하였다. 에스트로겐 수용체, 프로게스테론 수용체, HER2 수용체에 대한 면역조직화학 염색 결과도 기술하였다.
연속성 변수는 평균과 표준편차에 대해서 기술하였다. 연속형 변수간의 비교에는 Student’s t-test를 사용하였다. 범주형 변수는 명수와 빈도로 기술하였다. 범주형 변수간의 비교에는 카이제곱분석을 사용하였다. 독립변수와 림프절 전이의 정도를 평가하기 위하여 이분형 단변량 로지스틱 회귀분석 및 다변량 로지스틱 회귀분석을 사용하였다. 유의수준은 P-value가 0.05 미만일 때를 기준으로 하였다. 모든 통계적 분석은 SPSS 버전 24.0을 사용하였다(IBM Inc., Armonk, NY, USA).
본 연구는 한림대학교성심병원의 임상연구심사위원회에서 심의를 받았다(IRB No. 2020-08-001). 최소위험연구에 속하여 동의서 작성은 면제되었다.
총 3,099명의 환자들 중 563명의 환자가 연구대상자에 포함되었다. 연구대상자의 임상병리학적인 특성은 Table 1에 정리하였다. 563명의 환자들 중 407명(72.3%)의 환자는 pN1 병기였고, 156명(27.7%)의 환자는 pN2 이상의 병기로 나타났다. 높은 림프절 병기와 관련된 요인으로는 유방 전절제술(30.7% vs. 51.9%), 큰 종양 크기(2.29 cm vs. 2.68 cm), 비정상 액와부 초음파(41.5% vs. 80.8%), 높은 조직학적 등급(28.7% vs. 42.3%), 림프관 침범(41.5% vs. 78.8%), 호르몬 수용체 음성(21.4% vs. 32.1%), HER2 수용체 양성(25.6% vs. 44.9%) 등으로 나타났다.
비정상 액와부 초음파 소견을 보이는 295명의 환자들을 분석한 결과, 169명(57.3%)의 환자는 pN1 병기, 126명(42.7%)의 환자는 pN2 이상의 병기로 나타났다. 높은 림프절 병기를 보이는 환자에서 비정상 림프절의 개수가 많았으며(1.72 vs. 3.01), 림프절 문의 폐색이 높은 빈도로 나타났다(47.9% vs. 68.3%). 그러나, 전이 림프절의 단축의 길이, 장축의 길이, 피질의 두께는 양 군간에 통계적으로 의미 있는 차이를 보이지 않았다(Table 2).
액와부 초음파에서 비정상 림프절의 개수와 림프절 병기 간의 상관관계를 분석한 ROC 곡선에서, 곡선 아래의 넓이는 0.777 (95% 신뢰구간 0.731–0.823, P = 0.024)로 나타났다. 두 개 이상의 비정상 림프절 소견이 보일 때 민감도는 62.2%, 특이도는 85.3%로 가장 진단적 가치가 높게 나타났다(Fig. 3).
위에 기술한 임상병리학적인 요인들 중 pN2 이상의 림프절 병기에 대한 예측 인자를 찾기 위하여 이분형 로지스틱 회귀분석을 시행하였다(Table 3). 단변량 분석에서는 50세 미만의 연령, T2 병기, 유방 전절제술, 호르몬 수용체 음성, HER2 수용체 양성, 높은 조직학적 등급, 림프관 침범, 2개 이상의 비정상 림프절, 림프절 문의 폐색 등이 높은 림프절 병기와 관련이 있었다. 다변량 분석에서는 50세 미만의 연령, 림프관 침범, 2개 이상의 비정상 림프절, 림프절 문의 폐색 등이 pN2 이상의 림프절 병기에 대한 독립적인 예측인자로 나타났다.
본 연구에서 총 563명의 액와부 림프절 전이를 동반한 유방암 환자의 의무기록을 분석한 결과, 액와부 초음파 소견과 pN2 이상의 높은 림프절 병기 간에 강한 상관관계를 확인할 수 있었다. 높은 림프절 병기에서는 액와부 초음파에서 확인된 비정상 림프절의 개수가 많았으며, 림프절 문의 폐색이 높은 빈도로 나타났다. 두 개 이상의 림프절 전이가 보이는 환자에서 62.2%의 민감도와 85.3%의 특이도로 pN2 이상의 높은 림프절 병기를 예측할 수 있었다. 다변량 분석 결과에서 50세 이하의 나이, 림프관 침범, 2개 이상의 비정상 림프절 및 림프절 문의 폐색이 높은 림프절 병기에 대한 독립적인 예측 인자로 확인되었다.
유방암 환자의 치료에 있어서 액와부 병기 설정은 매우 중요하다. Z0011 연구가 발표되기 이전에는 액와부 림프절 전이가 있는 유방암 환자들은 대부분 액와부 림프절 곽청술을 시행 받았으며, 액와부 초음파는 조직검사를 통해 림프절 전이를 확진하기 위한 목적으로 주로 사용되었다.(7) 그러나 Z0011 연구가 발표된 이후에는 액와부 초음파의 역할이 변화하였다.(8) 최근의 연구들은 액와부 림프절의 종양 부담 및 병기예측에 초점을 맞추고 있다.(9-11) 초음파에서 림프절 전이가 없는 환자군에서는 림프절 전이의 빈도가 낮으며, 이러한 경우에 감시림프절 생검술조차 생략하기 위한 연구가 시도되고 있다.(12) 초음파에서 한 개의 림프절 전이가 의심되는 환자에서는 액와부 종양 부담이 낮은 것으로 알려져 있으나, 액와부 림프절 곽청술을 생략할 수 있을 지는 아직 논쟁 중이다.(13,14) 본 연구에 따르면 두 개 이상의 림프절 전이가 의심되는 환자들은 높은 림프절 병기와 관련이 있었으며, 대부분 액와부 림프절 곽청술을 시행해야 한다.
림프절 전이를 동반한 유방암에서 액와부 림프절 곽청술의 대안으로 선행항암화학요법을 시도해 볼 수 있다. 선행항암화학요법 후 감시림프절 생검술에서 음성인 경우에는 액와부 림프절 곽청술을 생략할 수 있다.(15) 선행항암화학요법의 효과는 유방암의 분자생물학적 아형과 관련이 있다.(16) 특히, HER2에 대한 새로운 표적치료제가 개발되면서 HER2 양성 유방암의 병리학적 완전관해율이 상승하였다.(17) 액와부 림프절이 양성인 유방암에서도 선행항암화학요법 후 병리학적 완전관해가 예상되는 경우에 감시림프절 생검술을 시행할 수 있다. 수술 전 액와부 초음파에서 전이로 확인된 림프절에 대해서 금속 클립, 레이더 반사 장치(radar reflector), 자석 물질(magnetic seed), 활성탄(activated charcoal) 등으로 표시를 하여 수술 중 반드시 제거해야 한다.(18-20) 이러한 선택적 액와부 림프절 절제술을 통하여 감시 림프절 생검술의 민감도를 향상시킬 수 있다.
액와부 초음파 소견은 수술 후 방사선 치료의 범위를 결정 하는 데에도 중요하다. 림프절 전이를 동반한 유방암 환자에서는 액와부 방사선 치료를 고려하여야 한다. 미국 NCCN 가이드라인은 pN2 이상의 높은 림프절 병기를 나타내는 환자에서는 방사선 치료 범위에 액와부뿐만 아니라 쇄골상부와 내유림프절도 포함하도록 권고하고 있다.(21) 선행항암화학요법 후에는 액와부 림프절에 완전 관해가 올 수 있기 때문에, 수술 전 액와부 초음파 소견이 방사선 치료의 범위를 결정하는 데 도움이 될 수 있다.
본 연구는 액와부 초음파 소견과 림프절 병기 사이의 높은 상관관계를 밝혀내어 초음파를 통한 액와부 림프절 병기 설정의 유용성을 입증하였다. 많은 수의 유방암 환자들을 대상으로 액와부 초음파 소견을 분석하여 통계적인 유의성을 확보할 수 있었다. 본 연구의 가장 큰 한계점은 단일 기관에서 시행한 후향적 연구라는 점이다. 액와부 림프절에 대한 평가는 최초에 시행한 영상의학과 의사의 소견에 의존하였다. 또한, 이전 병원의 초음파 소견, 유방 촬영술, 유방 MRI 소견 등을 모두 확인한 후에 초음파를 시행한 경우도 있었다. 이러한 단점을 보완하기 위하여 모든 환자의 액와부 초음파 사진을 분석하였다.
REFERENCES
1. Mansel RE, Fallowfield L, Kissin M, Goyal A, Newcombe RG, Dixon JM, et al. 2006; Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC trial. J Natl Cancer Inst. 98:599–609. DOI: 10.1093/jnci/djj158. PMID: 16670385.

2. Castelo M, Hu SY, Dossa F, Acuna SA, Scheer AS. 2020; Comparing observation, axillary radiotherapy, and completion axillary lymph node dissection for management of axilla in breast cancer in patients with positive sentinel nodes: a systematic review. Ann Surg Oncol. 27:2664–76. DOI: 10.1245/s10434-020-08225-y. PMID: 32020394.

3. Giuliano AE, Ballman KV, McCall L, Beitsch PD, Brennan MB, Kelemen PR, et al. 2017; Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (Alliance) randomized clinical trial. JAMA. 318:918–26. DOI: 10.1001/jama.2017.11470. PMID: 28898379. PMCID: PMC5672806.

4. Elmore LC, Appleton CM, Zhou G, Margenthaler JA. 2013; Axillary ultrasound in patients with clinically node-negative breast cancer: which features are predictive of disease? J Surg Res. 184:234–40. DOI: 10.1016/j.jss.2013.03.068. PMID: 23664535.

5. Chang JM, Leung JWT, Moy L, Ha SM, Moon WK. 2020; Axillary nodal evaluation in breast cancer: state of the art. Radiology. 295:500–15. DOI: 10.1148/radiol.2020192534. PMID: 32315268.

6. Youn HJ, Ahn HR, Kang SY, Jung SH. 2020; Ultrasonography for Staging axillary lymph node in breast cancer patients. J Surg Ultrasound. 7:1–6. DOI: 10.46268/jsu.2020.7.1.1.

7. Choi YJ, Ko EY, Han BK, Shin JH, Kang SS, Hahn SY. 2009; High-resolution ultrasonographic features of axillary lymph node metastasis in patients with breast cancer. Breast. 18:119–22. DOI: 10.1016/j.breast.2009.02.004. PMID: 19297159.

8. Farrell TP, Adams NC, Stenson M, Carroll PA, Griffin M, Connolly EM, et al. 2015; The Z0011 trial: is this the end of axillary ultrasound in the pre-operative assessment of breast cancer patients? Eur Radiol. 25:2682–7. DOI: 10.1007/s00330-015-3683-6. PMID: 25740803.

9. Angarita S, Ye L, Rünger D, Hadaya J, Baker JL, Dawson N, et al. 2021; Assessingthe burden of nodal disease for breast cancer patients with clinically positive nodes: hope for more limited axillary surgery. Ann Surg Oncol. 28:2609–18. DOI: 10.1245/s10434-020-09228-5. PMID: 33084993.

10. Lim GH, Upadhyaya VS, Acosta HA, Lim JMA, Allen JC Jr, Leong LCH. 2018; Preoperative predictors of high and low axillary nodal burden in Z0011 eligible breast cancer patients with a positive lymph node needle biopsy result. Eur J Surg Oncol. 44:945–50. DOI: 10.1016/j.ejso.2018.04.003. PMID: 29705286.

11. Ahn SK, Kim MK, Kim J, Lee E, Yoo TK, Lee HB, et al. 2017; Can we skip intraoperative evaluation of sentinel lymph nodes? Nomogram predicting involvement of three or more axillary lymph nodes before breast cancer surgery. Cancer Res Treat. 49:1088–96. DOI: 10.4143/crt.2016.473. PMID: 28161935. PMCID: PMC5654155.

12. Gentilini O, Veronesi U. 2012; Abandoning sentinel lymph node biopsy in early breast cancer? A new trial in progress at the European Institute of Oncology of Milan (SOUND: Sentinel node vs Observation after axillary UltraSouND). Breast. 21:678–81. DOI: 10.1016/j.breast.2012.06.013. PMID: 22835916.
13. Pilewskie M, Jochelson M, Gooch JC, Patil S, Stempel M, Morrow M. 2016; Is preoperative axillary imaging beneficial in identifying clinically node-negative patients requiring axillary lymph node dissection? J Am Coll Surg. 222:138–45. DOI: 10.1016/j.jamcollsurg.2015.11.013. PMID: 26711795. PMCID: PMC4729648.

14. Puri S, Sharma N, Newcombe RG, Kaushik M, Al-Attar M, Pascaline S, et al. 2018; Axillary tumour burden in women with one abnormal node on ultrasound compared to women with multiple abnormal nodes. Clin Radiol. 73:391–5. DOI: 10.1016/j.crad.2017.12.014. PMID: 29352595.

15. Boughey JC, Suman VJ, Mittendorf EA, Ahrendt GM, Wilke LG, Taback B, et al. 2013; Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA. 310:1455–61. DOI: 10.1001/jama.2013.278932. PMID: 24101169. PMCID: PMC4075763.

16. Pilewskie M, Zabor EC, Mamtani A, Barrio AV, Stempel M, Morrow M. 2017; The optimal treatment plan to avoid axillary lymph node dissection in early-stage breast cancer patients differs by surgical strategy and tumor subtype. Ann Surg Oncol. 24:3527–33. DOI: 10.1245/s10434-017-6016-y. PMID: 28762114. PMCID: PMC5697709.

17. Schneeweiss A, Chia S, Hickish T, Harvey V, Eniu A, Hegg R, et al. 2013; Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol. 24:2278–84. DOI: 10.1093/annonc/mdt182. PMID: 23704196.

18. van der Noordaa MEM, van Duijnhoven FH, Straver ME, Groen EJ, Stokkel M, Loo CE, et al. 2018; Major reduction in axillary lymph node dissections after neoadjuvant systemic therapy for node-positive breast cancer by combining PET/CT and the MARI procedure. Ann Surg Oncol. 25:1512–20. DOI: 10.1245/s10434-018-6404-y. PMID: 29511992.

19. Kim WH, Kim HJ, Jung JH, Park HY, Lee J, Kim WW, et al. 2018; Ultrasound-guided restaging and localization of axillary lymph nodes after neoadjuvant chemotherapy for guidance of axillary surgery in breast cancer patients: experience with activated charcoal. Ann Surg Oncol. 25:494–500. DOI: 10.1245/s10434-017-6250-3. PMID: 29134374.

20. Kim WH, Kim HJ, Kim SH, Jung JH, Park HY, Lee J, et al. 2019; Ultrasound-guided dual-localization for axillary nodes before and after neoadjuvant chemotherapy with clip and activated charcoal in breast cancer patients: a feasibility study. BMC Cancer. 859. DOI: 10.1186/s12885-019-6095-1. PMID: 31470821. PMCID: PMC6716853.

21. National Comprehensive Cancer Network. 2021. NCCN clinical practice guidelines in oncology: Breast Cancer (Version 8, 2021). Available from: https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf. cited 2021 Nov 24.
Fig. 2
Ultrasonographic findings of axillary lymph nodes. (A) A normal lymph node presents with uniform cortical thickness. (B) An indeterminate lymph node presents with diffuse cortical thickening or partial hilar effa-cement. (C) Abnormal lymph nodes present with irregular cortical thicken-ing, (D) complete hilar effacement, or (E) internal microcalcifications.

Fig. 3
A receiver-operator curve analysis showing the relationship between the number of abnormal lymph nodes on ultrasonography and pN2 stage.
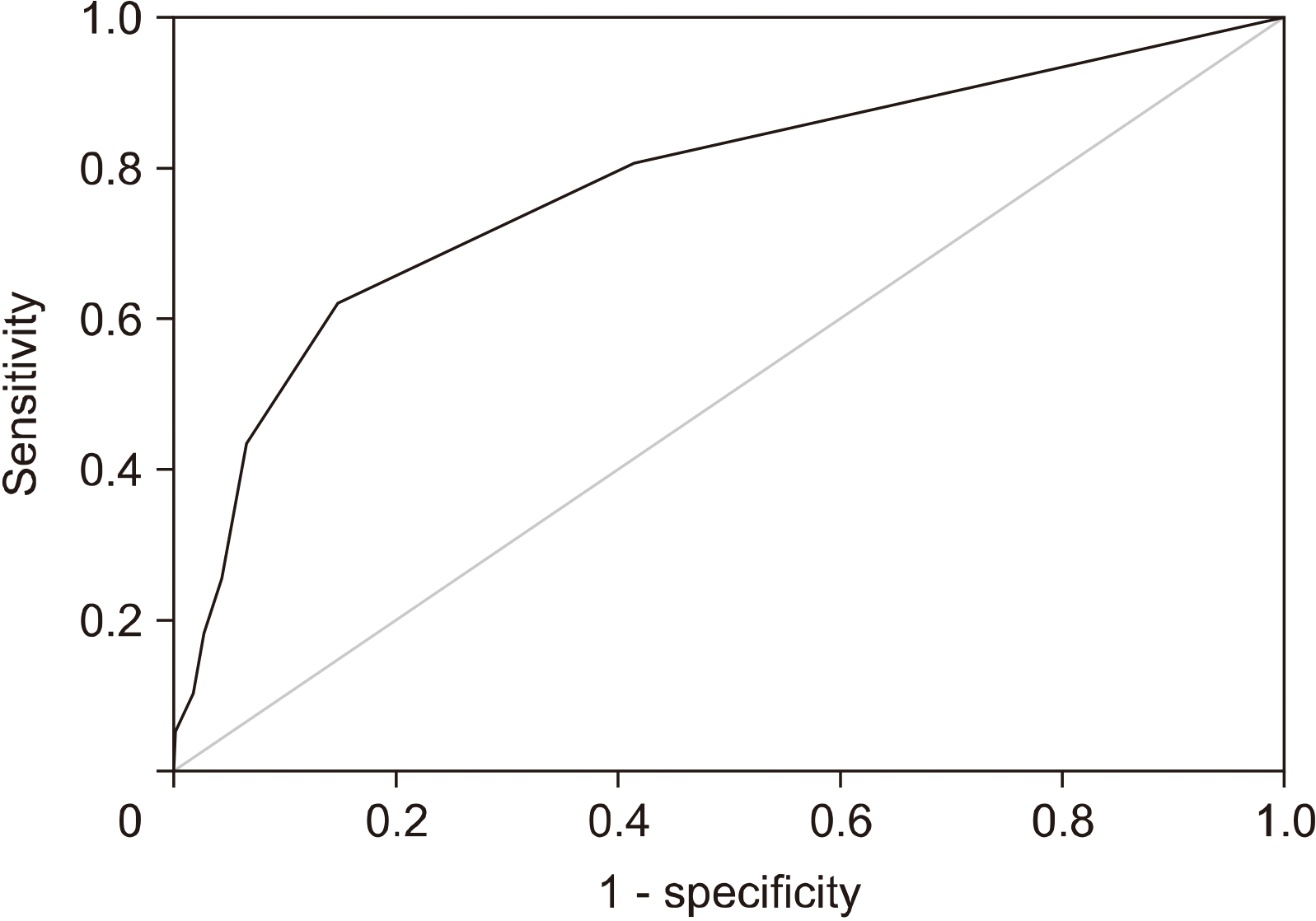
Table 1
Baseline Clinicopathologic Characteristics of the Patients
Table 2
Ultrasonographic Features of the Patients with Abnormal Axillary Lymph Nodes
Table 3
Factors Associated with High Nodal Staging




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download