Abstract
The identification of axillary lymph node metastases in breast cancer patients is a critical factor in determining the stage, deciding the treatment modality, and predicting the prognosis. Over the years, axillary staging has evolved from a radical axillary lymph node dissection to a more conservative sentinel lymph node biopsy. The main goal of axillary imaging techniques is to identify metastatic lymph nodes with optimal accuracy, high enough to initially select patients for an upfront lymph node dissection. Features suggestive of an axillary lymph node metastasis may be seen with a range of imaging modalities. On the other hand, ultrasonography is the method of choice for evaluating the node morphology and allowing image-guided interventions of abnormal nodes. Gray-scale ultrasonography is not perfect on its own. Newer techniques, such as elastography or contrast-enhanced ultrasonography, have shown promise in identifying axillary lymph node metastases. This review provides a comprehensive overview of ultrasonography for an axillary lymph node assessment in breast cancer patients.
Go to : 
유방암 환자의 겨드랑이 림프절 전이 여부 확인은 병기 결정, 치료 방법 선택 그리고 예후 판정에 매우 중요한 인자이다.(1) 과거에는 모든 유방암 환자에서 겨드랑이 림프절 절제술(axillary lymph node dissection)을 통해 림프절 전이 여부를 확인하였으나 림프부종, 운동 제한, 감각 저하 등의 수술 후 합병증으로 인해 선택적인 환자에서 감시 림프절 생검술(sentinel lymph node biopsy)의 개념이 도입되었다.(2, 3) 그리하여 2005년 이후 미국 임상 종양 학회(American Society of Clinical Oncology)는 조기 유방암 환자에서 겨드랑이 림프절 절제술을 대신해 감시 림프절 생검술을 시행할 것을 권고하였고,(4) 최근에는 American College of Surgeons Oncology Group Z0011 trial의 결과에 따라 T1 또는 T2 유방암 환자 중 유방보존술을 시행 받아 수술 후 방사선 치료 예정인 환자에서 감시 림프절 전이가 있더라도 그 개수가 2개 이하인 경우에는 겨드랑이 림프절 절제술을 생략하는 외과의가 늘어나고 있다.(5)
감시 림프절 생검술은 매우 유용한 수술법이지만 정확도와 합병증 측면에서 여전히 제한점이 있다.(6, 7) 따라서 비침습적인 영상학적 검사를 통해 수술 전 유방암 환자의 겨드랑이 림프절 전이 여부를 정확히 예측할 수 있다면 수술 방법 결정에 큰 도움이 될 것이다. 지금까지 보고된 다양한 영상학적 검사 방법들의 겨드랑이 림프절 전이 여부 확인 시 장, 단점과 민감도, 정확도를 요약하면 Table 1과 같다. 이와 같은 여러 영상학적 검사 중 초음파(ultrasonography)는 지금까지 유방암 환자의 겨드랑이 림프절 평가와 영상-유도하 조직검사(image-guided biopsy)에 가장 유용한 방법으로 알려져 있다.(8)
Advantages, Disadvantages, Sensitivity and Specificity of Imaging Modalities for Axillary Lymph Node Staging in Patients with Breast Cancer
이에 저자들은 유방암 환자에서 겨드랑이 림프절 전이 여부 평가를 위한 초음파의 유용성에 관하여 문헌 고찰을 통해 포괄적으로 살펴보고자 한다.
Go to : 
겨드랑이의 해부학적 구조에 대한 지식은 정확한 초음파 시행 및 판독을 위해 필수적이다. 겨드랑이는 흉벽(thoracic wall)의 위쪽 측면(upper aspect)과 상완(upper arm)의 안쪽 측면(medical aspect) 사이에 위치한 피라미드 형태의 공간이다. 겨드랑이 림프절은 소흉근(pectoralis minor muscle)을 기준으로 하외측(infero-lateral)을 level I, 아래(beneath)와 흉근간(interpectoral)을 level II, 상내측(supero-medial)을 level III로 구분한다. 일반적으로 유방으로부터의 림프 배액은 level I에서 II 그리고 III의 순으로 진행된다.(9) 감시림프절은 종양으로부터 제일 먼저 배액되는 림프절로 유방암의 경우 level I, 그 중에서도 외측 유방 군(external mammary group)에서 제일 많이 발견된다.(10)
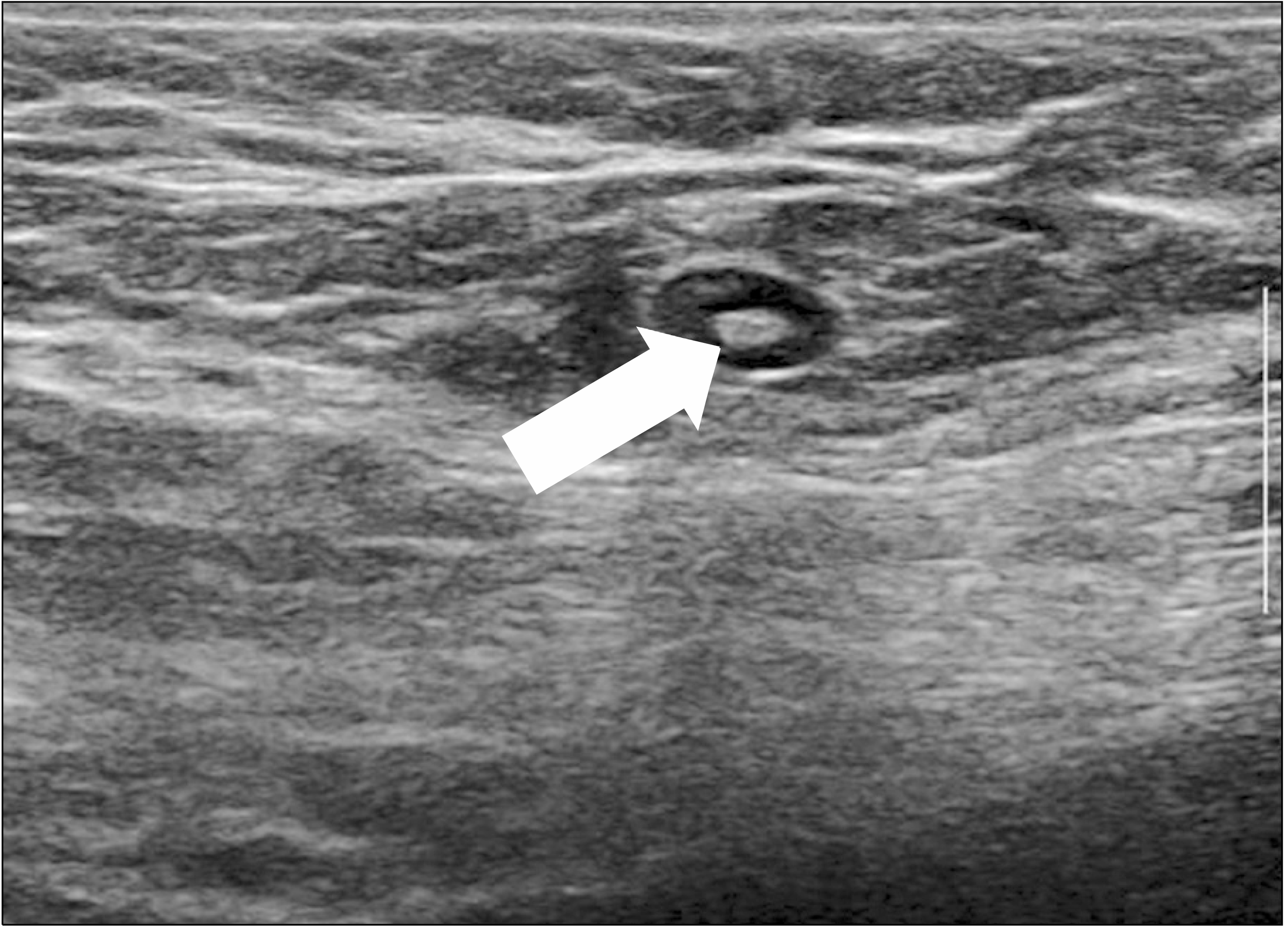
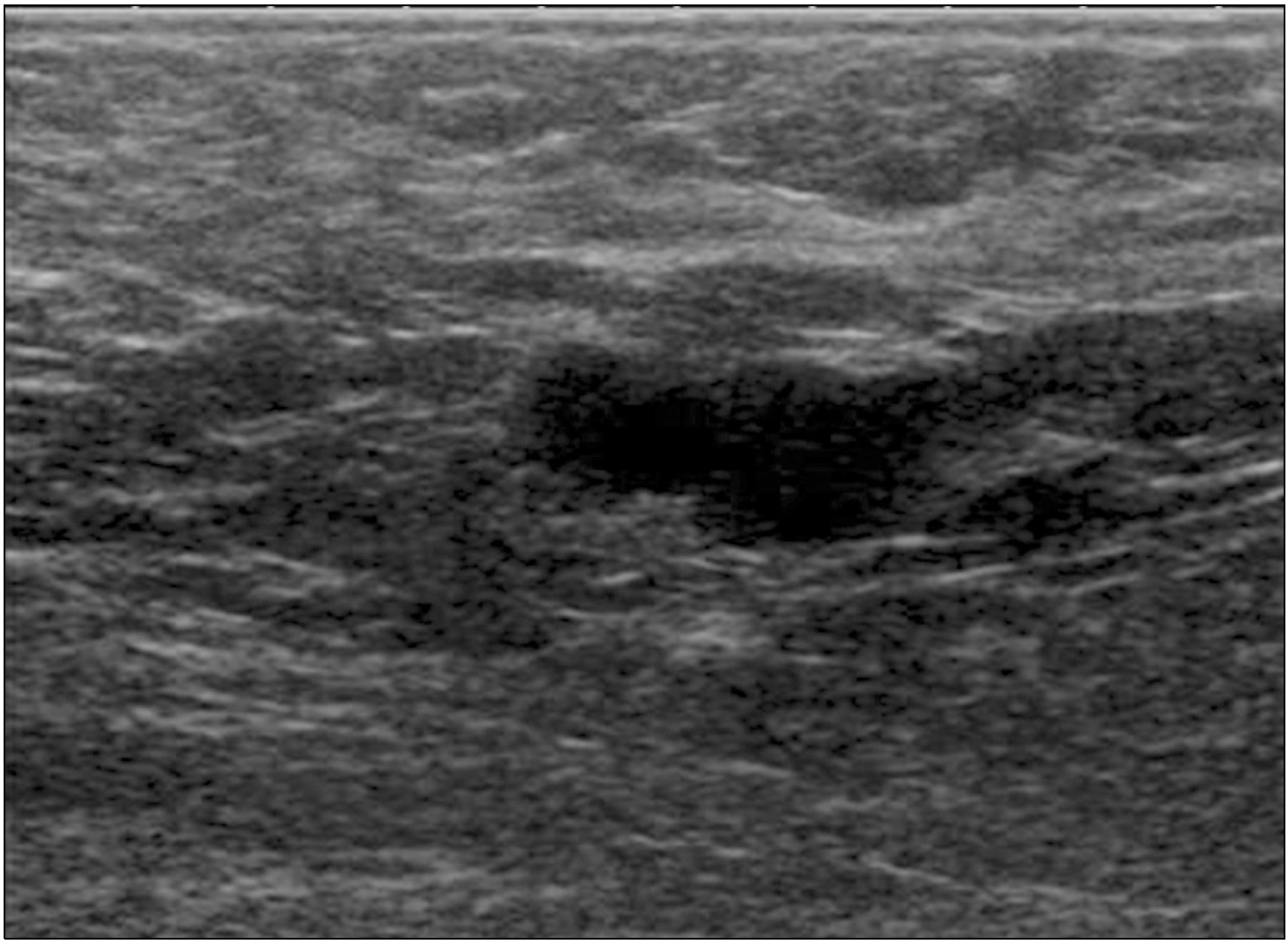
겨드랑이 초음파의 주된 목적은 림프절의 질환 여부를 확인하고 그 정도를 파악하는 것이다. 초음파를 통해 겨드랑이 림프절의 해부학적 위치, 개수, 치수(dimension), 횡단면의 단축/장축비, 모양, 에코 강도, 림프절 문(hilum), 피질(cortex), 혈관분포(vascularity) 등을 평가해야 한다. 전이 여부 확인은 일반적으로 형태학적 기준(morphologic criteria)이 크기보다 더 중요한 것으로 알려져 있다.(8) 정상 림프절은 타원형으로 매끄러운 윤곽(smooth contour)과 저에코의 얇은 피질을 보이며, 고에코의 지방 문(fatty hilum)이 관찰된다(Fig. 1).(11) 반면에 전이 림프절은 불규칙한 경계와 저에코로 3 mm 이상의 비후된 피질을 보인다. 피질의 비후는 다양한 형태로 보일 수 있는데 미만성 비후(diffuse thickening)는 전이 림프절 뿐 만 아니라 반응성 림프절에서도 관찰될 수 있지만 국소적 이거나 편향된(focal or eccentric thickening) 비후는 전이 림프절의 특징적인 소견이다.(12) 거칠고 불분명한 경계는 피막 침윤의 결과이며 에코의 불균질성, 체액 저류(fluid collection)와 석회화는 침범된 림프절의 괴사와 섬유화를 나타낸다. 또한 지방 문이 소실되며 서로 뭉쳐있거나 주변 조직과 고정된 양상을 보이기도 한다(Fig. 2).(13, 14)
회색조 초음파에 부가적으로 컬러 도플러(color Doppler)를 사용하여 전이 림프절 구별에 도움을 받을 수 있다. 컬러 도플러는 혈관 패턴과 혈액 공급의 기능적 특징을 평가할 수 있는데 전이 림프절은 산만하고 혼돈된 패턴의 과형성된 혈관으로 관찰되며, 양성 림프절에서 보여지는 중심부 패턴보다는 주변부에 증가된 혈류를 보이는 특징이 있다.(15)
악성을 시사하는 겨드랑이 림프절의 다양한 형태학적 특징에도 불구하고 고식적 초음파(conventional ultrasonography)는 여전히 제한점이 존재한다.(16) 많은 연구들이 다양한 민감도와 주관적인 결과들을 보여주는데 Sidibé 등(17)은 5 mm 이상의 크기를 전이 기준으로 하였을 때 민감도는 66.1-87.1%, 특이도는 44.1-97.9%이었으며, 형태를 기준으로 하였을 때 민감도는 40.5-92.3%, 특이도는 44.1-97.9%이었다. 체계적 고찰에 따르면 겨드랑이 림프절 전이에 대한 초음파의 민감도는 26-76%, 특이도는 88-98%이었으며,(18) 최근에 발표된 메타 분석에서도 64%의 민감도와 82%의 특이도를 보였다.(19)
초음파가 전이 림프절 진단에 도움이 되는 특징을 알 수 있긴 하지만 초음파 유도 하에 세침흡인세포검사(fine needle aspiration cytology) 또는 침 생검(needle biopsy)과 같은 검사를 함께 시행하면 좀 더 정확한 검사 결과를 얻을 수 있다. 초음파 유도 하 세침흡인세포검사는 신속하고 환자들의 불편함이 적으며 유병률(morbidity)이 낮은 장점이 있는데 25-87%의 민감도와 100%의 특이도를 보인다.(20) 초음파 유도 하 침 생검은 림프절 조직의 많은 부분을 획득할 수 있는 장점이 있고 세침흡인세포검사와 동등한 안전성을 보이며 79-100%의 높은 민감도를 가지고 있다.(19, 21) 특히 미세 전이(micrometastasis)와 고립 종양 세포(isolated tumor cell) 진단에 큰 장점이 있어 초음파 유도 하 침 생검은 향후 세포흡인세포검사를 대체할 것으로 예상된다.
전이 림프절 확인을 위한 겨드랑이 초음파의 낮은 민감도를 극복하기 위해 다양한 인자들을 조합해 만든 점수 체계(scoring system)를 이용한 노모그램이 활용되고 있다. 현재 겨드랑이 림프절 전이 위험도를 예측하기 위한 다양한 온라인 도구가 제공되고 있는데 가장 먼저 소개된 노모그램으로는 Evidencio (www.evidencio. com)가 있다.(22) 이는 피질 두께, 횡경(transverse diameter), 문 상태, 조직학적 등급, 종양 크기, 에스트로겐 수용체 상태의 6가지 인자들로 구성되었으며 AUC (area under the curve) 0.864의 값으로 전이 여부를 판정할 수 있다. 최근에는 Memorial Sloan- Kettering Cancer Center에서 개발한 노모그램도 자유롭게 이용할 수 있는데 연령, 종양의 크기와 위치, 종양의 종류와 등급, 림프혈관 침범 여부, 다발성, 특이 형태, 에스트로겐과 프로게스테론 수용체 여부의 9가지 인자로 AUC 0.76의 값으로 전이 여부를 판정한다.(23) 이러한 노모그램들은 많은 연구를 통해 타당성이 입증되었지만 아직까지는 유방암의 이질성(heterogeneity) 등으로 인해 임상적인 결정을 내릴 수 있는 정확한 절단값(cutoff value)을 제시하지 못하고 있다.(24) 따라서 임상적 활용을 위해서는 향후 유전 표지자(genetic marker)와 같은 좀 더 환자 특이적인 인자들을 반영한 노모그램의 개발이 필요할 것으로 생각한다.
탄성초음파는 비침습적으로 조직의 단단한 정도를 실시간으로 측정하고 영상화할 수 있는 방법으로 악성 병변이 정상 조직 또는 양성 병변보다 더 단단하다는 특성을 이용하여 종양의 단단한 정도(stiffness)와 탄성도(elasticity)를 측정한다.(25) 겨드랑이 림프절 전이 여부를 진단하는데 다양한 진단 정확도를 보이는 고식적 초음파와 함께 탄성초음파를 사용하면 민감도와 특이도를 모두 향상시킬 수 있다.(26) 탄성초음파에서 조직의 탄성도는 압박(stress)을 가해 조직이 이동(displacement)하는 정도에 따라 측정하는데 크게 정적(static)인 방법(strain elastography)과 동적(dynamic)인 방법(shear wave elastography; SWE)으로 나뉜다.
Strain 탄성초음파는 초음파 탐촉자(probe)로 피부 표면에 가벼운 압력을 일정하게 반복적으로 가해 조직 변형을 영상화하는 방식으로 관심 영역(region of interest)내에서 조직의 상대적인 변형률(relative strain)을 계산한다. 변형 정도는 조직의 단단함에 반비례하므로 단단할수록 악성 병변을 시사한다. 간편하게 실시간으로 영상을 얻을 수 있는 장점이 있는 반면에 주관적이고 시행자 의존적인 단점이 있다.(27) Wojcinski 등(28)의 보고에 따르면 겨드랑이 림프절 전이 판정에 있어 회색조 초음파는 민감도 40%, 특이도 97%이었고, strain 탄성초음파는 민감도 60%, 특이도 80%이었으며 두 검사를 종합하였을 때 민감도 73%, 특이도 99%로 우수한 결과를 보였다.
SWE는 점탄성 매체의 한 지점에 초음파를 집속시켜 강한 충격을 줌으로써 발생하는 shear wave를 이용하여 매체 내의 탄성 변형 상태를 영상화하는 것이다. Shear wave의 전파 속도는 조직의 단단한 정도를 반영하여 속도가 빠를수록 악성의 가능성을 시사한다. Strain 탄성초음파에 비해 시행자에게 덜 의존적이며 재현성(reproducibility)이 좋고 정량적 측정(quantitative measurement)이 가능한 장점이 있어 최근에 많이 시행하고 있다.(29) Tourasse 등(30)은 겨드랑이 림프절이 단단할수록 전이 가능성이 높아지며 림프절 피질의 단단함을 측정함으로써 고식적 초음파의 제한점을 보완할 수 있다고 보고하였다. 또한 Youk 등(31)은 SWE가 겨드랑이 림프절 전이 여부를 예측할 수 있으며 특히 E ratio가 전이 림프절의 독립적인 예측 인자라고 보고하였다. 최근에는 SWE로 측정한 원발성 유방암의 mean stiffness가 겨드랑이 림프절 전이의 독립적인 예측인자라는 보고도 있어,(32) 향후 이에 관한 더 많은 연구가 이루어질 것으로 기대한다.
고식적 회색조 초음파의 근본적인 문제는 겨드랑이 림프절 전이 여부 확인을 위해 감시림프절을 찾아야만 한다는 것이다. 감시림프절은 환자마다 깊이와 위치가 다양해 회색조 초음파로 확인하지 못하는 경우가 있으며 찾더라도 비감시림프절과의 감별이 쉽지 않은 단점이 있다.(33) 이러한 문제들을 해결하기 위해 조영 증강 초음파가 소개되었다.
조영 증강 초음파는 유륜 주위에 microbubble suspension을 진피 내(intradermally)로 주입 후 시행하며 유방 조직의 림프관으로 빠르게 이동하는 microbubble을 확인함으로써 주입 후 수 초 이내에 감시림프절을 찾을 수 있다. 조영 증강 초음파는 확인된 감시림프절을 대상으로 침 생검을 시행해 수술 시 불필요한 감시림프절 생검술의 시행을 줄일 수 있고, 또한 림프절 내의 종양 축적(deposit)을 확인함으로써 전이 정도(extent)를 예측할 수 있다는 장점이 있다.(34)
654명의 유방암 환자들을 대상으로 겨드랑이 조영 증강 초음파를 적용한 대규모 연구에서 605명(93%)의 환자에서 감시림프절을 확인할 수 있었으며 그 중 85%에서 침 생검을 성공적으로 시행하였고 23%의 환자에서 전이를 확인하였다.(35) 최근에 발표된 체계적 고찰에서도 유방암 환자에서 조영 증강 초음파를 이용한 감시림프절 조직 검사는 54%의 민감도와 100%의 특이도를 보여 향후 기존의 방사성 동위원소(radioisotope)와 생체 염료(vital dye)를 이용한 감시림프절 생검술을 대체할 수 있을 것으로 보고하였다.(36) 또한 조영 증강 초음파는 재현할 수 있는 영상 검사로 선행항암화학요법(neoadjuvant chemotherapy)을 시행 받는 환자에서 치료 후 반응 평가 시 유용하게 사용 할 수 있다는 장점이있다.(13)
다양한 영상학적 기법의 발전에 힘입어 유방암 환자의 겨드랑이 림프절 병기 결정을 위한 술식에도 많은 변화가 있을 것이다. 향후 더 많은 연구를 통해 타당성이 입증된다면 현재까지 통용되고 있는 감시림프절 생검술은 조영 증강 초음파를 이용한 초음파 유도 하 조직검사로 대체될 수 있을 것이다. 더 나아가 조기 유방암 환자에서 겨드랑이 초음파를 확인 후 특이 소견이 없을 때 감시림프절 생검술을 시행하는 군과 시행하지 않는 군의 예후를 비교한 임상 시험(Sentinel lymph node versus Observation after axillary ultrasound; SOUND trial)의 결과가 나온다면 초음파의 역할이 더욱 증대될 수 있다.(37) 외과 의사는 다학제 팀(multidisciplinary team)의 일원으로써 덜 침습적이면서도 정확한 진단 및 치료를 추구하는 정밀 의료(precision medicine)에 발 맞추기 위해 갈수록 진보하는 영상 기법에 적응하고 이를 실제 임상에 적용하려는 부단한 노력이 필요하다.
Go to : 
유방암 환자에서 겨드랑이 림프절 병기 결정을 위해 시행하는 수술의 범위를 줄이기 위한 연구가 많이 이루어지고 있다. 초음파는 현재까지 유방암 환자의 겨드랑이 림프절 전이 여부 평가에 가장 널리 사용되는 영상 기법이지만 신뢰할만한 정확도를 보이지는 못하고 있다. 향후 조영 증강 초음파 유도 하 조직검사 등의 더욱 진보된 기술을 적용한다면 보다 정확한 수술 전 겨드랑이 림프절 병기 결정을 할 수 있을 것이다. 따라서 외과의는 유방암 환자에게 정확하고 적절한 진료 서비스를 제공하기 위해 발전하는 영상 기법의 적용을 위한 많은 관심과 노력이 필요할 것으로 생각한다.
Go to : 
REFERENCES
Fisher B., Bauer M., Wickerham DL., Redmond CK., Fisher ER., Cruz AB, et al. 1983. Relation of number of positive axillary nodes to the prognosis of patients with primary breast cancer. An NSABP update. Cancer. 52:1551–7. DOI: 10.1002/1097-0142(19831101)52:9<1551::AID-CNCR2820520902>3.0.CO;2-3.

Carlson GW., Wood WC. 2011. Management of axillary lymph node metastasis in breast cancer: making progress. JAMA. 305:606–7. DOI: 10.1001/jama.2011.131. PMID: 21304087.

Harlow SP., Krag DN., Julian TB., Ashikaga T., Weaver DL., Feldman SA, et al. 2005. Prerandomization surgical training for the national surgical adjuvant breast and bowel project (NSABP) B-32 trial: a randomized phase III clinical trial to compare sentinel node resection to conventional axillary dissection in clinically node-negative breast cancer. Ann Surg. 241:48–54. DOI: 10.1097/01.sla.0000149429.39656.94. PMID: 15621990. PMCID: PMC1356845.

Lyman GH., Giuliano AE., Somerfield MR., Benson AB 3rd., Bodurka DC., Burstein HJ, et al. 2005. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer. J Clin Oncol. 23:7703–20. DOI: 10.1200/JCO.2005.08.001. PMID: 16157938.

Humphrey KL., Saksena MA., Freer PE., Smith BL., Rafferty EA. 2014. To do or not to do: axillary nodal evaluation after ACOSOG Z0011 trial. Radiographics. 34:1807–16. DOI: 10.1148/rg.347130141. PMID: 25384280.

Kim T., Giuliano AE., Lyman GH. 2006. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma: a metaanalysis. Cancer. 106:4–16. DOI: 10.1002/cncr.21568. PMID: 16329134.

Barthelmes L., Goyal A., Newcombe RG., McNeill F., Mansel RE. NEW START and ALMANAC Study Groups. 2010. Adverse reactions to patent blue V dye- The NEW START and ALMANAC experience. Eur J Surg Oncol. 36:399–403. DOI: 10.1016/j.ejso.2009.10.007. PMID: 19939618.

Marino MA., Avendano D., Zapata P., Riedl CC., Pinker K. 2020. Lymph node imaging in patients with primary breast cancer: concurrent diagnostic tools. Oncologist. 25:e231–42. DOI: 10.1634/theoncologist.2019-0427. PMID: 32043792. PMCID: PMC7011661.

Manca G., Rubello D., Tardelli E., Giammarile F., Mazzarri S., Boni G, et al. 2016. Sentinel lymph node biopsy in breast cancer: indications, contraindications, and controversies. Clin Nucl Med. 41:126–33. DOI: 10.1097/RLU.0000000000000985. PMID: 26447368.
Giuliano AE., Kirgan DM., Guenther JM., Morton DL. 1994. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg. 220:391–8. discussion 398-401. DOI: 10.1097/00000658-199409000-00015. PMID: 8092905. PMCID: PMC1234400.

Bedi DG., Krishnamurthy R., Krishnamurthy S., Edeiken BS., Le-Petross H., Fornage BD, et al. 2008. Cortical morphologic features of axillary lymph nodes as a predictor of metastasis in breast cancer: in vitro sonographic study. AJR Am J Roentgenol. 191:646–52. DOI: 10.2214/AJR.07.2460. PMID: 18716089.

Ecanow JS., Abe H., Newstead GM., Ecanow DB., Jeske JM. 2013. Axillary staging of breast cancer: what the radiologist should know. Radiographics. 33:1589–612. DOI: 10.1148/rg.336125060. PMID: 24108553.

Lowes S., Leaver A., Cox K., Satchithananda K., Cosgrove D., Lim A. 2018. Evolving imaging techniques for staging axillary lymph nodes in breast cancer. Clin Radiol. 73:396–409. DOI: 10.1016/j.crad.2018.01.003. PMID: 29439780.

Cho N., Moon WK., Han W., Park IA., Cho J., Noh DY. 2009. Preoperative sonographic classification of axillary lymph nodes in patients with breast cancer: node-to-node correlation with surgical histology and sentinel node biopsy results. AJR Am J Roentgenol. 193:1731–7. DOI: 10.2214/AJR.09.3122. PMID: 19933672.

Yang WT., Chang J., Metreweli C. 2000. Patients with breast cancer: differences in color Doppler flow and gray-scale US features of benign and malignant axillary lymph nodes. Radiology. 215:568–73. DOI: 10.1148/radiology.215.2.r00ap20568. PMID: 10796941.

Lee B., Lim AK., Krell J., Satchithananda K., Coombes RC., Lewis JS, et al. 2013. The efficacy of axillary ultrasound in the detection of nodal metastasis in breast cancer. AJR Am J Roentgenol. 200:W314–20. DOI: 10.2214/AJR.12.9032. PMID: 23436877.

Sidibé S., Coulibaly A., Traoré S., Touré M., Traoré I. 2007. [Role of ultrasonography in the diagnosis of axillary lymph node metastases in breast cancer: a systematic review]. Mali Med. 22:9–13. French. PMID: 19434975.
Alvarez S., Añorbe E., Alcorta P., López F., Alonso I., Cortés J. 2006. Role of sonography in the diagnosis of axillary lymph node metastases in breast cancer: a systematic review. AJR Am J Roentgenol. 186:1342–8. DOI: 10.2214/AJR.05.0936. PMID: 16632729.

Houssami N., Ciatto S., Turner RM., Cody HS 3rd., Macaskill P. 2011. Preoperative ultrasound-guided needle biopsy of axillary nodes in invasive breast cancer: meta-analysis of its accuracy and utility in staging the axilla. Ann Surg. 254:243–51. DOI: 10.1097/SLA.0b013e31821f1564. PMID: 21597359.
Rao R., Lilley L., Andrews V., Radford L., Ulissey M. 2009. Axillary staging by percutaneous biopsy: sensitivity of fine-needle aspiration versus core needle biopsy. Ann Surg Oncol. 16:1170–5. DOI: 10.1245/s10434-009-0421-9. PMID: 19263171.

Gruber I., Hahn M., Fehm T., Hann von Weyhern C., Stäbler A., Winckelmann A, et al. 2012. Relevance and methods of interventional breast sonography in preoperative axillary lymph node staging. Ultraschall Med. 33:337–43. DOI: 10.1055/s-0031-1273317. PMID: 21618166.

Qiu SQ., Zeng HC., Zhang F., Chen C., Huang WH., Pleijhuis RG, et al. 2016. A nomogram to predict the probability of axillary lymph node metastasis in early breast cancer patients with positive axillary ultrasound. Sci Rep. 6:21196. DOI: 10.1038/srep21196. PMID: 26875677. PMCID: PMC4753408.

Bevilacqua JL., Kattan MW., Fey JV., Cody HS 3rd., Borgen PI., Van Zee KJ. 2007. Doctor, what are my chances of having a positive sentinel node? A validated nomogram for risk estimation. J Clin Oncol. 25:3670–9. DOI: 10.1200/JCO.2006.08.8013. PMID: 17664461.

Azmil A., Bansal GJ. 2018. Can nomograms predict preoperative axillary lymph node metastasis in patients with breast cancer to guide second look ultrasonography? J Ultrasound Med. 37:1447–53. DOI: 10.1002/jum.14485. PMID: 29152824.

Faruk T., Islam MK., Arefin S., Haq MZ. 2015. The journey of elastography: background, current status, and future possibilities in breast cancer diagnosis. Clin Breast Cancer. 15:313–24. DOI: 10.1016/j.clbc.2015.01.002. PMID: 25858446.

Chang W., Jia W., Shi J., Yuan C., Zhang Y., Chen M. 2018. Role of elastography in axillary examination of patients with breast cancer. J Ultrasound Med. 37:699–707. DOI: 10.1002/jum.14538. PMID: 29344976.

Lee SH., Chang JM., Cho N., Koo HR., Yi A., Kim SJ, et al. 2014. Practice guideline for the performance of breast ultrasound elastography. Ultrasonography. 33:3–10. DOI: 10.14366/usg.13012. PMID: 24936489. PMCID: PMC4058975.

Wojcinski S., Dupont J., Schmidt W., Cassel M., Hillemanns P. 2012. Real-time ultrasound elastography in 180 axillary lymph nodes: elasticity distribution in healthy lymph nodes and prediction of breast cancer metastases. BMC Med Imaging. 12:35. DOI: 10.1186/1471-2342-12-35. PMID: 23253859. PMCID: PMC3536617.

Youk JH., Son EJ., Gweon HM., Kim H., Park YJ., Kim JA. 2014. Comparison of strain and shear wave elastography for the differentiation of benign from malignant breast lesions, combined with B-mode ultrasonography: qualitative and quantitative assessments. Ultrasound Med Biol. 40:2336–44. DOI: 10.1016/j.ultrasmedbio.2014.05.020. PMID: 25130444.

Tourasse C., Dénier JF., Awada A., Gratadour AC., Nessah-Bousquet K., Gay J. 2012. Elastography in the assessment of sentinel lymph nodes prior to dissection. Eur J Radiol. 81:3154–9. DOI: 10.1016/j.ejrad.2012.04.031. PMID: 22656671.

Youk JH., Son EJ., Kim JA., Gweon HM. 2017. Pre-operative evaluation of axillary lymph node status in patients with suspected breast cancer using shear wave elastography. Ultrasound Med Biol. 43:1581–6. DOI: 10.1016/j.ultrasmedbio.2017.03.016. PMID: 28511961.

Evans A., Rauchhaus P., Whelehan P., Thomson K., Purdie CA., Jordan LB, et al. 2014. Does shear wave ultrasound independently predict axillary lymph node metastasis in women with invasive breast cancer? Breast Cancer Res Treat. 143:153–7. DOI: 10.1007/s10549-013-2747-z. PMID: 24305976. PMCID: PMC4363519.

Sever A., Jones S., Cox K., Weeks J., Mills P., Jones P. 2009. Preoperative localization of sentinel lymph nodes using intradermal microbubbles and contrast-enhanced ultrasonography in patients with breast cancer. Br J Surg. 96:1295–9. DOI: 10.1002/bjs.6725. PMID: 19847869.

Goldberg BB., Merton DA., Liu JB., Thakur M., Murphy GF., Needleman L, et al. 2004. Sentinel lymph nodes in a swine model with melanoma: contrast-enhanced lymphatic US. Radiology. 230:727–34. DOI: 10.1148/radiol.2303021440. PMID: 14990839.

Cox K., Weeks J., Mills P., Chalmers R., Devalia H., Fish D, et al. 2016. Contrast-enhanced ultrasound biopsy of sentinel lymph nodes in patients with breast cancer: implications for axillary metastases and conservation. Ann Surg Oncol. 23:58–64. DOI: 10.1245/s10434-015-4606-0. PMID: 25990967.

Nielsen Moody A., Bull J., Culpan AM., Munyombwe T., Sharma N., Whitaker M, et al. 2017. Preoperative sentinel lymph node identification, biopsy and localisation using contrast enhanced ultrasound (CEUS) in patients with breast cancer: a systematic review and meta-analysis. Clin Radiol. 72:959–71. DOI: 10.1016/j.crad.2017.06.121. PMID: 28774472.

Gentilini O., Veronesi U. 2012. Abandoning sentinel lymph node biopsy in early breast cancer? A new trial in progress at the European Institute of Oncology of Milan (SOUND: Sentinel node vs Observation after axillary UltraSouND). Breast. 21:678–81. DOI: 10.1016/j.breast.2012.06.013. PMID: 22835916.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download