Abstract
Purpose
Upstaging to invasive cancer (IC) is often found after surgery in those patients diagnosed with ductal carcinoma in situ (DCIS) and who underwent preoperative needle biopsy. This may change the post-surgical plans that include the re-operation, chemotherapy, and/or radiotherapy. Yet, there are no clinically available factors to predict IC in preoperatively diagnosed DCIS patients. This study evaluated the clinical and pathological predictive risk factors for upgrading DCIS to IC.
Methods
This study retrospectively evaluated those patients who were diagnosed with DCIS preoperatively, and this diagnosis was followed by performing breast surgery between Jan 2005 and June 2018. Clinico-pathological factors were collected for the analysis between the pure DCIS group and the IC group.
Results
Of the 431 patients included in the study, 34 (7.9%) were upstaged to IC after surgery, and 397 (92.1%) were diagnosed as having pure DCIS. The nuclear grade was the sole predictor of upstaging to IC on the analysis of the clinico-pathological factors (odds ratio [OR] = 2.39, 95% confidence interval [95% CI] = 1.05–5.42, P = 0.038 on the univariate analysis; aOR = 2.86, 95% CI = 1.14–7.14, P = 0.025 on the multivariate analysis). The mass’s size and characteristics, as determined by sonography, were not predictive of IC.
Conclusion
The sonographic findings were not significant factors for predicting IC in preoperative DCIS patients. A high nuclear grade was the only statistically significant factor associated with IC. Considering the variability of the gauge of biopsy needles or the method for needle biopsy, large-scale prospective studies that control these variables may well reveal available predictive factors of IC in patients with DCIS.
유방암은 전세계적으로 여성암 중에 가장 흔한 암이며,(1) 이에 따른 건강검진으로 유방 촬영술(mammography)이 시행되고 있고, 치밀 유방이거나 고위험군 여성에서는 유방 초음파(ultrasonography), 자기공명영상(magnetic resonance imaging; MRI) 등이 추가로 시행되어져 왔다. 특히 아시아 여성에서는 치밀 유방의 빈도가 높아 초음파 검사의 중요성은 서구에 비해 높다고 할 수 있다.(2)
유방암의 병리학적 진단을 위해서는 중심부 바늘 생검(Core needle biopsy; CNB) 또는 진공 흡인 보조 생검(vacuum-assisted breast biopsy; VABB)이 많이 사용되는데, 이러한 검사법은 관상피내암(ductal carcinoma in situ; DCIS) 내의 침윤암(invasive cancer; IC)의 유무를 완벽히 판별할 수 없는 단점이 있다.(3-5) 관상피내암은 유관 내에만 한정되어 암세포가 있는 것으로, 주변 조직을 침윤하지 않는 특징이 있어 침윤암과는 치료 및 예후에 차이가 있다. 수술 전 관상피내암으로 진단된 환자에서 수술 후 조직에서 침윤암이 발견되는 경우에는, 추가적인 감시림프절 생검술 및 방사선 치료, 보조항암화학요법 등에 의한 삶의 질 저하 및 유방 재건술 동시 시행한 환자의 경우 재건 부위의 손상이 발생할 수 있다.(6)
수술 전 관상피내암이 진단된 환자에서 수술 후 침윤암이 발견될 수 있는 임상 병리적 예측 인자들에 관한 연구들이 있었으나(연령, 유방촬영 BI-RADS [breast imaging-reporting and data system], 촉진가능성, 유두 분비물, 검체 개수, 유방촬영상 병변의 최대 크기, 초음파검사상 병변의 최대 크기, 초음파상 mass 형성 여부(sonographic mass), 고등급 DCIS, 액와림프절 침윤, 다중심 병변, 반대쪽 병변, MRI상 종괴 유사 병변, MRI상 유두유륜복합체 침윤, ADC area, MRI상 조영증강패턴, HER2 과발현 등), 결과들이 일치하지 않아 현재 정립된 결론이 없다.(7-12) 따라서 이 연구에서는 이러한 인자들에 대한 연구를 본 기관의 환자 정보를 이용하여 분석하였다.
2005년 1월부터 2018년 6월까지 성균관대학교 강북삼성병원에서 유방암 수술을 받은 환자의 수술 전 병리결과에서 관상피내암으로 진단된 439명의 환자를 대상으로 후향적 분석을 시행하였다. 임상-병리학적 종합 데이터가 없는 환자들은 제외되었고, 결과적으로 431명의 환자가 후향적 검토와 분석에 적합한 대상이 되었다. 임상정보는 연령, 영상소견, 조직검사 방법, 종양 등급, 수술 후 조직검사 결과, 치료 정보(수술, 방사선치료, 항암치료), 에스트로겐 수용체(estrogen receptor; ER), 프로게스테론 수용체(progesterone receptor; PR), 인간 표피 성장인자 수용체 2 (human epithelial growth factor receptor 2; HER-2) 발현상태를 포함한 의무기록에서 얻었다. 이 연구는 2017년 3월 3일 성균관대학교 강북삼성병원 연구윤리심의위원회(Institutional Review Board)에 의해 승인되었다(KBSMC 2017-03-018). 연구윤리심의위원회는 국가생명윤리심의위원회의 2017년 National Statement on Ethical Conduct in Human Research에 따라 이 프로젝트가 저위험도 또는 무시할 수 있는 위험도 범주로 포함되어 환자들로부터의 서면동의서는 받지 않았다.
초음파는 중심부 바늘 생검시 고해상도 5-12 MHz 선형 배열 탐측자(linear array transducer)를 이용하여 시행되었다(Aixplorer Ultimate, Supersonic, Weston, FL, USA). 진찰 시, 환자의 유방은 양팔을 머리 위로 올린 상태에서 횡면과 방사면으로 검사되었다. 표준 유방촬영 유닛(Mammomat 3000, Nova Siemens, Pennsylvania, PA, USA)을 이용하여 양쪽 유방촬영상을 얻었다. 초음파에서 확인된 검체는 16 또는 18 게이지 바늘을 이용하여 초음파 유도 중심부 바늘 생검을 통상 4-6회 시행하여 획득하였고, 유방촬영상에서만 발견된 병변은 입체 정위 생검 또는 바늘 국소화(needle localization)가 동반된 절제생검을 통해 얻어졌다. Automated gun과 14 게이지 Starcut biopsy needle (22-mm-throw)을 사용했다(TSK Laboratory Japan, Tochigi-Shi, Japan).
모든 환자의 표본들은 영상 유도 바늘 생검(중심부 바늘 생검 또는 진공흡인 보조 생검) 또는 10% 포름알데히드 용액에 고정 후 파라핀 처리된 수술 검체로부터 얻어졌다. 검체의 절편은 종양의 크기, 조직학적 유형, 핵분화도, 절제면 상태, 전이된 림프절의 존재 유무를 확인하기 위해 H&E (hematoxylin and eosin)에 의해 염색되었다. 면역조직화학(immunohistochemical; IHC) 분석은 숙련된 유방 조직병리학자에 의해 ER, PR, HER-2의 상태와 Ki-67을 평가하기 위해 시행되었다.
모든 통계 분석은 R version 3.3.2를 이용하였다.(13, 14) 관상피내암 환자와 침윤암 환자에서 범주형 변수는 n (%)로 나타내었고, Fisher’s exact test 또는 Chi-square test를 이용하여 분석하였다. 연속형 변수는 mean ± standard deviation으로 나타내었고, Student’s t-test가 이용하여 검정하였다. 단변수와 다변수 분석을 위해 로지스틱 회귀분석을 사용하여 Odds ratio (95% CI)를 추정하였다. 모든 검정은 양측 검정, P-value < 0.05 일 때 유의성이 있는 것으로 판단하였다.
431명 환자들의 특성이 Table 1에 나타나 있다. 이러한 특성은 관상피내암을 진단 받은 환자군과 침윤암을 포함하는 환자군에서 비교되었다. 수술 전 관상피내암을 진단 받은 환자 431명 중에서 92.1%인 397명은 수술 후 조직검사에서 관상피내암으로 진단되었고, 7.9%인 34명의 환자들은 관상피내암과 침윤암을 가지고 있다고 진단되었다. 대상 환자의 특성은 관상피내암 환자군과 관상피내암과 침윤암을 같이 가진 환자군 사이에서 비교되었다. BI- RADS category (P = 0.028), 조직검사방법(needle biopsy or excisional biopsy, P = 0.001), 수술유형(breast- conserving surgery or total mastectomy, P = 0.009), 병리학적 관상피내암의 크기(≤ 2 cm, > 2 cm, or no residual DCIS, P = 0.010)가 두 환자군에서 유의미하게 차이가 있었다.
수술 전 바늘 생검(needle biopsy)을 통해 관상피내암을 진단 받은 282명의 환자들 중 절제생검(excisional biopsy)을 통해 수술 전 관상피내암을 진단 받은 149명의 환자들은 제외되었다. 수술 중에 획득된 검체에서 침윤암을 예측할 수 있는 임상 병리학적 예측인자를 평가하였다. 단변수분석과 다변수분석에서 핵분화도(OR = 2.39, 95% CI; 1.05-5.42, P = 0.038 in univariate analysis; aOR = 2.86, 95% CI; 1.14-7.14, P = 0.025 in multivariate analysis)만이 유일하게 침윤암의 유의미한 예측 인자였다(Table 2). 연령, 초음파상 종양의 크기, 초음파 소견(mass vs. non-mass) (Fig. 1), 유방촬영상 소견, 다병소성(multifocality), ER, PR, HER-2, Ki-67, 수술의 유형은 침윤암의 예측인자로서 유의미하지 않았다.
이 연구는 수술 전에 관상피내암으로 진단된 환자에게서 수술 후에 침윤성 유방암으로 변경 될 수 있는 예측인자에 대해서 분석하였다. 이전의 연구에서는 나이, 체질량지수, 유방촬영술상의 의심 소견, 촉지되는 소견, 유두 분비물, 바늘 생검상 채취된 조직의 개수, 석회질의 범위, 종양의 크기, 핵등급, 액와 림파선 전이, 다중심성 병소, 반대측 유방의 병소, HER-2 과발현 등이 위험인자라고 보고하였다.(3,6-12,15-29) 하지만 이러한 연구들은 대부분 소규모를 대상자로 한 후향적 연구였으며, 결과들이 일치하지 않아 현재 임상적으로 이용할 수 있는 예측인자는 없다. 따라서 비교적 많은 수를 대상으로 하는 이 연구를 통해 이러한 한계점을 극복하고자 하였다.
현재 예측인자로서의 나이에 대한 가치는 불분명하다. Yen 등(15)은 55세 이하의 나이가 관상피내암에서 침윤암으로 병기상승의 예측인자라고 하였다. 하지만 Nori 등(11)은 반대의 결과를 보고하였는데, 55세이상의 나이가 오히려 침윤암의 예측인자라고 하였다. 이러한 상반된 결과 및 다른 대부분의 연구들에서 나이를 유의한 예측인자로 보고하지 않은 점을 종합했을 때, 나이는 예측인자로 보기 힘들며 이것은 우리의 연구 결과와도 일치한다.
핵등급의 예측적 가치에 대해서도 다양한 결과들이 보였었다. 본 연구에서 핵등급은 침윤암을 예측하는 유일한 병리학적 인자였다(OR = 2.39, CI = 1.05-5.42, P = 0.038 in univariate analysis; OR = 2.86, CI = 1.14-7.14, P = 0.025 in multivariate analysis). Guillot 등(6)은 고등급의 핵등급을 가진 관상피내암은 수술 후 침윤암으로 병기상승이 될 가능성이 높다고 하였다. Brennan 등(21)도 고등급의 관상피내암은 수술 전 검사에서 침윤암이 관상피내암으로 저평가되는 위험 요소라고 하였다. 그러나 다른 연구들에서는 핵등급을 예측인자로서의 가치가 없다고 분석하였다.(3, 15, 30) 이러한 일관되지 않은 결과의 이유는 암 미세침윤(microinvasion)에 대한 병리 의사간 해석의 다양성 때문일 가능성이 크다. 따라서 이론적 암의 진화과정을 고려했을 때 핵등급의 예측가치는 있어 보이며, 앞으로의 연구에서 면포상 괴사(comedo-necrosis)와 같은 인자들과 함께 고려하여 분석 한다면 더 확실한 결과를 알 수 있을 것이다.
큰 종양의 크기는 침윤암으로의 병기상승의 예측인자로 알려져 왔다. 유방촬영술상의 병변의 크기가 예측인자로 작용한다는 연구도 있었고,(10, 24) Lee 등(31)은 초음파상 종양의 크기가 20 mm이상일 때 침윤암일 가능성이 높다고 하였다. Park 등(10)은 32 mm이상의 초음파상 종양의 크기의 관상피내암이 수술 후 침윤암으로 병기 상승의 위험성이 있다고 하였고, MRI와 유방 촬영술상의 크기도 관련성이 있다고 보고하였다.(9) 이러한 이론적 배경은 조직검사 대상이 되는 범위가 클수록 바늘 검사의 채취량이 모든 범위를 반영하기 힘들어져, 결국 침윤성 암세포를 채취하지 않게 될 개연성이 높아진다는 것이다. 하지만 우리의 연구에서는 초음파상 종양의 크기 및 침윤암의 위험성은 통계적으로 유의한 연관성을 보이지 않았다. 이처럼 다른 결과를 보이는 이유는, 생검 시 사용하는 바늘 종류 및 채취 횟수의 차이, 술자 및 병리 의사의 숙련도, 불충분한 연구 대상자 수가 원인일 수 있을 것이다. 본 연구 결과와는 다르게 초음파상의 mass 형성 여부(sonographic mass)와 높은BI-RADS 범주는 기존연구에서 침윤암의 유의미한 예측인자로 보고되고 있고, 초음파에서 병변의 여러 특징들(shape, orientation, margin, Echo pattern, posterior feature, calcification)은 병리학적 악성 병변(malignant lesion)을 예측하는 인자로서 평가의 대상이 되고 있으나, 일관된 결과를 보이지는 않는다.(32-34) 이는 초음파의 판독이 보이는 형태학적 특징을 기반으로 이루어지기 때문에 병변의 병리를 정확하게 반영하는 데 한계점이 있기 때문으로 생각된다.(34) 형태학적 특징을 기반으로 하는 기존 초음파의 판독에 보조적인 정보를 제공하여 위양성율을 줄일 수 있는 횡탄성 초음파의 사용은 이러한 초음파의 악성병변 예측에 대한 진단적 신뢰성을 높일 수 있는 중요한 진단도구로서 주목받고 있다.
최근 유방암의 탄성초음파(elastography)의 임상적 유용성에 대한 연구가 보고되고 있다. Youn 등(35)은 많은 고형 병변들을 양성으로 판정하여 낮은 특이도(specificity)를 갖는 유방초음파의 제한점을 극복하는데 탄성초음파(elastography)가 사용되고 있으며, 양성과 악성 병변의 구별 뿐만 아니라 선행항암화학요법의 반응 예측, 유방암 환자의 예후 예측에 임상적으로 매우 유용하다고 하였다. Vinnicombe 등(36)은 정량적 전단파 탄성초음파(quantitative SWE)에서 양성으로 분류된 유방암이 더 종양(tumor)의 크기가 작고(≤ 10 mm), 저등급이거나 순수 관상피내암일 가능성이 높다고 하였다. 또한 전단파 탄성초음파상 종양의 단단한 정도(stiffness)는 초음파 유도 중심 바늘 생검으로 관상피내암이 진단된 환자에서 잠재적 침윤(occult invasion)의 예측인자로 보고되고 있다는 점에서,(37) 탄성초음파의 악성과 양성 감별을 위한 임상적 유용성에 더하여 추후 침윤암의 예측인자로서의 추가적인 연구들이 더욱 활발히 진행되어야 한다고 생각된다.
이 연구의 한계점은, 후향적 연구로서 생검을 시행한 술자가 다수여서 숙련도가 일치하지 않는다는 것이다. 또한 진단력에 차이가 있을 수 있는 중심부 바늘 생검과 진공 흡인 보조 생검간의 바늘 굵기 차이나 생검 횟수의 차이가 반영이 되지 않았다는 점이다. 그러나 본 연구는 상대적으로 이전 연구에 비해 많은 대상자를 분석하여, 불일치 된 결과에 대한 종합적인 결론 형성에 기여할 것으로 생각된다.
본 연구는 수술 전 조직검사에서 관상피내암이 진단되었을 때 고등급의 핵등급만이 유일한 수술 후 침윤암으로의 병기상승을 예측할 수 인자라는 것이다. 또한 이전의 연구들에서 관련이 있는 인자였던 초음파 상의 종양의 크기는 관련이 없었다는 점에서 볼 때, 술자의 숙련도나 바늘 생검의 종류 및 방법에 따라 많은 차이가 있을 수 있다는 가정을 해 볼 수 있다. 앞으로의 더 많은 연구를 통해 침윤암으로의 병기 상승의 예측인자를 파악하여, 2차 수술을 피하고 방사선 치료 및 항암화학요법의 예측하지 못했던 시행으로 인한 유방 재건술의 합병증의 빈도를 낮추기 위한 수술 전 계획 수립을 효과적으로 할 수 있을 것이다.
REFERENCES
World Cancer Research Fund, American Institute for Cancer Research. 2019. Breast cancer statistics: breast cancer is the most common cancer in women worldwide [Internet]. World Cancer Research Fund;London: Available at: https://www.wcrf.org/dietandcancer/cancer-trends/breast-cancer-statistics
. cited 2019 Oct 30.
Youn HJ., Ahn HR., Kang SY., Jung SH. 2019. Efficacy of ultrasonography in breast cancer screening. J Surg Ultrasound. 6:1–7. DOI: 10.46268/jsu.2019.6.1.1.

Dillon MF., McDermott EW., Quinn CM., O'Doherty A., O'Higgins N., Hill AD. 2006. Predictors of invasive disease in breast cancer when core biopsy demonstrates DCIS only. J Surg Oncol. 93:559–63. DOI: 10.1002/jso.20445. PMID: 16705731.

Maffuz A., Barroso-Bravo S., Nájera I., Zarco G., Alvarado-Cabrero I., Rodríguez-Cuevas SA. 2006. Tumor size as predictor of microinvasion, invasion, and axillary metastasis in ductal carcinoma in situ. J Exp Clin Cancer Res. 25:223–7. PMID: 16918134.
Meijnen P., Oldenburg HS., Loo CE., Nieweg OE., Peterse JL., Rutgers EJ. 2007. Risk of invasion and axillary lymph node metastasis in ductal carcinoma in situ diagnosed by core-needle biopsy. Br J Surg. 94:952–6. DOI: 10.1002/bjs.5735. PMID: 17440955.
Guillot E., Vaysse C., Goetgeluck J., Falcou MC., Couturaud B., Fitoussi A, et al. 2014. Extensive pure ductal carcinoma in situ of the breast: identification of predictors of associated infiltrating carcinoma and lymph node metastasis before immediate reconstructive surgery. Breast. 23:97–103. DOI: 10.1016/j.breast.2013.12.002. PMID: 24388733.

Goto M., Yuen S., Akazawa K., Nishida K., Konishi E., Kajihara M, et al. 2012. The role of breast MR imaging in pre-operative determination of invasive disease for ductal carcinoma in situ diagnosed by needle biopsy. Eur Radiol. 22:1255–64. DOI: 10.1007/s00330-011-2357-2. PMID: 22205445.

Mori N., Ota H., Mugikura S., Takasawa C., Tominaga J., Ishida T, et al. 2013. Detection of invasive components in cases of breast ductal carcinoma in situ on biopsy by using apparent diffusion coefficient MR parameters. Eur Radiol. 23:2705–12. DOI: 10.1007/s00330-013-2902-2. PMID: 23732688.

Wisner DJ., Hwang ES., Chang CB., Tso HH., Joe BN., Lessing JN, et al. 2013. Features of occult invasion in biopsy-proven DCIS at breast MRI. Breast J. 19:650–8. DOI: 10.1111/tbj.12201. PMID: 24165314. PMCID: PMC4036640.

Park AY., Gweon HM., Son EJ., Yoo M., Kim JA., Youk JH. 2014. Ductal carcinoma in situ diagnosed at US-guided 14-gauge core-needle biopsy for breast mass: preoperative predictors of invasive breast cancer. Eur J Radiol. 83:654–9. DOI: 10.1016/j.ejrad.2014.01.010. PMID: 24534119.

Nori J., Meattini I., Giannotti E., Abdulcadir D., Mariscotti G., Calabrese M, et al. 2014. Role of preoperative breast MRI in ductal carcinoma in situ for prediction of the presence and assessment of the extent of occult invasive component. Breast J. 20:243–8. DOI: 10.1111/tbj.12250. PMID: 24750509.

Lee CW., Wu HK., Lai HW., Wu WP., Chen ST., Chen DR, et al. 2016. Preoperative clinicopathologic factors and breast magnetic resonance imaging features can predict ductal carcinoma in situ with invasive components. Eur J Radiol. 85:780–9. DOI: 10.1016/j.ejrad.2015.12.027. PMID: 26971424.

R Core Team. 2016. R: a language and environment for statistical computing [Internet]. R Foundation for Statistical Computing;Vienna: Available at: https://www.R-project.org/
. cited 2019 Feb 20.
Therneau TM. 2015. A package for survival analysis in S. version 2.38. [Internet]. R Foundation for Statistical Computing;Vienna: Available at: https://CRAN.R-project.org/package=survival
. cited 2019 Feb 20.
Yen TW., Hunt KK., Ross MI., Mirza NQ., Babiera GV., Meric-Bernstam F, et al. 2005. Predictors of invasive breast cancer in patients with an initial diagnosis of ductal carcinoma in situ: a guide to selective use of sentinel lymph nodebiopsy in management of ductal carcinoma in situ. J Am Coll Surg. 200:516–26. DOI: 10.1016/j.jamcollsurg.2004.11.012. PMID: 15804465.
Rutstein LA., Johnson RR., Poller WR., Dabbs D., Groblewski J., Rakitt T, et al. 2007. Predictors of residual invasive disease after core needle biopsy diagnosis of ductal carcinoma in situ. Breast J. 13:251–7. DOI: 10.1111/j.1524-4741.2007.00418.x. PMID: 17461899.

Go EM., Chan SK., Vong JS., Lui PC., Chan AW., Ma TK, et al. 2010. Predictors of invasion in needle core biopsies of the breast with ductal carcinoma in situ. Mod Pathol. 23:737–42. DOI: 10.1038/modpathol.2009.187. PMID: 20081814.

Chan MY., Lim S. 2010. Predictors of invasive breast cancer in ductal carcinoma in situ initially diagnosed by core biopsy. Asian J Surg. 33:76–82. DOI: 10.1016/S1015-9584(10)60013-9. PMID: 21029943.

Huang YT., Cheung YC., Lo YF., Ueng SH., Kuo WL., Chen SC. 2011. MRI findings of cancers preoperatively diagnosed as pure DCIS at core needle biopsy. Acta Radiol. 52:1064–8. DOI: 10.1258/ar.2011.110213. PMID: 21969708.

Han JS., Molberg KH., Sarode V. 2011. Predictors of invasion and axillary lymph node metastasis in patients with a core biopsy diagnosis of ductal carcinoma in situ: an analysis of 255 cases. Breast J. 17:223–9. DOI: 10.1111/j.1524-4741.2011.01069.x. PMID: 21545433.

Brennan ME., Turner RM., Ciatto S., Marinovich ML., French JR., Macaskill P, et al. 2011. Ductal carcinoma in situ at core-needle biopsy: meta-analysis of underestimation and predictors of invasive breast cancer. Radiology. 260:119–28. DOI: 10.1148/radiol.11102368. PMID: 21493791.

Kim J., Han W., Lee JW., You JM., Shin HC., Ahn SK, et al. 2012. Factors associated with upstaging from ductal carcinoma in situ following core needle biopsy to invasive cancer in subsequent surgical excision. Breast. 21:641–5. DOI: 10.1016/j.breast.2012.06.012. PMID: 22749854.

Hollingsworth AB., Stough RG. 2012. Multicentric and contralateral invasive tumors identified with pre-op MRI in patients newly diagnosed with ductal carcinoma in situ of the breast. Breast J. 18:420–7. DOI: 10.1111/j.1524-4741.2012.01273.x. PMID: 22804792.

Trentin C., Dominelli V., Maisonneuve P., Menna S., Bazolli B., Luini A, et al. 2012. Predictors of invasive breast cancer and lymph node involvement in ductal carcinoma in situ initially diagnosed by vacuum-assisted breast biopsy: experience of 733 cases. Breast. 21:635–40. DOI: 10.1016/j.breast.2012.06.009. PMID: 22795363.

Nadrljanski M., Maksimović R., Plešnac-Karapandžć V., Nikitović M., Marković-Vasiljković B., Milošvić Z. 2014. Positive enhancement integral values in dynamic contrast enhanced magnetic resonance imaging of breast carcinoma: ductal carcinoma in situ vs. invasive ductal carcinoma. Eur J Radiol. 83:1363–7. DOI: 10.1016/j.ejrad.2014.05.006. PMID: 24894697.

Deurloo EE., Sriram JD., Teertstra HJ., Loo CE., Wesseling J., Rutgers EJ, et al. 2012. MRI of the breast in patients with DCIS to exclude the presence of invasive disease. Eur Radiol. 22:1504–11. DOI: 10.1007/s00330-012-2394-5. PMID: 22367470.

Wilkie C., White L., Dupont E., Cantor A., Cox CE. 2005. An update of sentinel lymph node mapping in patients with ductal carcinoma in situ. Am J Surg. 190:563–6. DOI: 10.1016/j.amjsurg.2005.06.011. PMID: 16164920.

Goyal A., Douglas-Jones A., Monypenny I., Sweetland H., Stevens G., Mansel RE. 2006. Is there a role of sentinel lymph node biopsy in ductal carcinoma in situ?: analysis of 587 cases. Breast Cancer Res Treat. 98:311–4. DOI: 10.1007/s10549-006-9167-2. PMID: 16552627.

Lee JM., Kaplan JB., Murray MP., Mazur-Grbec M., Tadic T., Stimac D, et al. 2007. Underestimation of DCIS at MRI-guided vacuum-assisted breast biopsy. AJR Am J Roentgenol. 189:468–74. DOI: 10.2214/AJR.07.2172. PMID: 17646475.

Santamaría G., Velasco M., Farrús B., Zanón G., Fernández PL. 2008. Preoperative MRI of pure intraductal breast carcinoma--a valuable adjunct to mammography in assessing cancer extent. Breast. 17:186–94. DOI: 10.1016/j.breast.2007.09.005. PMID: 17964786.

Lee JW., Han W., Ko E., Cho J., Kim EK., Jung SY, et al. 2008. Sonographic lesion size of ductal carcinoma in situ as a preoperative predictor for the presence of an invasive focus. J Surg Oncol. 98:15–20. DOI: 10.1002/jso.21077. PMID: 18459155.

Kim S., Kim J., Park HS., Kim HY., Lee K., Lee J, et al. 2019. An updated nomogram for predicting invasiveness in preoperative ductal carcinoma in situ of the breast. Yonsei Med J. 60:1028–35. DOI: 10.3349/ymj.2019.60.11.1028. PMID: 31637884. PMCID: PMC6813145.

Si J., Yang B., Guo R., Huang N., Quan C., Ma L, et al. 2019. Factors associated with upstaging in patients preoperatively diagnosed with ductal carcinoma in situ by core needle biopsy. Cancer Biol Med. 16:312–8. DOI: 10.20892/j.issn.2095-3941.2018.0159. PMID: 31516751. PMCID: PMC6713631.
Kim YS., Park WS., Min SY. 2017. Diagnostic usefulness of shear-wave elastography for an evaluation of BI-RADS category 4a breast lesions detected by US. J Surg Ultrasound. 4:48–54.
Youn HJ., Kang SY., Jung SH. 2018. Clinical application of shear wave elastography in patients with breast cancer. J Surg Ultrasound. 5:33–8. DOI: 10.46268/jsu.2018.5.2.33.

Vinnicombe SJ., Whelehan P., Thomson K., McLean D., Purdie CA., Jordan LB, et al. 2014. What are the characteristics of breast cancers misclassified as benign by quantitative ultrasound shear wave elastography? Eur Radiol. 24:921–6. DOI: 10.1007/s00330-013-3079-4. PMID: 24326756.

Evans A., Purdie CA., Jordan L., Macaskill EJ., Flynn J., Vinnicombe S, et al. 2016. Stiffness at shear-wave elastography and patient presentation predicts upgrade at surgery following an ultrasound-guided core biopsy diagnosis of ductal carcinoma in situ. Clin Radiol. 71:1156–9. DOI: 10.1016/j.crad.2016.07.004. PMID: 27499466.

Fig. 1
Non-mass vs. mass lesion on pre-operative breast sonography. (A) Non mass lesion on pre-operative breast US, left breast 10H, BI-RADS C4a, diagnosed of DCIS on CNB, (B) Mass lesion on pre-operative breast US, left breast 12H, subareolar area, BI-RADS C4a, diagnosed of DCIS on CNB. BI-RADS = breast imaging-reporting and data system; CNB = core needle biopsy; DCIS = ductal carcinoma in situ; US = ultrasonography.
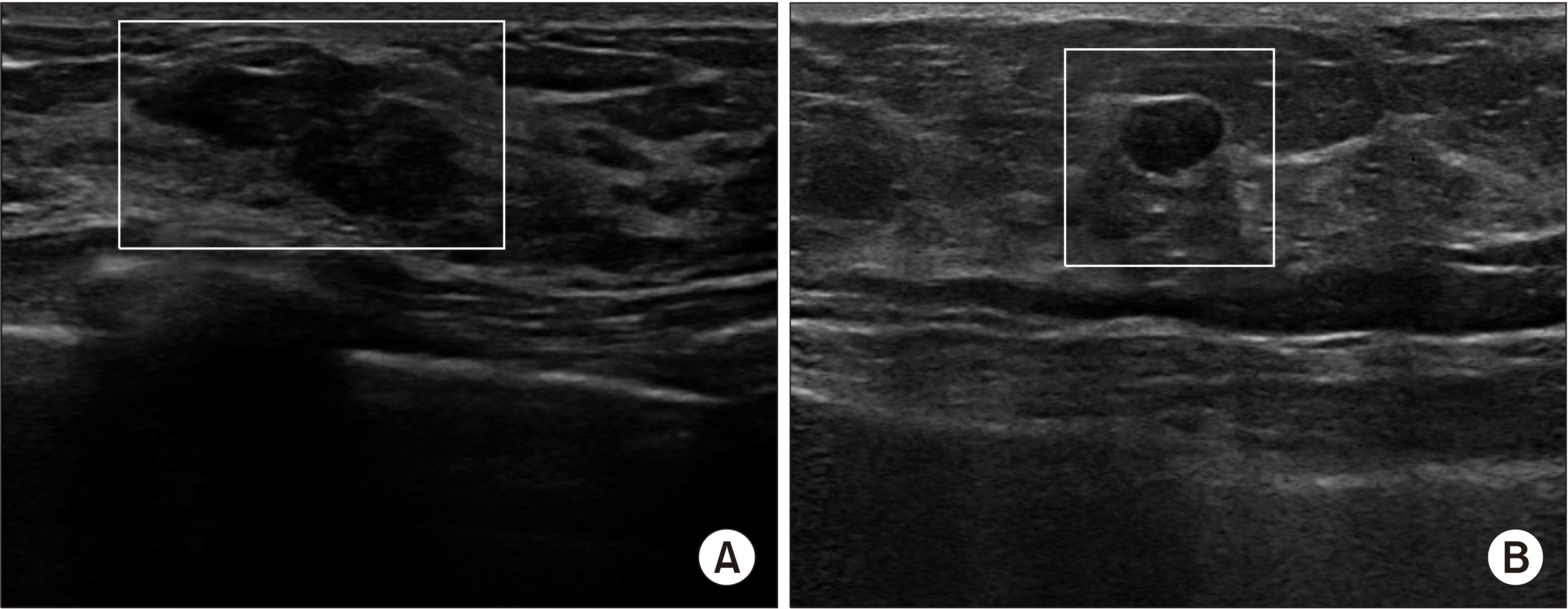
Table 1
Clinico-Pathological Features of 431 Patients with a Preoperative Histopathologic Diagnosis of DCIS
Table 2
Clinico-Pathological Predictors of Invasive Component in Patients with Preoperative Needle Biopsy-Based Diagnosis of DCIS




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download