Abstract
In the treatment of small hepatocellular carcinoma (HCC), percutaneous ultrasound guided radiofrequency ablation (RFA) is a proven therapy and is currently performed in clinical practice. However, depending on the location of the HCC, percutaneous RFA may not be possible. In these cases, intraoperative RFA can be implemented, but it is rarely performed by surgeons. Since laparoscopic intraoperative RFA is less invasive, it is increasingly used in small HCCs.
간세포암은 국내 남성 암 발생율 4위, 여성 6위를 차지하는 암이지만, 매년 사망자는 폐암에 이어 2위로 예후가 나쁘다. 대부분의 경우 처음 간세포암 진단 시 암이 많이 진행되어 예후가 나쁘지만 조기에 발견만 한다면 장기 생존이 가능한 암이다. 그러나 다른 장기에서 발생되는 암과 다르게 간세포암의 경우 간의 상태와 암의 위치에 따라 치료 방법이 다르다. 간세포암이 발생한 간의 경우 대부분 간경변이 동반되어, 간이식이 이론적으로 가장 좋은 치료지만 현재 간기증자의 부족으로 모든 간세포암 환자에게 적용할 수는 없다. 그 다음으로 선택할 수 있는 간절제술의 경우 간경변의 정도가 심하여 절제 후 간부전의 위험이 있다면 선택할 수 없다. 이러한 경우에 선택할 수 있는 가장 좋은 치료로는 고주파열치료술(radiofrequency ablation)이나 에탄올주입술(percutaneous ethanol injection)이 있다. 물론 최근에는 초단파소작술(microwave ablation)이나 냉동소작술(cryoablation) 등이 유효한 치료로 인정되지만, 아직까지는 고주파열치료술이 임상에서 가장 많이 시행되고 있다. 고주파열치료술은 간세포암 내에 삽입한 전극 주위로 교류(460-500 kHz) 전류를 흘려 분자들 간의 마찰을 일으켜 종양과 그 주위 조직을 가열하여 괴사를 유도한다. 간세포암의 크기가 2 cm 이하인 경우 높은 종양괴사율을 보인다.(1-4) 경피적 고주파열치료술의 경우 간문(hilum) 주변이나, 담낭, 담도, 대장 및 위 같은 주요 장기가 간세포암에 인접한 경우 시술 중 또는 후에 합병증의 위험성이 높고, 횡경막 주변에 간세포암이 위치 할 경우 접근이 힘들며, 큰 혈관 주위에 종양이 인접한 경우 열씻김현상(heat sink effect)으로 인하여 치료효과가 떨어질 수 있다.(5, 6) 특히 담낭, 대장, 위 및 횡경막 주위에 종양이 있어 합병증 위험성이 높거나 경피적 접근이 어려울 경우 수술 중 초음파 유도 간 고주파열치료술을 시행 할 수 있다.(7) 국내에서는 수술 중 초음파 유도 고주파열치료술을 외과의가 직접하는 경우는 드물다. 특히 복강경을 통한 고주파열치료술의 경우 방사선과 전문의가 시행하기 힘들기 때문에 외과의가 술기에 익숙해 지는 것이 좋다. 이에 저자들은 문헌 고찰 및 저자들의 경험을 토대로 외과의가 직접 시행하는 수술 중 초음파 유도 고주파열치료술에 대해 살펴보고자 한다.
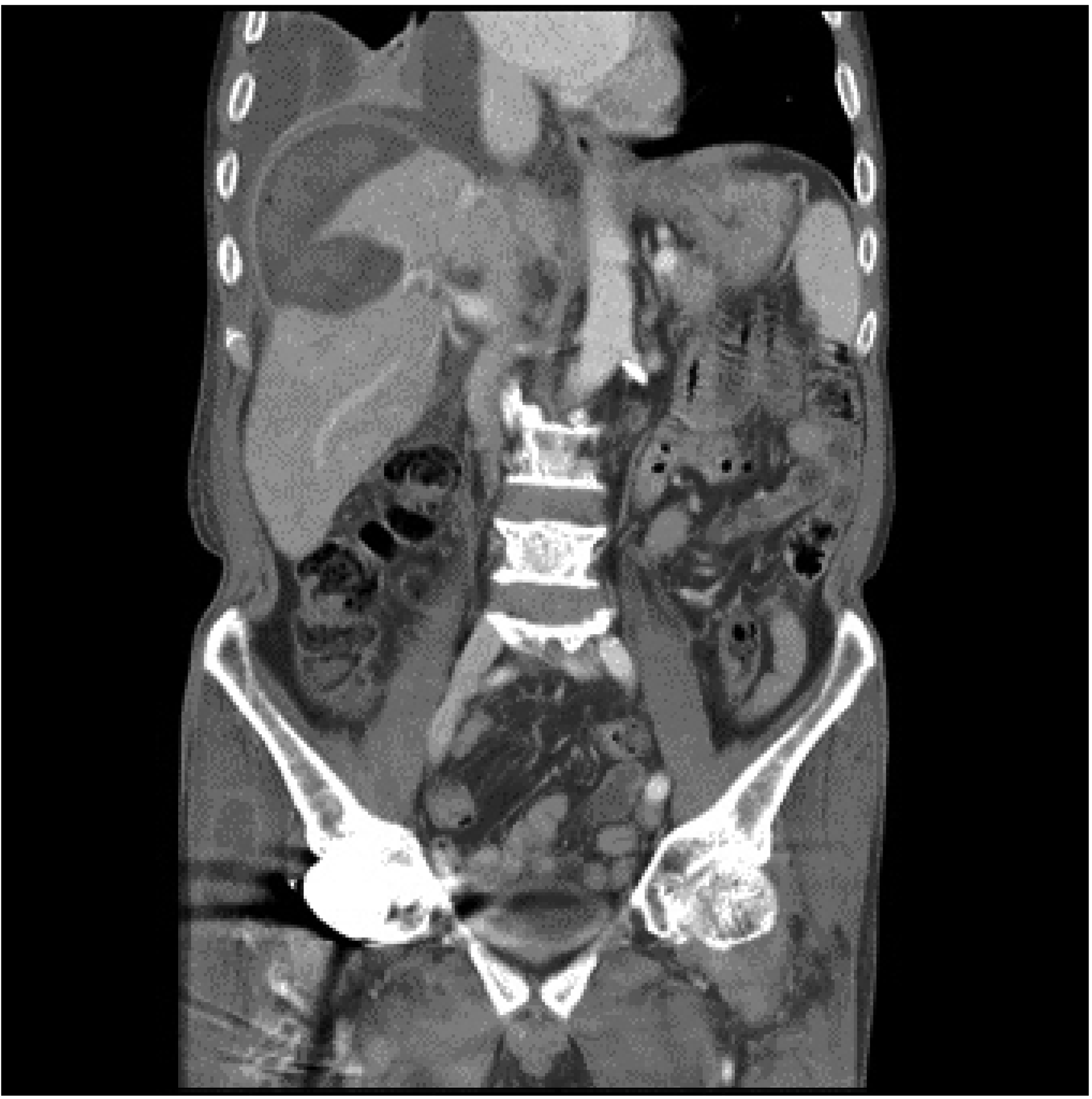
수술 중 초음파 유도 고주파열치료술의 경우 위치에 따른 제약은 없다. 오히려 보통의 경우 경피적 고주파열치료술이 불가능할 때 시행되기 때문에 주로 종양이 담낭, 대장, 위 및 횡경막 주변에 있을 때 시행하는 경우가 대부분이다. 그러나 경피적 고주파열치료술의 경우와 마찬가지로 종양이 간문(hilum) 주변에 있거나 큰 혈관 주변에 있는 경우 가능하면 시행하지 않는 것이 좋다. 간문 주변에 있는 종양에 고주파열치료술을 시행하게 되면 담관의 손상의 위험성이 있고 담관 손상이 있을 경우 주변조직의 괴사로 인해 보통의 담관 손상보다 치유가 잘 안된다(Fig. 1). 또한 종양이 큰 혈관 주변에 있을 경우 열씻김현상(heat sink effect)으로 인하여 치료효과가 떨어질 수 있으므로 가능하면 다른 치료방법을 고려하는 것이 좋겠다. 고주파열치료술에 적당한 종양의 크기는 장경이 2 cm 이하이다. 저자들의 경우 3년 국소 재발율은 10.3%로 다른 연구들과 비슷한 결과를 보였는데(0.9-21.4%) 국소재발을 한 집단에서 종양의 크기가 더 컸음을 알 수 있었다 [1.57 ± 0.60 cm vs 2.23 ± 0.65 cm (P=0.013)].(8-10) 수술 중 고주파열치료술은 좀 더 큰 종양에 반복적으로 시행할 수 있어서 경피적 고주파열치료술 보다는 좀 더 광범위한 적응증을 적용해도 될 것으로 생각되지만 추후 연구가 필요하다. 고주파열치료술은 간절제술에 비해 잔존간기능에 대한 고려가 적지만 그럼에도 불구하고 간부전으로 인한 합병증이 보고되고 있다.(11, 12) 이를 방지하기 위해서는 Child-Pugh 등급 A나 B에 적용하는 것이 가장 이상적이다. 그러나 다른 치료를 고려할 수 없는 Child-Pugh 등급 C에서도 선택적으로 시행할 수는 있겠다.
고주파열치료술 장비는 크게 3가지로 구성되어 있다. 직접 간을 통과하여 종양에 도달하는 전극(electrode), 교류 전류를 발생시켜주는 전류 발생기(current generator) 및 발생된 열을 식혀 주변 조직의 손상을 방지하는 물 순환 펌프(circulation pump) 이다(Fig. 2). 물론 이 세가지 장비는 cable로 연결되어 있고 on/off 스위치는 수술 중 발판을 이용하여 사용할 수 있다. 전류 발생기에는 출력(power), 파(pulse), 온도(temperature) 및 시간을 조절하는 단자가 있다. 전극이 종양에 잘 삽입되면 출력은 20 W에서 시작하여 점차 증가시켜 120 W까지 올린다. 특히 간피막 주위의 종양을 치료할 때 주의해야 하는 데 처음부터 높은 출력은 종양의 파열을 일으켜 복막 파종을 일으킬 수 있다. 파(pulse)는 간세포암에서는 지속(continuance) type을 설정한다. 또한 온도는 100°C로 설정하는 것이 좋다. 종양은 45-50°C의 열에 3분 이상 노출 시, 그리고 60°C 이상의 고열에 대해서는 거의 즉시 응고성 괴사가 일어난다. 전극 끝 부위에 온도를 측정하는 센서가 있어서 시술 중 종양 주변의 온도를 알 수 있다. 치료 시간은 보통 5분에서 30분 정도를 설정하는데 종양의 크기 및 상태에 따라 괴사되는 속도가 다르므로 초음파 영상을 확인하면서 조절해야 한다.
초음파를 준비할 때 probe가 중요한데 저자들은 개복을 통한 고주파열치료술의 경우 간의 후방(posterior section)을 관찰하기 용이한 T자 형으로 생긴 선형(linear) probe를 이용하고, 복강경을 통한 고주파열치료술의 경우 굴곡(flexible) probe를 이용한다(Fig. 3).
개복을 통한 고주파열치료술의 경우 바로누운(supine) 상태에서 시행한다. 종양이 간 후방(posterior section)에 위치한 경우 간절제술과 마찬가지로 세모인대(triangular ligament) 및 낫인대(falciform ligament)를 박리하면 좀 더 쉽게 접근할 수 있다. 복강경을 통한 고주파열치료술을 시행할 경우에 종양이 간 1-5, 8 분절에 위치 할 경우 바로누운(supine) 상태에서 시행하지만 6,7 분절에 위치한 경우 옆누운자세(lateral decubitus position)를 시행한다. 이 경우에도 세모인대 및 낫인대를 박리하여 우측 간을 우측 복벽 및 횡격막으로부터 분리해야 수술이 용이하다.
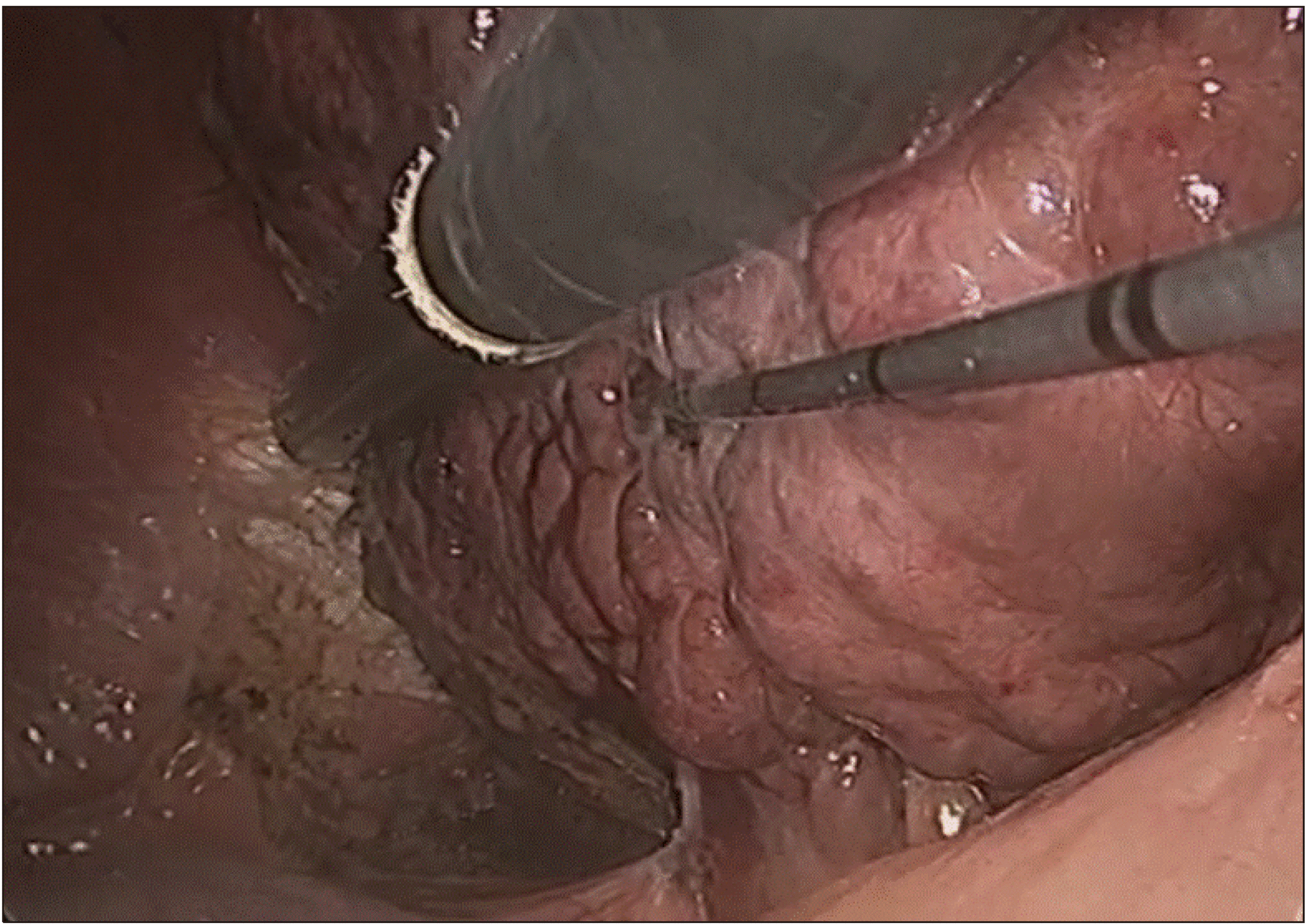
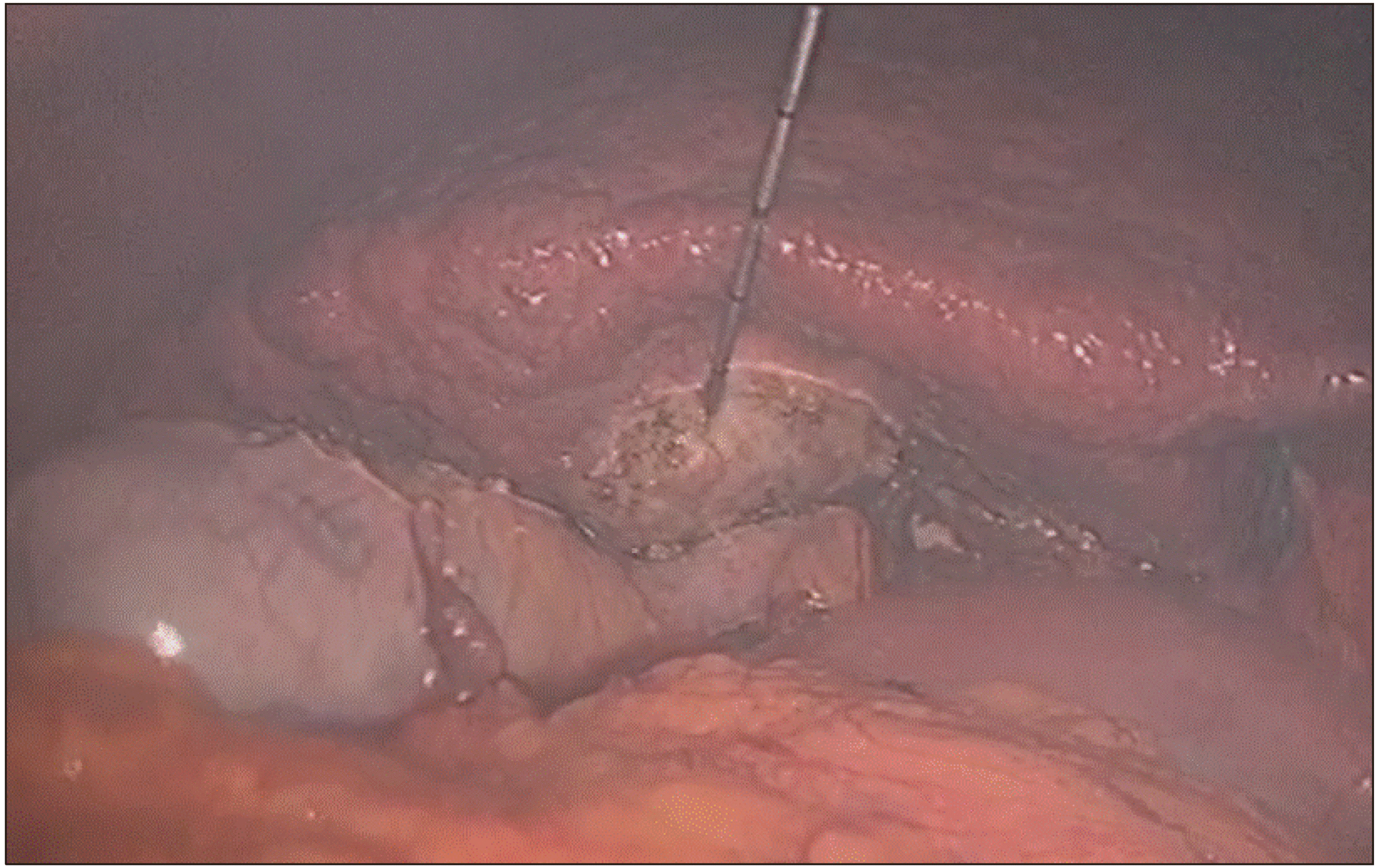
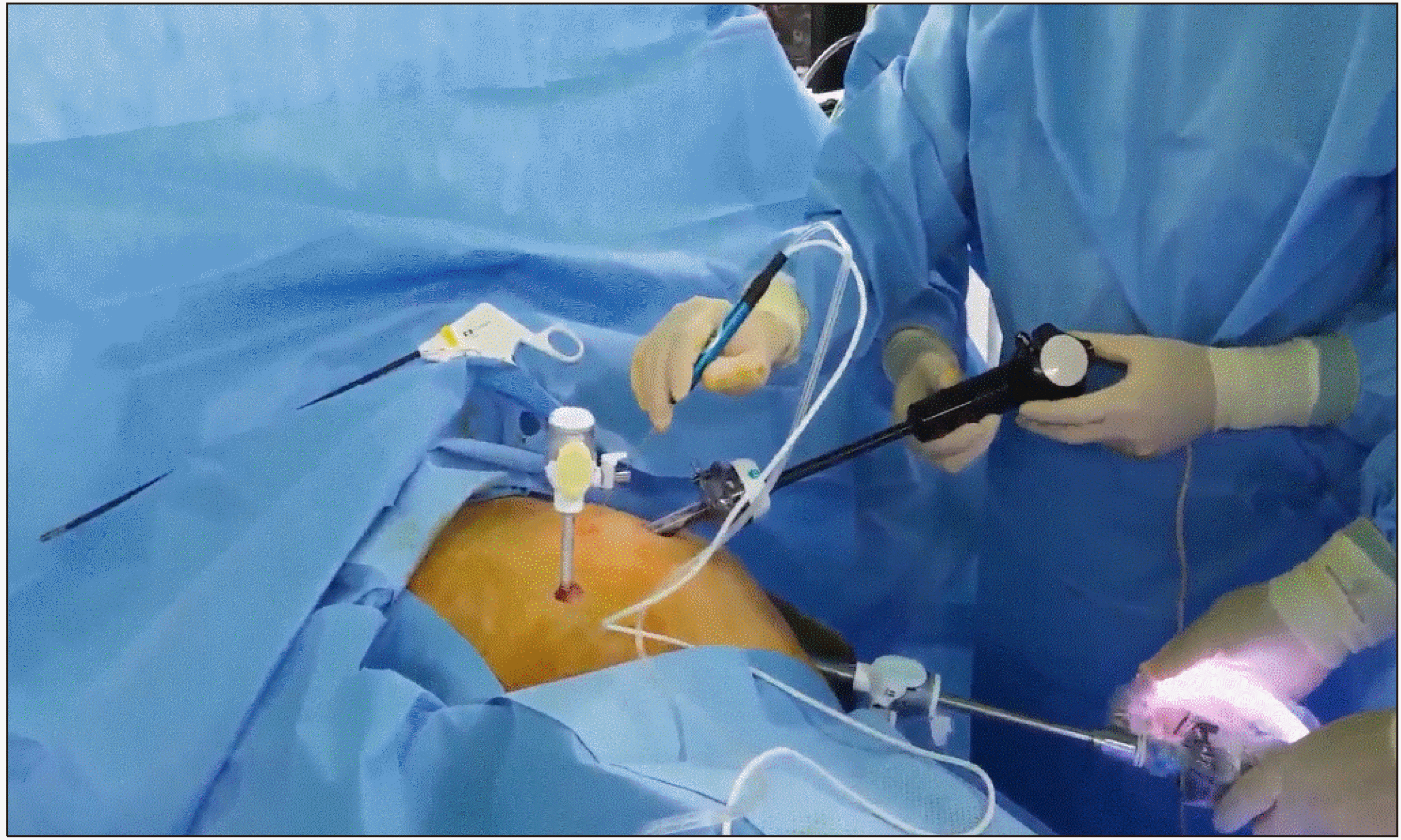
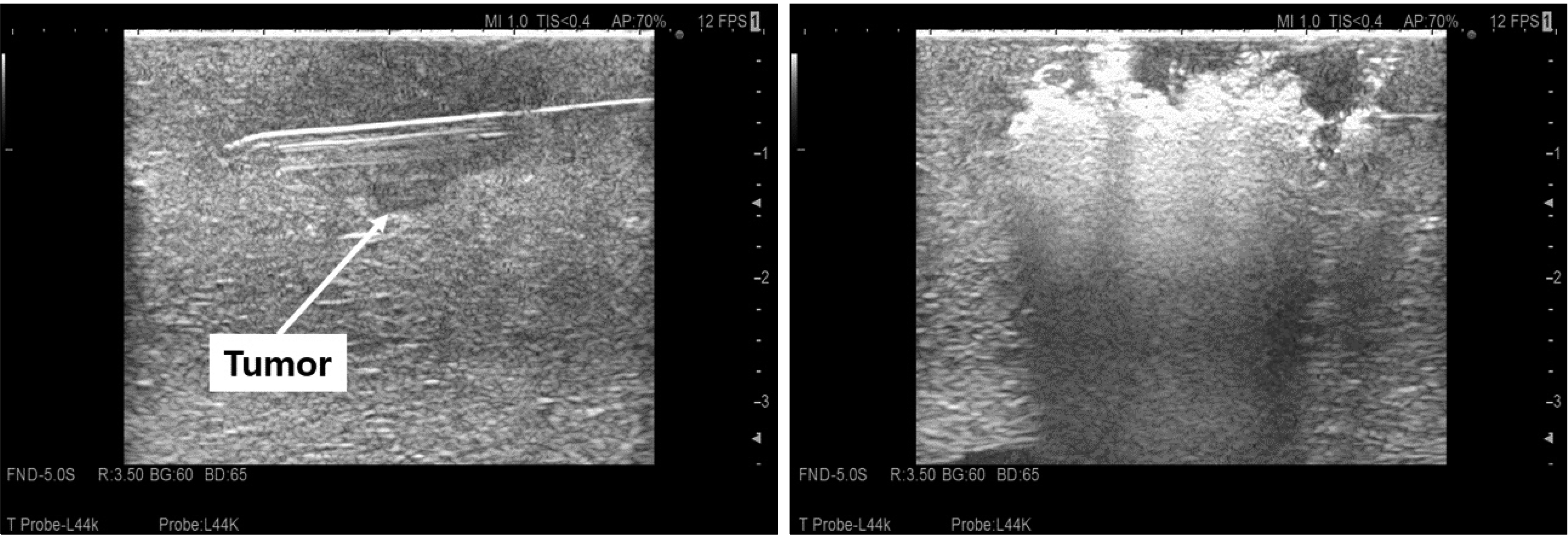
개복을 통한 고주파열치료술에 비해 복강경을 통한 고주파열치료술은 좀 더 비 침습적이고 수술 후 회복이 빠르다는 장점이 있다.(13, 14) 또한 여러 연구에서 수술 후 합병증이나 무병생존율에 차이가 없다.(15-17) 그러나 복강경을 통해 초음파 유도 하 종양에 electrode를 정확하게 삽입하는 것은 쉽지 않다. 특히 간 7,8 분절에 종양이 위치한 경우 흉곽을 통해 electrode를 삽입하면 좀 더 용이하겠지만 기흉 및 혈흉의 위험이 있기 때문에 술 전 영상 및 수술 중 초음파를 통해 종양의 위치를 3차원 적으로 파악하여 electrode를 삽입하는 위치를 선택하여야 한다. 그렇게 하기 위해서는 복벽에서의 삽입 위치부터 정확하게 설정하는 것이 중요한데 복강경을 통한 초음파와 평행이 되게 electrode를 삽입 하되 복강내에서 어떻게 종양까지 도달하게 할 것인지를 고려해야 한다(Fig. 4). 담낭 주변에 종양이 위치하는 경우 우선 담낭절제술을 시행하고 고주파열치료술을 시행 할 부위에 떼어낸 담낭을 위치시키면 위나 십이지장 등 주변장기에 불필요한 열 전달로 인한 합병증을 막을 수 있다(Fig. 5). 저자들의 경우 환자의 체위와 상관없이 배꼽을 통해 10 mm camera port를 삽입하고 electrode가 삽입될 부위를 고려하여 12 mm port를 삽입하고 초음파 probe를 복강내로 진입시킨다. 또한 경우에 따라 5 mm port를 삽입하여 복강내에 들어온 electrode의 위치를 조절하는데 사용한다(Fig. 6). Electrode가 정확하게 종양에 삽입이 되었는지 초음파로 확인한 뒤 전류를 통과 시키고, 병변이 완전하게 괴사되었슴을 확인 후 시술을 끝낸다(Fig. 7). 종양이 3 cm가 넘을 경우 electrode를 한번 삽입하여 완벽하게 괴사가 되지 않는 경우가 있는데, 이런 경우 괴사되지 않은 부위에 electrode를 다시 삽입하여 초음파로 확인 후 전류를 통과시킨다.
경피적 고주파열치료술과 마찬가지로 electrode 삽입부위의 출혈, 삽입부위를 통한 복막으로의 종양 파종, 기흉, 혈흉, 흉막삼출, 피부화상, 간 피막하 혈종, 담관 손상 및 간농양 등 여러가지 합병증이 보고되었다.(1, 11, 12) 저자들은 간 피막 주변에 위치한 간종양에 고주파열치료술을 시행할 경우 증류수를 이용한 복강내 세척을 철저히 시행한다. 이는 혹시 모를 종양파종을 예방하기 위하여 시행하는데 현재까지 수술 중 고주파열치료술 80여례에서 복강 내 종양 파종은 없었다. Electrode를 간에서부터 제거한 후 삽입부위 간피막에서 지속적으로 출혈을 하는 경우가 종종 있다. 이러한 경우에는 우리가 흔히 이용하는 전기 소작기로 electrode가 삽입되었던 부위를 소작하여 마무리한다. 또한 담도 합병증은 주변 조직의 괴사로 인해 치유가 잘 되지 않으므로 간문(hilum) 주변이나 담도 가지 주변은 고주파열치료술을 시행하지 않는 것이 좋겠다.
수술 중 고주파열치료술의 경우 간 절제와 동반해서 시행되기도 한다. 2개 이상의 종양이 있을 때 절제 후 잔존 간기능이 충분하지 않다고 판단되면 2 cm 이하의 종양에는 고주파열치료술을 시행하는 것이 대안이 될 수 있다. 또한 간세포암종 파열의 경우 보통의 경우 경동맥 화학 색전술을 시행하게 되는 데 이 경우 종양 파종 및 복강내 혈종이 해결되지 않는다는 단점이 있다. 이에 저자들은 간세포암종 파열 4예에 대하여 수술 중
고주파열치료술 및 증류수를 이용한 복강내 세척을 통해 종양 파종을 최대한 방지하는 치료를 하고 있고 4예 모두 종양 파종은 없었다. 아직 증례수가 부족하여 결론을 내기에 충분하지 않지만 간세포암종 파열을 치료함에 있어 이론적으로 다른 치료에 비해 종양의 복막 파종을 방지하는 데 최고의 방법으로 판단된다.
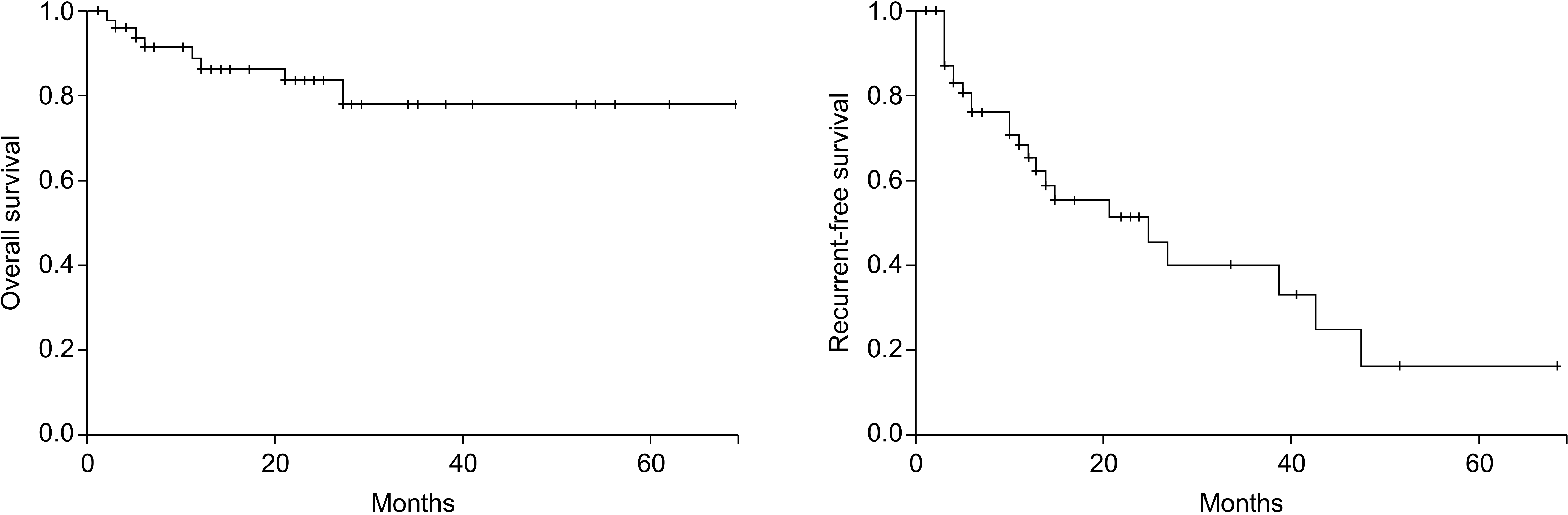
간세포암을 고주파열치료술로 치료 후 생존율은 다른 치료와 마찬가지로 간 기능과 종양 크기에 따라 많은 차이가 있다. Child-Pugh 등급 A에 국한하였을 때 장경 2 cm 이하는 3년 생존율이 90% 내외, 5년 생존율이 65-70%로 간절제술과 뚜렷한 차이가 없다.(8-10,18) 저자들의 경우 Child-Pugh 등급 A, B이면서 장경 2 cm 이하의 간세포암 환자 52명을 조사하였는데 3, 5년 생존율은 83.4%, 78.2%로 우수한 결과를 보였으나 3, 5년 무병생존율은 56.0%, 16.9%로 좋지 않았다(Fig. 8). 그러나 고주파열치료술은 여러 번 시행할 수 있다는 장점이 있다. 또한 고주파열치료술을 시행 후 재발하여 다시 고주파열치료술을 시행하는 경우에 주변 조직과의 유착이 적어 크게 문제는 없었다. 경피적 고주파열치료술에 비해 수술 중 고주파열치료술의 경우 좀 더 큰 종양을 여러 번 안전하게 괴사시킬 수 있다는 장점이 있어 추후 크기에 따른 수술 중 고주파열치료술의 효과에 대해 연구가 필요하다.
REFERENCES
Lencioni R., Cioni D., Crocetti L., Franchini C., Pina CD., Lera J, et al. 2005. Early-stage hepatocellular carcinoma in patients with cirrhosis: long-term results of percutaneous image-guided radiofrequency ablation. Radiology. 234:961–7. DOI: 10.1148/radiol.2343040350. PMID: 15665226.

Lin SM., Lin CJ., Lin CC., Hsu CW., Chen YC. 2004. Radiofrequency ablation improves prognosis compared with ethanol injection for hepatocellular carcinoma < or =4 cm. Gastroenterology. 127:1714–23. DOI: 10.1053/j.gastro.2004.09.003. PMID: 15578509.

Shiina S., Teratani T., Obi S., Sato S., Tateishi R., Fujishima T, et al. 2005. A randomized controlled trial of radiofrequency ablation with ethanol injection for small hepatocellular carcinoma. Gastroenterology. 129:122–30. DOI: 10.1053/j.gastro.2005.04.009. PMID: 16012942.

Lencioni RA., Allgaier HP., Cioni D., Olschewski M., Deibert P., Crocetti L, et al. 2003. Small hepatocellular carcinoma in cirrhosis: randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection. Radiology. 228:235–40. DOI: 10.1148/radiol.2281020718. PMID: 12759473.

Minami Y., Kudo M. 2010. Radiofrequency ablation of hepatocellular carcinoma: current status. World J Radiol. 2:417–24. DOI: 10.4329/wjr.v2.i11.417. PMID: 21179308. PMCID: PMC3006479.

Kim YS., Lee WJ., Rhim H., Lim HK., Choi D., Lee JY. 2010. The minimal ablative margin of radiofrequency ablation of hepatocellular carcinoma (> 2 and < 5 cm) needed to prevent local tumor progression: 3D quantitative assessment using CT image fusion. AJR Am J Roentgenol. 195:758–65. DOI: 10.2214/AJR.09.2954. PMID: 20729457.

Choi HJ., Seo JK., Lee SH., Lim YS., Park IY. 2015. Open-approach radiofrequency ablation of hepatocellular carcinoma using intraoperative ultrasonography. J Surg Ultrasound. 2:22–5.
Shiina S., Tateishi R., Arano T., Uchino K., Enooku K., Nakagawa H, et al. 2012. Radiofrequency ablation for hepatocellular carcinoma: 10-year outcome and prognostic factors. Am J Gastroenterol. 107:569–77. DOI: 10.1038/ajg.2011.425. PMID: 22158026. PMCID: PMC3321437.

Kim YS., Lim HK., Rhim H., Lee MW., Choi D., Lee WJ, et al. 2013. Ten-year outcomes of percutaneous radiofrequency ablation as first-line therapy of early hepatocellular carcinoma: analysis of prognostic factors. J Hepatol. 58:89–97. DOI: 10.1016/j.jhep.2012.09.020. PMID: 23023009.

Livraghi T., Meloni F., Di Stasi M., Rolle E., Solbiati L., Tinelli C, et al. 2008. Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis: is resection still the treatment of choice? Hepatology. 47:82–9. DOI: 10.1002/hep.21933. PMID: 18008357.

de Baère T., Risse O., Kuoch V., Dromain C., Sengel C., Smayra T, et al. 2003. Adverse events during radiofrequency treatment of 582 hepatic tumors. AJR Am J Roentgenol. 181:695–700. DOI: 10.2214/ajr.181.3.1810695. PMID: 12933462.

Rhim H., Yoon KH., Lee JM., Cho Y., Cho JS., Kim SH, et al. 2003. Major complications after radio-frequency thermal ablation of hepatic tumors: spectrum of imaging findings. Radiographics. 23:123–34. DOI: 10.1148/rg.231025054. PMID: 12533647.

Yokoyama T., Egami K., Miyamoto M., Watanabe H., Hasegawa H., Iida S, et al. 2003. Percutaneous and laparoscopic approaches of radiofrequency ablation treatment for liver cancer. J Hepatobiliary Pancreat Surg. 10:425–7. DOI: 10.1007/s00534-002-0830-7. PMID: 14714162.

Sakoda M., Ueno S., Iino S., Minami K., Ando K., Kawasaki Y, et al. 2013. Endoscopic versus open radiofrequency ablation for treatment of small hepatocellular carcinoma. World J Surg. 37:597–601. DOI: 10.1007/s00268-012-1868-6. PMID: 23192169.

Machi J., Uchida S., Sumida K., Limm WM., Hundahl SA., Oishi AJ, et al. 2001. Ultrasound-guided radiofrequency thermal ablation of liver tumors: percutaneous, laparoscopic, and open surgical approaches. J Gastrointest Surg. 5:477–89. DOI: 10.1016/S1091-255X(01)80085-8.

Topal B., Hompes D., Aerts R., Fieuws S., Thijs M., Penninckx F. 2007. Morbidity and mortality of laparoscopic vs. open radiofrequency ablation for hepatic malignancies. Eur J Surg Oncol. 33:603–7. DOI: 10.1016/j.ejso.2007.02.031. PMID: 17418994.

Tanaka S., Shimada M., Shirabe K., Taketomi A., Maehara S., Tsujita E, et al. 2009. Surgical radiofrequency ablation for treatment of hepatocellular carcinoma: an endoscopic or open approach. Hepatogastroenterology. 56:1169–73. PMID: 19760963.
Cho YK., Kim JK., Kim WT., Chung JW. 2010. Hepatic resection versus radiofrequency ablation for very early stage hepatocellular carcinoma: a Markov model analysis. Hepatology. 51:1284–90. DOI: 10.1002/hep.23466. PMID: 20099299.





 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download