초록
방법
임상화학 분야를 담당하는 국내 진단검사의학과 전문의들을 대상으로 네이버 웹 기반의 구조화된 설문조사를 2회에 걸쳐 진행하였다. 첫 번째 설문조사는 검사방법, 정량법, 판독 보고서와 관련된 21개 문항으로 구성되었고, 이어서 기기명 및 내 · 외부 정도관리에 대한 두 번째 설문조사가 시행되었다.
Abstract
Background
This study aimed to investigate the current status of serum protein electrophoresis (SPEP) and immunofixation electrophoresis (IFE) in Korea.
Methods
Two structured questionnaires were developed using the Naver online platform and provided to clinical pathologists in charge of clinical chemistry. The first questionnaire consisted of 21 questions regarding the methods of testing, quantitation, and interpretation reports. A second questionnaire was administered on the name of the instrument and quality control.
Results
A total of 29 hospital clinical laboratories responded to our first survey, and among them, 15 hospitals participated in the second survey. Twenty-six (89.7%) laboratories reported both quantitative values and interpretation reports, and 24 (82.8%) laboratories presented the ratio of each globulin fraction along with the quantitative values. However, the reporting unit and decimal place, fractionation of each globulin, commentation, terminology, and quantitation method for a monoclonal protein varied among the participating laboratories. Seventeen (58.6%) laboratories performed the inter-laboratory proficiency test, and there were differences in the methods of internal and external quality control among the laboratories.
Conclusions
Variations in SPEP and IFE tests, including quantitation, interpretation reports, and quality control according to the laboratories, were observed. Although this study included a limited number of hospitals, it is the first to report the current status of SPEP and IFE in Korea. Harmonization of methods for reporting results and interpretation reports is needed to reduce the potential inconsistencies in the results.
전기영동(electrophoresis)은 전기장 내에서 하전된(charged) 단백 입자의 전하와 질량에 따라 각 단백 분획(fraction)을 분리하는 기술이다. 특히 혈청단백 전기영동(serum protein electrophoresis, SPEP)은 다발성골수종(multiple myeloma), 의미불명 단클론감마글로불린병증(monoclonal gammopathy of undetermined significance), 발덴스트롬 거대글로불린혈증(Waldenstrom’s macroglobulinemia), 아밀로이드증(amyloidosis), 림프증식성 질환, 신부전, 만성 간질환, 일부 암종 등의 진단 및 치료 경과 모니터링에 적용할 수 있다[1-6]. 면역고정 전기영동(immunofixation electrophoresis, IFE)은 혈청단백 전기영동에서 관찰되는 피크(peak)의 단클론성 단백(monoclonal protein) 여부 확인 및 면역표현형 확인에 사용되며[3, 7-9], 특히 소량의 단클론성 단백이 존재할 경우 혈청단백 전기영동보다 민감하게 검출할 수 있는 것으로 알려져 있다[1, 9, 10].
그러나 이들 검사 모두 전기영동 자체는 기기가 수행하지만 이후의 해석 작업은 검사자가 수동으로 한다는 한계가 있다. 이에 구획 및 보고 방식, 정량(quantitation)값 및 표기 단위, 판독 보고서에서의 문구 및 용어의 사용 등에 있어서도 검사실 별로 차이가 존재하고 있어, 혈청단백 전기영동 및 면역고정 전기영동의 판독 및 보고에 대한 표준화된 지침의 필요성이 제기되고 있다[6-12]. 이에 본 연구에서는 국내 임상검사실을 대상으로 혈청단백 전기영동 및 면역고정 단백영동 검사의 현황을 조사하고 이를 분석하여, 추후 판독 및 보고 방법의 표준화를 이루기 위한 기초 자료를 제시하고자 하였다.
본 설문조사는 2차에 걸쳐 진행되었다. 1차 설문조사는 2020년 7월 27일부터 8월 17일까지 네이버 폼을 이용하여 웹베이스 형태로 설문지를 진단검사의학과 임상화학분과 관련 전문의에게 발송하였으며 자발적으로 설문 회신을 받았다. 총 49기관에 발송하였고, 이 중 29기관이 회신하여 1차 설문조사의 회신율은 59.2%였다(Table 1). 1차 설문조사에 참여한 기관을 대상으로 2차 설문조사를 2020년 10월 19일부터 25일까지 진행하였으며, 총 15개 기관이 회신하여 51.7%의 회신율을 보였다.
설문조사 참여 기관 중 26기관(89.7%)에서 판독 보고서를 각 글로불린(globulin)별 정량 값과 함께 제공하고 있었으며, 3기관(10.3%)에서는 판독 보고서(interpretation report)만 제공한다고 답하였다. 13기관(44.8%)에서 혈청단백 전기영동 및 면역고정 전기영동 결과를 그림 혹은 그래프의 형태로 검사정보시스템(laboratory information system, LIS)을 통해 임상에 제공하고 있었으며, 모든 기관이 판독자의 성명을 판독 보고서에 제시한다고 응답하였다. 단클론성 단백을 추적관찰하는 환자의 경우 12기관(41.4%)에서 판독 보고서에 이전 결과를 현재 결과와 병기하고, 9기관(31.0%)에서는 판독 보고서에는 병기하지 않지만 검사정보시스템상 검사 결과창에는 보고한다고 응답하였다. 또한 3기관(10.3%)에서 면역글로불린(immunoglobulin) G/A/M 이나 유리형 경쇄(free light chain) 검사 결과를 판독 보고서에도 병기한다고 답하였으며, 대부분의 기관에서 환자에게 추가적인 검사(면역글로불린, 유리형 경쇄, 골수검사 등)가 필요한 경우 판독 보고서상에서 권장사항(recommendation)으로서 제시한다고 답변하였다. 이클론성(biclonal) 단백의 경우에는 20기관(69.0%)에서 각각의 피크의 위치, 개별형(isotype), 정량 값을 분리하여 제공하고, 8기관(27.6%)에서 각 피크의 위치와 개별형을 제공하나 정량 값의 경우에는 둘을 분리하지 않고 합친 값을 제공한다고 답변하였다. 외부정도관리 혹은 숙련도 조사의 경우, 검사실 간 숙련도 평가 17기관(58.6%), College of American Pathologists (CAP) 숙련도평가 4기관(13.8%), 둘 다 시행 5기관(17.2%), 시행하지 않거나 무응답 3기관(10.3%)으로 나타났다(Table 2).
각 글로불린별 구획 방식은 알부민(albumin), alpha-1, alpha-2, beta-1, beta-2, gamma의 경우가 22기관(75.9%)으로 가장 많았고, 정량 단위는 대부분의 경우 g/dL이었으나, 소수점 아래 표기의 경우 1자리와 2자리까지 표기한 기관의 수가 각 14기관으로 동일하였다. 24기관(82.8%)에서 각 구획의 정량 값(g/dL 또는 g/L)과 함께 총 단백(total protein)에 대한 비율(ratio, %)을 함께 제시하고, 참고구간(reference interval)의 경우 16기관(55.2%)에서 정량 값과 비율에 대한 참고구간을 모두 제시하고, 8기관(27.6%)에서는 비율에 대해서만 제시한다고 답변하였다. 각 병적 상황이나 의심 질환, 전기영동 패턴(pattern)에 대한 추가적인 서술(commentation)에 대한 응답은 Fig. 2와 같다. 단클론성 단백의 정량방법은 해당 영역 전체를 정량하는 방법(standard perpendicular drop method, 표준수직작도법) 13기관(44.8%), 해당 영역을 정량하되 아래쪽의 기저 다클론성 영역(baseline polyclonal region) 너비를 고려하여 약간 좁게 정량하는 방법(corrected perpendicular drop method, 교정수직작도법) 9기관(31.0%), 해당 영역에서 기저 영역을 제외하고 위 부분만 정량하는 방법(tangent skimming method, 접선절삭법) 6기관(20.7%)로 기관마다 상이하였다. 단클론성 단백의 영역은 14기관(48.3%)이 beta-1, beta-2 등으로 세분화하여 보고하고, 13기관(44.8%)이 beta나 gamma 등으로 단순화하여 보고한다고 응답하였다. 단클론성 단백을 지칭하는 용어는 Fig. 3A와 같이 기관별로 다양하였고, 정량한계(limit of quantitation) 또한 Fig. 3B와 같이 기관별로 차이를 보였다. 정량한계 미만이지만 소량의 단클론성 단백이 의심되는 경우 12기관(41.4%)에서 “단클론성 단백이 의심됩니다”, 5기관(17.2%)에서 “단클론성 단백이 검출되었으나, 검출한계 미만입니다.” 등으로 답변하였으나, 이를 특별히 보고하지 않는 경우도 8기관(27.6%)로 나타났다. 정량한계 미만이지만 개별형을 면역고정 전기영동 상에서 식별이 가능한 경우에는 24기관(86.2%)에서 이의 위치와 개별형을 보고하고 “면역고정 전기영동에서만 소량 관찰됩니다”라고 보고한다고 하였다(Table 2).
2차 설문조사까지 자발적으로 참여한 15개 기관 중에서, 12기관(80.0%)이 Sebia (Lisses, France) 사의 기기를, 3기관(20.0%)이 Helena (Beaumont, TX, USA) 사의 기기를 사용한다고 응답하였다. 내부정도관리는 모든 기관이 검사 시행일마다 진행하였는데, 주 2회 검사의 내부정도관리 및 검사하는 경우가 10기관(66.7%)로 가장 많았고, 제조사 전용 물질을 이용하는 경우가 13기관(86.7%)로 가장 많았다. 내부정도관리의 평균(mean)과 표준편차(standard deviation)의 목표 값의 경우 기관별 누적 자료를 이용하여 설정하는 경우가 13기관(86.7%)로 가장 많았고, 시행 농도별 정도관리물질 수는 1개 농도 사용 10기관(66.7%), 2개 물질 사용 5기관(33.3%)이었다. 외부정도관리 혹은 숙련도 평가의 적합성(acceptance) 기준은 차이(bias)가 10% 이내, 20% 이내, 농도 별 차등 적용, CAP 숙련도 평가 기준 차용 등으로 다양하였다(Table 3).
혈청단백 전기영동 및 면역고정 전기영동은 형질세포질환(plasma cell dyscrasia)은 물론 많은 단백 관련 질환 및 이외 전신질환을 감별하는 데에 유용한 검사법이지만, 자동화 분석기기를 이용하는 다른 일반화학 종목들과는 달리 판독자의 분석이 필요하다는 점에서 기관 간, 검사자 간 차이 가능성이 존재한다[5, 11, 13]. 또한 단클론성 단백 정량의 경우에는 검출되는 영역에서 아래쪽의 기저 다클론성 영역을 얼마만큼 배제하여 정량 영역을 잡을지에 따라서 차이가 발생하며, 면역글로불린 중쇄와 경쇄의 결합에 따라 정량 영역을 확정하기가 어려운 경우가 더러 발생하기도 한다[9, 12]. 물론 검사법의 발전에 따라 전기영동법의 해상도가 향상되어 단클론성 단백 검출의 민감도가 향상되고 간섭현상도 많이 개선되었지만[9], 검사 판독에 있어서는 아직 표준화된 지침이 없는 실정이다. 이에 본 연구에서는 국내에서의 혈청단백 전기영동 및 면역고정 단백영동 검사의 판독 및 보고 방법의 일치화 및 표준화를 위한 기초 자료를 마련하기 위하여 국내 임상검사실을 대한 설문조사를 시행하였다.
설문조사 참가기관의 월간 검사 시행 건수 및 검사 방식은 Fig. 1과 같이 기관별로 다양하였다. 모세관 전기영동법(capillary zone electrophoresis)과 아가로오스 겔 전기영동법(agarose gel electrophoresis) 모두 단클론성 단백에 대한 민감도가 90% 이상이나 특이도에서는 다소 차이가 나는 것으로 알려져 있다[1,5]. 그러나 일반적인 혈청단백 전기영동의 경우 선별검사의 목적으로 시행하기 때문에 민감도가 우수하고 상대적으로 사용이 편한 모세관 전기영동법도 충분히 사용 가능하여 많은 검사실에서 사용 중이고[6, 8], 면역고정 전기영동의 경우 혈청단백 전기영동에 비해 소량의 단클론성 단백도 검출할 수 있기 때문에 확인검사 용으로 사용되고 있다[1, 14].
판독 보고서의 전반적 형태의 경우, 필수적인 것은 아니지만 전기영동 패턴에 대해 그래프나 그림으로 제공하는 기관이 13기관(44.8%)이었고, 단클론성 단백에 대한 보고는 물론이고 Fig. 2와 같이 그 이외의 여러가지 의심질환이나 패턴에 대해서도 판독 보고를 시행하고 있었다. 이전 검사 결과에 대해서는 대부분 참고를 하되 보고 여부나 방식에 있어서는 기관별 차이가 존재하였다. 대부분의 경우 추가 혹은 추적 검사에 대한 권고를 시행하고 있었으며, 모든 기관이 판독 보고서에 판독자 성명을 명시하였다. 전기영동 검사에 대한 개괄적 보고 방식(synoptic reporting) 문헌에 의하면[11], 판독 보고서에는 이상소견을 보이는 밴드(band) 유무, 밴드의 수와 위치에 대한 세부 서술(가능한 경우), 이전 검사 결과, 판독 서술문, 추가 혹은 추적 검사에 대한 권고(필요한 경우), 판독자 성명 등을 보고서에 명시할 것을 권고하고 있다.
글로불린 영역별 구획 및 정량 값 보고의 경우, 많은 기관들(22기관, 75.9%)이 구획에 있어서 beta 영역도 세분화하여 보고하고, 권고안에는 제시되어 있지는 않으나 총 단백에 대한 각 구획의 비율(%)도 다수의(24기관, 82.8%) 경우 보고하고 있었다. 보고단위는 대부분 g/dL이었으며, 소수점 아래 표기 자리 수는 1자리 또는 2자리로 기관별로 상이하였다. Canadian Society of Clinical Chemists Monoclonal Gammopathy Working Group에서 제시하는 권고안에 따르면[8, 15], 각 글로불린을 albumin, alpha-1, alpha-2, beta (이상적으로는 beta-1과 2로 세분화하는 것을 권장), gamma로 구획하고 각 구획의 정량 값 및 참고구간을 제시하며, 보고단위로는 g/L를 사용할 것을 권장하고 있다. 호주-뉴질랜드의 권고안에서는 g/L 단위를 사용하고, 가장 근접한 정수로 반올림하여 보고할 것을 제시하고 있다[6, 7]. 양측의 권고안에서는 구획별 비율(%)에 대한 언급은 없었다. 국내의 경우 총 단백 및 알부민 정량 값을 g/dL으로 표기하기에 각 글로불린 구획의 경우에도 대부분 이를 따르고 있었다.
단클론성 단백 보고의 경우, 모든 기관이 정량 보고를 하되 세부 보고방식에는 기관별 차이가 존재하였다. 단클론성 단백의 위치 보고에 있어서도 각 구획별로 세분화하여 보고하는지 여부가 달랐고, 단클론성 단백을 표현하는 용어 또한 Fig. 3A와 같이 기관별로 상이하였다. 물론 아직까지는 용어에 대한 표준화된 지침은 없다. 이클론성 단백의 보고에 있어서는 대부분의 기관들에서 각 피크의 개별형과 위치를 보고하고 있었으나, 일부 기관에서는 각 피크의 정량값을 따로 분리하지 않고 각각의 피크 정량을 합쳐 보고하는 경우가 있어 이에 대해서도 통일된 지침이 필요할 것으로 보인다. 캐나다의 권고안에 따르면 단클론성 단백이 존재할 경우 이의 정량값 및 개별형을 보고하고, 이전 결과와 비교하여 의미 있는 변화가 있는지 여부를 명시하도록 하고 있으며, 이클론성 혹은 여러 개의 단클론성 단백이 존재할 경우에는 추적관찰을 위해 각각의 피크를 명확히 분리하여 제시하도록 권고하고 있다[8, 15].
단클론성 단백의 정량한계에 대해서는 Fig. 3B에 나타난 바와 같이 기관별로 그 기준이 다양하였다. 기존 문헌에서는 1 g/L (=0.1 g/dL)를 제시하고[8, 14, 16], 그 이하의 경우에는 기저 다클론성 영역 때문에 정량의 신뢰성이 떨어지기 때문에 trace 혹은 “<1 g/L (0.1 g/dL)”로 보고할 것을 권고하고 있다[6]. 그러나 본 연구에서는 0.1 g/L (0.01 g/dL)라고 대답한 기관이 가장 많았고(11기관, 37.9%), 1 g/L 미만의 값(0.1, 0.2, 0.5 g/L)을 정량한계로 설정한 기관이 20기관(69.0%)이었다. 이는 Sebia사의 소프트웨어의 경우 소수점 둘째 자리까지 표현해 주기 때문인 것으로 보이며, 전기영동의 경우 정량한계를 검증하기가 어렵다는 한계가 있다. 각 기관별로 임상과에서의 요구, 혹은 기기나 시약별 차이가 존재할 수 있기 때문에 각 검사실의 상황에 맞는 정량 한계를 설정하고 그에 맞추어 일관적인 보고를 하면 될 것으로 판단된다.
단클론성 단백의 정량방법 또한 기관별로 상이하였는데, 기저 다클론성 영역까지 같이 정량될 수 있다는 한계점에도 불구하고 국외의 한 설문조사에서는 표준수직작도법 51%, 교정수직작도법 7%, 접선절삭법 17%라는 결과를 보여[17], 본 연구에서 나타난 국내의 경우와는 양상이 약간 다르지만 표준수직작도법을 가장 많이 사용하는 것으로 나타났으며, 호주-뉴질랜드의 권고안 또한 이를 지지하고 있다[7]. 다만, 경우에 따라 정량법에 따른 값이 과대 혹은 과소평가될 수 있고[9], 단클론성 단백이 저농도로 존재할 경우 정량법 간 값의 차이가 최대 58%까지 난다는 보고도 있어[18], 동일 기관 내에서는 통일된 기준을 가지고 단클론성 단백을 정량하고 기관 내 검사자 간 일치화를 위한 노력이 필요할 것이다.
각 검사실의 내 · 외부 정도관리 현황 또한 기관별로 다양하였다. 내부정도관리의 주기는 다양하였으나 이는 많은 검사실에서 전기영동 검사를 매일 시행하는 것이 아니라서 시행일마다 정도관리를 하기 때문이었으며, 내부정도관리 목표는 대부분 검사실 누적치를 쓰는 경우가 많았다. 외부정도관리의 경우 많은 경우 검사실 간 숙련도 평가 혹은 CAP survey를 통해 시행 중이었으나, 일부의 경우에는 시행하지 않는 경우도 있어, 비록 기준 마련이 쉽지는 않겠으나 국내에서도 전기영동 검사에 대한 신빙도조사 혹은 외부정도관리를 위한 프로그램이 필요할 것으로 사료된다.
본 연구는 국내의 임상검사실에서의 혈청단백 전기영동 및 면역고정 전기영동의 현황에 대해 조사한 설문조사 연구이다. 다만, 기관 자체적으로 전기영동 검사를 시행하지 않고 외부 전문 수탁검사기관으로 검사를 위탁하는 경우도 많았고, 한 재단 내에 여러 개의 병원이 있는 경우 대표적인 한 기관으로 검사를 보내는 경우도 많아 설문조사의 응답률이 다소 낮았다. 또한 전문 수탁검사기관에도 설문지를 발송하였으나 응답한 기관이 없어서 본 연구에 포함되지 못한 이유로 최종적으로는 설문조사에 종합병원 및 대학병원만 포함된 점 또한 본 연구의 한계점이라 할 수 있다. 또한 본 연구에서 다루지 못한 문항을 꼽자면 다음과 같다. 첫째, 누가 판독을 하는지(예: 임상병리사, 전공의, 전문의), 판독자가 얼마만에 바뀌는지(예: 수 개월, 수 년, 담당자 1명이 계속 판독) 등 판독자에 대한 조사를 다루지 못하였다[19]. 둘째, 단클론성 단백의 정량 값을 판독 보고서 이외에도 검사정보 시스템상에도 따로 보고하는지에 대해 다루지 못하였고 셋째, 내부정도관리의 허용 기준에 대해서도 다루지 못하였다. 이는 앞으로의 후속 연구를 통해 보완되어야 할 것으로 생각된다.
본 연구는 국내의 혈청단백 전기영동 및 면역고정 전기영동 상황을 파악할 수 있는 첫 연구로서 앞으로의 국내의 전기영동 관련 표준 가이드라인 마련을 위한 기초 자료를 마련한 연구로 그 의의가 있다. 향후 더 많은 임상검사실을 대상으로 연구가 진행되어 혈청단백 전기영동 및 면역고정 전기영동 영역에서의 표준화 혹은 일치화 방안을 마련하여 검사의 신뢰성 향상을 이루어야 할 것으로 생각된다.
감사의 글
본 연구는 대한진단검사의학회 정도관리위원회의 연구비 지원을 받아 수행되었으며(진검연구-2021-02-009), 설문에 응답해 주신 국내 29개 병원의 진단검사의학과 선생님들께 감사의 뜻을 표합니다.
REFERENCES
1. Keren DF. 2012. Protein electrophoresis in clinical diagnosis. London, NW: Hodder Arnold.
2. Azim W, Azim S, Ahmed K, Shafi H, Rafi T, Luqman M. 2004; Diagnostic significance of serum protein electrophoresis. Biomedica. 20:40–4. DOI: 10.29271/jcpsp.2021.07.864,. PMID: 34271795.
3. Vavricka SR, Burri E, Beglinger C, Degen L, Manz M. 2009; Serum protein electrophoresis: an underused but very useful test. Digestion. 79:203–10. DOI: 10.1159/000212077. PMID: 19365122.

4. O'Connell TX, Horita TJ, Kasravi B. 2005; Understanding and interpreting the serum protein electrophoresis. Am Fam Physician. 71:105–12.
5. McCudden CR, Mathews SP, Hainsworth SA, Chapman JF, Hammett-Stabler CA, Willis MS, et al. 2008; Performance comparison of capillary and agarose gel electrophoresis for the identification and characterization of monoclonal immunoglobulins. Am J Clin Pathol. 129:451–8. DOI: 10.1309/6KT8N49BRNVVVBT1. PMID: 18285269.

6. Tate J, Caldwell G, Daly J, Gillis D, Jenkins M, Jovanovich S, et al. 2012; Recommendations for standardized reporting of protein electrophoresis in Australia and New Zealand. Ann Clin Biochem. 49:242–56. DOI: 10.1258/acb.2011.011158. PMID: 22402916.

7. Tate JR, Smith JD, Wijeratne N, Mollee P. 2019; Proposed addendum to 2012 recommendations for standardised reporting of protein electrophoresis in Australia and New Zealand. Clin Biochem Rev. 40:23–30. PMID: 30828117. PMCID: PMC6370285.
8. Booth RA, McCudden CR, Balion CM, Blasutig IM, Bouhtiauy I, Rodriguez-Capote K, et al. 2018; Candidate recommendations for protein electrophoresis reporting from the Canadian Society of Clinical Chemists Mono-clonal Gammopathy Working Group. Clin Biochem. 51:10–20. DOI: 10.1016/j.clinbiochem.2017.10.013. PMID: 29061378.

9. Keren DF, Schroeder L. 2016; Challenges of measuring monoclonal proteins in serum. Clin Chem Lab Med. 54:947–61. DOI: 10.1515/cclm-2015-0862. PMID: 26910744.

10. Kyle RA. 1994; The monoclonal gammopathies. Clin Chem. 40:2154–61. DOI: 10.1093/clinchem/40.11.2154. PMID: 7955402.

11. McCudden CR, Booth RA, Lin DCC, McCurdy A, Rupani N, Kew A. 2018; Synoptic reporting for protein electrophoresis and immunofixation. Clin Biochem. 51:21–8. DOI: 10.1016/j.clinbiochem.2017.09.020. PMID: 28964759.

12. Clavijo A, Ryan N, Xu H, Singh G. 2020; Measurement of monoclonal immunoglobulin protein concentration in serum protein electrophoresis: comparison of automated vs manual/human readings. Lab Med. 51:252–8. DOI: 10.1093/labmed/lmz055. PMID: 32374393.

13. Bender LM, Cotten SW, Fedoriw Y, Willis MS, McCudden CR. 2013; Evaluation of digital images for identification and characterization of monoclonal immunoglobulins by immunofixation. Clin Biochem. 46:255–8. DOI: 10.1016/j.clinbiochem.2012.10.030. PMID: 23127385.

14. Regeniter A, Siede WH. 2018; Peaks and tails: Evaluation of irregularities in capillary serum protein electrophoresis. Clin Biochem. 51:48–55. DOI: 10.1016/j.clinbiochem.2017.09.017. PMID: 28965683.

15. Chan PC, Chen Y, Randell EW. 2018; On the path to evidence-based reporting of serum protein electrophoresis patterns in the absence of a discernible monoclonal protein - A critical review of literature and practice suggestions. Clin Biochem. 51:29–37. DOI: 10.1016/j.clinbiochem.2017.09.010. PMID: 28916439.

16. Jacobs JFM, Turner KA, Graziani MS, Frinack JL, Ettore MW, Tate JR, et al. 2020; An international multi-center serum protein electrophoresis accuracy and M-protein isotyping study. Part II: limit of detection and follow-up of patients with small M-proteins. Clin Chem Lab Med. 58:547–59. DOI: 10.1515/cclm-2019-1105. PMID: 31940285.

17. Wijeratne N, Tate JR, Wienholt L, Mollee P. 2019; Report of the survey conducted by RCPAQAP on current practice for paraprotein and serum free light chain measurement and reporting: a need for harmonisation. Clin Biochem Rev. 40:31–42. PMID: 30828118. PMCID: PMC6370284.
18. Schild C, Wermuth B, Trapp-Chiappini D, Egger F, Nuoffer JM. 2008; Reliability of M protein quantification: comparison of two peak integration methods on Capillarys 2. Clin Chem Lab Med. 46:876–7. DOI: 10.1515/CCLM.2008.146. PMID: 18601614.

19. Willrich MAV, Long TA, Bashleben C, Fink SL, Rudolf JW, Peterson D, et al. 2020; Performance of perpendicular drop versus tangent skimming gating of M-protein in proficiency testing challenges. Clin Chem Lab Med. 59:e19–22. DOI: 10.1515/cclm-2020-0697. PMID: 32628626.

Fig. 1
Number of tests per month by participating laboratories (A) and the number of laboratories stratified according to the test method (SPEP/IFE) (B).
Abbreviations: SPEP, serum protein electrophoresis; IFE, immunofixation electrophoresis; CZE, capillary zone electrophoresis; AGE, agarose gel electrophoresis.
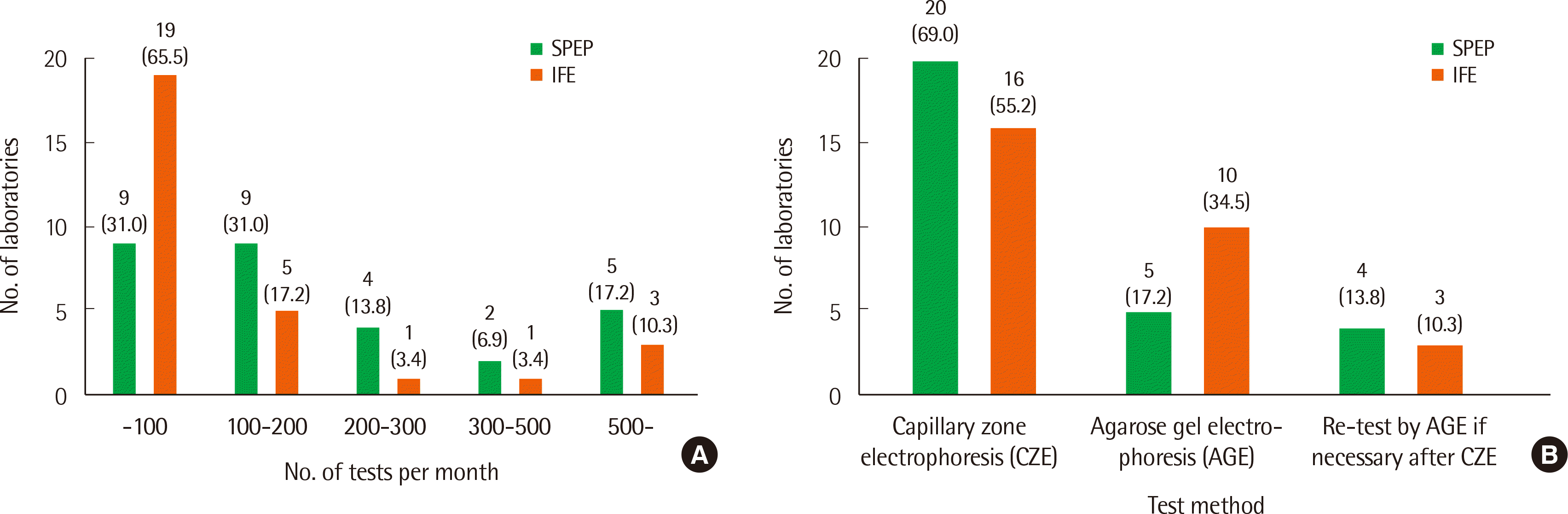
Fig. 2
Number of laboratories reporting comments on the following conditions (or suspected diseases) (A) and patterns (B).
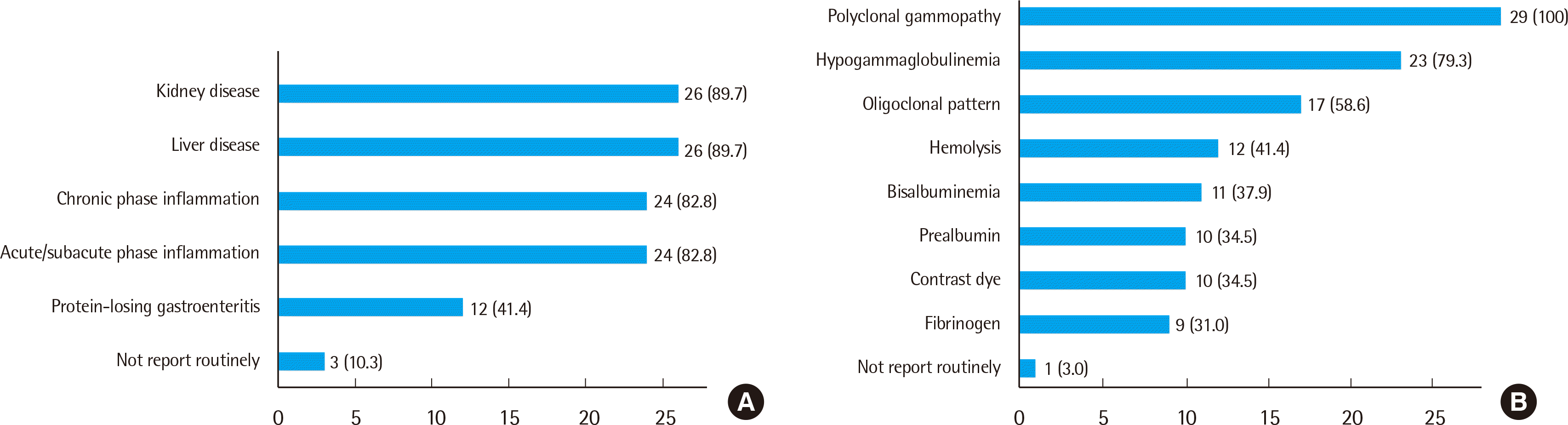
Fig. 3
Distribution of reporting terms for a monoclonal protein (A) and the limit of quantitations (B) according to the laboratories.
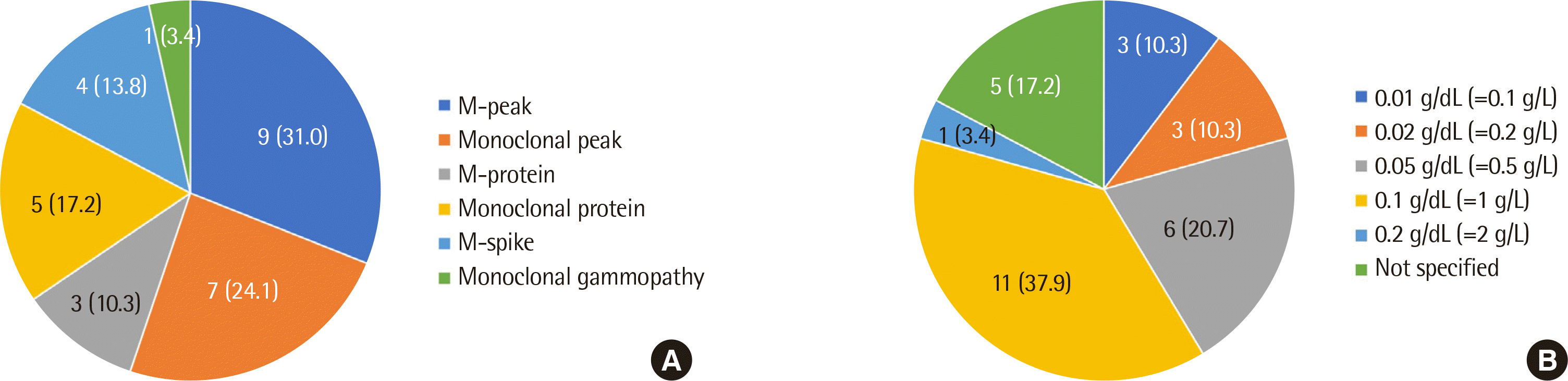
Table 1
List of participating hospitals
Table 2
First survey questions and response frequencies
| Questions | Answer, N (%) |
|---|---|
| Questions 1 through 10 of the survey are applicable to both SPEP and IFE. | |
|
1. How many SPEP/IFE tests are performed per month in your laboratory? See Fig. 1(A). |
|
|
2. Which method does your laboratory use for SPEP/IFE tests? See Fig. 1(B). |
|
| 3. Does your laboratory report only quantitative values, interpretation reports, or both? | |
| Quantitative values | 0 (0.0) |
| Interpretation reports | 3 (10.3) |
| Both | 26 (89.7) |
| 4. Does your laboratory display SPEP/IFE patterns as pictures or graphs? | |
| Yes | 13 (44.8) |
| No | 16 (55.2) |
| 5. Do you present the name of an interpreter on your interpretation report? | |
| Yes | 29 (100) |
| No | 0 (0.0) |
| 6. Do you report previous results in patients who follow up on a monoclonal protein? | |
| Report the previous results also in the interpretation report | 12 (41.4) |
| Report the previous results in the LIS, but not in the interpretation report | 9 (31.0) |
| Note these, but not report them in the interpretation report | 8 (27.6) |
| 7. If the patient has the results of serum IgG/A/M and free light chain tests, do you present these in the interpretation report? | |
| Report them also in the interpretation report | 3 (10.3) |
| Note these, but not report them in the interpretation report | 26 (89.7) |
| 8. If additional tests are required on the patient, do you suggest these? | |
| Yes | 28 (96.6) |
| No | 1 (3.4) |
| 9. How do you report a bi-clonal paraprotein: report as a combined result of the two parts, or separate results on each? | |
| Report the location, isotype, and quantity of each monoclonal protein | 20 (69.0) |
| Report the location and isotype of each monoclonal protein, but report the quantity as a combination of the two | 8 (27.6) |
| Report only that there are two monoclonal proteins | 1 (3.4) |
| 10. How does your laboratory manage the external quality control (proficiency test) of the SPEP/IFE test? | |
| Inter-laboratory proficiency test | 17 (58.6) |
| CAP survey | 4 (13.8) |
| Both | 5 (17.2) |
| No external quality control or no response | 3 (10.3) |
| Questions 11 through 20 are applicable to the survey on SPEP. | |
| 11. How do you compartmentalize each globulin fraction shown on the SPEP tests? | |
| Albumin, alpha-1, alpha-2, beta, and gamma | 6 (20.7) |
| Albumin, alpha, beta-1, beta-2, and gamma | 1 (3.4) |
| Albumin, alpha-1, alpha-2, beta-1, beta-2, and gamma | 22 (75.9) |
| 12. What are the reporting units (g/dL of g/L) and decimal places (1st or 2nd) of the quantitative values in your laboratory? | |
| g/dL, 1st decimal place | 14 (48.3) |
| g/dL, 2nd decimal place | 14 (48.3) |
| g/L, 1st decimal place | 1 (3.4) |
| g/L, 2nd decimal place | 0 (0.0) |
| 13. Do you present the ratio (%) of each globulin fraction to the total protein along with the quantitative value (g/dL or g/L)? | |
| Yes | 24 (82.8) |
| No | 5 (17.2) |
| 14. Do you present the reference intervals for each globulin fraction in the interpretation report? If so, which of the following do you present, the ratio or the quantity? | |
| Present them as the ratio (%) | 8 (27.6) |
| Present them as quantity (g/dL or g/L) | 2 (6.9) |
| Present them as both the ratio and the quantity | 16 (55.2) |
| Do not present them | 3 (10.3) |
|
15. Do you report comments on the following conditions (or suspected diseases)/patterns? See Fig. 2. |
|
| 16. Which of the following methods do you use to quantify a monoclonal protein? | |
| Standard perpendicular drop method | 13 (44.8) |
| Corrected perpendicular drop method | 9 (31.0) |
| Tangent skimming method | 6 (20.7) |
| Apply different methods depending on the pattern | 1 (3.4) |
| 17. When a monoclonal protein is detected, how do you indicate the corresponding region? | |
| Report the region subdivided into beta-1, beta-2, etc. | 14 (48.3) |
| Report the region as beta or gamma | 13 (44.8) |
| Not report the particular region | 2 (6.9) |
|
18. When a monoclonal protein is detected, which of the following terms do you use for reporting? See Fig. 3(A). |
|
|
19. What is the limit of quantitation of a monoclonal protein in your laboratory? See Fig. 3(B). |
|
| 20. How do you report a monoclonal protein below the limit of quantitation in your laboratory? | |
| Trace | 1 (3.4) |
| Monoclonal protein is detected, but at less than the limit of quantitation. | 5 (17.2) |
| Monoclonal gammopathy is suspected. | 12 (41.4) |
| Report all, even when in a small amount | 3 (10.3) |
| Not report | 8 (27.6) |
| Question 21 is applicable to the survey on IFE. | |
| 21. If the monoclonal protein amount is less than the limit of quantitation but you can distinguish the isotype on the IFE pattern, how would you report it? | |
| Report the region and isotype, but mention the amount as below the limit of quantitation or only visible by IFE | 25 (86.2) |
| Mention that monoclonal gammopathy is suspected | 4 (13.8) |
Table 3
Second survey questions and response frequencies




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download