Abstract
Functional dyspepsia is one of the most common functional gastrointestinal disorders with chronic bothersome epigastric pain or postprandial fullness without a definite organic cause. Despite its high clinical burden, the treatment modalities for modulating impaired motor dysfunction and visceral hypersensitivity have been unsatisfactory. Recently, studies demonstrating low-grade inflammation and dysbiosis of the duodenal mucosa as potential triggers of the disease have attracted attention. Observations, such as an increase in the proportion of oral commensal bacteria in the duodenal mucosa, such as Streptococcus species, highlight the importance of bacterial ecology in developing symptoms of functional dyspepsia. In the near future, anti-inflammatory drugs and probiotics that modulate the host-microbiome interaction are expected to emerge to treat functional dyspepsia.
기능성 소화불량증(functional dyspepsia) 은 인구의 약 15%에서 발견되는 매우 흔한 질환으로,1 소화성 궤양이나 위식도 역류 질환 또는 위장관 악성종양 등과 같은 기질적인 질환이없음에도 불쾌한 위장관 증상이 만성적, 반복적으로 나타나는증상증후군이다. 진단에는 불쾌한 식후 포만감(bothersome postprandial fullness), 불쾌한 조기 만복감(bothersome early satiation), 불쾌한 상복부 통증(bothersome epigastric pain)과 불쾌한 상복부 쓰림(bothersome epigastric burning) 등의 4가지 전형적 증상 중 하나와 상부위장관 내시경을 통해증상을 설명할 기질적 질환이 없음을 모두 확인하는 것이 필요하다. 기능성 소화불량증은 서로 다른 병태생리기전을 갖는두 가지 아형으로 나뉘게 되는데, 개정된 로마기준 IV에서도식후고통증후군(postprandial distress syndrome, PDS) 과 명치통증증후군(epigastric pain syndrome, EPS) 으로 분류되고있으며, 이들 아형은 서로 중복되어 나타날 수도 있다.2
또다른 기능성 소화기계 질환으로는 과민성 장증후군(irritable bowel syndrome, IBS) 이 있는데, 이는 그 질환 병인에 있어 장내미생물총과 면역계 변화를 통한 만성적 염증 발생이라는 기전이 비교적 잘 알려져 있다.3 특히, 감염후 과민성 장증후군(post-infectious IBS, PI-IBS) 에서 두드러지는데, 그 기전으로 소장내 장내 세균총의 변화 현상이 제시된다.4 위장관 감염 후에는 과민성 장증후군도 호발하지만, 기능성 소화불량증의 발생빈도도 크게 증가하는 것으로 알려져 있는데,5 이는 두 기능성 질환들의 발생과정에 공통적으로 장내미생물총의 변화가 관여하고 있음을 암시하고 있다.
기능성 소화불량증은 전통적으로 위의 기능이상 및 체성통증에 대한 과민성 등으로 인해 발병하는 것으로 여겨, 위의환경과 운동신경 기능에 대한 연구가 집중되어 왔고, 이를 조절하기 위한 양성제펌프억제제(proton pump inhibitor, PPI) 등이 주된 치료 방법으로 활용되어 왔다. 그러나 최근에는 십이지장의 만성 저등급 염증과 점막의 호산구 증가가 증상 발생에 크게 작용하고 있음이 확인되어 주목받고 있다.6,7 이에따라 십이지장의 장내미생물총의 변화를 밝히려는 노력이 나타나게 되었으며, 향후 진단과 치료에 있어 효과적인 바이오마커와 프로바이오틱스에 대한 연구가 진행되어 오고 있다. 따라서 본고에서는 이와 같은 활발한 연구의 흐름을 살펴보고향후의 기능성 소화불량증의 진단과 치료에 있어 어떻게 활용될 수 있을지 알아보고자 한다.
국내의 한 전향적 연구에 따르면, 건강검진을 수진한 인구의 약 10.3%가 기능성 소화불량증으로 진단되었으며,8 환자중 상당수(10-27%) 가 과민성 대장증후군을 동반하고 있었다.9 기능성 소화불량증의 원인은 아직 명확히 확립되지는 않았으나, 여러 연구들에서 위험인자들로는 위장관 감염,10 항생제사용,11 NSAIDs 복용,12 유년기의 침실 공유 및 반려동물 노출력,13 과체중 및 비만14 그리고 스트레스15 등이 있으며, 불안과우울과 같은 심리사회학적 상태나 특성16도 영향을 준다고 보고되었다. 이와 함께 음식, 환경과 같은 다양한 요인들은 위저부 적응장애(gastric fundic accommodation abnormality) 나 위배출 지연(delayed gastric emptying) 과 같은 위-십이지장 운동성 변화, 위 및 십이지장의 만성 염증, 중추신경계 이상등을 통해 직접적으로 증상 발현에 영향을 미친다.17
박테리아, 진균류, 진핵생물 및 바이러스 등을 포함한 약 100조 개의 공생 미생물총(microbiota) 이 인간의 장에 상재균(commensal bacteria) 으로 존재한다. 장내 미생물총은 병원균침입을 방어하고, 면역체계를 성숙시키며 비타민과 단쇄지방산을 생산하여 인체 대사 조절에 관여한다. 이는 인체와 상호작용을 통해 각종 질병에 큰 영향을 미친다.18 이 중 가장많은 부분은 박테리아이며, 약 100 여 종이 존재하는데 크게 4개의 문(phyla) 으로 구분될 수 있다. 그람음성균이면서 수소를 생산하는 박테로이데테스(Bacteroidetes), 그람양성균이면서 짧은사슬지방산을 생산하는 후벽균문(Firmicutes), 프로테오박테리아(Proteobacteria) 및 방선균(Actinobacteria)이 바로 그것이다. 이 중 Bacteroides 종으로 구성된 Bacteroidetes 와 Firmicutes가 대부분을 차지하고 있다. 개인 간의 미생물총의 구성은 아주 다양하며, 환경과 유전의 영향을 고루 받는다. 쌍둥이에서도 장내 미생물 종(species) 은 약 50% 미만에서만일치하며, 한국인은 외국인과 비교하여 사람 간 장내 미생물총의 구성 차이가 적어, 숙주 유전자와 식사습관이 장내 미생물총의 구성에 영향을 주는 것으로 추정된다.19
인간이 섭취한 식품성분은 장내 미생물총에 의해 다양한대사산물(metabolites) 로 전환된다. 복합 탄수화물은 대부분아세트산, 프로피온산, 부티르산 등의 단쇄지방산을 생성하는데, 특히 부티르산을 생산하는 점은 장뇌축의 기능에 있어 중요하며, 장표피 세포벽을 공고하게 하고, 면역계를 향상시키는 점에서 유리하다. 이러한 다양한 대사산물들은 장표피를통해 확산해 들어가 면역체계를 활성화시키고 장뇌신경계(enteric nervous system) 와 연결된다.20
이처럼 장내 미생물총은 위장건강 뿐 아니라 전신의 면역항상성 유지와 관계되어 있기 때문에 변화된 장내미생물총은 비만과 지방간, 자가면역질환, 과민성 장증후군과 염증성 장질환 등 다양한 질환의 발생에 관여될 수 있다.21 한편 최근에는 십이지장의 장내 미생물총, 식품에 함유된 항원 또는 감염등은 십이지장의 미세 염증을 유발시켜 기능성 소화불량증의 일부 증상을 발현시킬 수 있다는 가설이 제시되었다.22 이러한새로운 가설은 아직까지 기능성 소화불량증에 대한 진단이나 치료가 충분하지 못한 현실에서, 잠재적으로 새로운 치료의표적을 확보한다는 점에서 중요한 의미가 있다고 하겠다. 다음에서는 기능성 소화불량증에서 나타나는 장내미생물 불균형과 이에 따른 변화들에 대해 소개해 보고자 한다.
이상 감각운동기능(sensorimotor function)은 기능성 소화불량증, 특히 식후고통증후군 환자의 발병기전에 있어 한 축을 담당한다.23 장내 미생물 불균형(intestinal dysbiosis) 은 상부위장관 운동성에 영향을 미칠 수 있는데, 무균 mice의 경우 장관신경계(enteric nervous system, ENS) 발달이 매우 미성숙하며, 적은 장관 내 운동신경총이 관찰된다.24 한편이와 같은 미성숙한 ENS는 정상 세균총의 이식 및 정착으로 빠르게 정상화될 수 있음이 확인되었는데, 이는 장내 미생물불균형이 해소되면 장관 운동성이 회복될 수도 있음을 시사한다. 장점막 표피에 위치한 장내분비세포(enteroendocrine cells)는 장내미생물로부터의 트립토판(triptophan) 과 같은 대사산물 자극을 받아들여 장관계와 미주신경계를 모두 활성화시키는 과정을 나타내는데, 이러한 기전이 위장관 운동성증대에 관여하는 것으로 생각된다.25
장내세균은 우리 장 속에서 살아가며 다양한 대사산물을만드는데, 이는 장 점막에 있는 혈관으로 흡수돼 인체의 각부분을 순환하며 영향을 준다. 이 중 단쇄지방산과 담즙산(bile acid) 과 같은 대사산물은 그 자체로 장운동촉진 기능을 갖고있음이 알려졌다.26 특히, 십이지장 내에 존재하는 단쇄지방산의 경우 장운동을 촉진할 뿐 아니라, 십이지장에서의 중탄산염(bicarbonate) 의 분비조절을 담당하며, 세균과증식에 의한 기능성 소화불량증의 제증상도 줄일 수 있는 다양한 효과가 보고되었다.27 또한, 대장균(Escherichia coli)이 생산하는 lipopolysaccharide 가 유의한 위배출속도 저하를 가져오며,28 비피도박테리움 락티스(Bifidobacterium lactis)의 임상적 투여는 복부팽만을 줄이고, 소장의 운동성을 증대시켜 증상 호전을가져올 수 있다.29
2007년 Talley 등이 조기 포만감에서 우세하게 나타나는식후고통증후군 환자에서 십이지장 점막의 호산구 증가가 특징적으로 나타남을 처음 제안한 이래, Walker 등30이 이들 질환군이 천식 등 알러지와 연관성이 있음을 보고하였다. Vanheel 등31은 기능성 소화불량증 환자들은 저등급 십이지장 염증 상태에 놓여 있으며, 이는 점막 호산구의 침윤과 비만세포(mast cell) 로 확인된다고 보았다. 그러면서 표피세포 간치밀이음(tight junction) 수준에서의 접합단백질(adhesion protein) 의 비정상적인 발현으로 인한 십이지장 장점막통합성 손상(impaired duodenal mucosal integrity) 과 투과도 증가 현상이 나타남을 보여주었다. 이와 같은 현상은 호산구와비만세포의 증가와 탈과립이 대조군과 비교하여 기능성 소화불량증 환자에서 유의하게 증가하여, 이에 기인한 T세포 연관알레르기 반응이 활성화되고, 그로 인한 점막하층의 신경세포칼슘 신호체계가 감소되는 것에서 기인하는 것으로 여겨진다.32 이러한 만성적인 저등급의 염증반응은 체성 통증 과민성을 일으키고, 신경근육세포들의 기능과 면역세포 활성도를저하시킨다. 또한 불안이나 우울과 같은 심리학적 요인들이만성적 염증반응과 상호 영향을 주고받는 것으로 보이는데,심리학적 스트레스와 이로 인한 코르티코트로핀분비호르몬(corticotropin releasing hormone) 분비가 십이지장의 국소염증과 전신적 염증반응을 증대시키기도 하며,33 이것과 반대방향으로 장뇌축의 영향으로 장내 염증이 심리학적 이상의 원인이 될 수 있다는 연구도 있다(Fig. 1).34
이러한 연구들은 기능성 소화불량증 치료에 있어서의 호산구 면역학적 기전의 활용 가능성에 대한 관심을 불러 일으키고 있으나, 호산구 질환의 치료에 있어 주로 사용되는 스테로이드(corticosteroids)는 아직까지 기능성 소화불량증과 관련해서는 성인을 대상으로 한 연구는 없는 실정이다.
위에서 소개한 바와 같이, 장내미생물 불균형은 기능성 소화불량증의 발병기전에 관여할 수 있음이 알려지고 있다(Table 1). Nakae 등35은 기능성 소화불량증 환자와 정상군(healthy control) 간의 위액 16S rRNA 유전자 시퀀싱을 통해 미생물 균종 다양성과 구성 차이를 비교하였다. 그 결과미생물총의 다양성 면에서 실험군이 유의하게 적은 모습을 보여주었고, 특히 Prevotella 종의 비율이 정상군에 비해 유의하게 낮고, Bifidobacterium, Clostridium 등은 증가되는 것이확인되었다. 한편 이와 유사하게 위액 연구를 진행한 Igarashi group에서는 Bacteroidetes/Proteobacteria 의 비율이 정상군에서는 <1 이하이던 것이, 기능성 소화불량증에서는 5 이상으로 상승하였으며, Actinobacter 군의 부재가 나타나는 것을 보고하였다.36 이와 같은 위액 내 미생물총 변화가 소장운동성 저하에 따른 위장 내용물의 역류로 인한 이차적인 변화인 것인지, 아니면 이와 같은 운동성 저하에 기여하는 원인요인인지는 명확하지 않은 상태이다.
앞서 언급한 대로, 십이지장의 저등급 염증과 장점막 투과도증가가 기능성 소화불량증의 병인기전에 있어 하나의 대안가설로 제시되면서 이후의 연구들은 십이지장의 장내 미생물총 구성에 보다 관심을 갖게 되었다. 기능성 소화불량증 환자와 정상군의 위와 십이지장 점막연관 미생물총을 모두 연구한Shanahan 등37은 십이지장에서는 Veionella 속이 상대적으로풍부하면서 위 배출 시간과 유의한 음의 상관관계를 확인하였지만, 위 점막에서는 이와 같은 관계를 관찰하지 못하였다. Streptococcus 는 십이지장 점막에서 가장 우세를 점하는 균종인데, Zhong 등38은 기능성 소화불량증 환자의 십이지장 점막Streptococcus 종의 분포가 내강 내에서 더욱 압도적인 우세종으로 변화하여 다른 균종의 비율을 낮추는 모습을 관찰하였다. 이에 따라 Fukui 등39은 구강, 식도, 위, 십이지장 등의상부위장관 각 부분 모두의 점막 샘플을 브러시로 수집하여점막연관 미생물총(mucosa associated microbiota) 을 분석함과 동시에 위장 증상을 함께 평가하였는데, 속(genus) 수준에서 Streptococcus 는 상부위장관의 모든 부위에서 유의하게증가함이 나타났다. 이와 같은 십이지장에서의 Streptococcus 의 상대적 풍부함은 각종 상부위장 증상들과 양의 상관관계가나타났는데, 연구자들은 위 및 십이지장의 연쇄상 구균 균주는호중구의 활성화, heparin-binding protein 및 "resistin" 등과같은 염증반응 촉진물질의 생산 증가 등으로 염증 유발 상태를가져와 기능성 소화불량증의 증상 발현에 기여한다고 생각하였다.40
이와 같은 변화는 기능성 소화불량증의 증상 발생에 있어십이지장 점막의 박테리아 변화의 중요성을 보여주고 있으며, 양성자펌프억제제 등과 같은 치료제들의 일관적이지 못한 치료 성적을 설명해 줄 수도 있을 것으로 생각된다.
기능성 소화불량증 환자에서 PPI와 같은 위산억제제는 몇안 되는 선택지 중의 하나이다. PPI는 십이지장의 위산 노출을 줄여 점막 보호효과를 갖는다. 일부 전향적 연구에서 PPI 의 투약으로 십이지장 점막의 호산구 연관 염증을 줄이고, 증상을 개선시켰다는 보고도 있다.41 이는 점막 보호효과에 따른점막 투과성 감소로 인한 결과로 보인다. 다만, 약제의 치료효과에 있어서는 환자마다 매우 큰 차이가 나타나는 것이 현실이다. 일부 환자들은 약으로 증상이 전혀 개선되지 않으며, 특히 약제 투약 첫 1주간 증상 개선이 없는 환자군에서는 오히려 이를 복용하였을 때에 복부팽만(bloating) 과 같은 증상이 증가한다고 호소하기도 한다.42
1,800명의 대규모 영국 쌍둥이의 분변 미생물총을 통해 PPI 사용군의 장내미생물총의 특징을 분석해 보았을 때, 이들은장내미생물 다양성 지수가 억제제를 사용하지 않는 대조군과 비교하여 유의하게 낮았으며, 분변 내 Actinomycetales, Lactobacillales 그리고 Streptococcaceae과의 유의한 풍부도 증가가 관찰되었다.43 저자들은 약제의 사용으로 위산이 감소해 구강 상재균의 차단벽이 상실된 것을 원인으로 지적하였다. 유사한 연구 결과로, Imhann 등44은 PPI 사용군에서 Rothia 속과같은 구강 상재균의 과발현과 Enterococcus, Streptococcus, Staphylococcus 및 Escherichia coli 와 같은 균종의 증가를확인하였다. 한편, 조직검사를 통해 위 점막연관 미생물총의차이를 확인한 연구에서도 헬리코박터 파일로리 균 감염 여부와 상관없이 Streptococcus 가 약물 사용과 관련하여 유의하게증가하였다.45 이와 같은 변화는 단지 기능성 소화불량증 환자에 그치지 않고 간경화 등과 같은 질환군에서도 일관적으로나타나는 것으로 보인다.46 장 점막이 치주 질환균 포르피로모나스 긴기발리스(Porphyromonas gingivalis)에 감염되면, 장 밀착 연접을 구성하는 세포 접합 단백질(Tjp 1)의 발현이 감소하는 현상47을 볼 때, 이와 같은 미생물총 변화는 장투과도를증가시키는 역할을 하는 것으로 볼 수 있다.
PPI 는 건강인과 기능성 소화불량증의 하위 환자들 각각에서 서로 다른 주효과를 갖는 것으로 생각된다. 일부 기능성소화불량증 환자에서는 점막 투과성 감소(improved mucosal permeability) 로 인한 증상 개선을 그리고 건강인과 식후고통증후군 등 환자의 일부에서는 오히려 장내미생물총 이상(dysbiosis) 으로 인한 증상 악화를 가져오는 것으로 추정된다. 따라서 기능성 소화불량증 환자에게 PPI를 사용할 때는초기표준용량에도 반응이 없다면, 이를 히스타민 수용체 길항제(H2-receptor antagonist) 로 대체하거나 투약 중지를 고려하고, 중복 증후군(EPS-PDS overlap) 환자들에게는 위장운동촉진제(prokinetics) 투약을 우선 고려해야 한다.48 향후에는PPI 치료로 인한 십이지장 호산구의 변화와 기능성 소화불량증 증상 개선 사이의 인과관계를 입증해야 한다는 과제가 남아 있다. 아울러 기능성 소화불량증에서 칼륨경쟁적 위산분비억제제의 십이지장 점막 안정화 효과를 검증해 보아야 하고,탄산수소나트륨이 갖는 복부팽만 개선 효과49를 감안할 때에PPI/ 탄산수소나트륨 복합제의 사용은 미생물총 이상 없이 점막투과도 개선 효과를 온전히 가질 수 있는지도 확인해 보아야 하겠다.
기능성 소화불량증에서의 장내미생물총 조절을 통한 증상개선의 노력은 크게 2가지 형태의 중재 방법으로 나타났다. 첫 번째는 프리/프로바이오틱스 및 포스트바이오틱스의 활용이다. 이와 같은 장내미생물총 개선 노력에 따른 부가적인 증상 개선이 가능할 수 있다는 가설 하에 여러 개별 연구의 데이터가 이 가설을 검증하였다. PPI 단독 사용과 PPI 와 Bacillus coagulans, Bacillus subtilis 를 함께 투약한 군을 비교한 최근의 무작위 이중맹검 위약대조군 연구에서 프로바이오틱스투약군은 faecalibacterium, roseburia, leuconostocaceae 등의 SCFA 생산 유익균이 증가하여 식후고통증후군의 정량적 증상 개선을 가져왔다.50 한편, Lactobacillus gasseri 를 함유한 요거트를 섭취시킨 기능성 소화불량증 환자에서는 명치통증증후군 환자들에게는 효과가 없었고, 식후고통증후군 환자에서만 효과가 선별적으로 나타나는 모습을 보여주었다.51 하지만 이러한 일부 연구들의 해석에는 주의가 필요한데, 최근의 5개의 무작위 대조 연구의 데이터를 이용한 메타분석결과는 프로바이오틱스 단독 사용은 기능성 소화불량증의 증상 개선에 유의한 연관성이 없다고 보고하였기 때문이다.52 또한 아직까지는 연구가 부족하기 때문에 앞서 언급한 균종들이다른 균종의 투약에 비해 우월한 효과를 갖는지 단언하기 어렵다. 따라서 본 주제와 관련해서는 추가적인 검증이 필요한 실정이다.
두 번째는 rifaximin과 같은 흡수되지 않는 위장관 항생제의 사용이다. 기능성 소화불량증에 대한 이와 같은 항생제의효과는 이미 무작위 대조군 연구에서 여러 차례 검증된 바있다. 특히 복부팽만(bloating and flatulence) 에 있어서는 위약 대비 10% 정도 더 치료 효과를 갖는 것으로 보인다.53 하루 600 mg에서 2,400 mg까지의 용량을 단기간(7-14일) 사용하게 되며 향후에는 최적의 용량을 확인하고 항생제 내성이나 Clostridium difficile 감염을 일으킬 수 있는 하위 그룹을 확인하는 후속 연구가 필요하다.
대변 미생물총 이식(fecal microbiota transplantation) 의 경우는 아직 연구가 없으나, 건강한 미생물군을 사용하여 장내 미생물총을 회복시킴으로써 최근에 중증 과민성대장증후군에서의 활용 예가 나타나고 있다.54 이에 따라 향후 불응성 미생물총 불균형으로 인해 만성적으로 증상을 보이는 기능성 소화불량증 환자군에서도 선택적으로 적용할 수 있을 것으로 기대된다.
앞선 여러 연구들에서 십이지장 생검으로 평가된 증가된십이지장 점막의 투과도는 기능성 소화불량증의 증상 발현에 중요한 역할을 할 수 있다. 여기서 생체 내(in vivo) 여러 정량화된 지표를 통해 기능성 소화불량증의 진단을 돕고 중증도를평가하며 아울러 치료의 추적에서 활용해 보고자 하는 노력들이 전개되었다.
전통적인 방법은 혈청의 조눌린(zonulin) 이 자주 사용되어왔다. 조눌린은 가역적인 밀착연접(tight junction) 의 분해가가능하므로 점막 투과성 조절과정에 관계가 있는 단백질이다.55 이러한 조눌린 경로의 조절 장애 및 장 투과성 증가로 인한 “장 누수”로 인해 이는 장점막 장벽의 투과도를 평가하는 대중적인 마커로 부각되어 왔다. 연구들은 건강한 개인과 비교하여기능성 소화불량 환자 그룹에서의 조눌린 수준 차이를 보고하였다.56 아직까지는 데이터가 부족하고, Talley 그룹57에서도 이와상반되는 연구 결과를 최근에 발표하기도 하였으나 측정 방법을표준화한다면 여전히 잠재력 있는 바이오마커로 인정된다.
엑소좀의 마이크로 RNA (miRNAs) 는 질병 특이적 특성을나타내며, 종양학에서 바이오마커로 적용되는 물질이다. 위액의microarray 검사를 통한 miRNA 의 분석 결과 hsa-miR-933 은 정상대조군에 비해 기능성 소화불량증에서 유의하게 낮게 나타난 것이 확인되었다.58 또한 hsa-miR-933 수치는 기능성 소화불량증 증상지표 및 그 빈도에 있어서 역의 상관관계가 있다고알려졌다.
이 외에도 십이지장 및 공장 임피던스(duodenal and jejunal baseline impedence) 를 측정하는 방법이 있다. Nakagawa 등59은 임상 연구를 통해 기능성 소화불량 환자에서의 보행성식도내압검사 및 임피던스 검사(HRM/Z)를 통해서 환자군의기저 임피던스 수치가 정상대조군에 비해 유의하게 낮음을 확인할 수 있었다. 최근에는 십이지장 상피 장벽의 손상 정도를직접 확인하는 공초점 레이저 현미경 내시경(confocal laser endoscopy) 을 통해 기능성 소화불량증의 높은 상피 결손율을확인하고, 이를 표피세포 피부저항(transepithelial electric resistance, TEER) 과 일치함을 확인한 연구도 있었다.60 이들은 비록 생물학적 단백질 및 유전자로 표현되는 바이오마커는아니지만 정량화, 시각화된 기능성 소화불량증의 진단 및 추적에 도움을 줄 것으로 기대된다.
Notes
REFERENCES
1. Koloski NA, Talley NJ, Boyce PM. 2002; Epidemiology and health care seeking in the functional GI disorders: a population-based study. Am J Gastroenterol. 97:2290–2299. DOI: 10.1111/j.1572-0241.2002.05783.x. PMID: 12358247.

2. Stanghellini V, Chan FK, Hasler WL, et al. 2016; Gastroduodenal disorders. Gastroenterology. 150:1380–1392. DOI: 10.1053/j.gastro.2016.02.011. PMID: 27147122.

3. Törnblom H, Abrahamsson H, Barbara G, et al. 2005; Inflammation as a cause of functional bowel disorders. Scand J Gastroenterol. 40:1140–1148. DOI: 10.1080/00365520510023657. PMID: 16265771.

4. Pimentel M. 2010; An evidence-based treatment algorithm for IBS based on a bacterial/SIBO hypothesis: part 2. Am J Gastroenterol. 105:1227–1230. DOI: 10.1038/ajg.2010.125. PMID: 20523308.

5. Futagami S, Itoh T, Sakamoto C. 2015; Systematic review with meta-analysis: post-infectious functional dyspepsia. Aliment Pharmacol Ther. 41:177–188. DOI: 10.1111/apt.13006. PMID: 25348873.

6. Talley NJ, Walker MM, Aro P, et al. 2007; Non-ulcer dyspepsia and duodenal eosinophilia: an adult endoscopic population-based casecontrol study. Clin Gastroenterol Hepatol. 5:1175–1183. DOI: 10.1016/j.cgh.2007.05.015. PMID: 17686660.

7. Vanheel H, Carbone F, Valvekens L, et al. 2017; Pathophysiological abnormalities in functional dyspepsia subgroups according to the Rome III criteria. Am J Gastroenterol. 112:132–140. DOI: 10.1038/ajg.2016.499. PMID: 27958284.

8. Kim SE, Kim N, Lee JY, et al. 2018; Prevalence and risk factors of functional dyspepsia in health check-up population: a nationwide multicenter prospective study. J Neurogastroenterol Motil. 24:603–613. DOI: 10.5056/jnm18068. PMID: 29938463. PMCID: PMC6175566.

9. Suzuki H, Hibi T. 2011; Overlap syndrome of functional dyspepsia and irritable bowel syndrome - are both diseases mutually exclusive? J Neurogastroenterol Motil. 17:360–365. DOI: 10.5056/jnm.2011.17.4.360. PMID: 22148104. PMCID: PMC3228975.

10. Pike BL, Porter CK, Sorrell TJ, Riddle MS. 2013; Acute gastroenteritis and the risk of functional dyspepsia: a systematic review and meta-analysis. Am J Gastroenterol. 108:1558–1564. DOI: 10.1038/ajg.2013.147. PMID: 23711623.

11. Paula H, Grover M, Halder SL, et al. 2015; Non-enteric infections, antibiotic use, and risk of development of functional gastrointestinal disorders. Neurogastroenterol Motil. 27:1580–1586. DOI: 10.1111/nmo.12655. PMID: 26303310. PMCID: PMC4624515.

12. Holtmann G, Gschossmann J, Buenger L, Gerken G, Talley NJ. 2002; Do changes in visceral sensory function determine the development of dyspepsia during treatment with aspirin? Gastroenterology. 123:1451–1458. DOI: 10.1053/gast.2002.36556. PMID: 12404219.

13. Koloski NA, Jones M, Weltman M, et al. 2015; Identification of early environmental risk factors for irritable bowel syndrome and dyspepsia. Neurogastroenterol Motil. 27:1317–1325. DOI: 10.1111/nmo.12626. PMID: 26202154.

14. Jung JG, Yang JN, Lee CG, et al. 2016; Visceral adiposity is associated with an increased risk of functional dyspepsia. J Gastroenterol Hepatol. 31:567–574. DOI: 10.1111/jgh.13146. PMID: 26313910.

15. Deding U, Torp-Pedersen C, Bøggild H. 2017; Perceived stress as a risk factor for dyspepsia: a register-based cohort study. Eur J Gastroenterol Hepatol. 29:560–567. DOI: 10.1097/MEG.0000000000000831. PMID: 28350746.
16. Brook RA, Kleinman NL, Choung RS, Smeeding JE, Talley NJ. 2012; Excess comorbidity prevalence and cost associated with functional dyspepsia in an employed population. Dig Dis Sci. 57:109–118. DOI: 10.1007/s10620-011-1822-8. PMID: 21750928.

17. Enck P, Azpiroz F, Boeckxstaens G, et al. 2017; Functional dyspepsia. Nat Rev Dis Primers. 3:17081. DOI: 10.1038/nrdp.2017.81. PMID: 29099093.

18. Clemente JC, Ursell LK, Parfrey LW, Knight R. 2012; The impact of the gut microbiota on human health: an integrative view. Cell. 148:1258–1270. DOI: 10.1016/j.cell.2012.01.035. PMID: 22424233. PMCID: PMC5050011.

19. Nam YD, Jung MJ, Roh SW, Kim MS, Bae JW. 2011; Comparative analysis of Korean human gut microbiota by barcoded pyrosequencing. PLoS One. 6:e22109. DOI: 10.1371/journal.pone.0022109. PMID: 21829445. PMCID: PMC3146482.

20. Charney AN, Micic L, Egnor RW. 1998; Nonionic diffusion of short-chain fatty acids across rat colon. Am J Physiol. 274:G518–G524. DOI: 10.1152/ajpgi.1998.274.3.G518. PMID: 9530153.
21. Ko JS. 2013; The intestinal microbiota and human disease. Korean J Gastroenterol. 62:85–91. DOI: 10.4166/kjg.2013.62.2.85. PMID: 23981941.

22. Talley NJ. 2017; Editorial: moving away from focussing on gastric pathophysiology in functional dyspepsia: new insights and therapeutic implications. Am J Gastroenterol. 112:141–144. DOI: 10.1038/ajg.2016.519. PMID: 28050031.

23. Barbara G, Feinle-Bisset C, Ghoshal UC, et al. The intestinal microenvironment and functional gastrointestinal disorders. Gastroenterology. 2016; Feb. 18. [Epub ahead of print]. DOI: 10.1053/j.gastro.2016.02.028. PMID: 27144620.

24. De Vadder F, Grasset E, Mannerås Holm L, et al. 2018; Gut microbiota regulates maturation of the adult enteric nervous system via enteric serotonin networks. Proc Natl Acad Sci U S A. 115:6458–6463. DOI: 10.1073/pnas.1720017115. PMID: 29866843. PMCID: PMC6016808.

25. Ye L, Bae M, Cassilly CD, et al. 2021; Enteroendocrine cells sense bacterial tryptophan catabolites to activate enteric and vagal neuronal pathways. Cell Host Microbe. 29:179–196.e9. DOI: 10.1016/j.chom.2020.11.011. PMID: 33352109. PMCID: PMC7997396.

26. Tziatzios G, Gkolfakis P, Papanikolaou IS, et al. 2020; Gut microbiota dysbiosis in functional dyspepsia. Microorganisms. 8:691. DOI: 10.3390/microorganisms8050691. PMID: 32397332. PMCID: PMC7285034.

27. Kaji I, Iwanaga T, Watanabe M, et al. 2015; SCFA transport in rat duodenum. Am J Physiol Gastrointest Liver Physiol. 308:G188–G197. DOI: 10.1152/ajpgi.00298.2014. PMID: 25394661. PMCID: PMC4312951.

28. Collares EF. 1997; Effect of bacterial lipopolysaccharide on gastric emptying of liquids in rats. Braz J Med Biol Res. 30:207–211. DOI: 10.1590/S0100-879X1997000200008. PMID: 9239306.

29. Agrawal A, Houghton LA, Morris J, et al. 2009; Clinical trial: the effects of a fermented milk product containing Bifidobacterium lactis DN-173 010 on abdominal distension and gastrointestinal transit in irritable bowel syndrome with constipation. Aliment Pharmacol Ther. 29:104–114. DOI: 10.1111/j.1365-2036.2008.03853.x. PMID: 18801055.

30. Walker MM, Salehian SS, Murray CE, et al. 2010; Implications of eosinophilia in the normal duodenal biopsy - an association with allergy and functional dyspepsia. Aliment Pharmacol Ther. 31:1229–1236. DOI: 10.1111/j.1365-2036.2010.04282.x. PMID: 20222916.

31. Vanheel H, Vicario M, Vanuytsel T, et al. 2014; Impaired duodenal mucosal integrity and low-grade inflammation in functional dyspepsia. Gut. 63:262–271. DOI: 10.1136/gutjnl-2012-303857. PMID: 23474421.

32. Cirillo C, Bessissow T, Desmet AS, Vanheel H, Tack J, Vanden Berghe P. 2015; Evidence for neuronal and structural changes in submucous ganglia of patients with functional dyspepsia. Am J Gastroenterol. 110:1205–1215. DOI: 10.1038/ajg.2015.158. PMID: 26077177.

33. Vanuytsel T, van Wanrooy S, Vanheel H, et al. 2014; Psychological stress and corticotropin-releasing hormone increase intestinal permeability in humans by a mast cell-dependent mechanism. Gut. 63:1293–1299. DOI: 10.1136/gutjnl-2013-305690. PMID: 24153250.

34. Koloski NA, Jones M, Kalantar J, Weltman M, Zaguirre J, Talley NJ. 2012; The brain--gut pathway in functional gastrointestinal disorders is bidirectional: a 12-year prospective population-based study. Gut. 61:1284–1290. DOI: 10.1136/gutjnl-2011-300474. PMID: 22234979.

35. Nakae H, Tsuda A, Matsuoka T, Mine T, Koga Y. 2016; Gastric microbiota in the functional dyspepsia patients treated with probiotic yogurt. BMJ Open Gastroenterol. 3:e000109. DOI: 10.1136/bmjgast-2016-000109. PMID: 27752337. PMCID: PMC5051319.

36. Igarashi M, Nakae H, Matsuoka T, et al. 2017; Alteration in the gastric microbiota and its restoration by probiotics in patients with functional dyspepsia. BMJ Open Gastroenterol. 4:e000144. DOI: 10.1136/bmjgast-2017-000144. PMID: 28761692. PMCID: PMC5508964.

37. Shanahan ER, Shah A, Do A, et al. 2018; 146 - duodenal mucosa-associated microbiota (MAM) and gastric emptying: veillonella in the duodenal MAM linked to slow gastric emptying. Gastroenterology. 154(Suppl 1):S–40. DOI: 10.1016/S0016-5085(18)30604-8.

38. Zhong L, Shanahan ER, Raj A, et al. 2017; Dyspepsia and the microbiome: time to focus on the small intestine. Gut. 66:1168–1169. DOI: 10.1136/gutjnl-2016-312574. PMID: 27489239.

39. Fukui A, Takagi T, Naito Y, et al. 2020; Higher levels of streptococcus in upper gastrointestinal mucosa associated with symptoms in patients with functional dyspepsia. Digestion. 101:38–45. DOI: 10.1159/000504090. PMID: 31752012.

40. Snäll J, Linnér A, Uhlmann J, et al. 2016; Differential neutrophil responses to bacterial stimuli: streptococcal strains are potent inducers of heparin-binding protein and resistin-release. Sci Rep. 6:21288. DOI: 10.1038/srep21288. PMID: 26887258. PMCID: PMC4758080.

41. Wauters L, Ceulemans M, Frings D, et al. 2021; Proton pump inhibitors reduce duodenal eosinophilia, mast cells, and permeability in patients with functional dyspepsia. Gastroenterology. 160:1521–1531.e9. DOI: 10.1053/j.gastro.2020.12.016. PMID: 33346007.

42. Bolling-Sternevald E, Lauritsen K, Talley NJ, Junghard O, Glise H. 2003; Is it possible to predict treatment response to a proton pump inhibitor in functional dyspepsia? Aliment Pharmacol Ther. 18:117–124. DOI: 10.1046/j.1365-2036.2003.01651.x. PMID: 12848633.

43. Jackson MA, Goodrich JK, Maxan ME, et al. 2016; Proton pump inhibitors alter the composition of the gut microbiota. Gut. 65:749–756. DOI: 10.1136/gutjnl-2015-310861. PMID: 26719299. PMCID: PMC4853574.

44. Imhann F, Bonder MJ, Vich Vila A, et al. 2016; Proton pump inhibitors affect the gut microbiome. Gut. 65:740–748. DOI: 10.1136/gutjnl-2015-310376. PMID: 26657899. PMCID: PMC4853569.

45. Paroni Sterbini F, Palladini A, Masucci L, et al. 2016; Effects of proton pump inhibitors on the gastric mucosa-associated microbiota in dyspeptic patients. Appl Environ Microbiol. 82:6633–6644. DOI: 10.1128/AEM.01437-16. PMID: 27590821. PMCID: PMC5086557.

46. Horvath A, Rainer F, Bashir M, et al. 2019; Biomarkers for oralization during long-term proton pump inhibitor therapy predict survival in cirrhosis. Sci Rep. 9:12000. DOI: 10.1038/s41598-019-48352-5. PMID: 31427714. PMCID: PMC6700098.

47. Nakajima M, Arimatsu K, Kato T, et al. 2015; Oral administration of P. gingivalis induces dysbiosis of gut microbiota and impaired barrier function leading to dissemination of enterobacteria to the liver. PLoS One. 10:e0134234. DOI: 10.1371/journal.pone.0134234. PMID: 26218067. PMCID: PMC4517782.

48. Lacy BE, Talley NJ, Locke GR 3rd, et al. 2012; Review article: current treatment options and management of functional dyspepsia. Aliment Pharmacol Ther. 36:3–15. DOI: 10.1111/j.1365-2036.2012.05128.x. PMID: 22591037. PMCID: PMC3970847.

49. Pellicano R, Strona S, Simondi D, et al. 2009; Benefit of dietary integrators for treating functional dyspepsia: a prospective pilot study. Minerva Gastroenterol Dietol. 55:227–235. PMID: 19829282.
50. Wauters L, Slaets H, De Paepe K, et al. 2021; Efficacy and safety of spore-forming probiotics in the treatment of functional dyspepsia: a pilot randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol. 6:784–792. DOI: 10.1016/S2468-1253(21)00226-0. PMID: 34358486.

51. Ohtsu T, Takagi A, Uemura N, et al. 2017; The ameliorating effect of lactobacillus gasseri OLL2716 on functional dyspepsia in helicobacter pylori-uninfected individuals: a randomized controlled study. Digestion. 96:92–102. DOI: 10.1159/000479000. PMID: 28768250. PMCID: PMC5637312.

52. Zhang J, Wu HM, Wang X, et al. 2020; Efficacy of prebiotics and probiotics for functional dyspepsia: a systematic review and meta-analysis. Medicine (Baltimore). 99:e19107. DOI: 10.1097/MD.0000000000019107. PMID: 32049821. PMCID: PMC7035106.
53. Yoon K, Kim N, Lee JY, et al. 2018; Clinical response of rifaximin treatment in patients with abdominal bloating. Korean J Gastroenterol. 72:121–127. DOI: 10.4166/kjg.2018.72.3.121. PMID: 30270593.

54. Johnsen PH, Hilpüsch F, Cavanagh JP, et al. 2018; Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial. Lancet Gastroenterol Hepatol. 3:17–24. DOI: 10.1016/S2468-1253(17)30338-2. PMID: 29100842.

55. Tripathi A, Lammers KM, Goldblum S, et al. 2009; Identification of human zonulin, a physiological modulator of tight junctions, as prehaptoglobin-2. Proc Natl Acad Sci U S A. 106:16799–16804. DOI: 10.1073/pnas.0906773106. PMID: 19805376. PMCID: PMC2744629.

56. Dunlop SP, Hebden J, Campbell E, et al. 2006; Abnormal intestinal permeability in subgroups of diarrhea-predominant irritable bowel syndromes. Am J Gastroenterol. 101:1288–1294. DOI: 10.1111/j.1572-0241.2006.00672.x. PMID: 16771951.

57. Talley NJ, Holtmann GJ, Jones M, et al. 2020; Zonulin in serum as a biomarker fails to identify the IBS, functional dyspepsia and non-coeliac wheat sensitivity. Gut. 69:1–3. DOI: 10.1136/gutjnl-2019-318664. PMID: 31563879.

58. Tanaka F, Takashima S, Nadatani Y, et al. 2020; Exosomal hsa-miR-933 in gastric juice as a potential biomarker for functional dyspepsia. Dig Dis Sci. 65:3493–3501. DOI: 10.1007/s10620-020-06096-7. PMID: 31974910.

59. Nakagawa K, Hara K, Fikree A, et al. 2020; Patients with dyspepsia have impaired mucosal integrity both in the duodenum and jejunum: in vivo assessment of small bowel mucosal integrity using baseline impedance. J Gastroenterol. 55:273–280. DOI: 10.1007/s00535-019-01614-5. PMID: 31468184. PMCID: PMC7026227.

60. Nojkov B, Zhou SY, Dolan RD, et al. 2020; Evidence of duodenal epithelial barrier impairment and increased pyroptosis in patients with functional dyspepsia on confocal laser endomicroscopy and "ex vivo" mucosa analysis. Am J Gastroenterol. 115:1891–1901. DOI: 10.14309/ajg.0000000000000827. PMID: 33156108. PMCID: PMC8409129.

Fig. 1
Changes in the duodenal microenvironment and pathophysiology of functional dyspepsia symptoms. Diverse endoluminal triggers from altered food and/or dysbiosis may lead to both local and systemic immune activation with impaired signaling of duodeno-gastric reflex mechanisms by neuronal changes in afferent nerves of the duodenum. TEER, trans-epithelial electrical resistance; CCR2, C-C chemokine receptor 2; IL, interleukin; TNF-α, tumor necrosis factor-α.
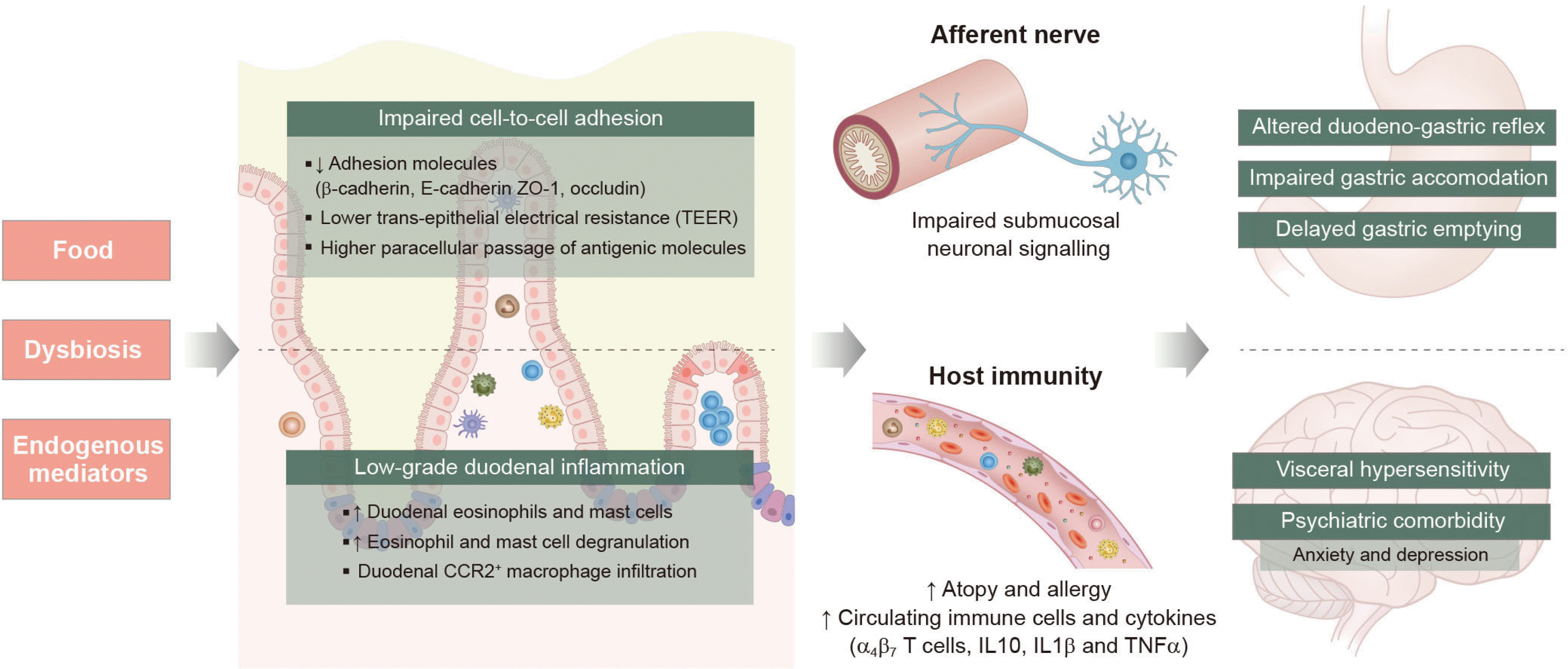
Table 1
Microbiota Studies in FD
| Study | Target | Population composition (FD/controls, n) | Principal findings | Microbiota from |
|---|---|---|---|---|
| Collares28 (1997) | Rats | N/A | Lipopolysaccharide from Escherichia coli induces delayed gastric emptying. | |
| Nakae et al.35 (2016) | Clinical | 44/44 | FD patients have lower levels of Prevotella, while Bifidobacterium, Clostridium increase compared with healthy controls. | Stomach |
| Igarashi et al.36 (2017) | Clinical | 21/21 | Bacteroides/Proteobacteria abundance ratio increases 5-fold in FD group. | Stomach |
| Shanahan et al.37 (2018) | Clinical | 26/10 | Duodenal (MAM) had negative correlation between abundance of Veionella and gastric emptying time, while gastric MAM did not. | Duodenum |
| Zhong et al.38 (2017) | Clinical | 9/9 |
Negative correlation between duodenal bacterial load and quality of life. Abundance of Streptococcus, relative decrease in Prevotella, Veionella and Actinomyces in FD group. |
Duodenum |
| Fukui et al.39 (2020) | Clinical | 11/7 | Higher levels of Streptococcus and Firmicutes in FD Streptococcus abundancy is correlated with symptoms | Intra-oral, esophagus, gastric body/antrum, duodenum |
| Snäll et al.40 (2016) | Clinical | - | HBP and resistin correlated significantly with the strongest association seen in GAS, indicating that Streptococcal strains are potent inducers of neutrophil responses to intraluminal bacteria. | |
| Wauters et al.50 (2021) | Clinical (RCT) | 32/36 (PPI+probiotics/PPI only) | Bacillus coagulans MY01 and Bacillus subtilis MY02 were efficacious and safe in the treatment of functional dyspepsia. | |
| Ohtsu et al.51 (2017) | Clinical (RCT) | 58/58 (yogurt+probiotics/ yogurt only) |
Overall effect on gastric symptoms was more positive in the L. gasseri OLL2716 group compared to that in the placebo group. L. gasseri OLL2716-induced improvements were not found for EPS-like symptoms. |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download