초록
치태세균에 의해 야기되는 괴사성 치주질환은 감염부위에서 위막과 치간사이의 연조직 괴사 및 출혈, 촉진시 통증과 치은 출혈이 관찰된다. 환자들의 구내 세균을 조사해보면 방추균과 나선균이 혼합하여 존재하는 방추스피로헤타 세균총을 가지고 있다. 본 증례는 괴사성 치주질환으로 잠정 진단된 환자 2명을 대상으로 비외과적 치주치료, 3% 과산화수소를 적신 면봉을 이용한 드레싱 후 국소전달항생제를 도포하였고, 치료 전과 초기 치료 3 - 5일 후 치은열구액을 채득하여 실시간 연쇄중합반응법을 이용한 정량분석으로 구강내 미생물수를 측정하였다. 비외과적 치주치료 후 감염부위 치은이 정상으로 회복되었고, 7종 이상 검출되던 치주질환 관련 미생물도 1종만 검출되었다. 결과적으로 비외과적 치주치료를 통해 괴사성 치주질환 환자들의 치주 조직을 정상으로 회복하였다.
Go to : 
Abstract
Necrotizing periodontal disease caused by plaque bacteria is showed clinical findings including pseudo-membrane, interproximal necrosis of the affected area, pain on palpation and gingiva bleeding. Microbiological examination is showed that patients have fusospirochetal bacteria. Two patients who were provisionally diagnosed as necrotizing periodontal disease received nonsurgical periodontal treatments in conjunction with dressing using 3% hydrogen peroxide and local antibiotic delivery. Before and 3 - 5 days after initial treatment, the levels of periodontal bacteria in gingival crevicular fluid obtained using quantitative PCR were compared. After treatment, patients recovered normal gingiva. The number of periodontal diseases related bacterial species decreased from seven or eight to one. As a result, periodontium of patients with necrotizing periodontal disease was recovered to normal periodontium by nonsurgical periodontal treatments.
Go to : 
괴사성 치주질환(necrotizing periodontal disease, NPD)은 급작스러운 발현, 치간유두의 급속한 파괴, 동통 및 치은 출혈 등을 특징으로 가지고 있다.1 Horning과 Cohen2은 NPD에서 나타나는 임상적 증상들을 치간유두의 괴사, 치은 통증, 치은 출혈, 위막, 악취, 발열, 불쾌감, 림프절의 변화 8가지로 보고하였다. 이러한 다양한 증상들 때문에 Vincent’s disease, fusospirochetal gingivitis, trench mouth 등 여러가지 이름으로 불리다가 1999년에 와서야 괴사성 궤양성 치은염(necrotizing ulcerative gingivitis)과 괴사성 궤양성 치주염(necrotizing ulcerative periodontitis)을 포함하는 NPD로 정의되고 분류되었다. 이후 궤양이 괴사의 이차증상으로 간주되면서 괴사성 치은염(necrotizing gingivitis, NG)과 괴사성 치주염(necrotizing periodontitis, NP)으로 변경되었다.3
NPD와 감별진단해야 하는 질환으로는 포진성 치은 구내염, 박리성 치은염, 다형 홍반, 심상 천포창, 방선균증(Actinomycosis), 연쇄구균성 구내염, 매독 감염으로 구내에 발생하는 점막반점, 디프테리아가 있다. 이 중 방선균증, 연쇄구균성 구내염, 매독 감염으로 구내에 발생하는 점막반점, 디프테리아 같은 특정 세균에 의한 감염과 감별진단하기 위해 미생물학적 검사가 시행된다.4 Rosebury5는 NPD에서 방추균과 나선균이 혼합하여 존재하는 방추스피로헤타 세균총이 관찰됨을 언급하였고, NPD에서 Treponema 종, Selenomaonas 종, Fusobacterium 종, Intermedius 종이 공통적으로 관찰된다고 Loesche 등6이 보고하였다.
NPD의 치료의 주 목표는 조직 괴사를 통해 나타나는 구내 통증 및 불편감을 경감시키는 것이다. 이를 위해 비외과적 치주치료가 선호되며, 치석제거술, 치근활택술 등의 기계적 방법과 과산화수소 드레싱, 클로르헥시딘 세정, 전신적 항생제 투여, 국소전달 항생제 적용 등의 화학적 방법이 이용된다.7 위와 같은 치료를 통해 조직 괴사 및 통증이 사라지고 나면 부골이 잔존하거나 분화구 양상이 있을 경우에 추가적인 외과적 시술이나 처치가 고려된다. 일반적으로 NPD에는 기계적 방법에 전신적 항생제를 병행치료 하는 것이 효과적이나 Gomes 등8의 연구에 따르면 NPD같은 급성의 치주질환에서는 기계적 방법을 동반한 국소전달항생제 사용도 효과적이라고 하였다. 또한 이렇게 기계적 방법을 국소전달항생제와 병행하여 치료하였을 때 기계적 방법만 시술했을 때와 구강 미생물 환경을 비교해보면 치주염과 연관된 그람음성세균 제거에 유의성 있게 높은 효과를 보이는 것도 보고되었다.9
따라서 본 증례에서는 국소전달 항생제를 포함한 비외과적 치주치료를 받은 NPD 환자들의 임상 사진과 실시간 연쇄중합반응법을 이용한 정량분석으로 계측된 구강내 미생물수 변화를 통한 치료 효과를 보고하고자 한다.
Go to : 
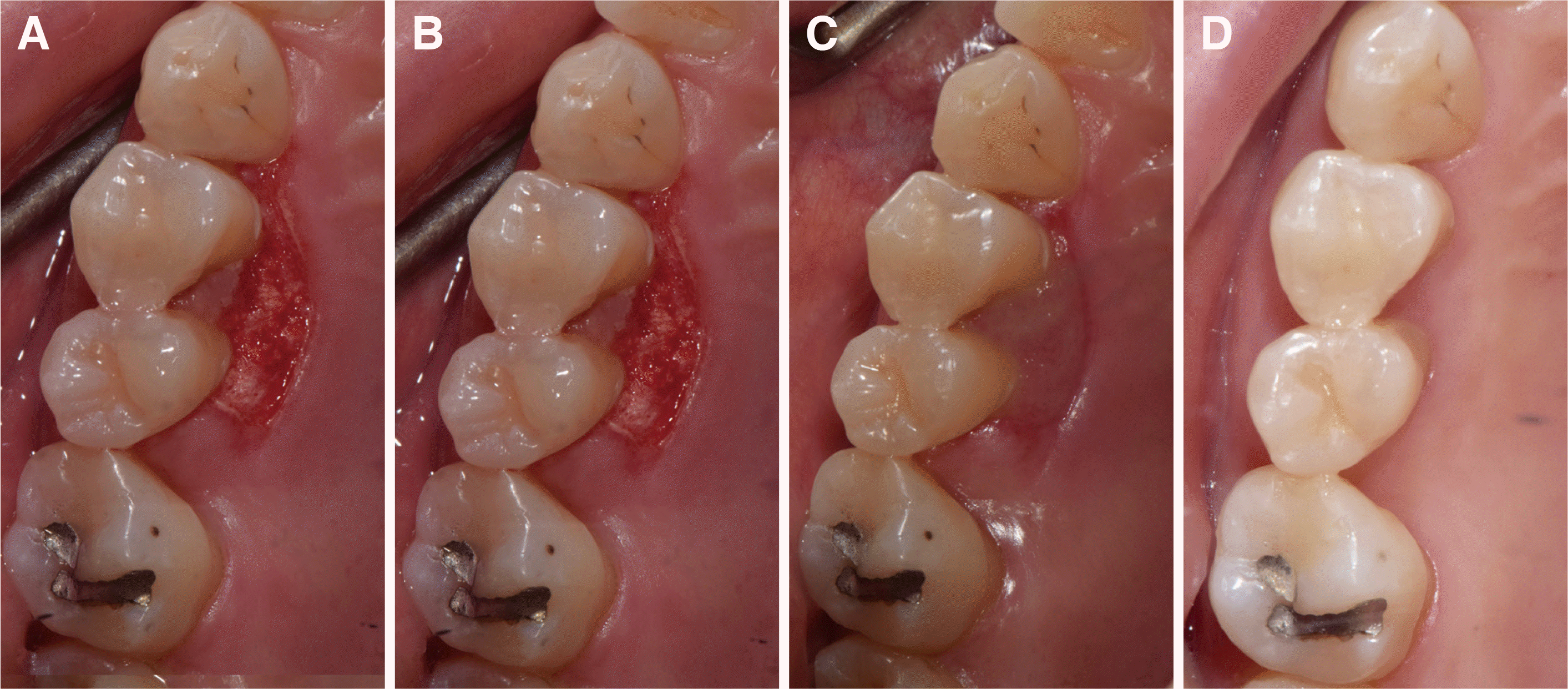
첫번째 증례의 환자(P1)는 만 42세 여환으로 오른쪽 입천장 잇몸이 개인치과에서 치료를 받아도 차도가 없다는 주소로 본원에 내원하였다. 초진시 #14, 15 구개측 및 #14 협측 치은 괴사 및 위막이 있는 상태였고, 파노라마 방사선 사진상 주소 부위 치조골 소실은 없는 상태였다(Fig. 1A). 또한 NPD에 영향을 줄 수 있는 특별한 전신질환이나 치과적 병력은 없었다. 이에 따라 괴사성 치은염(Necrotizing gingivitis, NG)으로 잠정진단하고 치료를 진행하였다.
치료 진행 전에 주소 부위 치은열구에서 페이퍼포인트(Millimeter marked paper pointTM, DiaDent, Cheongju, Korea)를 이용하여 미생물 검사를 위한 치은열구액을 채취하였다. 채취 후 전악 치은연상 치석제거술(supragingival scaling, 이하 치석제거술)을 시행하였고, 주소 부위에는 3% 과산화수소를 적신 면봉으로 세정하였다. 항생제는 Minocycline 성분의 국소전달항생제(Periocline®, Sunstar, Osaka, Japan)를 치은 열구 및 과산화수소 세정으로 위막이 제거된 출혈부위에 도포하였다. 추가적인 복용약 및 구강 세정제(Hydrogen peroxide solution 3%)는 따로 처방하지 않고 잇솔질은 통증이 있는 부위는 피해서 시행하도록 지도하였다.
두번째 치료는 초진 3일 후에 시행하였다. 치료 진행 전에 미생물 검체 채취를 시행하였고, 주소부위에만 추가 치석제거술, 3% 과산화수소수를 적신 면봉을 이용한 세정 그리고 국소전달항생제 도포를 시행하였다. 세번째 치료부터는 일주일 간격으로 미생물 검사 없이 치석제거술과 3% 과산화수소수를 적신 면봉을 이용한 세정 그리고 국소전달항생제 도포하였으며, 다섯번째 치료까지 진행하였다. 주소 부위의 임상적 개선을 평가하기 위해 치료 전후 임상사진을 촬영하여 치유 과정을 관찰하였다(Fig. 1). 5회의 시술 전후 위막이 제거되는 양상이 관찰되었으며, 후속 치료가 진행됨에 따라 괴사부위 크기가 감소하였고, 5회의 치료 후 정상치은 회복이 관찰되었다(Fig. 1D).
초진과 두번째 치료 전에 채취된 치은열구액은 미생물 DNA 추출키트(ExgeneTM Clinic SV mini Kit, GeneAll, Seoul, Korea)를 이용하여 검체에서 구강미생물 DNA를 추출하고, 실시간 중합효소 연쇄반응법(ABI 7500 Fast Real-Time PCR system, Life technologies, Daejeon, Korea)으로 DNA를 증폭함으로써 정량분석하여 미생물수를 조사하였다.10 NPD와의 연관성을 확인하기 위해 치주 질환과 관련이 있다고 알려진 Treponema denticola, Prevotella intermedia (Pi), Fusobacterium nucleatum (Fn), Aggregatibacter actinomycetemcomitans (Aa), Porphyromonas gingivalis, Tannerella forsythia, Parvimonas micra, Campylobacter rectus, Eubacterium nodatum, Prevotella nigrescens (Pn), Eikenella corrodens (Ec)의 11가지 미생물 각각의 정량적 미생물수와 이를 포함한 총 구강 미생물의 수를 측정하였다.11 각 세균의 수는 표준균주의 genomic DNA를 10배수로 희석하여 완성된 표준곡선에 대입하여 DNA copy/ml 단위로 정량화하여 계측하였다(Table 1).
Realtime PCR quantitive data of oral bacteria at Patient 1 and patient 2
검사 결과를 살펴보면 P1의 초진 검사에서는 Aa, Pn, Ec를 제외한 8종의 미생물이 검출되었으며, 총 구강 미생물 대비 치주 질환 관련 미생물이 차지하는 비율이 88%였다. 재진 검사에서는 11종의 미생물 중에서 Fn만 검출되었으며, 총 구강 미생물 대비 치주 질환 관련 미생물이 차지하는 비율도 1.7%로 확연하게 감소하였다.
두번째 증례의 환자(P2)는 만 53세 여환으로 양쪽 어금니 잇몸이 벗겨지고 치료받아도 좋아졌다가 재발하여 계속 아프다는 주소로 내원하였다. 초진시 양측 구치부 협측 치은 괴사, 출혈 및 위막이 점막치은경계 하방까지 있는 상태였고, 방사선 사진상 치조골 소실은 없는 상태였다(Fig. 2A). 과거에도 동일한 증상이 있었다는 치과적 병력을 고려하여 재발성 괴사성 구내염(Necrotizing stomatitis, NS)으로 잠정진단하고 치료를 진행하기로 하였다.
치료계획은 P1과 동일하게 전악 치석제거술을 시행하고, 위막이 있는 구치부에 3% 과산화수소를 적신 면봉을 이용한 세정을 하였다. P2에서는 양측 구치부 세정시 심한 통증을 호소하여 리도카인(Huons Lidocaine HCl and Epinephrine Inj. 1:100,000, Huons, Seongnam, Korea) 국소마취하에 치석제거술과 과산화수소 세정을 진행하였다. 기계적 및 화학적 처치후에 치은열구 및 위막이 제거된 치은 출혈 부위에 국소전달항생제를 도포하고, 복용약은 처방하지 않고 잇솔질은 통증이 있는 부위를 피해서 하도록 지도하였다. P1에서 시행했던 미생물 검사도 동일하게 진행하였다. 두번째 치료는 초진 5일뒤에 진행하였으며, 초진 치료에 큰 차도 없이 양측 구치부 치은에 전반적으로 위막 및 치은 출혈이 나타났다(Fig. 2C). 구내 통증에도 차도가 없어 재진 시에도 국소마취하에 전악 치석제거술을 진행하고, 주소 부위에 3% 과산화수소수를 적신 면봉을 이용한 세정을 시행하였다. P2의 경우 초기 치료에 증상의 개선이 보이지 않아 일주일 간격으로 총 20회의 치주치료가 진행되었다. 장기간의 치료를 진행하고 초진 22주 뒤에 체크하였을때 양호한 치은상태 회복하였다(Fig. 2D).
미생물 검사 결과를 살펴보면 P2의 초진검사에서는 Aa, Pn, Ec 및 Pi도 검출되지 않아 7종의 치주 질환 관련 미생물이 검출되었으며, 총 구강 미생물 대비 치주 질환 관련 미생물이 차지하는 비율은 87%로 확인되었다(Table 1). 재진 검사에서는 P1과 동일하게 Fn만 검출되었으며, 총 구강 미생물 대비 치주 질환 관련 미생물이 차지하는 비율도 1.4%로 감소하였다.
Go to : 
NPD는 포진성 치은 구내염, 박리성 치은염, 다형 홍반, 심상 천포창과 같은 질환들과 종종 혼동되어 정확한 감별진단이 필요하다.12 특히 포진성 치은 구내염과 자주 혼동되는데 NPD와 다르게 아동에서 발생하고, 38°C 이상의 고열과 치간사이에 한정되지 않은 구내증상으로 감별진단이 가능하다.13 본 연구에서 살펴본 2명의 환자들은 모두 만 40세가 넘는 성인으로 38°C 이상의 고열이 없고 위막이 관찰되어 포진성 치은 구내염은 제외하였다. 환자들의 구내에 나타난 치은괴사, 출혈 및 위막의 임상증상들로 NPD를 잠정 진단하였다.
NPD는 증상 범위에 따라 NG, 괴사성 치주염(Necrotizing periodontitis, NP) 그리고 NS로 분류되기도 한다.14 괴사부위가 치은조직에 국한되며 치조골 소실이 없을 때 NG로 분류되며, P1이 해당하는 것으로 판단된다. NP의 경우 부착 소실이 나타나고 괴사부위가 치주인대, 치조골을 포함한 치주조직에 한정되지만 NS는 점막치은경계를 넘어가서 진행되는 경우를 의미한다. P2의 경우 양측 구치부 치은 MGJ 하방으로 위막과 출혈 양상을 보여 NS로 판단된다.
또한 증례들의 치료기간을 살펴보면 P1의 경우 비교적 단기간에 치유가 되었지만, P2의 경우 155일에 걸쳐 20회의 치료가 진행되었다. Formicola 등15은 NPD의 증세에 따라서 score 0에서 5로 분류하였는데, 이 분류에 따르면 국소적인 치간 치은 부위에서만 괴사가 나타난 P1은 치간유두 끝부분에 국소적인 괴사소견을 보이고 탐침이나 촉진시 출혈이 나타나는 Score 1으로 판단되며, 전반적인 구치부 협측 치은 및 점막에 위막 및 괴사조직이 나타나고 장기간의 치료가 필요했던 P2 환자는 급성 증세와 과거 병력이 있는 재발성 NPD인 Score 5로 판단되어 가장 긴 치료기간이 필요했던 것으로 사료된다. NPD 환자에서 치석제거술에 metronidazole 같은 전신적 항생제 복용이 즉각적인 치료 효과를 보였다는 연구5 와 과산화수소 구강 세정제를 같이 사용했을 때 더 효과적이라는 연구7를 고려해보면 본 증례에서 P2 환자의 치료기간 단축을 위해 추가적인 전신적 항생제 복용과 구강 세정제 처방을 고려하지 못한 점에 한계가 있다고 생각된다.
미생물 검사결과를 살펴보면 초진 검사에서는 7 - 8종의 치주 질환 관련 미생물들 총 구강 미생물 대비 80%이상을 차지하고 있었으나, 두번째 치료전에 시행한 미생물 검사에서는 Fn만 검출되는 모습이 관찰되었다. 이는 치석제거술, 면봉을 이용한 3% 과산화수소수 세정 그리고 국소전달항생제 도포의 치료 효과로 대부분의 치주 질환 관련 미생물이 실시간 연쇄중합반응법 검사에서 검출되는 기준 이하로 감소되었지만, Fn만 치료 전보다 감소하였지만 검출되었다. 이는 아직 완치되지 않은 NPD의 영향으로 판단되어 추가적인 치료를 진행하였다. Loesche 등6의 연구에서 NPD환자들의 미생물 검사에서 Fusobacterium 종이 우세한 경향을 보였던 것처럼 초기 치료로 감소된 구내 미생물들 중에서 우세했던 Fn만 실시간 연쇄중합반응법 검사에서 검출된 것으로 보인다. 하지만 O’Connor 등16의 실험실 연구에서 Minocycline이 만성치주염 환자에서 채집된 미생물군들에 적용했을 때 Aa, Ec, Bacteroides intermedius, Bacteroides gingivalis, Campylobacter sputorum, Streptococcus sanguis, Actinomyces viscosus, Wolinella recta, Haemophilus aphrophilus에는 유효한 억제효과를 보였지만 Fn과 Veillonella parvula에는 영향이 없던 것과 유사하게 Fn을 제외한 다른 미생물만 변화를 보여 NPD 치료로 인한 미생물 세균총의 변화과정인지 Minocycline 성분의 국소전달항생제의 영향인지 확인이 필요할 것으로 판단된다. 또한 면봉에 사용된 3% 과산화수소도 구강내 치주 질환 미생물을 억제하는 영향17도 있었을 것으로 사료된다. 흔하게 발병하지 않는 NPD의 특성상 대조군 설정을 통한 비교연구는 어렵지만 보고되는 증례들의 치료방법 비교를 통해서 재발성 NPD같은 난치성 질환도 치료기간을 단축할 수 있는 더욱 효과적인 치료 방법의 개발이 필요할 것으로 생각된다.
Go to : 
References
1. Park JB. 1983; Symptoms & treatment of ulcerative conditions. J Korean Dent Assoc. 21:449–52.
2. Horning GM, Cohen ME. 1995; Necrotizing ulcerative gingivitis, periodontitis and stomatitis: Clinical staging and predisposing factors. J Periodontol. 66:990–8. DOI: 10.1902/jop.1995.66.11.990. PMID: 8558402.
3. Herrera D, Retamal-Valdes B, Alonso B, Feres M. 2018; Acute periodontal lesions (periodontal abscesses and necrotizing periodontal diseases) and endoperiodontal lesions. J Clin Periodontol. 45:S78–S94. DOI: 10.1111/jcpe.12941. PMID: 29926493.
4. Newman MG, Takei H, Klokkevold PR, Carranza FA. 2011. Carranza's clinical periodontology. 12th ed. Elsevier health sciences;Amsterdam: p. 271–9. p. 350–3.
5. Rosebury T. Gordon SM, editor. 1938. The etiology of Vincent's infection. Dental science and dental art. Lea & Febiger;Philadelphia: p. 415.
6. Loesche WJ, Syed SA, Laughon BE, Stoll J. 1982; The bacteriology of acute necrotizing ulcerative gingivitis. J Periodontol. 53:223–30. DOI: 10.1902/jop.1982.53.4.223. PMID: 6122728.
7. Lang NP, Berglundh T, Giannobile WV, Sanz M. 2021. Lindhe's clinical periodontology and implant dentistry. 6th ed. John Wiley & Sons;Hoboken: p. 428–33.
8. Gomes EWB, Casarin M, Martins TM, da Silva AF. 2020; Local delivery therapies as adjuvants to non-surgical periodontal treatment of periodontitis grade C: a systematic review. Clin Oral Investig. 24:4213–24. DOI: 10.1007/s00784-020-03631-8. PMID: 33070281.
9. Nakagawa T, Yamada S, Oosuka Y, Saito A, Hosaka Y, Ishikawa T, Okuda K. 1991; Clinical and microbiological study of local minocycline delivery (Periocline) following scaling and root planing in recurrent periodontal pockets. Bull Tokyo Dent Coll. 32:63–70. PMID: 1819445.
10. Pfaffl MW. 2001; A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 29:e45. DOI: 10.1093/nar/29.9.e45. PMID: 11328886. PMCID: PMC55695.
11. Haffajee AD, Socransky SS, Patel MR, Song X. 2008; Microbial complexes in supragingival plaque. Oral Microbiol Immunol. 23:196–205. DOI: 10.1111/j.1399-302X.2007.00411.x. PMID: 18402605.
12. Malek R, Gharibi A, Khlil N, Kissa J. 2017; Necrotizing ulcerative gingivitis. Contemp Clin Dent. 8:496–500. DOI: 10.4103/ccd.ccd_1181_16. PMID: 29042743. PMCID: PMC5644015.
13. Klotz H. 1973; Differentiation between necrotic ulcerative gingivitis and primary herpetic gingivostomatitis. N Y State Dent J. 39:283–94. PMID: 4348461.
14. Novak MJ. 1999; Necrotizing ulcerative periodontitis. Ann Periodontol. 4:74–8. DOI: 10.1902/annals.1999.4.1.74. PMID: 10863377.
15. Formicola AJ, Witte ET, Curran PM. 1970; A study of personality traits and acute necrotizing ulcerative gingivitis. J Periodontol. 41:36–8. DOI: 10.1902/jop.1970.41.41.36. PMID: 5264373.
16. O'Connor BC, Newman HN, Wilson M. 1990; Susceptibility and resistance of plaque bacteria to minocycline. J Periodontol. 61:228–33. DOI: 10.1902/jop.1990.61.4.228. PMID: 2324922.
17. Wennström J, Lindhe J. 1979; Effect of hydrogen peroxide on developing plaque and gingivitis in man. J Clin Periodontol. 6:115–30. DOI: 10.1111/j.1600-051X.1979.tb02190.x. PMID: 379049.
Go to : 




 PDF
PDF Citation
Citation Print
Print




 XML Download
XML Download