1. Ishikawa I, Aoki A, Takasaki AA, Mizutani K, Sasaki KM, Izumi Y. Application of lasers in periodontics: true innovation or myth? Periodontol 2000. 2009; 50:90–126. DOI:
10.1111/j.1600-0757.2008.00283.x. PMID:
19388956.
2. Dörtbudak O, Haas R, Bernhart T, Mailath-Pokorny G. Lethal photosensitization for decontamination of implant surfaces in the treatment of periimplantitis. Clin Oral Implants Res. 2001; 12:104–8. DOI:
10.1034/j.1600-0501.2001.012002104.x. PMID:
11251658.
3. Schwarz F, Sculean A, Rothamel D, Schwenzer K, Georg T, Becker J. Clinical evaluation of an Er: YAG laser for nonsurgical treatment of periimplantitis: a pilot study. Clin Oral Implants Res. 2005; 16:44–52. DOI:
10.1111/j.1600-0501.2004.01051.x. PMID:
15642030.
4. Atieh MA, Alsabeeha NH, Faggion CM Jr, Duncan WJ. The frequency of peri-implant diseases: a systematic review and meta-analysis. J Periodontol. 2013; 84:1586–98. PMID:
23237585.
5. Lindhe J, Meyle J; Group D of European Workshop on Periodontology. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008; 35:282–5. DOI:
10.1111/j.1600-051X.2008.01283.x. PMID:
18724855.
6. Froum SJ, Rosen PS. A proposed classification for peri-implantitis. Int J Periodontics Restorative Dent. 2012; 32:533–40. PMID:
22754901.
7. Esposito M, Grusovin MG, Kakisis I, Coulthard P, Worthington HV. Interventions for replacing missing teeth: treatment of peri implantitis. Cochrane Database Syst Rev. 2008; Apr. 16(2):CD004970. doi:10.1002/14651858.CD004970.pub3. DOI:
10.1002/14651858.CD004970.pub3.
8. Ntrouka VI, Slot DE, Louropoulou A, Van der Weijden F. The effect of chemotherapeutic agents on contaminated titanium surfaces: a systematic review. Clin Oral Implants Res. 2011; 22:681–90. DOI:
10.1111/j.1600-0501.2010.02085.x. PMID:
21198891.
10. Tosun E, Tasar F, Strauss R, Kivanc DG, Ungor C. Comparative evaluation of antimicrobial effects of Er: YAG, diode, and CO2 lasers on titanium discs: and experimental study. J Oral Maxillofac Surg. 2012; 70:1064–9. DOI:
10.1016/j.joms.2011.11.021. PMID:
22285338.
11. Stubinger S, Etter C, Miskiewicz M, Homann F, Saldamli B, Wieland M, Sader R. Surface alterations of polished and sandblasted and acid-etched titanium implants after Er: YAG, carbon dioxide, and diode laser irradiation. Int J Oral Maxillofac Implants. 2010; 25:104–11. PMID:
20209192.
12. Park JH, Heo SJ, Koak JY, Kim SK, Han CH, Lee JH. Effects of laser irradiation on machined and anodized titanium disks. Int J Oral Maxillofac Implants. 2012; 27:265–72. PMID:
22442763.
13. Kreisler M, Al Haj H, Götz H, Duschner H, d'Hoedt B. Effect of simulated CO2 and GaAlAs laser surface decontamination on temperature changes in Ti-Plasma sprayed dental implants. Lasers Surg Med. 2002; 30:233–9. DOI:
10.1002/lsm.10025. PMID:
11891744.
14. Kim JH, Choi BK, Choi SH, Cho KS, Chai JK, Kim CK. Ribotyping of Porphyromonas Gingivalis isolated from rapidly progressive periodontitis patients. J Korean Acad Periodontol. 1999; 29:963–77. DOI:
10.5051/jkape.1999.29.4.963.
15. Kim SY, Woo DH, Lee MA, Kim JS, Lee JH, Jeong SH. Red fluorescence of oral bacteria interacting with Porphyromonas gingivalis. J Korean Acad Oral Health. 2017; 41:22–7. DOI:
10.11149/jkaoh.2017.41.1.22.
16. Peck SY, Ku Y, Rhyu IC, Hahm BD, Han SB, Choi SM, Chung CP. The frequency of detecting Prevotella intermedia and Prevotella nigrescens in Korean adult periodontitis patients. J Korean Acad Periodontol. 2000; 30:419–27. DOI:
10.5051/jkape.2000.30.2.419.
17. Romanos GE, Everts H, Nentwig GH. Effects of diode and Nd: YAG laser irradiation of titanium discs: a scanning electron microscope examination. J Periodontol. 2000; 71:810–5. DOI:
10.1902/jop.2000.71.5.810. PMID:
10872964.
18. Slater SC, Voige WH, Dennis DE. Cloning and expression in Escherichia coli of the Alcaligenes eutrophus H16 poly-beta-hydroxybutyrate biosynthetic pathway. J Bacteriol. 1988; 170:4431–6. DOI:
10.1128/jb.170.10.4431-4436.1988. PMID:
3049530. PMCID:
PMC211473.
19. McDaniel TK, Kaper JB. A cloned pathogenicity island from enteropathogenic Escherichia coli confers the attaching and effacing phenotype on E. coli K 12. Mol Microbiol. 1997; 23:399–407. DOI:
10.1046/j.1365-2958.1997.2311591.x. PMID:
9044273.
20. Cooper GM. The cell: a molecular approach. 4th ed. Sunderland: Sinauer Associates, Inc;2007. p. 43–73. PMID:
18368739.
21. Lee KJ, Lee JH, Kum KY, Lim YJ. Laser therapy in peri-implantitis treatment: literature review. J Dent Rehabil Appl Sci. 2015; 31:340–8. DOI:
10.14368/jdras.2015.31.4.340.
22. Kreisler M, Kohnen W, Marinello C, Götz H, Duschner H, Jansen B, D'Hoedt B. Bactericidal effect of the Er: YAG laser on dental implant surfaces: an in vitro study. J Periodontol. 2002; 73:1292–8. DOI:
10.1902/jop.2002.73.11.1292. PMID:
12479633.
23. Koo PM, Lee DW. The diagnosis and treatment of peri-implantitis. J Dent Implant Res. 2015; 34:76–80.
24. Oh WS, Ryu JJ, Ji S. Microbiology of Peri-implantitis. J Dent Implant Res. 2013; 32:1–6.
 ; 1 W,
; 1 W,  ; 1.5 W,
; 1.5 W,  ; 2 W,
; 2 W,  ; 2.5 W (n = 5). (C) Initial temperature change by laser power. (D) Temperature change range by laser power. ○; B808. ● P810. * P < 0.05.
; 2.5 W (n = 5). (C) Initial temperature change by laser power. (D) Temperature change range by laser power. ○; B808. ● P810. * P < 0.05.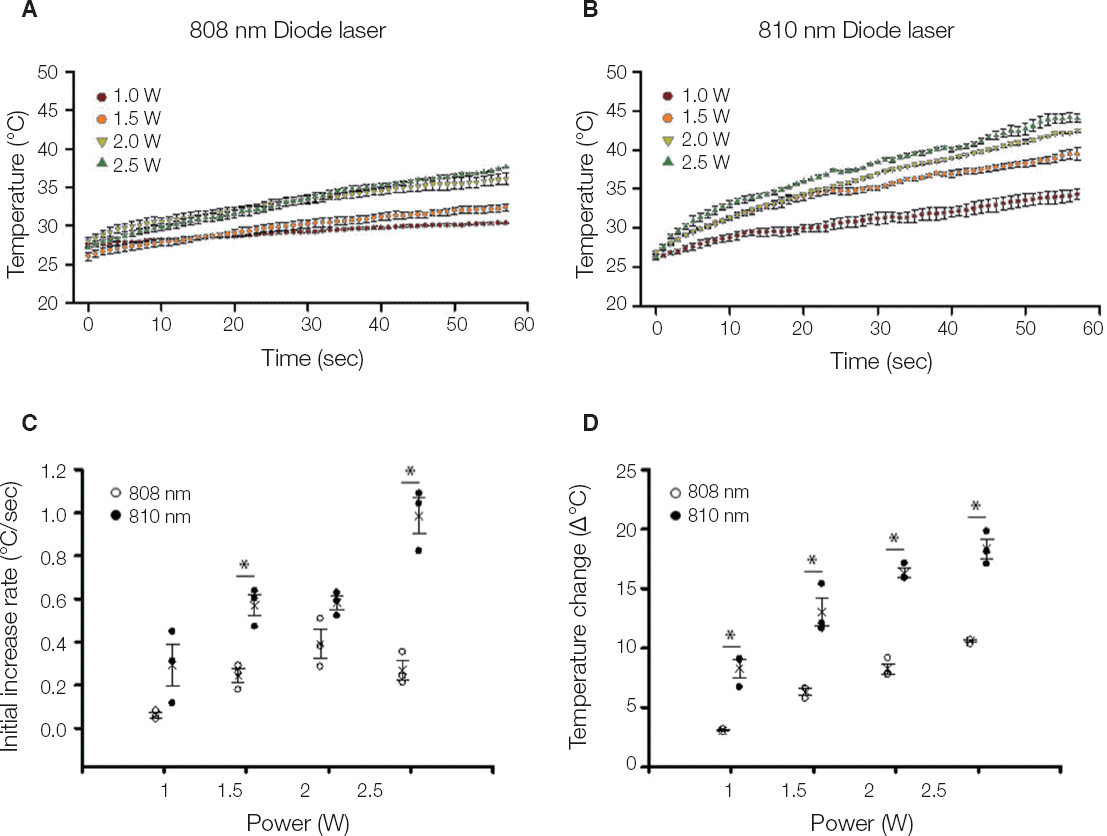
 ; 1 W,
; 1 W,  ; 1.5 W,
; 1.5 W,  ; 2 W,
; 2 W,  ; 2.5 W (n = 5). (C) Initial temperature change by laser power. (D) Temperature change range by laser power. ○; B808. ●; P810. * P < 0.05.
; 2.5 W (n = 5). (C) Initial temperature change by laser power. (D) Temperature change range by laser power. ○; B808. ●; P810. * P < 0.05.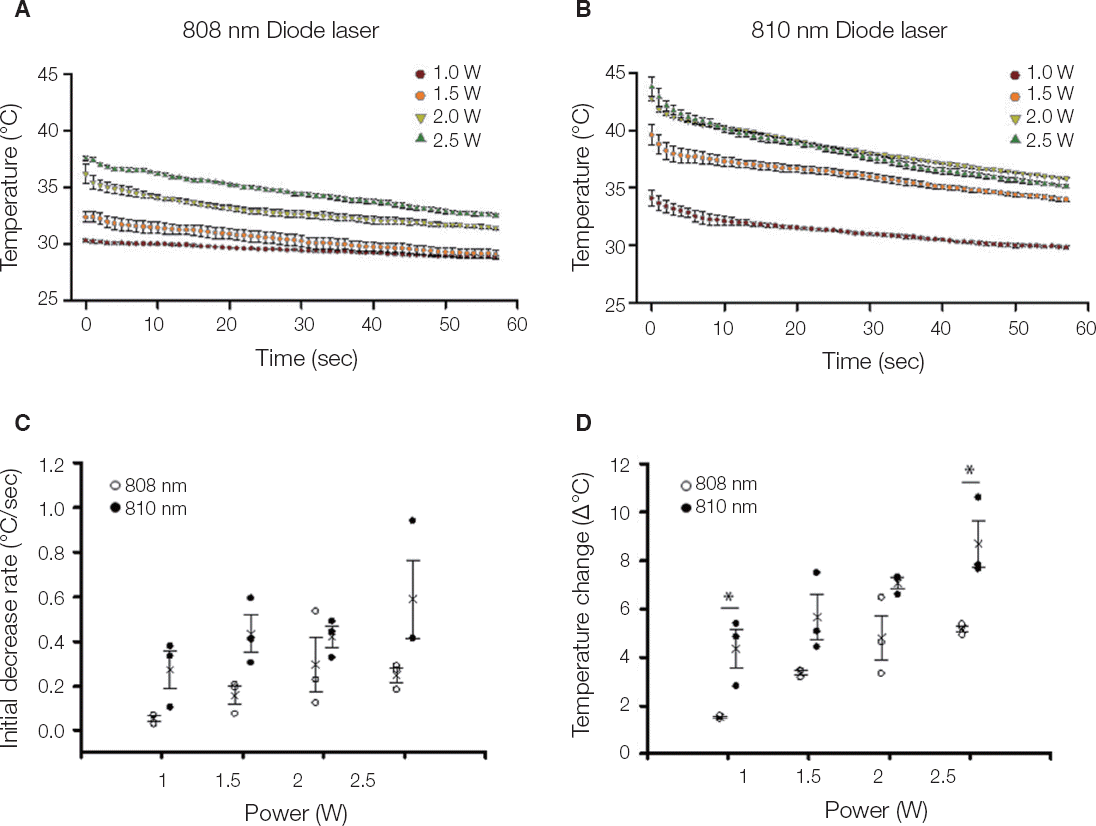
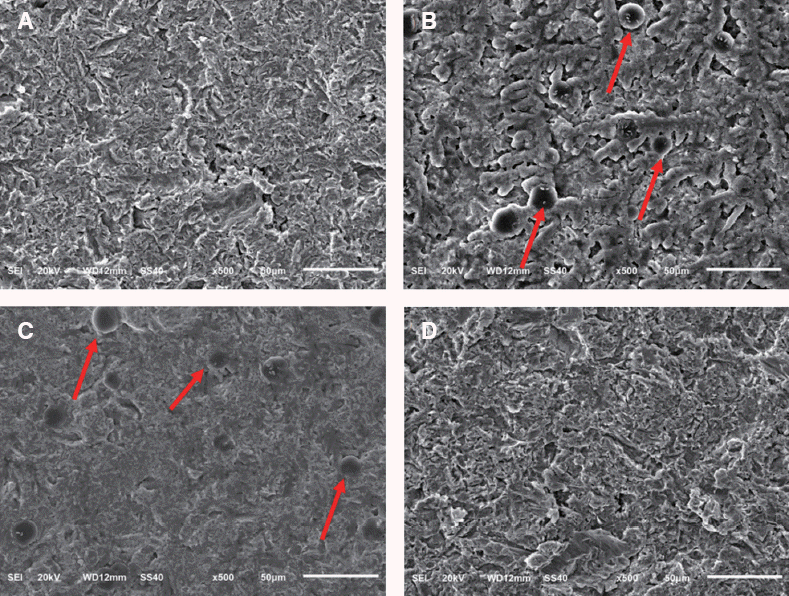
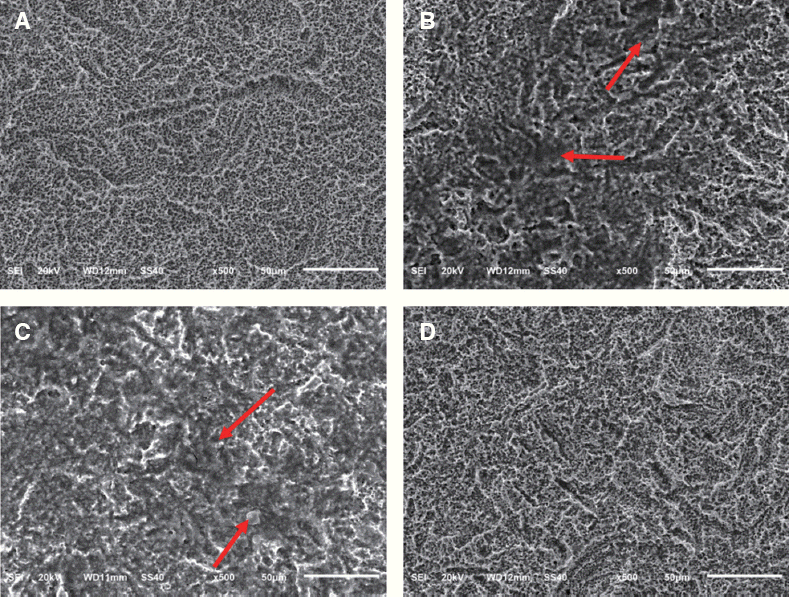




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download