초록
건강에 대한 관심과 평균 수명 증가로 보철수복을 위해 치과에 내원하는 고령 환자의 수도 증가하고 있다. 고령 환자는 다양한 만성 질환을 가지고 있는 경우가 많다. 특히 골다공증은 고령 환자에서 매년 증가하는 추세로 치과에 내원하는 골다공증 환자 수는 더욱 증가할 전망이다. 현재 비스포스포네이트 제재가 골다공증 치료에 가장 많이 사용되며 장기간 경구복용 하거나 주사제를 투여 받은 환자에서 악골괴사가 부작용으로 보고되었다. 이러한 약제관련 악골괴사는 외과적인 치과치료가 원인이 되는 경우가 많고 발병하면 치유가 어려워 예방이 중요하다. 보철 수복을 위한 구강형성 과정에서 외과적 치료가 필요할 수 있으며, 골다공증 환자의 성공적인 치료를 위해 치과의사는 질환에 대해 충분히 이해하고 관심을 가져야 한다.
Abstract
The average life expectancy has been increased, so the proportion of elderly patients that visit to the dental clinic for prosthetic restoration has increased. Elderly patients have various chronic diseases. Recent trends show an increase of osteoporosis in elderly patients, and thus, the number of osteoporosis patients is expected to escalate. Currently, the most widely used drug for osteoporosis is bisphosphonate. However, osteonecrosis of the jaw has been reported as a side effect derived from long-term oral administration or injection treatment of the drug. Surgical dental treatment was the main cause of medication related osteonecrosis of the jaw (MRONJ). As MRONJ is very difficult to cure, it is important to take preventive measures. Surgical operation may be needed for the mouth preparation before prosthetic restoration. For successful treatment, the dentist should have a full understanding of osteoporosis and show a continued interest toward this disease for careful management.
우리나라는 급속도로 고령사회에 접어들고 있다. 2015년 65세 이상 인구는 전체 인구의 13.1%이며, 2026년에는 20.8%까지 증가하여 초고령화 사회에 진입할 것으로 예상된다.1 건강에 대한 관심의 증가와 의학 기술의 발달로 평균 수명이 증가함에 따라 보철수복을 위해 치과에 내원하는 고령 환자의 수도 점차 증가하고 있다. 보철치료를 위한 구강 형성 과정에서 고령 환자의 치아는 대부분 치주질환, 치아우식증 등에 이환 되어 있기 때문에 치주 치료, 발치 등의 외과적 처치가 필요한 경우가 많다. 또한 보철수복 과정에서 부분무치악 수복을 위해 임플란트 식립이 필요한 경우도 있고, 의치를 제작하는 과정에서도 골융기 절제나, 치조골 성형술 등의 외과적 처치가 수반되는 경우도 많다. 그러므로 고령 환자는 치료 계획 단계에서부터 외과적 처치와 관련하여 복용 약물이나 전신 상태를 고려해야 한다. 심혈관 질환이나 당뇨병 등 치과치료 시 주의가 필요한 전신 질환들은 환자가 대부분 이를 이미 인지하고 있어 치료 전에 자신의 병력에 대한 정보를 제공하는 경우가 많다. 그러나 골다공증은 과거에 비해 많이 알려져 있긴 하지만 아직도 환자가 치과치료와의 관련성을 잘 알지 못하는 경우가 많기 때문에 병력 청취 시에 주의를 기울여야 한다.
건강보험심사평가원의 통계에 따르면 2014년 골다공증으로 의료기관을 이용한 65세 이상의 환자 수는 약 53만 명으로 65세 이상 인구의 8%를 넘으며 매년 증가하는 추세이다. 그러므로 향후 치과에 내원하는 골다공증 환자의 수는 더욱 증가할 전망이다. 현재 골다공증의 치료제로 가장 많이 사용되고 있는 제재는 비스포스포네이트이다.2 비스포스포네이트는 파골세포에 작용하여 골흡수를 억제하는 기전으로 골다공증 치료에 효과가 있다. 그러나 비스포스포네이트를 장기간 경구 복용하거나 주사제를 투여 받은 환자에서 악골괴사가 부작용으로 보고되었다.3 뿐만 아니라 최근 비스포스포네이트와 다른 기전으로 골다공증을 치료하는 데노수맙을 복용한 환자에서도 악골괴사의 부작용이 보고되었다.4 이러한 약제 관련 악골괴사(medication-related osteonecrosis of the jaw, MRONJ)는 발치와 같은 외과적인 치과치료가 그 원인이 되는 경우가 많고, 한 번 발병하면 치유가 어렵기 때문에 예방이 더욱 중요하다.5 치료에 앞서 병력을 청취하여 내과 전문의에 의뢰하는 것이 필수적이며, 골다공증 환자에 대해 충분히 이해하고 환자 관리에 관심을 가져야 할 것이다.
성인의 골량은 18 - 25세에 최대에 도달한 후 점차 감소한다.6 최대 골량은 유전적 요인, 영양, 내분비계 상태, 신체 활동, 성장기 동안의 건강에 의해 결정된다. 건강한 골격을 유지하기 위한 골재형성의 과정은 파골세포에 의한 오래된 골의 흡수와 이후 조골세포에 의한 새 골의 형성을 통해 이루어진다. 골다공증은 골량의 감소와 미세구조의 이상을 특징으로 하는 전신적인 골격계 질환으로, 결과적으로 골이 약화되어 골절되기 쉬운 상태가 되는 질환으로 정의된다.7 성장기에는 골형성이 흡수보다 많아 지속적으로 성장이 일어나고 최대 골량에 도달한 이후에는 점차 골의 흡수가 많아져 골량의 소실이 일어나게 된다.
성호르몬, 부갑상선호르몬, 갑상선호르몬, 비타민 D, 유즙분비호르몬 등의 호르몬, 시토카인, 렙틴, 세로토닌 등의 신경계 펩티드들이 이 골재형성 과정을 조절하는 것으로 알려져 있다. 파골세포를 활성화하는 가장 중요한 시토카인은 receptor activator of nuclear factor-κB ligand (RANKL)로 파골세포 및 전구세포에 위치한 수용체와 결합하여 파골세포의 형성과 활성을 촉진한다. 또한 RANKL에 대한 생체내의 길항제가 존재하는데 이를 오스테오프로테게린이라고 한다. 오스테오프로테게린과 RANKL과의 균형에 의하여 파골세포의 형성과 활성이 조절되게 된다. 골흡수를 자극하는 원인(에스트로겐 결핍, 부갑상선 호르몬 항진증 등)이 발생하게 되면 오스테오프로테게린과 RANKL의 균형이 깨지게 되어 파골세포가 활성화 되고 골흡수가 촉진되게 된다.8
골다공증의 위험 요인은 유전적 요인, 생활 습관 및 영양, 질병, 약제 등으로 다양하나 주된 두 가지 요인은 청장년기에 낮게 형성된 최대 골량과 노화 및 폐경으로 인한 빠른 골소실이다. 폐경과 노화로 인한 경우를 일차성으로, 특정 질환이나 수술, 약물에 의해 최대 골량의 형성에 장애가 있거나 골소실이 증가해 발생하는 경우를 이차성 골다공증으로 분류한다. 일차성 골다공증은 폐경 후 발생하는 경우가 80%를 차지하며 에스트로겐 결핍이 주된 요인으로 생각되고 있다.5 이차성 골다공증은 그 원인이 매우 다양하고 뚜렷한 임상적 특징이 없어 발병 정도나 기전이 잘 알려져 있지 않으나 스테로이드로 인한 골다공증이 가장 흔히 나타난다.7
에스트로겐 결핍은 폐경 후 골다공증뿐만 아니라 노인성 골다공증의 주요 원인이므로 폐경 이후 에스트로겐 결핍에 의하여 발생할 수 있는 증상과 질환을 예방 및 치료할 목적으로 사용할 수 있다. SERM은 에스트로겐 수용체에 결합하여 에스트로겐 활동에 대한 작용제 또는 길항제로 조직에 따라 다른 효과를 유도한다.9
칼시토닌은 혈액 속의 칼슘량을 조절하는 갑상선 호르몬으로 혈액의 칼슘 농도가 정상보다 높을 때 작용하며 파골세포의 수용체에 결합해 골흡수를 억제시킨다. 연어 칼시토닌이 사람 칼시토닌 보다 수용체 친화력이 높고 천천히 대사되어 골다공증 치료에 주로 사용된다.10
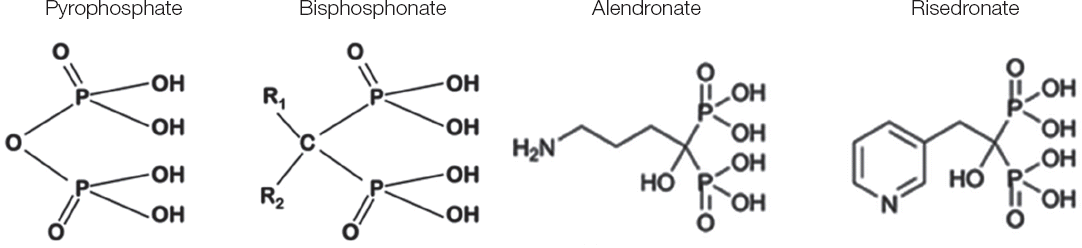
비스포스포네이트는 가장 중요하고 효과적인 골흡수 억제제이다. 비스포스포네이트의 분자구조(P-C-P)는 자연발생의 피로포스페이트(P-O-P)와 유사하며, 두 개의 짧은 측부 사슬(R1, R2)이 탄소 원소에 결합한다. R1 측부 사슬은 골결합 친화력을 결정하고, R2 측부 사슬은 흡수 억제 효과를 결정한다. 약제에 따라 R2 사슬을 변환시켜 골흡수 억제 효과를 증가시킬 수 있으며, 측부 사슬 구조의 변환이 비스포스포네이트의 골결합 강도와 치료가 중단된 이후 골 내에 존재하는 기간과 양을 결정한다. 흡수 후 골재형성이 활발히 진행되는 골의 수산화인회석 내에 결합해 수년간 존재하며 파골세포에 의한 골흡수 과정에서 축적되어 있던 비스포스포네이트가 유리됨으로써 파골세포는 국소적으로 고농도의 비스포스포네이트에 노출된다.11
부갑상선호르몬은 저용량을 간헐적으로 투여할 때 골형성을 촉진시킨다. 그러나 고용량을 지속적으로 투여할 때 골흡수를 증가시키는 작용을 한다. 주로 조골세포의 사멸을 억제하고 분화와 재활성화를 증가시켜 골형성을 촉진시키는 것으로 알려져 있다.12
데노수맙은 RANKL에 결합하는 인간 단클론항체로 파골세포의 성숙, 기능, 생존을 억제하여 골흡수를 감소시키고 결과적으로 골밀도가 증가하도록 한다. 비스포스포네이트와 달리 파골세포 전구세포에 작용하여 파골세포로의 분화를 억제한다. 즉, 오스테오프로테게론과 유사한 작용을 하게 되며 체내에서 더 긴 반감기를 가진다.13
현재 골다공증 치료를 위해 주로 사용되는 약제는 Table 1과 같다.7 전 세계적인 골다공증 치료제 시장은 2007년 총 92억 달러의 규모로 비스포스포네이트 계열이 골다공증 치료제의 주류를 이루어 전체 사용의 73%를 차지하였으며, 다음이 SERM 15%, 칼시토닌 10%, 부갑상선호르몬 1.4%의 순이었다.14
Classification of pharmacologic agents for osteoporosis treatment
2009년 실시한 건강보험심사평가원의 골다공증 질환의 의료이용 및 약제처방 양상에 관한 연구에 따르면 비스포스포네이트 계열이 약 51%로 가장 많았고 그 뒤로 칼슘, 비타민 D 계열(약 42%), 칼시토닌(14.44%) 순으로 나타났다. 비스포스포네이트 계열 중에서는 경구 형태가 전체 비스포스포네이트 계열의 98%로 주를 이루었으며, 주 1회 복용하는 용법이 가장 많이 처방되었다. 여성호르몬 및 조직 특이 여성호르몬의 경우 전체 약 5% 정도로 처방 비율이 높지 않으나, 부작용 발생 위험의 증가로 그 사용이 감소하는 추세이다.15
비스포스포네이트에 의한 악골괴사(bisphosphonate-related osteonecrosis of the jaw, BRONJ)는 2003년 Marx가 다발성 골수종, 유방암 등의 암환자에서 발생한 비스포스포네이트 관련 악골괴사를 처음 보고하면서 알려졌다.3 최근에는 비스포스포네이트 외에도 RANKL antibody 계열의 약제 데노수맙과 혈관신생억제제 베바시주맵의 복용에 의한 악골괴사의 발생이 추가로 보고되면서 약제 관련 악골괴사(medication-related osteonecrosis of the jaw, MRONJ)로 그 명칭을 바꾸었다.5
MRONJ는 현재 또는 과거에 골흡수 억제제나 혈관신생억제제를 사용한 병력이 있으면서 악골이 노출되어 있거나 구강 내 또는 구강 외 누공이 8주 이상 지속되고 악골에 방사선 치료를 받은 병력 또는 대사성 질환이 없는 경우로 정의된다.16 관련 약물의 투여 후 악골에서만 특이적으로 골괴사가 나타나는 이유는 명확하게 밝혀지지 않았으나 파골세포 및 골대사 억제, 감염 또는 염증에 대한 국소조직의 반응에 관여, 신생혈관 형성 억제로 인한 혈류 저하, 연조직에 대한 독성으로 골노출 초래, 면역 체계에 대한 영향, 미세골절의 치유 억제, 비타민 D 결핍 등 여러 기전의 복합적인 작용에 의한 것으로 추정된다. 골흡수 억제제는 파골세포의 분화와 기능을 억제하고, 세포사멸을 증가시켜 골 흡수와 개조를 감소시킨다. 파골세포의 분화와 기능은 모든 골격계의 골치유와 개조에 중요한 역할을 하지만 오로지 악골에서만 괴사가 발생하는 이유는 악골에서 보다 높은 골개조율을 보이기 때문인 것으로 설명할 수 있다. 또한 발치는 악골괴사를 일으키는 주요한 위험 인자 중 하나로 여겨지는데, 이러한 치아들이 치주질환이나 치근단 병소에 이환된 경우가 많아 감염이나 염증 또한 악골 특이적 골괴사의 요인으로 설명할 수 있다.17
2014년 미국 구강악안면외과학회의 MRONJ 지침서에 따르면 비스포스포네이트 투여 후에도 악골괴사가 발생하지 않은 환자들은 평균 복용 기간이 3.5년이었고, 악골괴사가 발생한 환자들은 평균 복용 기간이 4.4년이었다.18 골다공증으로 비스포스포네이트를 경구 복용한 환자의 0.1%에서 MRONJ가 발생한 것으로 보고되었고, 4년 이상 장기 복용한 경우 0.21%로 발생률이 증가하였다. 이는 암환자에서의 1.1% - 1.3%에 비해 매우 낮은 수치이며, 암환자에서는 보다 고용량의 약물이 투여되기 때문인 것으로 해석할 수 있다. 대부분의 MRONJ 증례는 비스포스포네이트를 정맥으로 투여 받은 암환자에서 보고되었다. 비스포스포네이트를 정맥 투여 받거나 데노수맙을 복용한 경우 악골괴사의 발생률은 0.017 - 0.04%로 보고되었다.16
MRONJ의 주된 원인 중 하나가 파골세포의 골흡수 억제로 인한 골개조의 방해이다. Marx 등은 혈액의 파골세포의 골흡수 표지자인 C-telopeptide (CTX)가 비스포스포네이트 복용의 중단 기간과 관련이 있으며, CTX 수치가 150 pg/mL보다 큰 경우 파골세포의 골흡수 작용의 회복으로 판단할 수 있고, 외과적인 치과치료에도 악골괴사를 일으키지 않는다고 하였다.19 이후 추가적인 연구들이 이루어졌으나 이를 뒷받침할 수 있는 근거는 부족한 실정이다.20 현재 MRONJ의 예측을 위해 CTX를 가장 많이 사용하고 있으나, CTX의 유용성 여부에는 아직 논쟁의 여지가 있다. 또한 MRONJ를 예측할 수 있는 다른 유용한 골대사 표지자도 아직 알려지지 않았다.
MRONJ의 발생률은 약제 투여 기간, 투여량에 비례하고, 투여 방법에 따라서도 차이를 나타낸다.16 그 외에 MRONJ의 발생률을 높일 수 있는 위험인자는 다음과 같다.
(1) 구강 내 수술
치조골을 포함하는 외과적인 수술은 MRONJ를 일으키는 주요인이다. 그 중 발치가 MRONJ 환자의 52 - 61%에서 유발 요인으로 보고되었다.21 경구용 비스포스포네이트를 복용한 환자에서 발치에 의해 악골괴사가 발병할 확률은 0.5% 정도로 추정되며, 정맥 주사제를 투여 받은 암환자에서는 그 확률이 1.6%에서 14.8%로 높아진다. 발치 이외의 다른 치조골 수술이나 임플란트 고정체 식립 수술, 근관 또는 치주치료 과정에서 MRONJ 발병률은 아직 잘 알려져 있지 않다.
(2) 국소해부학적 요인
MRONJ는 주로 상악골(22.5%)보다 하악골(73%)에서 발생하며, 양쪽 모두(4.5%)에서 발생하는 경우도 있다.21 이러한 결과는 악골이 다른 체축 골격에 비해 외부 환경에 노출되기 쉬우며 저작 등에 의한 반복적인 미세 손상과 높은 골 교체율 등으로 설명할 수 있다.16 특히 하악 골융기, 악설골근 부착부, 구개골 융기 등 돌출된 골표면이 비교적 얇은 점막으로 덮여 있는 부위는 의치의 사용 등으로 지속적으로 자극이 가해질 경우 MRONJ 발생의 기여 요인이 될 수 있으며, 잘 맞지 않는 의치에 의한 구강 점막의 손상은 MRONJ의 발생 확률을 더욱 높일 수 있다.7
MRONJ 유발 약물을 복용하게 되는 기저질환이 있는 경우가 전신적 위험 요인이 될 수 있다. 고령의 여성의 경우 유방암, 폐경 후 골다공증 등으로 인해 MRONJ 유발 약물을 복용하게 되는 경우가 많으며, 악성 종양 환자의 경우 치료 과정에서 스테로이드 제제를 병용하는 경우가 많다.22
골다공증 치료에 사용되는 약제 중 비스포스포네이트, 데노수맙과 같은 골흡수억제제가 MRONJ를 일으키는 것으로 알려져 있다. 따라서 골다공증으로 진단되어 치료를 받을 예정이거나 이미 골흡수억제제를 복용 중인 환자의 치과치료 시 주의가 필요하며, 내과 전문의와 협진을 통해 약물의 변경, 휴약 여부를 결정해야 한다.
골흡수 억제제를 투여하는 경우 MRONJ가 발생할 수 있음을 사전에 설명한다. 가능하다면 골다공증 치료 전 치과 검진을 받도록 하여 구강건강을 회복하고, 구강위생관리 교육과 정기적인 검진을 통해 구강 건강을 유지할 수 있도록 한다.
(1) 증상이 없고 4년 미만 투여
계획된 대부분의 수술은 진행 가능하다. 그러나 임플란트 식립 시에는 골흡수 억제제를 중단하지 않고 수술을 진행하는 경우 MRONJ가 발생할 수 있으며, 장기적으로 임플란트가 실패할 수 있음을 설명해야 한다. 술 후에는 정기적인 추적과 관찰이 필요하고, 약물 처방의와 상의하여 약물 용량 변경, 휴약, 대체 약물 투여를 고려할 수 있다.
(2) 스테로이드 또는 혈관형성 억제제를 병용하는 경우
전신상태가 허락한다면 술 전 최소 2개월 전부터 골흡수 억제제를 중단하고 골이 완전히 치유된 후 재투여 한다.
(3) 증상이 없고 4년 이상 투여
가능하면 비수술적인 치료 선택하고, 수술적 치료가 필요한 경우 전신상태가 허락한다면 술 전 최소 2개월 전부터 골흡수 억제제를 중단한다. 이후 골이 완전히 치유되면 재투여한다.
발치 후 발치와의 골재형성이 완료되는 데는 약 2달이 소요되며, 이 기간이 지난 후에 골흡수 억제제를 투여하는 것이 추천된다. 그러나 원인 질환의 치료를 위해 조기에 골흡수 억제제의 재투여가 필요한 경우에는 2주 후, 감염의 증상 없이 발치와가 일차 치유를 보일 때 재투여를 결정할 수 있다.
미국 구강악안면외과학회에서는 MRONJ의 증상에 따라 단계를 나누고 각 단계에 맞는 치료법을 제시하였다(Table 2).16 증상은 없으나 MRONJ 유발 가능성이 있는 약물을 복용중인 환자는 at risk, 괴사 골편은 없으나 비특이적 증상과 방사선학적 변화를 보이는 경우는 0단계로 분류하였다. At risk 단계의 환자에서는 특별한 치료를 필요로 하지 않으며 교육 및 구강 위생 관리를 통한 예방에 중점을 둔다. 0단계의 환자에서는 각 증상에 대한 치료 및 우식이나 치주질환과 같은 국소적 요인에 대한 보존적인 치료를 시행한다. 필요한 경우 통증 완화와 감염 조절을 위해 약물을 처방한다. 1단계 환자에서는 0.12%의 클로르헥시딘 구강세정제를 사용하여 관리하며, 즉각적인 수술 치료는 필요하지 않다.
Staging and treatment strategies of medication-related osteonecrosis of the jaw
2단계 환자에서는 항생제를 포함한 구강세정제를 사용하도록 한다. 대부분 페니실린 계열의 항생제에 효과가 있으며, 페니실린 과민반응이 있는 환자에서는 퀴놀론, 메트로니다졸, 클린다마이신, 독시사이클린, 에리트로마이신 등을 사용할 수 있다. 노출된 골 표면에 세균막이 형성된 경우는 전신적인 항생요법이 실패할 수 있으며, 수술적 치료를 필요로 한다.24 3단계 환자에서는 골절제술을 포함한 괴사 조직의 제거와 항생제 요법을 병행한다.
MRONJ 치료의 목적은 환자의 안심과 교육, 동통과 이차 감염의 조절, 병소의 확대와 새로운 괴사 영역의 발생 방지를 통한 삶의 질의 보존에 있다. MRONJ의 단계와 관계없이 유동적인 부골은연조직 치유를 위해 제거되어야 하며, 노출된 범위에서 증상을 나타내는 치아의 발치와 괴사된 골편의 제거는 이미 존재하는 괴사의 과정을 가속화시킬 수 있으므로 신중하게 고려되어야 한다. 3단계 이상으로 진행된 경우나 잘 경계된 부골이 있는 경우를 제외하고는 보존적인 치료가 실패한 경우에 한해 수술적인 치료를 결정하는 것이 좋다.
골다공증 환자의 치과치료 시 가장 유의해야 할 것은 자세한 문진을 통해 사전에 병력을 인지하는 것이다. 고령 환자, 특히 골다공증의 발병률이 높은 폐경기 이후의 여성 환자인 경우 병력 청취 시 골다공증 항목을 명시할 필요가 있다. MRONJ는 임상적으로 흔하게 발생하는 것은 아니다. 특히 골다공증 환자의 치료에 사용되는 골흡수 억제제의 용량은 암환자에 비해 적고, 그 발생률은 4년 이상 장기간 복용한 경우에도 0.5%를 넘지 않는다. 그러나 MRONJ는 발병하면 치료가 어렵기 때문에 예방이 중요하다. 전신 상태가 허락한다면 약물을 복용하기 이전에 구강검진을 통해 필요한 치과치료를 완료하는 것이 좋다. 이미 약물을 복용 중인 환자의 경우에는 처방의와 협진을 통해 약물의 중단이나 대체 약물의 복용을 검토해야 한다. 또한 골흡수 억제제 복용 환자의 치료 시 가능하면 비외과적 처치를 우선하도록 하며, 외과적 처치가 필요한 경우에는 환자에게 MRONJ의 발생가능성을 미리 알려야 한다. 수술 이후 주기적인 검진을 통해 MRONJ의 발생 시 이를 조기 진단하여 적절한 치료를 받을 수 있도록 하고, 지속적으로 구강 건강을 유지할 수 있도록 해야 한다.
처음 비스포스포네이트 관련 악골괴사 증례가 보고된 이후 그 원인을 규명하려는 노력이 지속적으로 이루어져 왔다. 그러나 골흡수 억제제 등에 의해 골의 재형성 과정이 과도하게 억제되어 발생한다는 것 외에 구체적인 원인이 밝혀지지 않았다. 뿐만 아니라 발병 전 진단을 위해 사용할 수 있는 방법도 명확하게 제시되지 않고 있다. MRONJ의 명확한 예방에 대해서는 추가적인 연구가 필요할 것으로 보이며, 치과 종사자들의 지속적인 관심과 노력이 필요할 것으로 생각된다.
Ji-Yeon Baek http://orcid.org/0000-0002-1921-2041
Jin-Han Lee http://orcid.org/0000-0001-9360-0635
References
1. Statistics Korea. 2015 Statistics on the aged. Available from: http://kostat.go.kr/portal/korea/kor_nw/2/1/index.board?bmode=read&bSeq=&aSeq=348565&pageNo=1&rowNum=10&navCount=10&currPg=&sTarget=title&sTxt (updated 2016 Mar 10).
2. Kim I, Ki H, Lee W, Kim H, Park JB. The effect of systemically administrated bisphosphonates on bony healing after tooth extraction and osseointegration of dental implants in the rabbit maxilla. Int J Oral Maxillofac Implants. 2013; 28:1194–200. DOI: 10.11607/jomi.2685. PMID: 24066308.
3. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg. 2003; 61:1115–7. DOI: 10.1016/S0278-2391(03)00720-1.
4. Taylor KH, Middlefell LS, Mizen KD. Osteonecrosis of the jaws induced by anti-RANK ligand therapy. Br J Oral Maxillofac Surg. 2010; 48:221–3. DOI: 10.1016/j.bjoms.2009.08.030. PMID: 19836866.
5. Kim KM, Rhee Y, Kwon YD, Kwon TG, Lee JK, Kim DY. Medication related osteonecrosis of the jaw: 2015 position statement of the Korean society for bone and mineral research and the Korean Association of Oral and Maxillofacial Surgeons. J Bone Metab. 2015; 22:151–65. DOI: 10.11005/jbm.2015.22.4.151. PMID: 26713306. PMCID: PMC4691589.
6. Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, Lindsay R. National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2014; 25:2359–81. DOI: 10.1007/s00198-014-2794-2. PMID: 25182228. PMCID: PMC4176573.
7. Korean society for bone and mineral research. Physician’s guide for diagnosis & treatment of osteoporosis 2015. Available from: http://www.ksbmr.org/journal/index4.php (updated 2016 Mar 10).
8. Hadjidakis DJ, Androulakis II. Bone remodeling. Ann N Y Acad Sci. 2006; 1092:385–96. DOI: 10.1196/annals.1365.035. PMID: 17308163.
9. Hadji P. The evolution of selective estrogen receptor modulators in osteoporosis therapy. Climacteric. 2012; 15:513–23. DOI: 10.3109/13697137.2012.688079. PMID: 22853318. PMCID: PMC3793274.
10. Munoz-Torres M, Alonso G, Raya MP. Calcitonin therapy in osteoporosis. Treat Endocrinol. 2004; 3:117–32. DOI: 10.2165/00024677-200403020-00006. PMID: 15743107.
11. Whitaker M, Guo J, Kehoe T, Benson G. Bisphosphonates for osteoporosis-where do we go from here? N Engl J Med. 2012; 366:2048–51. DOI: 10.1056/NEJMp1202619. PMID: 22571168.
12. Ponnapakkam T, Katikaneni R, Sakon J, Stratford R, Gensure RC. Treating osteoporosis by targeting parathyroid hormone to bone. Drug Discov Today. 2014; 19:204–8. DOI: 10.1016/j.drudis.2013.07.015. PMID: 23932952. PMCID: PMC3979969.
13. Cummings SR, San Martin J, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C. FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009; 361:756–65. DOI: 10.1056/NEJMoa0809493. PMID: 19671655.
14. Park HM. Current use of drugs for osteoporosis in Korea. Korean J Obstet Gynecol. 2010; 53:152–9. DOI: 10.5468/kjog.2010.53.2.152.
15. Health insurance review & assessment service. A research of medical care utilization and drug prescribing pattern for osteoporosis. Available from: http://dlps.nanet.go.kr/DlibViewer.do?cn=MONO1201021608&sysid=nhn (updated 2016 Mar 10).
16. Ruggiero SL, Dodson TB, Fantasia J, Goodday R, Aghaloo T, Mehrotra B, O’Ryan F. American Association of Oral and Maxillofacial Surgeons. American association of oral and maxillofacial surgeons position paper on medication-related osteonecrosis of the jaw-2014 update. J Oral Maxillofac Surg. 2014; 72:1938–56. DOI: 10.1016/j.joms.2014.04.031. PMID: 25234529.
17. Marx RE, Sawatari Y, Fortin M, Broumand V. Bisphosphonate-induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment. J Oral Maxillofac Surg. 2005; 63:1567–75. DOI: 10.1016/j.joms.2005.07.010. PMID: 16243172.
18. Lo JC, O’Ryan FS, Gordon NP, Yang J, Hui RL, Martin D, Hutchinson M, Lathon PV, Sanchez G, Silver P, Chandra M, McCloskey CA, Staffa JA, Willy M, Selby JV, Go AS. Prevalence of osteonecrosis of the jaw in patients with oral bisphosphonate exposure. J Oral Maxillofac Surg. 2010; 68:243–53. DOI: 10.1016/j.joms.2009.03.050. PMID: 19772941.
19. Marx RE, Cillo JE Jr, Ulloa JJ. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. J Oral Maxillofac Surg. 2007; 65:2397–410. DOI: 10.1016/j.joms.2007.08.003. PMID: 18022461.
20. Kim JW, Kong KA, Kim SJ, Choi SK, Cha IH, Kim MR. Prospective biomarker evaluation in patients with osteonecrosis of the jaw who received bisphosphonates. Bone. 2013; 57:201–5. DOI: 10.1016/j.bone.2013.08.005. PMID: 23954759.
21. Saad F, Brown JE, Van Poznak C, Ibrahim T, Stemmer SM, Stopeck AT, Diel IJ, Takahashi S, Shore N, Henry DH, Barrios CH, Facon T, Senecal F, Fizazi K, Zhou L, Daniels A, Carriere P, Dansey R. Incidence, risk factors, and outcomes of osteonecrosis of the jaw: integrated analysis from three blinded active-controlled phase III trials in cancer patients with bone metastases. Ann Oncol. 2012; 23:1341–7. DOI: 10.1093/annonc/mdr435. PMID: 21986094.
22. Khan AA, Morrison A, Hanley DA, Felsenberg D, McCauley LK, O’Ryan F, Reid IR, Ruggiero SL, Taguchi A, Tetradis S, Watts NB, Brandi ML, Peters E, Guise T, Eastell R, Cheung AM, Morin SN, Masri B, Cooper C, Morgan SL, Obermayer-Pietsch B, Langdahl BL, Al Dabagh R, Davison KS, Kendler DL, Sandor GK, Josse RG, Bhandari M, El Rabbany M, Pierroz DD, Sulimani R, Saunders DP, Brown JP, Compston J. International task force on osteonecrosis of the jaw. Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus. J Bone Miner Res. 2015; 30:3–23. DOI: 10.1002/jbmr.2405. PMID: 25414052.
23. Kim I, Ki H, Lee W, Kim H, Park JB. The effect of systemically administered bisphosphonates on bony healing after tooth extraction and osseointegration of dental implants in the rabbit maxilla. Int J Oral Maxillofac Implants. 2013; 28:1194–200. DOI: 10.11607/jomi.2685. PMID: 24066308.
24. Kumar SK, Gorur A, Schaudinn C, Shuler CF, Costerton JW, Sedghizadeh PP. The role of microbial biofilms in osteonecrosis of the jaw associated with bisphosphonate therapy. Curr Osteoporos Rep. 2010; 8:40–8. DOI: 10.1007/s11914-010-0008-1. PMID: 20425090.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download