Abstract
With emerging more effective drugs, the therapeutic goal of inflammatory bowel disease (IBD) has progressed from clinical remission to mucosal healing. Although the inflammation could be controlled more effectively than before, symptoms such as abdominal pain and bowel habit change is still bothersome to some IBD patients. Recently, these “refractory functional gastrointestinal symptoms” in quiescent IBD patients has been paid more attention. The pathophysiology could be multifactorial with genetics, change in gut motility associated with post inflammatory condition, increased permeability, impaired colorectal function, visceral hypersensitivity and gut microbiota. Because both IBD and functional gastrointestinal disease (FGID) could share similar symptoms and some pathophysiology, it is sometimes challenging to distinguish them exactly. However, to reduce the risk of overtreatment or insufficient control of inflammation, exact diagnosis of functional disease or symptoms in quiescent IBD patients is important. Because there is limited randomized controlled trials or prospective study currently, most of the therapeutic approach in IBD patients are empirical or referred to those of functional gastrointestinal disorders. However, approaches based on pathophysiological mechanisms could give appropriate therapies for both IBD and FGIDs.
Go to : 
기능성 위장관 질환은 가장 흔한 만성 소화기 질환 중 하나로 복통, 더부룩함(bloating) 혹은 복부 팽만감, 설사 및 변비 등의 증상이 다른 기질적인 원인없이 발생하는 질환으로 삶의 질을 저하시키게 된다.1 기능성 위장관 질환과 달리 크론병 혹은 궤양성 대장염으로 대표되는 염증성 장질환은 유전적 소인을 가진 개인에서 면역이상, 장내미생물에 의한 장점막 방어 기능 약화 등이 발생되면서 만성적으로 위장관에 염증이 발생하는 질환으로, 설사, 복통, 복부 팽만감과 같이 기능성 위장관 질환과 유사한 증상 뿐 아니라 혈변, 체중감소 등이 나타날 수 있으며, 적절한 치료가 이루어지지 않을 경우 협착, 천공과 같은 합병증이 발생할 수 있다.2 최근 다양한 병태생리를 표적으로 하는 효과적인 약제들이 나오면서 염증성 장질환 치료 목표가 증상 호전에서 점막 치유를 통해 질병 경과를 바꾸는 것으로 진화하게 되었다.2,3
염증성 장질환에서 임상관해 및 점막치유율이 증가하였음에도 불구하고 여전히 복통, 팽만감, 설사와 같은 증상을 지속적으로 호소하는 환자들이 있다. 이처럼 염증성 장질환 환자에서 객관적인 염증 소견 없이, 다른 가능성 있는 원인에 대한 적절한 치료를 시도하였음에도 증상이 지속될 경우 과민성장증후군과 같은 기능성 위장관 질환의 동반을 고려해봐야 하며, 실제로 염증성 장질환에 동반되는 기능성 장질환 증상의 빈도가 적지 않음이 보고되면서, 이에 대한 관심도 증가하고 있다.4,5
염증성 장질환에서 기능성 위장관 질환 혹은 증상이 발생하는 것은 두 질환에 공통적으로 관련된 일부 병태생리와 만성적인 염증으로 인한 구조적 손상에 의한 기능적 변화가 관여될 수 있다.5 그런데 설사, 복통 및 팽만감은 두 질환 모두에서 나타날 수 있는 유사 증상으로 감별이 필요할 수 있는데, 이때 염증성 장질환의 영상학적, 내시경적 활성도와 환자들의 임상적인 활성도가 항상 잘 일치하지는 않기 때문에, 장내 염증 혹은 섬유화 등과 관련된 증상과 기능성 장질환을 구분한다는 것은 쉽지 않다.6 염증성 장질환 환자에서 염증 소견없이 지속되는 불응성 소화기 증상을 질병 활성도 증가와 구분하는 것은 스테로이드 혹은 면역억제제와 같은 과도한 치료의 위험을 줄이는 데 있어 중요한 문제가 될 수 있다. 이에 본고에서는 염증성 장질환 환자에서 동반된 기능성 위장관 질환, 특히 과민성장증후군과 관련된 병태생리, 진단 및 치료에 대해 알아보고자 한다.
Go to : 
염증성 장질환에서 기능성 장질환의 빈도는 연구대상 및 진단 기준에 따라 다양하게 보고되는데,7 과민성장증후군의 경우 메타분석 결과에 따르면 유병률이 39% (95% CI 30-48%)로 염증성 장질환이 동반되지 않은 대조군에 비해 증상이 발생할 위험이 4.89배였으며, 염증성 장질환 환자에서 비교하였을 때 관해 상태의 크론병 환자에서 궤양성 대장염보다 유병률이 더 높은 것으로 보고되고 있다(OR 1.74, 95% CI 1.24-2.43).8
염증성 장질환에서 과민성장증후군 혹은 유사 증상은 여성, 삶의 질 감소 및 높은 피로감 점수와 관련이 있다.9 한 3년간의 추적 연구에 따르면, 관해 상태의 궤양성 대장염 환자에서 과민성장증후군 유사 증상은 호전과 재발로 오랜 시간 지속되는 경향이 있으며, 매년 19% 정도씩 보고되는데, 이러한 환자들은 대개 걱정 및 불안과 같은 기분장애가 있다.8,9 하지만 염증성 장질환 환자에서 발생하는 과민성장증후군의 위험인자로서 걱정은 중등도 정도의 위험을 보이는 것으로 보고되어 단순히 신경학적 부분만으로 증상의 발생을 설명할 수는 없다.8 그 밖에 다른 몇몇 기전과 관련되어 일부 연구에 따르면 염증성 장질환 환자에서 과민성장증후군 증상이 궤양성 대장염 환자의 1/3, 크론병의 1/2에서 나타날 수 있다고 보고되었다.8 염증성 장질환에서 염증조절능력이 좋아질수록 향후에는 기능성 질환과 증상에 대한 부담은 커질 수 있을 것이다.
그동안 두 질환 간의 공통적인 병태생리로 명확하게 밝혀진 것은 없었지만, 최근 몇몇 연구를 통해서 기능성 장질환 역시 병태생리학적으로 미세 염증 등과 관련이 있는 것으로 밝혀지게 되었다.10-12 그런데 알려진 바와 같이 염증성 장질환의 병태생리에서 가장 핵심은 염증이며, 관해 상태의 염증성 장질환 환자라도 약 1/3에서 미세 염증은 존재하는 것으로 보고되어,13 두 질환의 감별이 어려워졌다.10-12 실제 일부 과민성장증후군 환자에서 비만세포 혹은 T 림프구와 같은 염증세포가 증가되어 있으며 단백분해효소, 히스타민, 프로스타글란딘과 같은 염증 매개 물질들이 대조군과 비교하여 많이 분비된다고 보고되었다.13-16 이때 장 신경 가까이 분포하고 있는 활성화된 비만세포(mast cell)는 복통의 강도 및 빈도와 관련이 있을 수 있다.16 미세 염증은 주로 감염 후 과민성장증후군과 관련이 있는 것으로 알려져 있지만, 설사 및 변비 우세형과민성장증후군에서도 유사한 결과가 보고된 바 있다.17 미세염증 발생에 영향을 주는 인자로는 알러지 및 스트레스 등이있으며 이는 두 질환 모두에서 공통적으로 이야기되고 있다.18,19
스트레스의 경우 과민성장증후군 환자에서 시상하부-뇌하수체-부신피질(hypohalamic-pituitary-adrenal, HPA) 축에 변형이 생기면서20,21 부신 자극 호르몬 유리인자(corticotrophin releasing factor, CRF)의 자극이나22,23 스트레스에 대한 호르몬 반응이 변형되어 나타나며,20 말초에서는 CRF 수용체가 활성화 되면서 염증성 변화가 나타나, 장관내 면역반응을 비정상적으로 활성화 시키거나16 급작스럽게 증상을 유발할 수 있다.24 이로 인해 장관 내 상재균의 변화와 점막 손상 및 세균 생산물의 이동이 발생하며, 염증 증가와 사이토카인의 분비가 내장 감각과민(visceral hypersensitivity)을 초래하게 된다.25 그런데, 명확한 것은 아니나, 정상인에 비해 궤양성 대장염 환자의 장점막에서 면역 활성화된 CRF의 발현이 증가되어 있는 것이 보고됨으로써 염증성 장질환 환자의 말초에서 CRF가 면역 및 염증 조절에 어느 정도 역할을 하고 있을 가능성을 보여주었고, 실제로 CRF 길항제를 말초에 투여할 경우 HPA 축에 영향을 주지 않고도 과도하게 증가된 장관의 운동성이나 과민성 등이 억제되었다는 보고가 있었다.26 스트레스는 상부위장관 운동에는 억제 효과를 가지지만 하부위장관에서는 대장 통과 시간을 감소시키고, 장관의 수축력을 증가시켜 설사를 유발하게 된다.27,28
한편, 미주신경은 HPA 축을 통한 감각 신경로와 콜린성 경로를 통한 운동 신경로의 양방향 모두 항 염증성 속성을 지니는데, 염증성 장질환 및 기능성 장질환 환자 모두에서 이 미주신경의 조절기능부전이 발생하면서 증상이 유발된다.29
유전학적으로도 염증성 장질환 환자에서 숙주와 장내세균 사이에서 병원균에 대한 방어 및 조절에 관여하는 tumor necrosis factor soluble factor 15 (TNFSF15)가 과민성장증후군 환자에서 일반인에 비해 좀 더 발현되었다는 연구 결과가 보고되었고, 이후 연구에서 같은 결과가 한 번 더 확인이 되면서, 과민성장증후군이 크론병의 불완전한 면역 변이형의 하나로 둘 사이 공통적 기전 작용의 가능성이 제시되기도 하였다.30-32
내장 감각과민과 관련해서 염증 정도와의 연관성에 대해서는 논란이 많지만,33 관해 상태임에도 불구하고 복통과 같은 증상이 지속되는 염증성 장질환 환자에서 감각신경 과민이 좀 더 두드러지는 것으로 보고되었다.9
장내 미생물 역시 관련이 있을 수 있는데, 일반적으로 염증성 장질환 환자에서 장내 세균 다양성 감소 및 단쇄지방산인 butyrate, propionate 대사와 관련된 일부 세균들이 감소되어 있는 것으로 알려져 있다.34-36 일반적으로 급성 장염 등에 의해 장내 미생물 이상 등이 발생할 수 있는 것으로 알려져 있는데, 기능성 위장관 질환 중 장내 세균 연구가 가장 활발히 진행된 과민성장증후군의 경우 약 3.7-36.0% 정도의 환자들은 과민성장증후군을 만족하는 진단이 내려지기 전 급성 장염을 경험하는 것으로 보고되고 있으며, 급성 감염성 장염은 염증성 장질환의 독립적 위험인자이기도 하다.37,38 최근 장내미생물과 정신과 및 장내 생리적 인자의 연관성을 분석한 연구에 따르면 장내 미생물 이상은 장의 이동 등에 변화를 유발하고, 이에 대한 적절한 개선이 이루어지지 않는 경우 걱정 혹은 우울과 관련이 될 수 있다.39 과민장성증후군 환자에서 장 및 대변내 단백 분해효소의 활성도가 증가되었다는 보고가 있는데, 이 단백 분해효소는 통증의 전달이나, 대장기능이상에 관여하는 수용체의 활성과 관련이 있으며, Lactobacillales, Lachnospiraceae 및 Steroptococcaceae와 같은 일부 장내 세균들이 대변 단백분해효소의 활성과 관련이 있는 것으로 밝혀져, 세균이 대변 단백분해효소활성도 증가에 중요한 역할을 하며, 나아가 세균과 복통의 연관성의 가능성을 보였다.40 하지만 최근의 단면 연구에 따르면 염증성 장질환 환자에서 과민성장증후군의 증상과 미생물 변화 간의 연관성을 찾지 못해 이 분야에 있어서는 좀 더 연구가 필요할 것으로 생각된다.41
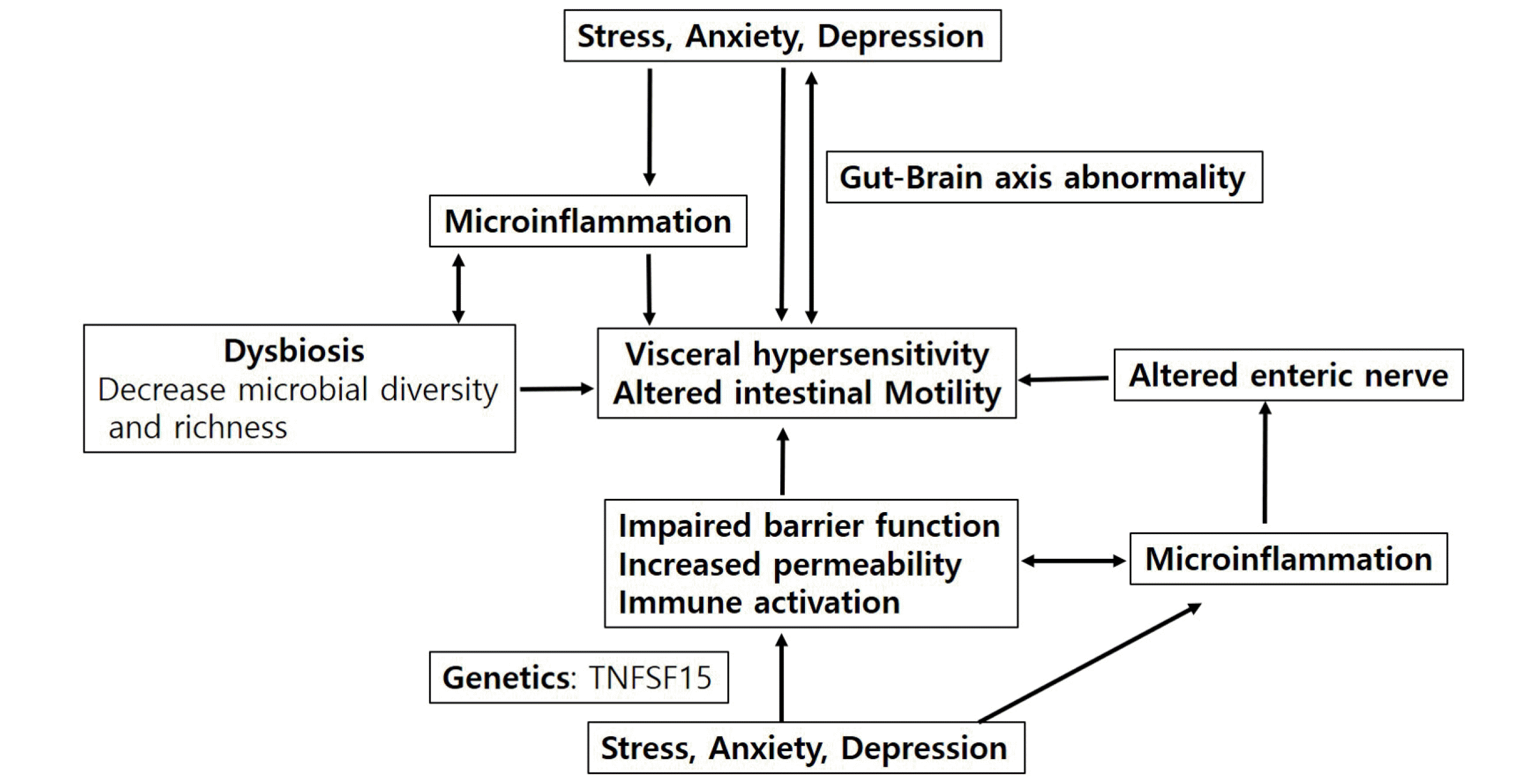
한편, 장기간에 걸친 장점막 방어 기능의 변화는 염증성 장질환 환자의 병태생리 및 재발에 있어 중요한 역할을 하는데, 과민성장증후군이 동반된 염증성 장질환 환자에서 그렇지 않은 환자에 비해 장점막 투과도가 증가되어 있다고 보고되었다.42 이는 과민성장증후군에서도 점막 투과성 증가가 증상 유발의 중요한 기전 중 하나임을 보여주는 것으로,43,44 실험 연구 결과에 따르면, 과민성장증후군 환자의 대장조직에서 높은세포 사이 투과성과 zonular occludens-1 mRNA 발현이 저하되어 있음이 발견되었고, 증가된 장점막 투과성은 복통의중증도와 연관이 있었다.45,46 방어 기능의 변화는 구조적인 변화와 함께 나타나며, 이는 비만세포 활성화와 설사, 복통을포함하는 임상 양상과 연관이 있다.47 장점막 방어와 관련된구조적, 기능적 변화의 정확한 원인은 아직 알려져 있지 않지만, 아마도, 경도의 염증, 식이 등이 관여할 것으로 생각되고있다.48,49 지금까지 기술한 두 질환에서 공통적으로 관여하는일부 병태생리들을 정리 해보면 각각의 기전들이 서로 연결되어 관여하고 있다(Fig. 1). 그 밖에도 장관 운동기능 변화가복통을 유발할 수 있으며,8,42,50-56 염증 반응 후 대장 톤 이상,직장 컴플라이언스 감소 등도 증상의 발생과 관련될 수 있다.52
기능성 위장관 질환은 유병률이 일반인57과 염증성 장질환환자8 각각에서 약 35% 정도를 차지할 만큼 흔한 질환으로, 증상에 근거하여 진단을 하게 된다. 염증성 장질환에 동반된 기능성 위장관 질환의 진단은 증상에 대한 주의 깊은 병력 청취를 통해 기질성 질환에 의한 증상과 기능성 질환의 감별하는 것에서부터 시작된다.58 염증성 장질환과 관련된 임상 양상 뿐 아니라, 기능성 장질환 선별을 위해 로마기준 IV에 따른 복통, 더부룩함, 배변습관 및 형태 변화를 확인하고,1 골반 기저근 기능이상의 위험인자(폐색성 배변증상, 불완전 배변감 및 힘주기, 가성설사 및 분변매복) 등에 대해 질문하는 것이 도움이 될 수 있다.59-61
유사한 증상을 호소하지만 양상에 있어서 차이가 있을 수 있는데, 일반적으로 염증성 장질환에 의한 복통의 경우 연속적으로 발생하며, 배변 등에 의해 호전을 보이지 않으나, 과민성장증후군과 같은 기능성 질환은 배변에 의해 호전될 수 있다.4 체중감소는 염증성 장질환에 흔히 동반되는 증상이지만, 기능성 장질환 환자에서도 증상으로 인한 음식물 섭취에 대한 두려움으로 섭취량이 저하되면서 발생할 수 있으며, 구역, 구토는 염증성 장질환에서, 흉통 혹은 소화 불량 등은 기능성 질환에서 연관되어 나타나는 경우가 좀 더 흔하다.4
다음으로 활동성 염증을 배제하기 위한 객관적인 검사가 필요하다. 최근 제안된 알고리즘에 따르면, 분변 칼프로텍틴(fecal calprotectin), C-반응단백(CRP)과 같은 생화학적 검사를 우선적으로 고려하고, 이후 내시경 및 조직 검사 혹은 영상학적 검사를 고려해야 한다.7 이와 더불어 회장 질환이나, 이전 수술 등과 관련하여 발생할 수 있는 담즙성 설사, 소장 세균 과증식, 췌장 기능 부전 등과 같은 유사 질환에 의한 증상도 감별할 수 있어야 한다.62 이와 같은 원인이 배재된 이후 환자가 호소하는 증상의 기전에 대해 주의 깊게 고려해 볼 필요가 있다. 염증성 장질환에서 유병률이 높은 것으로 보고되고 있는, 대변 실금에 대한 감별도 필요하며, 직장항문기능검사가 도움이 될 수 있다.61
아직까지 염증성 장질환 환자에서 기능성 장질환 증상 치료에 대한 무작위 배정 혹은 전향적 연구조차 이루어지지 않은 실정이라, 경험적 혹은 과민장성증후군 뿐 아니라 다른 기능성 질환에서 효과적인 것으로 알려진 약물 및 비약물적 치료들이 흔히 적용되고 있다.7 이와 더불어 병태생리학적으로 경미한 염증과 기능성 증상이 함께 있을 수 있기 때문에 염증 치료와 증상 치료는 함께 이루어 져야한다. 현재까지 알려진 치료와 이와 관련된 병태생리 및 각각의 치료가 도움이 되는 증상을 Table 1과 같이 요약해 보았다.
Available Treatment of Functional Gastrointestinal Symptoms in IBD Patients
유당 감소 식이, 저포드맵, 글루텐 제거 식이 및 특이 탄수화물 식이가 일부 기능성 위장관 질환 환자의 증상 호전에 도움이 되었다는 보고가 있다.7 그런데 기능성 질환에서 식이 치료의 공통분모를 자세히 보면, 소화가 잘되지 않는 탄수화물의 섭취를 줄이는 것과 관련이 있다. 실제로 이러한 종류의 탄수화물은 장내 팽창을 유발하고, 삼투 효과 및 발효로 인해 기계적 감각수용체를 자극시킬 수 있다. 크론병 환자들을 대상으로 한 무작위 배정 연구에 따르면, 전형적인 포드맵 식이는 증상의 중증도를 증가시켰다는 보고가 있다.63 또한 염증성 장질환 환자에서 저포드맵 식이가 염증 조절에도 불구하고 지속되는 증상을 가진 환자의 절반에서 증상 호전에 도움이 되었다는 연구도 있다.64
아직까지 기능성 소화기 증상이 동반된 염증성 장질환 환자에서 약물 치료와 관련된 양질의 연구가 많이 없는 실정이다. 치료에 이용되는 5-aminisalicylate 제제가 장점막에서 T 림프구와 비만세포를 하향조절하는 기능이 있으며, 이러한 효과는 과민성장증후군 환자에서 사용하였을 때에도 확인이 되었고, 전신적 건강함을 느끼는 데 도움이 되었으나 복통과 팽만감의 호전이나 배변 횟수 변화에 유의한 호전을 보이는 데 실패하였다.66
결국 대부분의 치료는 각각의 증상에 대하여 이루어지는데, 변비 환자의 경우 하제 혹은 소화관 운동 촉진제를, 설사 환자의 경우 진경제 혹은 loperamide와 같은 지사제, 담즙성 설사의 경우 담즙산 분리제(sequestrant), 췌장기능부전의 경우 췌장 효소, 복통에 대해 진경제, 진통제 등을 이용하며, 걱정 혹은 우울뿐 아니라 복부 증상에 대해 항우울제나 불안제 등을 이용할 수 있다.5 항우울제와 관련하여 81명의 기능성 소화기 증상을 동반한 염증성 장질환 환자에서 삼환계 항우울제가 증상 호전에 도움이 되었다는 연구가 있다.67 두 질환 모두에서 반복적인 복통으로 약물에 대한 의존도가 증가될 수 있는데, 이러한 환자에서 마약성 진통제의 만성적 사용은 마약성 장증후군과 같은 구조적 이상이 없이 소장 폐색유사 소견이 발생할 수 있으므로 피해야 하며, 특히 급성 염증 후 관해 상태의 환자에서는 주의가 필요하다.68
장내 세균이 두 질환의 병태생리와 관련이 있는 것으로 밝혀지면서 최근 다양한 연구 결과들이 나오고 있다. Rifaximin과 같은 항생제가 소장세균 과증식에 흔히 이용되어 왔는데, 염증성 장질환에서는 아직까지 제한적이다. 14명의 비활동성 회장 크론병에서 수소호기검사로 소장세균 과증식이 확인된 환자를 대상으로 진행된 무작위 배정 연구에 따르면 rifaximin을 치료한 그룹의 경우 모든 환자가 추적 검사에서 음성으로 나타났으나, 위약군의 경우 두 명에서 반응을 보인 것으로 확인되었다.71 한편, rifaximin이 활동성 염증성 장질환 환자에서 관해유도 및 유지에 효과가 있을 수 있다는 연구가 보고되기도 하였다.72-74 또한 과민성장증후군 환자의 더부룩함, 복통, 무른 변 및 설사 등의 증상에 rifaximin이 도움이 될 수 있음은 여러 무작위 배정 임상 연구를 통해 증명이 되어 설사 우세형 과민성장증후군의 치료에 승인을 받았다.75 최근 연구에 따르면 rifaximin으로 치료한 과민성장증후군 환자에서 미생물 풍부도(microbial richness)는 보통 정도의 효과가 있었지만, 이 약제의 효과가 소장세균 과증식 감소에 의한 것인지, 장내 미생물 변화와 관련이 있는지는 명확하지가 않다.76 정장제의 경우 기능성 소화기 증상에서 널리 연구되어 왔지만 다양한 결과가 보고되고 있고, 추가적인 유익함이 있다하더라도 그 효과가 크지는 않았으며, 염증성 장질환 환자에서의 증상은 연구된 것 없다. 대변 세균이식의 경우는 염증성 장질환 환자의 염증 조절을 위해 시도되었으나, 기능성 증상을 위해 시도된 연구는 아직 없다.
과민성장증후군 환자에서 정신과적 치료로 인지행동 치료, 최면 치료, 정신역동학적 치료 등이 복부 증상에 도움이 되는 것으로 알려져 있으며,77 염증성 장질환 환자의 경우 장기적 효과는 불분명하지만, 인지행동 치료가 단기적으로 우울을 호전시켜 삶의 질을 향상시킨다고 보고되었으며, 최면 치료의 경우 2개의 소규모 연구에서 효과를 보여주었다.77,78 실제 염증성 장질환 환자는 질병의 진행에 대한 두려움과 불안이 있고 이로 인해 1/3 정도는 정신과적 치료가 요구되며, 크론병에서 더 효과가 좋은 것으로 보고되고 있다.79 하지만 두 질환이 함께 있는 환자에서의 연구는 진행된 것이 없다. 뇌-장 간의 상호작용을 포함한 스트레스나 정신건강이 환자의 증상에중요한 영향을 미칠 수 있으므로 이에 대해 좀 더 집중된 연구가 필요하다.80
Go to : 
염증성 장질환 치료의 발달로 연관된 증상이 호전된 후에도 질환 자체와 관계없이 발생하는 장증상에 대한 인식이 높아짐에 따라, 동반된 기능성 위장관 질환 증상을 감별할 수 있는 효과적인 진단 방법이 필요하게 되었다. 유전, 대사 및 미생물학적 경로에 근거한 새로운 생물학적 지표가 도움이 될 수 있을 것으로 생각이 되나 아직 많은 연구가 이루어지지 않았다. 이와 더불어 뇌-장 간의 상호작용을 포함한 스트레스나, 정신건강이 환자의 증상에 중요한 영향을 미칠 수 있으므로 이에 대한 관심과 연구도 필요한 실정이다. 병태생리에 대한 정확한 이해와 좀 더 객관적인 근거를 통한 감별이 가능해지고, 치료 역시 경험이 아닌, 잘 고안된 무작위 배정 연구 결과에 근거하여 이루어질 때 염증성 장질환의 염증뿐 아니라 환자들마다 개별화된 효과적인 기능성 증상 치료를 기대할 수 있을 것으로 생각된다.
Go to : 
REFERENCES
1. Lacy BE, Fermin M, Chang L, et al. 2016; Bowel Disorders. Gastroenterology. 150:1393–1407.e5. DOI: 10.1053/j.gastro.2016.02.031. PMID: 27144627.

2. Kim JM, Cheon JH. 2020; Pathogenesis and clinical perspectives of extraintestinal manifestations in inflammatory bowel diseases. Intest Res. 18:249–264. DOI: 10.5217/ir.2019.00128. PMID: 32295331. PMCID: PMC7385581.

3. Turner D, Ricciuto A, Lewis A, et al. 2021; STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology. 160:1570–1583. DOI: 10.1053/j.gastro.2020.12.031. PMID: 33359090.

4. Ryu KH, Huh KC. 2010; Irritable Bowel Syndrome in Inflammatory Bowel Disease. Intest Res. 8:95–105. DOI: 10.5217/ir.2010.8.2.95.

5. Vasant DH, Ford AC. 2020; Functional gastrointestinal disorders in inflammatory bowel disease: Time for a paradigm shift? World J Gastroenterol. 26:3712–3719. DOI: 10.3748/wjg.v26.i26.3712. PMID: 32774052. PMCID: PMC7383849.

6. Peyrin-Biroulet L, Reinisch W, Colombel JF, et al. 2014; Clinical disease activity, C-reactive protein normalisation and mucosal healing in Crohn's disease in the SONIC trial. Gut. 63:88–95. DOI: 10.1136/gutjnl-2013-304984. PMID: 23974954.

7. Colombel JF, Shin A, Gibson PR. 2019; AGA Clinical Practice Update on Functional Gastrointestinal Symptoms in Patients With Inflammatory Bowel Disease: Expert Review. Clin Gastroenterol Hepatol. 17:380–390.e1. DOI: 10.1016/j.cgh.2018.08.001. PMID: 30099108. PMCID: PMC6581193.

8. Halpin SJ, Ford AC. 2012; Prevalence of symptoms meeting criteria for irritable bowel syndrome in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol. 107:1474–1482. DOI: 10.1038/ajg.2012.260. PMID: 22929759.

9. Jonefjäll B, Strid H, Ohman L, Svedlund J, Bergstedt A, Simren M. 2013; Characterization of IBS-like symptoms in patients with ulcerative colitis in clinical remission. Neurogastroenterol Motil. 25:756–e578. DOI: 10.1111/nmo.12163. PMID: 23731196.

10. Drossman DA. 2005; Functional GI disorders: what's in a name? Gastroenterology. 128:1771–1772. DOI: 10.1053/j.gastro.2005.04.020. PMID: 15940609.

11. Drossman DA. 2006; Functional versus organic: an inappropriate dichotomy for clinical care. Am J Gastroenterol. 101:1172–1175. DOI: 10.1111/j.1572-0241.2006.00592.x. PMID: 16771931.

12. Quigley EM. 2005; Irritable bowel syndrome and inflammatory bowel disease: interrelated diseases? Chin J Dig Dis. 6:122–132. DOI: 10.1111/j.1443-9573.2005.00202.x. PMID: 16045602.

13. Barbara G, Cremon C, Carini G, et al. 2011; The immune system in irritable bowel syndrome. J Neurogastroenterol Motil. 17:349–359. DOI: 10.5056/jnm.2011.17.4.349. PMID: 22148103. PMCID: PMC3228974.

14. Cenac N, Andrews CN, Holzhausen M, et al. 2007; Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest. 117:636–647. DOI: 10.1172/JCI29255. PMID: 17304351. PMCID: PMC1794118.

15. Barbara G, Wang B, Stanghellini V, et al. 2007; Mast cell-dependent excitation of visceral-nociceptive sensory neurons in irritable bowel syndrome. Gastroenterology. 132:26–37. DOI: 10.1053/j.gastro.2006.11.039. PMID: 17241857.

16. Barbara G, Stanghellini V, De Giorgio R, et al. 2004; Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome. Gastroenterology. 126:693–702. DOI: 10.1053/j.gastro.2003.11.055. PMID: 14988823.

17. Matricon J, Meleine M, Gelot A, et al. 2012; Review article: Associations between immune activation, intestinal permeability and the irritable bowel syndrome. Aliment Pharmacol Ther. 36:1009–1031. DOI: 10.1111/apt.12080. PMID: 23066886.

18. Mawdsley JE, Rampton DS. 2006; The role of psychological stress in inflammatory bowel disease. Neuroimmunomodulation. 13:327–336. DOI: 10.1159/000104861. PMID: 17709955.

19. Mulak A, Bonaz B. 2004; Irritable bowel syndrome: a model of the brain-gut interactions. Med Sci Monit. 10:RA55–RA62. PMID: 15260348.
20. Posserud I, Agerforz P, Ekman R, Björnsson ES, Abrahamsson H, Simrén M. 2004; Altered visceral perceptual and neuroendocrine response in patients with irritable bowel syndrome during mental stress. Gut. 53:1102–1108. DOI: 10.1136/gut.2003.017962. PMID: 15247175. PMCID: PMC1774150.

21. Böhmelt AH, Nater UM, Franke S, Hellhammer DH, Ehlert U. 2005; Basal and stimulated hypothalamic-pituitary-adrenal axis activity in patients with functional gastrointestinal disorders and healthy controls. Psychosom Med. 67:288–294. DOI: 10.1097/01.psy.0000157064.72831.ba. PMID: 15784796.

22. Dinan TG, Quigley EM, Ahmed SM, et al. 2006; Hypothalamic-pituitary-gut axis dysregulation in irritable bowel syndrome: plasma cytokines as a potential biomarker? Gastroenterology. 130:304–311. DOI: 10.1053/j.gastro.2005.11.033. PMID: 16472586.

23. Fukudo S, Nomura T, Hongo M. 1998; Impact of corticotropin-releasing hormone on gastrointestinal motility and adrenocorticotropic hormone in normal controls and patients with irritable bowel syndrome. Gut. 42:845–849. DOI: 10.1136/gut.42.6.845. PMID: 9691924. PMCID: PMC1727153.

24. Taché Y, Perdue MH. 2004; Role of peripheral CRF signalling pathways in stress-related alterations of gut motility and mucosal function. Neurogastroenterol Motil. 16(Suppl 1):137–142. DOI: 10.1111/j.1743-3150.2004.00490.x. PMID: 15066020.

25. Vanuytsel T, van Wanrooy S, Vanheel H, et al. 2014; Psychological stress and corticotropin-releasing hormone increase intestinal permeability in humans by a mast cell-dependent mechanism. Gut. 63:1293–1299. DOI: 10.1136/gutjnl-2013-305690. PMID: 24153250.

26. Sagami Y, Shimada Y, Tayama J, et al. 2004; Effect of a corticotropin releasing hormone receptor antagonist on colonic sensory and motor function in patients with irritable bowel syndrome. Gut. 53:958–964. DOI: 10.1136/gut.2003.018911. PMID: 15194643. PMCID: PMC1774093.

27. Welgan P, Meshkinpour H, Beeler M. 1988; Effect of anger on colon motor and myoelectric activity in irritable bowel syndrome. Gastroenterology. 94:1150–1156. DOI: 10.1016/0016-5085(88)90006-6. PMID: 3350284.

28. Evans PR, Bak YT, Shuter B, Hoschl R, Kellow JE. 1997; Gastroparesis and small bowel dysmotility in irritable bowel syndrome. Dig Dis Sci. 42:2087–2093. DOI: 10.1023/A:1018874602790. PMID: 9365140.
29. Camilleri M, Ford MJ. 1994; Functional gastrointestinal disease and the autonomic nervous system: a way ahead? Gastroenterology. 106:1114–1118. DOI: 10.1016/0016-5085(94)90775-7. PMID: 8143980.

30. Jostins L, Ripke S, Weersma RK, et al. 2012; Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491:119–124. DOI: 10.1038/nature11582. PMID: 23128233. PMCID: PMC3491803.
31. Swan C, Duroudier NP, Campbell E, et al. 2013; Identifying and testing candidate genetic polymorphisms in the irritable bowel syndrome (IBS): association with TNFSF15 and TNFα. Gut. 62:985–994. DOI: 10.1136/gutjnl-2011-301213. PMID: 22684480.

32. Labus JS, Dinov ID, Jiang Z, et al. 2014; Irritable bowel syndrome in female patients is associated with alterations in structural brain networks. Pain. 155:137–149. DOI: 10.1016/j.pain.2013.09.020. PMID: 24076048. PMCID: PMC4100785.

33. Srinath AI, Walter C, Newara MC, Szigethy EM. 2012; Pain management in patients with inflammatory bowel disease: insights for the clinician. Therap Adv Gastroenterol. 5:339–357. DOI: 10.1177/1756283X12446158. PMID: 22973418. PMCID: PMC3437534.

34. Major G, Spiller R. 2014; Irritable bowel syndrome, inflammatory bowel disease and the microbiome. Curr Opin Endocrinol Diabetes Obes. 21:15–21. DOI: 10.1097/MED.0000000000000032. PMID: 24296462. PMCID: PMC3871405.

35. Cader MZ, Kaser A. 2013; Recent advances in inflammatory bowel disease: mucosal immune cells in intestinal inflammation. Gut. 62:1653–1664. DOI: 10.1136/gutjnl-2012-303955. PMID: 24104886.

36. Rajilić-Stojanović M, Shanahan F, Guarner F, de Vos WM. 2013; Phylogenetic analysis of dysbiosis in ulcerative colitis during remission. Inflamm Bowel Dis. 19:481–488. DOI: 10.1097/MIB.0b013e31827fec6d. PMID: 23385241.

37. Spiller R, Garsed K. 2009; Postinfectious irritable bowel syndrome. Gastroenterology. 136:1979–1988. DOI: 10.1053/j.gastro.2009.02.074. PMID: 19457422. PMCID: PMC8803069.

38. Porter CK, Tribble DR, Aliaga PA, Halvorson HA, Riddle MS. 2008; Infectious gastroenteritis and risk of developing inflammatory bowel disease. Gastroenterology. 135:781–786. DOI: 10.1053/j.gastro.2008.05.081. PMID: 18640117.

39. Jeffery IB, O'Toole PW, Öhman L, et al. 2012; An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota. Gut. 61:997–1006. DOI: 10.1136/gutjnl-2011-301501. PMID: 22180058.

40. Carroll IM, Ringel-Kulka T, Ferrier L, et al. 2013; Fecal protease activity is associated with compositional alterations in the intestinal microbiota. PLoS One. 8:e78017. DOI: 10.1371/journal.pone.0078017. PMID: 24147109. PMCID: PMC3798377.

41. Shutkever O, Gracie DJ, Young C, et al. 2018; No Significant Association Between the Fecal Microbiome and the Presence of Irritable Bowel Syndrome-type Symptoms in Patients with Quiescent Inflammatory Bowel Disease. Inflamm Bowel Dis. 24:1597–1605. DOI: 10.1093/ibd/izy052. PMID: 29668957.

42. Vivinus-Nébot M, Frin-Mathy G, Bzioueche H, et al. 2014; Functional bowel symptoms in quiescent inflammatory bowel diseases: role of epithelial barrier disruption and low-grade inflammation. Gut. 63:744–752. DOI: 10.1136/gutjnl-2012-304066. PMID: 23878165.

43. Salim SY, Söderholm JD. 2011; Importance of disrupted intestinal barrier in inflammatory bowel diseases. Inflamm Bowel Dis. 17:362–381. DOI: 10.1002/ibd.21403. PMID: 20725949.

44. Piche T. 2014; Tight junctions and IBS--the link between epithelial permeability, low-grade inflammation, and symptom generation? Neurogastroenterol Motil. 26:296–302. DOI: 10.1111/nmo.12315. PMID: 24548256.

45. Piche T, Barbara G, Aubert P, et al. 2009; Impaired intestinal barrier integrity in the colon of patients with irritable bowel syndrome: involvement of soluble mediators. Gut. 58:196–201. DOI: 10.1136/gut.2007.140806. PMID: 18824556.

46. Camilleri M. 2012; Peripheral mechanisms in irritable bowel syndrome. N Engl J Med. 367:1626–1635. DOI: 10.1056/NEJMra1207068. PMID: 23094724.

47. Martínez C, Lobo B, Pigrau M, et al. 2013; Diarrhoea-predominant irritable bowel syndrome: an organic disorder with structural abnormalities in the jejunal epithelial barrier. Gut. 62:1160–1168. DOI: 10.1136/gutjnl-2012-302093. PMID: 22637702.

48. Barbara G, Cremon C, Stanghellini V. 2014; Inflammatory bowel disease and irritable bowel syndrome: similarities and differences. Curr Opin Gastroenterol. 30:352–358. DOI: 10.1097/MOG.0000000000000070. PMID: 24811054.
49. Zhou SY, Gillilland M 3rd, Wu X, et al. 2018; FODMAP diet modulates visceral nociception by lipopolysaccharide-mediated intestinal inflammation and barrier dysfunction. J Clin Invest. 128:267–280. DOI: 10.1172/JCI92390. PMID: 29202473. PMCID: PMC5749529.

50. Mawe GM. 2015; Colitis-induced neuroplasticity disrupts motility in the inflamed and post-inflamed colon. J Clin Invest. 125:949–955. DOI: 10.1172/JCI76306. PMID: 25729851. PMCID: PMC4362261.

51. Villanacci V, Bassotti G, Nascimbeni R, et al. 2008; Enteric nervous system abnormalities in inflammatory bowel diseases. Neurogastroenterol Motil. 20:1009–1016. DOI: 10.1111/j.1365-2982.2008.01146.x. PMID: 18492026.

52. Bassotti G, Antonelli E, Villanacci V, Salemme M, Coppola M, Annese V. 2014; Gastrointestinal motility disorders in inflammatory bowel diseases. World J Gastroenterol. 20:37–44. DOI: 10.3748/wjg.v20.i1.37. PMID: 24415856. PMCID: PMC3886030.

53. Annese V, Bassotti G, Napolitano G, Usai P, Andriulli A, Vantrappen G. 1997; Gastrointestinal motility disorders in patients with inactive Crohn's disease. Scand J Gastroenterol. 32:1107–1117. DOI: 10.3109/00365529709002989. PMID: 9399391.

54. Peuhkuri K, Vapaatalo H, Korpela R. 2010; Even low-grade inflammation impacts on small intestinal function. World J Gastroenterol. 16:1057–1062. DOI: 10.3748/wjg.v16.i9.1057. PMID: 20205274. PMCID: PMC2835780.

55. Bassotti G, Villanacci V, Nascimbeni R, et al. 2009; Enteric neuroglial apoptosis in inflammatory bowel diseases. J Crohns Colitis. 3:264–270. DOI: 10.1016/j.crohns.2009.06.004. PMID: 21172285.

56. Chang J, Leong RW, Wasinger VC, Ip M, Yang M, Phan TG. 2017; Impaired Intestinal Permeability Contributes to Ongoing Bowel Symptoms in Patients With Inflammatory Bowel Disease and Mucosal Healing. Gastroenterology. 153:723–731.e1. DOI: 10.1053/j.gastro.2017.05.056. PMID: 28601482.

57. Shivaji UN, Ford AC. 2014; Prevalence of functional gastrointestinal disorders among consecutive new patient referrals to a gastroenterology clinic. Frontline Gastroenterol. 5:266–271. DOI: 10.1136/flgastro-2013-100426. PMID: 28839783. PMCID: PMC5369735.

58. MacDermott RP. 2007; Treatment of irritable bowel syndrome in outpatients with inflammatory bowel disease using a food and beverage intolerance, food and beverage avoidance diet. Inflamm Bowel Dis. 13:91–96. DOI: 10.1002/ibd.20048. PMID: 17206644.

59. Nigam GB, Limdi JK, Vasant DH. 2018; Current perspectives on the diagnosis and management of functional anorectal disorders in patients with inflammatory bowel disease. Therap Adv Gastroenterol. 11:1756284818816956. DOI: 10.1177/1756284818816956. PMID: 30574193. PMCID: PMC6295686.

60. Vasant DH, Solanki K, Radhakrishnan NV. 2017; Rectal Digital Maneuvers May Predict Outcomes and Help Customize Treatment Intensity of Biofeedback in Chronic Constipation and Dyssynergic Defecation. Dis Colon Rectum. 60:e2. DOI: 10.1097/DCR.0000000000000725. PMID: 27926570.

61. Norton C, Dibley LB, Bassett P. 2013; Faecal incontinence in inflammatory bowel disease: associations and effect on quality of life. J Crohns Colitis. 7:e302–e311. DOI: 10.1016/j.crohns.2012.11.004. PMID: 23228710.

62. Barros LL, Farias AQ, Rezaie A. 2019; Gastrointestinal motility and absorptive disorders in patients with inflammatory bowel diseases: Prevalence, diagnosis and treatment. World J Gastroenterol. 25:4414–4426. DOI: 10.3748/wjg.v25.i31.4414. PMID: 31496621. PMCID: PMC6710178.

63. Halmos EP, Christophersen CT, Bird AR, Shepherd SJ, Muir JG, Gibson PR. 2016; Consistent Prebiotic Effect on Gut Microbiota With Altered FODMAP Intake in Patients with Crohn's Disease: A Randomised, Controlled Cross-Over Trial of Well-Defined Diets. Clin Transl Gastroenterol. 7:e164. DOI: 10.1038/ctg.2016.22. PMID: 27077959. PMCID: PMC4855163.

64. Gibson PR. 2017; Use of the low-FODMAP diet in inflammatory bowel disease. J Gastroenterol Hepatol. 32(Suppl 1):40–42. DOI: 10.1111/jgh.13695. PMID: 28244679.

65. Skodje GI, Sarna VK, Minelle IH, et al. 2018; Fructan, Rather Than Gluten, Induces Symptoms in Patients With Self-Reported Non-Celiac Gluten Sensitivity. Gastroenterology. 154:529–539.e2. DOI: 10.1053/j.gastro.2017.10.040. PMID: 29102613.

66. Corinaldesi R, Stanghellini V, Cremon C, et al. 2009; Effect of mesalazine on mucosal immune biomarkers in irritable bowel syndrome: a randomized controlled proof-of-concept study. Aliment Pharmacol Ther. 30:245–252. DOI: 10.1111/j.1365-2036.2009.04041.x. PMID: 19438846.

67. Iskandar HN, Cassell B, Kanuri N, et al. 2014; Tricyclic antidepressants for management of residual symptoms in inflammatory bowel disease. J Clin Gastroenterol. 48:423–429. DOI: 10.1097/MCG.0000000000000049. PMID: 24406434. PMCID: PMC4111227.

68. Camilleri M, Lembo A, Katzka DA. 2017; Opioids in Gastroenterology: Treating Adverse Effects and Creating Therapeutic Benefits. Clin Gastroenterol Hepatol. 15:1338–1349. DOI: 10.1016/j.cgh.2017.05.014. PMID: 28529168. PMCID: PMC5565678.

69. Klooker TK, Braak B, Koopman KE, et al. 2010; The mast cell stabiliser ketotifen decreases visceral hypersensitivity and improves intestinal symptoms in patients with irritable bowel syndrome. Gut. 59:1213–1221. DOI: 10.1136/gut.2010.213108. PMID: 20650926.

70. Han S, Thoresen L, Jung JK, et al. 2017; Discovery of APD371: Identification of a Highly Potent and Selective CB2 Agonist for the Treatment of Chronic Pain. ACS Med Chem Lett. 8:1309–1313. DOI: 10.1021/acsmedchemlett.7b00396. PMID: 29259753. PMCID: PMC5733264.

71. Biancone L, Vernia P, Agostini D, Ferrieri A, Pallone F. 2000; Effect of rifaximin on intestinal bacterial overgrowth in Crohn's disease as assessed by the H2-Glucose Breath Test. Curr Med Res Opin. 16:14–20. DOI: 10.1185/0300799009117003. PMID: 16422030.

72. Khan KJ, Ullman TA, Ford AC, et al. 2011; Antibiotic therapy in inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol. 106:661–673. DOI: 10.1038/ajg.2011.72. PMID: 21407187.

73. Prantera C, Lochs H, Grimaldi M, et al. 2012; Rifaximin-extended intestinal release induces remission in patients with moderately active Crohn's disease. Gastroenterology. 142:473–481.e4. DOI: 10.1053/j.gastro.2011.11.032. PMID: 22155172.

74. Jigaranu AO, Nedelciuc O, Blaj A, et al. 2014; Is rifaximin effective in maintaining remission in Crohn's disease? Dig Dis. 32:378–383. DOI: 10.1159/000358141. PMID: 24969283.

75. Pimentel M, Lembo A, Chey WD, et al. 2011; Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med. 364:22–32. DOI: 10.1056/NEJMoa1004409. PMID: 21208106.

76. Acosta A, Camilleri M, Shin A, et al. 2016; Effects of Rifaximin on Transit, Permeability, Fecal Microbiome, and Organic Acid Excretion in Irritable Bowel Syndrome. Clin Transl Gastroenterol. 7:e173. DOI: 10.1038/ctg.2016.32. PMID: 27228404. PMCID: PMC4893683.

77. Ballou S, Keefer L. 2017; Psychological Interventions for Irritable Bowel Syndrome and Inflammatory Bowel Diseases. Clin Transl Gastroenterol. 8:e214. DOI: 10.1038/ctg.2016.69. PMID: 28102860. PMCID: PMC5288603.

78. Gracie DJ, Irvine AJ, Sood R, Mikocka-Walus A, Hamlin PJ, Ford AC. 2017; Effect of psychological therapy on disease activity, psychological comorbidity, and quality of life in inflammatory bowel disease: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2:189–199. DOI: 10.1016/S2468-1253(16)30206-0. PMID: 28404134.

79. Deter HC, Keller W, von Wietersheim J, et al. 2007; Psychological treatment may reduce the need for healthcare in patients with Crohn's disease. Inflamm Bowel Dis. 13:745–752. DOI: 10.1002/ibd.20068. PMID: 17230495.

80. Gracie DJ, Guthrie EA, Hamlin PJ, Ford AC. 2018; Bi-directionality of Brain-Gut Interactions in Patients With Inflammatory Bowel Disease. Gastroenterology. 154:1635–1646.e3. DOI: 10.1053/j.gastro.2018.01.027. PMID: 29366841.

81. Cheifetz AS, Gianotti R, Luber R, Gibson PR. 2017; Complementary and Alternative Medicines Used by Patients With Inflammatory Bowel Diseases. Gastroenterology. 152:415–429.e15. DOI: 10.1053/j.gastro.2016.10.004. PMID: 27743873.

82. Johannesson E, Simrén M, Strid H, Bajor A, Sadik R. 2011; Physical activity improves symptoms in irritable bowel syndrome: a randomized controlled trial. Am J Gastroenterol. 106:915–922. DOI: 10.1038/ajg.2010.480. PMID: 21206488.

83. Hollander D. 2001; Intestinal permeability in patients with Crohn's disease and their relatives. Dig Liver Dis. 33:649–651. DOI: 10.1016/S1590-8658(01)80038-4.

Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download