Abstract
The novel SARS-CoV-2 virus that causes COVID-19 has emerged rapidly and the virus has caused a global pandemic since it was first diagnosed in December 2019. SARS-CoV-2 is the seventh virus associated with human transmission among corona viruses. Otorhinolaryngologists could be vulnerable to this viral transmission due to the high viral load in the nasal cavity and nasopharynx. Hence, it is essential to understand the novel COVID-19 from the perspective of otorhinolaryngologists. We provide literature reviews of previous human coronaviruses and the novel COVID-19 with clinical hallmarks, diagnostic approaches, and possible treatment options. Further study is necessary to elucidate viral features and standardize treatment protocols with curable anti-viral agents and vaccines.
Go to : 
코로나바이러스감염증-19(coronavirus disease 2019, COVID-19)는 2019년 12월 중국 우한에서 원인 불명의 폐렴으로 처음 보고된 이후 약 3개월만에 세계적 대유행 양상을 보이고 있다[1]. 전파력이 빠르고 많은 사망자를 보이고 있으며 세계보건기구(World Health Organization, WHO)는 2020년 3월 11일 판데믹(pandemic) 선언을 한 이후 세계 각국은 의료재난적 상황으로 대처하고 있다. 이비인후과 의사는 감염원이 될 수 있는 비강, 구강 및 인후두를 직접 접촉하기 때문에 에어로졸의 형태로 전염되는 코로나바이러스-19에 감염될 가능성이 높은 고위험군이며, 실제로 세계 각국에서 이비인후과 의사가 COVID-19에 감염된 사례가 보고되고 있다. 외래 진료나 수술 시에 상기도 호흡기 질환을 많이 접하고 치료하는 이비인후과 의료진들 입장에서 직, 간접적으로 코로나바이러스감염증-19에 노출되는 경우가 있을 수 있기 때문에 바이러스의 특성을 숙지하는 것이 무엇보다 중요할 것으로 생각된다. 이에 문헌 고찰을 통해 이전 코로나바이러스의 특성 및 신종 코로나바이러스감염증-19의 역학적, 면역학적, 임상적 특성을 분석하고자 한다.
Go to : 
인간에게 감염되는 코로나바이러스(human corona virus, HCoV)는 1965년에 최초 보고 되었으며 전 연령에서 상기도 감염을 일으키는 바이러스 중 하나로[2] 코로나바이러스아과(coronavirinae)에 속하며 single stranded positive-sense RNA 바이러스이다. 사람에게 감염을 일으키는 코로나바이러스는 이전에 6가지가 있었는데 HCoV-229E, HCoV-NL63, HCoV-OC43, HCoV-HKU1아형, 중증 급성 호흡기 증후군 바이러스(severe acute respiratory syndrome coronavirus, SARS-CoV)와 중동 호흡기 증후군 바이러스(Middle East Respiratory Syndrome Coronavirus, MERS-CoV)가 이에 속한다. 코로나바이러스의 아과(subfamily)는 알파, 베타, 감마, 델타의 4가지 속(genus)으로 구분되며 HCoV-229E, HCoVNL63는 알파, HCoV-OC43, HCoV-HKU1, SARS-CoV 및 MERS-CoV는 베타 속에 속한다. SARS-CoV와 MERS-CoV는 인수공통감염(zoonotic infection)을 일으킨다. 코로나바이러스라는 이름은 왕관을 뜻하는 라틴어 코로나(c˘or´ona)에서 유래되었는데 이는 전자현미경에서 관찰하면 바이러스 표면에 존재하는 스파이크 단백질(SARS-CoV-2 spike glycoprotein, S protein)이 마치 왕관처럼 생긴 형태학적 특성 때문에 명명되었다.
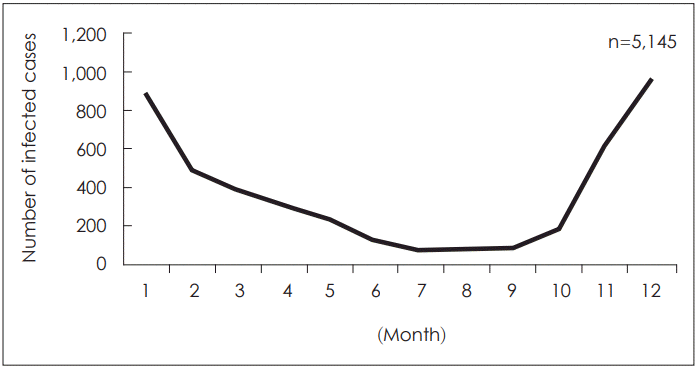
코로나바이러스 감염은 상대적으로 겨울이나 봄철에 흔하지만 특별한 계절성(seasonality)없이 연중 발생 할 수 있다고 알려져 있다. 저자는 질병관리본부 자료를 바탕으로 국내 급성 호흡기환자 중 5,145명의 HCoV의 계절성을 분석한 결과 인플루엔자나 호흡기세포융합바이러스(Respiratory Syncytial Virus, RSV)와 마찬가지로 겨울철에 높고 여름철에 낮은 빈도를 보였다(Fig. 1). HCoV 감염은 요양원 등 장기 요양시설에서 흔하게 발병할 수 있는데 2002년 겨울 호주에서(92명 중 16명에서), 그리고 2003년 여름 캐나다에서(요양원 142명 중 95명, 직원 160명 중 53명에서) HCoV-OC43에 의한 집단 발병(outbreak) 보고가 있었다[3,4]. 두 경우 모두 장기 요양시설에서 발생하였으며 실시간 유전자 증폭 검사(realtime polymerase chain reaction test, RT-PCR)로 진단되었으며, 장기 요양시설에서 노인이 HCoV 감염에 취약하다는 점과 근무자에 의한 전파 가능성을 시사하였다.
기존의 코로나 바이러스 감염은 인간 메타뉴모바이러스(human metapneumoniae virus), 인간 파라인플루엔자바이러스(human parainfluenza virus) 그리고 인간 리노바이러스(human rhinovirus) 등의 다른 호흡기 바이러스와 마찬가지로 특이 증상 없이 흔한 상기도 감염을 일으키는 경우가 대부분이다. 직접적인 바이러스성 기관지염이나 이차적 세균성 기관지염을 일으킬 수 있고, 직접적인 바이러스성 폐렴이나 이차적 세균성 폐렴을 유발하기도 한다. Walsh 등[5]은 미국 뉴욕에서 발생한 급성 호흡기 환자를 대상으로 RTPCR 검사를 바탕으로 전향적 코호트 분석을 시행하였는데, 무증상 감염이 많았고(약 33~44%) 코막힘, 가래, 기침 등 상기도 증상이 흔했지만(40~79%) 발열 등의 전신 증상은 드물었다. 만성 폐쇄성 폐질환의 악화(acute exacerbation of chronic obstructive pulmonary disease)나 지역사회 폐렴(community-acquired pneumonia)를 일으키는 경우도 호흡기세포융합바이러스(RSV), 인간 메타뉴모바이러스나 인간 파라인플루엔자바이러스에 의한 경우보다 비교적 드물다고 알려져 있다[6,7]. 대개 가벼운 상기도 감염을 일으키지만 드물게 소아에서 크룹이나 열성 경련과 연관되는 경우도 있다[8].
SARS-CoV는 2002~2003년에 유행했으며 특히 홍콩 및 아시아 지역에 많이 발병하였다[9]. 발열, 두통, 전신 쇠약감으로 시작해서 5~7일 후 심한 호흡기 증상과 호흡곤란을 유발한다[10]. 특징적으로 초기에는 호흡기 증상보다는 38도 이상의 고열, 두통, 근육통을 호소하지만[10,11], 이후 마른 기침, 호흡 곤란을 호소하며 인공호흡기가 필요한 호흡 부전 및 흉부 영상에서 진행성 폐침윤 소견이 관찰된다[12]. WHO 보고 기준으로 총 8,098명 감염 중 774명 사망하여 대략 10%의 사망률을 보였으며 26개국에서 감염사례가 보고되었다.
MERS-CoV는 2015년 중동에서 시작되어 세계적인 유행 양상을 보였으며 국내에서도 유행하였다. 대개 성인에서 발병하며 발열, 근육통, 기침 및 호흡곤란 등을 호소한다[13]. 심한 경우 심한 폐렴과 급성 호흡부전 양상을 보이고 체외막산소공급장치(extracorporeal membrane oxygenation, ECMO) 치료가 필요하며 종종 신부전증이 보고되었다[14]. 설사, 구토 및 복통 등의 위장관 증상을 보이는 경우도 있었으며 노인과 기저질환이 있는 경우가 높은 사망률을 보였다[15]. WHO 보고 기준으로 성인에서 심한 폐렴이나 신부전증, 파종성혈관내응고(DIC), 심막염 등을 일으킬 수 있고[13,16]. 총 2,494명 감염에 858명 사망을 기록하여 약 34% 정도의 치사율을 보였고 27개국에서 감염사례가 보고되었다[17].
Go to : 
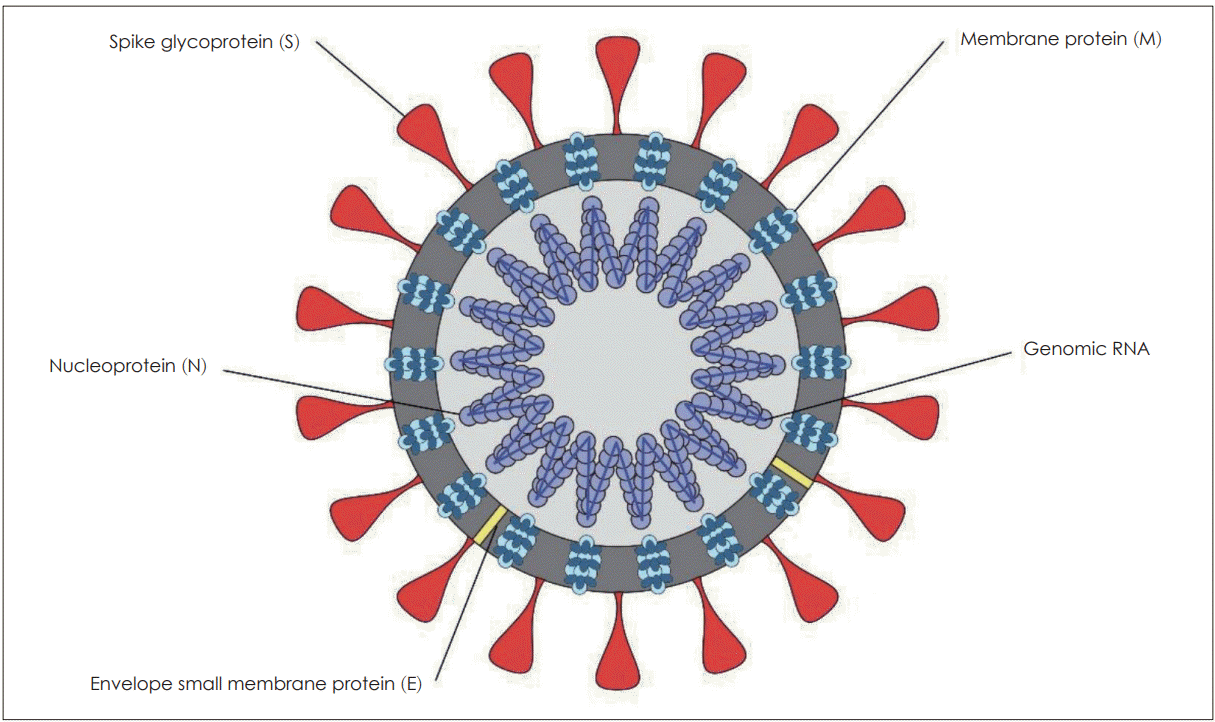
중국 우한에서 원인 불명의 폐렴 환자의 하기도에서 최초로 검출된 SARS-CoV-2는 베타 속에 속하는 신종 코로나바이러스이다[18]. 인수공통감염을 일으키는 기존의 MERS-CoV나 SARS-CoV와는 다른 바이러스임이 밝혀져서 인체 감염을 일으키는 일곱 번째 코로나바이러스로 확인되었다. WHO는 SARS-COV-2바이러스(severe acute respiratory syndrome coronavirus 2)에 의해 발생하는 호흡기 질환을 COVID-19(coronavirus disease, 국내 공식 명칭은 코로나바이러스감염증-19)라고 명명하였다. SARS-CoV-2는 유전자 분석을 통한 계통발생적 연구(phylogenetic analysis)에서 박쥐에서 발견되는 코로나바이러스와 매우 유사하며 SARSCoV와 45~90%, MERS-CoV와 20~60%의 유사성을 보였다[19]. 코로나바이러스는 생물학적으로 피막(envelope)이 있고 입자는 둥글거나 타원형 혹은 다형성의 형태를 띄며 직경은 50~200 nm이다(Fig. 2) [19].
Lam 등[20]은 동남아시아 숲에 서식하고 주로 나무나 둥지 속에 있거나 먹이를 찾으며 시간을 보내는 포유류의 일종인 말레이 천산갑의 유전자 분석을 통해 천산갑의 두개의 염기 서열이 SARS-CoV-2와 관계되며 이 중 하나는 수용체 결합 부위가 SARS-CoV-2와 거의 일치한다고 하였다. 박쥐가 숙주였던 신종 코로나바이러스(SARS-CoV-2)가 말레이 천산갑을 통해 사람에게 전파되었으며 수산 시장이 그 매개체가 되었다는 학설이 현재까지 가장 설득력이 있다.
Xu 등[19]은 SARS-CoV-2에 있는 S protein이 인체 안지오텐신전환효소2(angiotensin-converting enzyme 2, ACE2) 분자와 강력한 상호작용을 하는 것을 입증하여 S proteinACE2 결합 경로를 통한 바이러스의 인체 전파 가능성을 제시하였다. 한편, 실험실에서의 우발적 유출이나 다른 나라에서의 의도적 노출 등의 속설이 있으나 객관적으로 밝혀진 바는 없다.
일반적으로 바이러스의 전파력은 세포막 수용체에 결합하는 능력에 따라 좌우된다. SARS-CoV-2에는 스파이크 단백질(S protein)과 세포표면 수용체 종류의 하나인 인테그린(integrin) 부위가 바이러스 전파에 중요한 부분이라고 여겨지고 있다. 바이러스 표면에 존재하는 S protein은 삼량체 I급(trimeric class I) 단백질로서 S1, S2 아단위(subunit) 경계 부위에서 ACE2와 결합하여 바이러스의 세포내로의 진입을 촉진시킨다고 추정되고 있다[21,22]. SARS-CoV-2 단백질은 SARS-CoV 단백질 보다 불안정한데 이는 전결합(prefusion)과 후결합(postfusion)에 의한 결합 방식을 보이기 때문이라는 보고가 있다[22,23]. Tresoldi 등[24]은 최근 SARSCoV-2의 인테그린 수용체 부위는 기존 SARS-CoV, 박쥐 코로나바이러스와 부분적으로 일치하고, 이 부위가 과발현되어 바이러스 감염력이 증가되며 이 부위를 치료 타겟으로 삼아야 한다고 주장했다. 이는 HIV에서 인테그린 수용체 변이가 바이러스 전파력에 상당한 역할을 한다고 확인된 기존 문헌 개념과 일치한다.
코로나바이러스의 일반적인 생물학적 특성은 열에 약하고 섭씨 56도에 30분 정도면 사멸한다. 효과적인 소독제로 에테르(ether), 75% 에탄올, 염소소독제(chlorine disinfectant), 과초산(peracetic acid) 및 클로로포름(chloroform)이 있고, 클로르헥시딘(chlorhexidine)은 소독 효과가 없다[25].
국내에서는 누적 확진자 11,065명, 완치(격리해제) 9,904명, 치료 중(격리 중) 898명, 사망 263명이며 전세계적으로는 WHO기준으로 215 국가에 걸쳐 4,589,526명 감염, 310,391명 사망을 기록하고 있다(2020년 5월 18일 기준).26)27) 이는 앞서 1968년 홍콩독감과 2009년 신종 인플루엔자유행 당시 선포한 이후 WHO가 발표한 세번째 세계적 대유행(pandemic)이다.
코로나바이러스감염증-19의 전염 경로는 인플루엔자 등의 호흡기 감염과 같이 비말 감염에 의한 경우가 대부분이다. 기침이나 재채기로 인한 침방울에 의한 비말 감염 외에 감염자 간호를 포함한 밀접한 접촉이나 바이러스가 묻어 있는 물체나 표면을 만지고, 손위생 없이 눈, 코, 입 등을 만지는 접촉 감염에 의한 경우도 있을 수 있다. 코로나바이러스감염증-19 환자에서 상당수가 설사, 복통 등의 소화기 증상을 호소하고 대변 샘플에서 SARS-CoV-2가 검출된다는 보고가 있어 분변-경구 경로(fecal to oral transmission) 감염 가능성도 제기되고 있다[28,29]. 아직까지 공기 전파(airborne transmission) 가능성에 대해서는 과학적 근거가 부족하다. 중앙방역대책본부에서 발표한 국내에서 발병한 초기 30례의 전파경로 분석에 따르면 집안내감염에 의한 이차 전파 비율은 7.56%이었다[1,30]. 전염병이 전파되는 속도를 수치화한 기초감염재생산수(basic reproductive number, R0)는 한 명의 감염자가 정상 인구집단에서 다른 몇 명의 건강한 사람에게 이차 감염을 시킬 수 있는지를 나타낸다. 보통 R0가 1 이상이면 감염력이 증가 추세인 것으로 판단하고 1 이하이면 해당 감염병의 감염력이 줄어들고 있다고 판단한다. Liu 등[31]은 감염력을 비교한 메타분석 문헌을 통해 초기 COVID-19단계에서 R0는 평균 3.28(최저1.4, 최대 6.49, 중위수 2.79)라고 하였으며 이는 WHO예측 수치인 1.95보다 높았으며 SARS나 MERS 감염 보다 높은 수치라고 하였다(참고로 각종 전염성 질환에서 R0값은 다음과 같다. 홍역 12~18, 디프테리아 6~7, 천연두 5~7, 소아마비 5~7, 풍진 5~7, 볼거리 4~7, 백일해 5.5, 인플루엔자 2~3, AIDS 2~5, SARS 2~5, 에볼라 1.5~2.5) [32-34].
COVID-19감염증의 잠복기에 관해서는 아직까지 명확하게 정립되지 않았다. 무증상 감염과 간혹 비전형적으로 장기간의 잠복기를 보이는 경우도 보고되고 있으나 MERS-CoV 잠복기를 참조하면 보통 접촉 및 노출 이후 2~14일 이후에 증상이 나타난다고 여겨지고 있다. Lauer 등[35]은 후베이성 지역의 181명 환자를 대상으로 조사하여 COVID-19의 경우에 약 5일 정도의 잠복기를 보이며 이는 SARS-CoV와 비슷하다고 보고하였다. 미국 질병통제예방센터(Centers for Diseases Control and Prevention, CDC) 가이드라인에 따르면 COVID-19감염 증상으로는 보통 발열, 기침, 숨가쁨 증상이 나타나는데 현저한 호흡곤란, 지속적인 흉통, 의식저하 및 정신착란 및 창백한 입술과 얼굴 증상을 보이면 즉각적인 처치가 필요한 응급 경고의 징후(warning sign)로 볼 수 있다. 코막힘, 콧물 및 기타 상기도 감염 증상은 상대적으로 드문 편이고 감염 환자의 약 절반 정도에서 1주 이내에 호흡곤란 증상을 경험하였으며 중증 환자의 경우 급속도로 급성 호흡부전 상태로 빠져 폐혈성 쇼크, 대사성 산증 및 응고장애로 진행한다. 중증이나 위중 환자의 경우에도 발열 증상이 명확하지 않은 경우가 종종 있으므로 발열 상태 만으로 감염 상태의 심각도를 평가해서는 안된다. 발열이 없는 경증 환자에서는 1주 이내에 대부분 호전되었으며 양호한 예후를 보이는 반면, 노인이나 기저 질환이 있는 경우에는 예후가 좋지 않으며 소아 환자에서는 상대적으로 양호한 경향을 보인다. 중국 연구진에 따르면 41명의 사망 환자에게 보였던 주요 증상들은 발열(80%), 기침(56%), 숨가쁨(32%), 흉통(24%), 피로감(22%), 호흡곤란(12%), 전신통(7%), 어지러움(5%), 오한(5%)의 순이었다[18]. Yang 등[36]은 46,248명의 환자를 대상으로 8개의 문헌을 메타 분석하여 주요 증상 발현은 발열[91±3, 95% confidential interval(CI) 86~97%], 기침(67±7, 95% CI 59~76%), 피로감(51±0, 95% CI 34~68%), 호흡곤란(30±4, 95% CI 21~40%)이라고 보고하였다. 바이러스 검출 시기 별로 보면 SARS-CoV-2는 주로 초기 3~5일이나 무증상 시기나 잠복기에도 전파가 되며 이는 다른 호흡기 바이러스가 발열 이후에 기침, 콧물 등의 호흡기 증상과 함께 후기에 많이 배출된다는 점과 다르다[37].
무후각(anosmia) 증상이 무증상 COVID-19 양성 환자에서 특징적으로 보고되었다. 국내 무증상 양성 환자의 30%에서 무후각증이 보고되었으며 경증 환자에서 주호소 증상(major presenting symptom)인 경우가 많았으며 독일에서는 양성 환자의 2/3에서 무후각증이 보고되었다. 이에 미국 이비인후과 학회에서는(AAO statement) 비염이나 부비동염 없이 후각 또는 미각 저하 증상을 보이는 경우에는 COVID-19 가능성을 염두에 두고 후각, 미각 저하 증상을 COVID-19 진단에서 스크리닝 방법으로 사용할 것을 제안하였다. 영국 이비인후과 학회에서는(British association of Otorhinolaryngology-Head and Neck Surgery, ENT UK statement) COVID-19 세계적 대유행 시기에는 비용종이나 두부 외상과 관계없이 원인미상의 새로 발생한 성인 무후각 증 환자에서 7일 간의 자가 격리와 감염 위험도를 고려하여 경구 스테로이드 사용을 제한할 것을 권고하였다[38]. 하지만, 현재까지 COVID-19가 다른 바이러스 보다 후각이나 미각 이상을 더 많이 유발하는가에 대해서는 문헌상 근거가 부족하다. 앞으로 COVID-19감염증에 있어 이러한 비과적 증상에 관해 많은 연구가 필요할 것으로 판단된다.
Deng과 Peng [18]은 질병 발생 초기에 사망한 26명의 증례를 분석하여 환자들의 기저 질환에 대해 보고하였다. 고혈압(54%)과 당뇨(42%)가 가장 많았고 관상동맥질환(19%), 대뇌경색(15%) 등 혈관성 질환의 유병률이 높았으며 만성 기관 지염(19%), 파킨슨병(8%) 순의 빈도를 보였다. Guan 등[39]은 중국 575병원에 입원한 1,590명을 대상으로 분석하였는데 25%의 환자에서 최소 1가지 이상의 동반질환을 가지고 있었고 고혈압(17%), 당뇨(8%)가 가장 높았으며, 2개 이상의 동반질환을 가진 경우는 8% 가량으로 확인되었다. 각각의 기저 질환 별로 나이와 흡연 여부를 보정하여 COVID-19 감염증 이환의 위험도(hazard ratio)를 살펴보면 만성폐쇄성폐질환 2.681(95% CI 1.03~2.45), 당뇨 1.59(95% CI 1.03~2.45) 고혈압1.58(95% CI 1.07~2.32), 악성종양 3.50(95% CI 1.60~7.64)이었다. 메타 분석 문헌에서 중증 환자에서의 동반 질환의 교차비(odds ratio, OR)는 고혈압(OR 2.36, 95% CI: 1.46~3.83), 호흡기계 질환(OR 2.46, 95% CI: 1.76~3.44), 심혈관계 질환(OR 3.42, 95% CI: 1.88~6.22)의 결과를 보였다[36].
중앙방역대책본부에서 국내 초기 7,775명 환자를 대상으로 분석해 본 결과 66명의 사망례가 있었는데 이 중 집에서 입원 대기 중에 사망한 경우가 5례, 사망 후 진단된 경우가 11례였다. 또한, 증상 발현 이후 사망까지 걸린 기간은 10일, 진단까지는 4일, 입원까지 걸린 기간은 4.5일, 그리고 입원 이후 사망까지는 5일기간이 걸렸다고 보고되었다[40].
호흡기바이러스 감염은 2종류 이상의 바이러스가 동시 감염되는 경우가 흔하고 세균 감염과 동반되는 경우도 있다. 문헌 보고에 따르면 인플루엔자 바이러스를 포함한 인플루엔자양 질환(influenza like illness)에서 바이러스 동시 감염은 2종의 경우 82%, 3종의 경우 14%, 4종 이상의 바이러스 동시 감염은 4% 정도로 알려져 있다[41]. SARS-CoV-2의 경우에도 미국에서 인간 메타뉴모바이러스(human metapneumovirus)와 동시 감염 사례가 있어 호흡기 환자에서 일반적인 호흡기 바이러스 검사(routine virus panel)에서 다른 바이러스에 양성이라고 해서 SARS-CoV-2를 배제해서는 안된다는 보고가 있다[42].
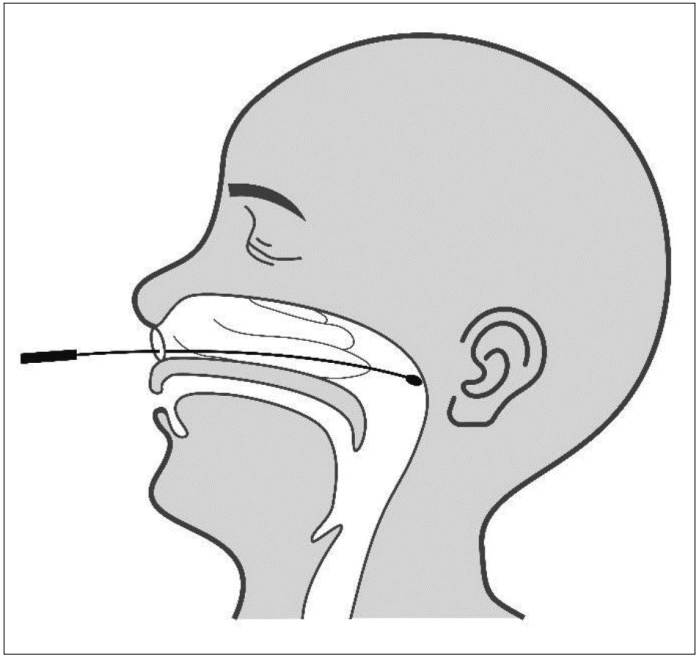
실시간 유전자 증폭 검사(RT-PCR)을 통한 SARS-CoV-2 핵산 반응의 양성 결과가 확진 방법(golden standard)이다. 미국 기관지 및 중재 호흡기 학회 지침에 따르면(American Association for Bronchology and Interventional Pulmonology, AABIP statement) [43] COVID-19 검사를 위한 일차 방법으로는 비인두(Fig. 3)나 구인두 스왑을 통한 상기도 검사법을 권고하며 가래 유발이나 기관지 내시경을 통한 하기도 검사법은 에어로졸을 발생시켜 환자나 의료진에게 위험을 노출시킬 수 있어 우선적으로 권고하지 않는다. Yu 등[44]은 76명의 COVID-19 양성 환자에서 323 샘플을 대상으로 RT-PCR 결과를 분석하였는데 검체별로는 가래(sputum)에서의 바이러스양(17429±6920 copies/test)이 인두 스왑(throat swab, 2552±1965 copies/test, p<0.001)이나 비강 스왑(651±501 copies/test, p<0.001) 보다 유의하게 높았고, 시기별로는 초기나 진행기에 회복기보다 바이러스양이 더 높다고 보고하였다. 한편, RT-PCR이 가장 정확한 확진 방법이지만 우한에서 진단된 610명의 입원 환자를 대상으로 시행한 연구에서는 RT-PCR결과에서 위음성률이 비교적 높았고 같은 환자에서도 시기별로 양성 여부가 달라지는 경우가 많았다. 이에 임상적으로 의심환자에서는 computed tomography(CT)와 같은 영상 진단을 적극적으로 고려하여 종합적으로 판단해야 할 것을 제안하였다[45].
SARS-CoV-2 감염 이후 혈청 특이 항체가 증가하는데 혈청 특이 IgM이나 IgG 양성 수치가 급성기에 비해 회복기에 4배 이상 증가하며 이는 의심 환자에서 PCR음성 검사인 경우 진단에 유용하게 이용될 수 있다[46]. SARS-CoV-2 serumspecific IgM은 증상 이후 약 10일경에, IgG는 약 12일경에 검출된다. 또한, 대부분의 COVID-19감염 환자에서 procalcitonin은 정상 수준이지만 C-reactive protein(CRP) 수치는 유의한 증가 소견을 보인다. 때문에, 다른 원인 없는 급작스러운 CRP 수치의 증가는 감염 가능성을 시사하며 중증 환자에서는 D-dimer 증가 소견도 특징적이다[47]. D-dimer 증가와 초기 림프구(lymphocyte) 저하(CD4+, CD8+T cell)를 보이는 경우에는 예후가 불량하며 중증 COVID-19 환자에서 IL6, IL-10, TNF-α 증가와 IFN-γ 감소가 관찰되어 싸이토카인 폭풍(cytokine storm)이 예후 및 경과에 중요한 역할을 하며 면역 치료나 백신 개발의 타겟으로 삼아야한다고 제시된 바 있다[48].
Yoon 등[49]은 국내에서 발병한 환자를 대상으로 영상의학적으로 분석하여 양성 환자 33%에서 단순 흉부 방사선에서 폐실질에 이상소견이 관찰되었으며, 대부분 말초성 경화 소견을 보인다고 하였다. CT 이상소견은 유증상 환자에서 대개 초기에 나타나서 RT-PCR 양성 소견 보다 일찍 나타나며 무증상 감염인 경우에도 발견될 수 있다. 다만, 소수에서는 RT-PCR 양성이지만 CT에서는 정상소견을 보이는 경우도 있다[50]. COVID-19 감염증에서 일반적으로 관찰되는 CT 소견은 양측성 폐렴, 늑막하 간유리음영(subpleural groundglass appearance), 하엽 경화(lower lobe consolidation)이다[51,52]. 감염 단계에서 중간 시기에는(대략 증상 발현 4~14일 경) 특징적으로 CT에서 소엽간중격 비후(interlobular septal thickening)와 소엽내 간질 비후(intralobular interstitial thickening) 소견을 보여 늑막하 그물망 모양(subpleural reticulation)을 보이는 소위 paving-stone like pattern이 관찰되며, 진행된 중증 환자에서는 폐 전체의 음영이 증가하여 백색 폐(white lung) 소견을 보인다[53]. Pan 등[54]은 21명의 환자에서 시간 경과 별로 CT소견을 분석하여 10일경에 영상의학적으로 가장 안 좋은 소견을 보이며 2주 동안 점차 호전된다고 하였다. 호전 여부를 판단하는 면에서도 CT가 RT-PCR 보다 우월하고[55], 예후와 사망률을 예측하는데 CT가 유용하게 사용될 수 있다는 연구가 있다[56].
기관지 내시경 소견으로는 광범위한 기관지 점막의 충혈(hyperemia), 부종, 점액성 분비물이 관찰되며 중증 환자에서는 젤리 같은 가래가 기도를 막는 소견이 보일 수 있다[57]. 미국 기관지 및 중재 호흡기 학회는 기관지내시경 검사에 대해 COVID-19 의심이나 확진 환자에서 상대적 금기이며 기관 삽관이 되어있으면서 상기도 검사법에서 음성인 경우에만 제한적으로 사용하며 다른 비침습적 방법으로 확진 되지않거나, 다른 진단이 의심되는 경우, 혹은 생명이 위급하여 중재 치료 목적으로 사용될 경우에만 시행하도록 권고하고 있다[43]. 기관지내시경을 이용하면 가래, 기관지흡입액(endotracheal aspirate)이나 기관지폐포세척(bronchoalveolar lavage) 등 하기도를 통해 COVID-19를 정확히 진단 할 수 있고 객혈 환자에서 정확한 출혈부위 확인 및 치료에 장점이 있다. 한편, α-interferon이나 N-acetylcystein과 같은 부가적인 약물을 주입하는 치료도 이용할 수 있다.
현재까지 COVID-19 감염증에 대해서 확실한 항바이러스제나 백신은 개발되어 있지 않다. 따라서, 기존의 항바이러스제를 경험적으로 투여하는 시도가 이루어지고 있다(Table 1). 초기에 항바이러스 치료가 시작되면 질병 경과 및 예후에 유리하다는 연구가 있다[58]. 발병 초기 중국에서 49명의 COVID-19 양성 환자를 대상으로 후천성면역결핍증(AIDS) 치료제인 칼레트라(Kaletra, Lopinavir/ritonarvir 2 capsules, po q 12 hr)와 인플루엔자 치료제인 아르비돌(Arbidol 200 mg q 12 hr)을 기본 치료법으로 사용하였는데 음성전환까지 걸린 기간은 약 12일(95% CI: 8~15일)이었고 2회 연속 음성전환까지는 약 13.5일(95% CI: 9.5~17.5일) 정도로 확인되었다[57]. Deng 등[59]은 칼레트라와 아르비돌 복합 투여군(combination group)과 칼레트라 단독 투여군(Lopinavir/ritonarvir only group)을 임상적, 진단검사의학적, 영상의학적으로 분석하였는데 복합 투여군이 COVID-19 경과 측면에서 우월하다고 확인하였다. 인터페론 분무 치료(Interferon nebulizer)도 음압격리실에서 사용해 볼 수 있다[57]. 또다른 AIDS 치료제인 심투자(Symtuza, Darunavir/cobicistat)도 in vitro 실험에서 바이러스 억제 능력이 입증되었고 부작용은 상대적으로 적기 때문에 옵션으로 고려될 수 있다[57]. 하지만, 세 가지 이상의 항바이러스 복합요법은 권장되지 않는다. 말라리아 치료제인 하이드록시클로로퀸(Hydroxychloroquine)도 COVID-19 감염증에서 치료 효과가 기대되고 있어 임상 시험이 진행되고 있다.
Current treatments on COVID-19
COVID-19 감염증은 바이러스에 의한 감염이므로 세균을 대상으로 하는 항생제는 원칙적으로 투여하지 않는다. 오히려 백혈구 감소증을 유발하여 면역력을 약화시킬 수 있기 때문이다. 하지만, 중증 환자에서 광범위한 폐 침윤, 화농성 객담 소견이 과도한 경우, 동반 질환의 악화 없이 발열이 지속되는 경우, 명확한 백혈구 증대증(특히, 중성구), procalcitonin이 0.5 ng/mL 이상인 경우, 혈중 산소포화도 저하, 그리고 기타 세균 감염이 의심되는 상황에서는 항생제를 사용해 볼 수 있다. 이때 환자 증상이나 CBC, CRP나 procalcitonin 같은 검사 수치를 면밀히 모니터링 해야 한다. 항생제 종류는 퀴놀론계, 2세대 혹은 3세대 세팔로스포린, 베타락탐계를 고려 할 수 있고 인공호흡기 치료를 받는 위중 환자에서는 상태에 따라 카바페넴계, 리네졸리드, 반코마이신 등을 추가로 투여할 수 있다[57].
급성 호흡부전 상태에서 전신 스테로이드 사용은 논란의 여지가 있지만 이전 SARS 연구에서[60,61] 양압기 치료나 스테로이드 사용이 도움이 된다고 알려져 있어서 COVID-19 감염증에서도 급속하게 진행하는 경우나 중증 환자에서 제한적으로 고려해 볼 수 있다(Methylprednisolone 40~80 mg/day, 하루 최대 용량 2 mg/kg) [62].
멜라토닌(Melatonin)은 항염증, 항산화 기능을 하는 물질로 알려져 있는데 바이러스 등의 병원균에 의한 급성 호흡부전 상태에서 보호 역할을 할 수 있다고 알려져 있다. 최근에는 COVID-19 위중 환자에서 멜라토닌이 혈관 투과성과 불안증을 감소시켜서 진정제 사용을 줄이고 수면 질을 향상시켜 임상 경과에서 장점이 있고 안정성도 입증되었다는 문헌이 있다[63].
한편, COVID-19감염 환자는 바이러스로 인한 면역기능 저하로 인해 이차적 진균 감염에 취약하다. 진균 감염을 확인하기 위해 의심 환자에서 혈액 D-Glucose 검사(G-test)나 갈락토만난 항원 검사(GM: galatomannan, GM-test) 혹은 기관폐포세척 검사(bronchoalveolar lavage)를 시행할 수 있다. 중증에서는 침습성 칸디다증을 유발할 수 있어 광범위 항생제를 7일 이상 사용하는 경우, 총정맥영양 공급(total parenteral nutrition)을 하는 경우, 침습성 시술을 받은 환자, 신체 두 곳 이상에서 칸디다 배양 양성 소견, G-test에서 증가된 경우 등에서는 플루코나졸(Fluconazole)이나 에키노칸딘(Echinocandin) 등의 투여를 고려한다. 또한, 침습성 폐아스페르길루스증을 유발 할 수 있어 7일 이상 스테로이드를 복용하는 경우, 무과립구증(agranulocytosis) 환자, 만성폐쇄성폐질환(COPD) 환자의 기도 검체에서 아스페르길루스배양 양성 소견인 경우, GM-test에서 유의한 증가 소견을 보일 때는 보리코나졸(Voriconazole), 포사코나졸(Posaconazole) 혹은 에키노칸딘 등의 항진균제를 투여할 수 있다[57].
섭씨 38.5도 이상인 경우에 해열제를 투여하고 38도 이하에서는 다른 증상과 소견을 고려하여 투여를 결정하며 하루에 4회 이상은 투여하지 않도록 한다[62]. 한편, 최근 보고에 따르면 이부프로펜 같은 비스테로이드성 소염제(NSAID)는 면역기능을 저하시킬 수 있으므로 단순한 해열 목적이라면 타이레놀 등의 파라세타몰 종류의 해열제를 사용하도록 권고하고 있다[64]. 영양공급은 Nutritional Risk Screening(NRS) 2002 기준에 따라[65] 3점 이하이면 고단백, 탄수화물 식이를 제공하는데 하루 권장 열량은 25~30 kcal/kg/day, 하루 권장 단백질은 1.5 g/kg/day이다. 3점 이상이면 하루에 2~3회 가량 단백질 파우더 등 추가적인 단백질 공급을 시행하며(18 g 이상/회) 경구 섭취가 불가능하면 경장 영양 공급을 고려한다[62]. 스트레스성 위장관 궤양이나 출혈을 예방하기 위해서 H2 길항제나 양성자 펌프 억제제를 투여하고 분비물 억제를 위해 선택적 M(muscarinic)1, M3 수용체 항콜린성 약물을 투여한다. 폐색전증을 방지 및 치료하기 위해 필요시 저분자량헤파린(low molecular weight heparin)을 고려한다[57].
중증 환자에서 호흡 부전 시에는 우선 2시간 가량 비침습성 인공호흡(non-invasive mechanical ventilation)을 시도해보고 효과가 없거나 분비물이나 기침이 더 심해지면 침습성 인공호흡을 시행 한다[18]. 이때 호흡량(tidal volume)을 낮춰야 폐손상을 줄일 수 있고 필요시 복와위(prone position) 인공호흡이나 extracorporeal membrane oxygenation(ECMO) 치료를 시행 한다. ECMO치료는 대퇴정맥(femoral vein)에서 나와서 내경정맥(internal jugular vein)으로 들어가는 VV-ECMO와 대퇴정맥(femoral vein)에서 나와서 대퇴동맥(femoral artery)를 통해서 직접 동맥순환계로 들어가는 VA-ECMO 두 종류로 나눌 수 있다. ECMO 치료는 인체의 순환 및 호흡 기능을 기계가 대신함으로써 감염에 의해 손상된 심폐 손상을 치료할 수 있는 시간을 벌어주는 의미가 있는데, 인공호흡기처럼 오래 시행한다고 하여 폐손상을 유발하지는 않는다. 다만, ECMO가 감염병 자체를 치료하는 것은 아니고 다학제 치료가 필요한 고난이도의 치료법이며 시행할 수 있는 기간은 대략 1~2주 가량이므로 시행 여부는 엄격한 기준 하에 결정되어야 한다. COVID-19 감염병에서 위중 환자 치료에 ECMO 치료가 많은 역할을 하는 것은 분명 하지만 아직까지 임상적으로 구체적인 가이드라인은 없는 상태이다. 일반 치료에 효과가 없는 심각한 저산소혈증 환자에서 ECMO 치료와 저호흡량 인공호흡 치료를 병합하여 치료하는 것을 고려해 볼 수 있다. 고주파 진동 인공호흡(high frequency oscillatory ventilation) 치료는 중등도 정도의 급성 호흡부전 환자에서 장점보다 오히려 단점이 더 많을 수 있어 일반적으로 사용이 권고되지는 않지만, 불응성의 심각한 저산소혈증 환자에서 구제 치료(rescue therapy)로써 고려해 볼 수 있다[62]. 한편, COVID-19 회복기 환자의 혈장을 이용한 치료법(convalescent therapy)도 옵션으로 고려해 볼 수 있는데 이미 감염을 앓고 난 이후 인체에는 바이러스 중화 항체가 많이 생성되기 때문에 이를 이용하여 고위험군에 예방 목적의 백신 개념으로 주입하거나 다른 양성 환자에게 주입하여 치료한다는 개념이다[66]. 이는 COVID-19 환자에서 아직 입증되지는 않았지만 특별한 치료제나 백신이 없는 상태에서 다른 감염병에서 성공적으로 시도되었던 경험을 바탕으로 고려해 볼 수 있는 치료법이며 국내에서 선별적으로 사용하여 성공한 사례가 보고되고 있다.
COVID-19 감염증에서 현재 치료제 및 백신 개발을 위한 다양한 연구들이 진행되고 있다(Table 2). 전세계적으로 빠르고 광범위한 전파력을 가지고 많은 사망자를 기록하는 현실을 고려하면, 새로운 치료제를 개발하는 것 보다는 기존 바이러스나 감염 질환에서 효과가 확인된 후보 약물을 신종 COVID-19 감염증에서 입증하는 것이 우선적인 목표이다. 최근 중국에서 하이드록시클로로퀸 예비시험을 시행하여 긍정적인 결과를 보였지만 샘플수가 적어서 임상 적용을 위해서는 확증 시험이 필요한 상태이다[67]. SARS-CoV-2의 이차 감염에 예방적 하이드록시클로로퀸 투여가 유의한지 확인하는 다기관 무작위 배정 임상시험(randomized controlled trials, RCT) 연구가 스페인 유행 지역인 카탈루냐 지역에서 진행되고 있는데 에볼라 백신 연구에 사용되었던 연구 디자인으로 시행될 예정이며 2020년 5월 경에 종료될 예정이다[68]. SARS-CoV-2 감염의 예방 치료에 대한 연구로써 세계적 대유행의 전반적인 경과를 변화시킬 수 있을지 기대된다. 또한, 에볼라 치료에 개발되었던 렘데시비르(Remdesivir)는 RNA 활동을 억제하여 바이러스를 비활성화 시킨다고 알려져 있어 MERS-CoV 감염에서 원숭이 실험을 통해 코로나바이러스에서도 효과가 있다고 추정되고 있다[69]. 하지만, Sarma 등[70]은 최근 COVID-19 감염증에서 하이드록시클로로퀸 치료의 임상적 유용성에 관한 리뷰 문헌을 통해 하이드록시클로로퀸 치료가 대조군에 비해 체온이나 기침 호전의 기간면에서 일부 장점이 있지만 영상의학적이나 임상적인 면에서 월등히 우월하다고 볼 수는 없다고 하였다. 최근 미국, 유럽, 캐나다 및 일본에서 53명의 중증 COVID-19 감염증 환자를 대상으로 한 렘데시비르 코호트 연구에서 인공호흡기 사용 등 임상적 호전면에서 렘데시비르 사용군에서 우월한 결과를 보였다[71]. 이처럼, 하이드록시클로로퀸이나 렘데시비르에 관한 연구 및 보고들이 진행되고 있으며 조만간 잘 디자인된 대규모 확증 임상 연구를 통해 COVID-19 감염증에서의 치료 역할이 정립될 것으로 기대한다. 한편, WHO에서는 연대(Solidarity)라는 이름으로 45개국 이상이 참여하는 대규모 국제 프로젝트를 진행중이다[72]. 이는 렘데시비르, 클로로퀸과 하이드록시클로로퀸, 칼레트라, 칼레트라와 인터페론 베타 복합제 등 유력한 4개 약물을 대상으로 COVID-19 치료제로써 역할을 확인하는 연구이다. 또한, 최근에 구충제의 일종인 이버멕틴(Ivermectin)이 SARS-CoV-2바이러스를 48시간 이내에 사멸한다는 체외(in vitro) 실험 결과가 발표되었다[73]. 이버멕틴 구충제는 미국 식품의약품안전처(FDA) 승인을 받은 약으로써 호주 연구진에 의해 실험이 시행되었는데 실험실 환경에서 배양된 바이러스가 이버멕틴에 노출된 후 모든 유전물질이 소멸되었다는 연구이다. 하지만, 약제에 대한 연구 단계의 제언이지 아직 임상에 검증된 결과가 아니기 때문에 안전성, 유효성은 입증되지 않았다고 판단된다.
Current researches about COVID-19 (May 18, 2020)
백신의 경우에는 치료제 보다는 연구 진행이 느린 실정인데 대부분 국내외 병원, 연구소나 다국적제약회사를 중심으로 후보 물질을 개발하는 단계이다. 건강한 성인 108명을 대상으로 제5형 아데노바이러스벡터(Adenovirus type 5 vector)를 이용한 재조합(recombinant) 코로나바이러스 백신의 적정 용량에 따른 안전성, 유효성을 평가하는 APICTH라는 이름의 1상 임상시험이 중국에서 진행 중이며 2020년 12월 말까지 단일기관 연구로 예정되어 있다[74]. 영국에서 진행되는 1상, 2상 백신 임상시험은 건강한 성인 510명을 대상으로 다기관 연구로 시행되며 근육주사 방식이며 안정성, 유효성을 평가하며 2021년 5월까지 까지 진행 예정이다[75]. 또한, BCG 백신이 COVID-19감염증에서 의료진 보호에 의미가 있다는 가설을 입증하는 3상 임상시험(연구명 BRACE)이 건강한 성인 4,170명을 대상으로 호주에서 시행되며 2022년 3월까지 진행될 예정이다[76].
미국 국립의학도서관(NIH) 내 임상시험(ClinicalTrials.gov) 온라인 사이트를 기준으로 2020년 5월 18일 현재 COVID-19에 관해 1,546건의 임상시험이 등록되어 있는데 대부분 대상자 모집(recruiting)의 초기 단계인 상태이다[77]. 이 중 현재까지 66건의 임상시험이 완료되었으며 유럽 31건, 중국 19건, 중동 7건, 미국 5건, 아프리카 3건, 인도 1건, 동아시아 1건이 포함되어 있고 주제별로 살펴보면 역학 11건, 임상 양상 16건, 진단 12건, 치료 17건, 그리고 재활, 예후 및 예방 10건이다. 앞으로 분야별로 다양하고 잘 디자인된 연구결과들이 발표되어 코로나바이러스-19 감염증에 대해 학문적, 임상적인 면에서 보다 명확하게 정립될 것으로 기대한다.
일반적으로 안면 마스크는 감염 환자나 호흡기 증상이 있는 의심환자, 고령, 동반 질환이 있는 취약 계층이나 의료진에게는 권고되지만 지역사회 감염 예방의 측면에서 건강한 일반인들에게는 권고되지 않았다. 하지만, 사람간 전파가 많고 지역사회 감염이 만연한 세계적 대유행 상황에서 COVID-19 감염 예방을 위해 일반 시민들이 안면 마스크 착용하는 것은 국가별로 차이를 보인다[78]. 이는 사회적, 문화적 차이에 의해 달라지는데 서양에서는 일반인 마스크 착용은 상대적으로 적은 편이지만, 여러 아시아 국가에서는 많은 사람들이 일상 생활시 마스크를 항시 착용한다. 한편, 우리나라나 독일 같은 경우에는 국내 수요를 위해 정부 차원에서 마스크의 수출을 금지하고 있다. Liu와 Zhang [79]은 COVID-19 발병이 폭증하던 중국 충칭에서 2시간 이상 장거리 버스를 타고 간 사람들을 대상으로 한 증례 문헌을 통해 마스크 착용을 하면 좁고 밀폐된 공간에서 지역사회 감염을 줄이는 역할을 한다고 주장하였다. 우리나라를 포함한 여러 아시아 국가에서 초기에 감염이 폭증하였으나 상대적으로 증가세가 둔화되고 비교적 방역 조절이 잘 되었다는 점에서 지역 사회에서 대규모 마스크 착용이 COVID-19 확산을 둔화시킬 수 있다는 추정을 할 수 있다. 최근 서양에서도 마스크 착용에 대한 인식이 최근 많이 바뀌어서 증상이 있는 환자 및 의료진의 사용 뿐만 아니라 무증상 감염을 예방하는 목적으로 격리 중인 사람이 다른 사람과 접촉할 때도 마스크를 착용하도록 권장하고 있다[80].
손위생에 관해서도 아직까지 COVID-19 감염증에서 효과에 대한 대규모의 연구 결과는 없다. 하지만, 병원내 감염 뿐만 아니라 지역사회 감염 예방 측면에서도 손위생은 중요하다. 특히, 고령이나 기저질환자 등 고위험군에서 더욱 중요한데 장기 요양시설에서 손위생의 긍정적 효과에 대한 연구 결과들이 보고되었다. Schweon 등[81]은 장기요양시설에서 직원들과 입소자 모두 알코올 성분의 손세정제를 자주 사용하여 하기도 질환 유병률이 현저히 감소하였다고 보고하였다. 바이러스 질환이나 이차성 세균 감염 모두에서 손위생은 중요하며 COVID-19 감염증도 바이러스 질환이며 비말 감염 혹은 접촉 감염의 경로로 전파되는 점을 생각해보면 적절한 손위생은 감염예방에 필수적이라고 할 수 있다.
무증상 감염 예방을 위해 자가격리조치와 사회적 거리두기가 각국에서 시행되고 있다. 이는 정치적, 경제적인 이유에 따라 나라별로 다소 차이를 보이지만 지역사회에서 대규모 감염 전파를 예방하는 방역측면에서 효과적이라고 여겨지고 있다[82]. Koo 등[83]은 사회적 거리두기에 관해 기초감염재생산수(basic reproductive number, R0) 수치를 바탕으로 수학적모델을 이용하여 분석하였는데 학교와 직장 폐쇄 등 강력한 사회적 거리두기를 하면 R0가 1.5일때 감염 중위수는 99.3%(IQR 92.6~99.9) 감소하고, R0가 2.0일 때 93.0%(IQR 81.5~99.7), R0가 2.5일 때 78.2%(IQR 59.0~94.4)감소한다고 보고하였다.
한편, 국내 중앙방역대책본부와 미국 질병통제예방센터에 따르면 흡연자의 경우 폐 기능이 저하될 가능성이 높아 고위험군에 포함된다. 그러므로, 비말 감염의 특성을 고려하여 많은 사람이 모이는 장소를 피하는 것뿐 만 아니라 금연하는 것도 중요한 생활 수칙 중 하나이다.
Go to : 
현재 COVID-19 감염증의 세계적 대유행 상황으로써 다양한 학문적 보고뿐만 아니라 언론매체 및 인터넷 등에서도 수많은 정보와 자료들이 발표되고 있다. 이 중 과학적으로 검증되지 않은 자료들과 근거 없는 속설이 많다. 또한, 상기도 감염 질환을 접하는 이비인후과 의료진을 위한 명확한 진료 지침이나 정리된 자료는 없는 실정이다. 따라서, 이비인후과 의료진의 입장에서 COVID-19 감염증에 대해 정확하고 중요한 정보들을 이해하는 것이 중요하다. 특히, COVID-19 감염증 초기에 무증상 전파가 많고 무후각증, 미각 저하 등의 비교적 가벼운 비과 증상만을 호소하는 경우가 많다. 따라서, 비과의사 입장에서는 COVID-19 감염증의 임상적 특성들을 명확히 숙지하여 부비동염, 외상력이 없는 원인미상의 무후각, 미각저하 환자에서 COVID-19 감염증 환자를 조기에 감별함으로써 감염전파 측면에 많은 역할을 할 수 있으며 의료진 자신도 보호할 수 있을 것이다. 또한, 다른 호흡기 바이러스처럼 COVID-19 감염증에 의한 부비동염, 비염, 수면 질환 등 비과질환과 그 역할에 대한 분야는 앞으로 좋은 임상 연구 분야가 될 것으로 판단한다. 코로나바이러스-19 감염증은 현재까지 접해보지 못한 새로운 감염병으로서 치료제나 백신은 개발되어 있지 않아 기존 사례나 연구들을 종합하여 진단과 치료에 임해야 한다. 신종 코로나바이러스-19 감염증에 대해 임상 현장에서 사용할 진단 및 치료 방법을 정립하고 앞으로 개발될 치료제나 백신을 포함하여 최적화된 치료 지침을 수립하기 위한 노력을 기울여야 할 것으로 사료된다.
Go to : 
References
1. Central disease control headquaters. COVID-19 response guidelines, 7th. http://ncov.mohw.go.kr/duBoardList.do?brdId=2&brdGubun=28/2020.
2. Kahn JS, McIntosh K. History and recent advances in coronavirus discovery. Pediatr Infect Dis J. 2005; 24(11 Suppl):S223–7. discussion S6.
3. Falsey AR, Dallal GE, Formica MA, Andolina GG, Hamer DH, Leka LL, et al. Long-term care facilities: a cornucopia of viral pathogens. J Am Geriatr Soc. 2008; 56(7):1281–5.
4. Birch CJ, Clothier HJ, Seccull A, Tran T, Catton MC, Lambert SB, et al. Human coronavirus OC43 causes influenza-like illness in residents and staff of aged-care facilities in Melbourne, Australia. Epidemiol Infect. 2005; 133(2):273–7.
5. Walsh EE, Shin JH, Falsey AR. Clinical impact of human coronaviruses 229E and OC43 infection in diverse adult populations. J Infect Dis. 2013; 208(10):1634–42.
6. Ko FW, Ip M, Chan PK, Chan MC, To KW, Ng SS, et al. Viral etiology of acute exacerbations of COPD in Hong Kong. Chest. 2007; 132(3):900–8.
7. Johnstone J, Majumdar SR, Fox JD, Marrie TJ. Viral infection in adults hospitalized with community-acquired pneumonia: prevalence, pathogens, and presentation. Chest. 2008; 134(6):1141–8.
8. Krause JC, Panning M, Hengel H, Henneke P. The role of multiplex PCR in respiratory tract infections in children. Dtsch Arztebl Int. 2014; 111(38):639–45.
9. Cherry JD, Krogstad P. SARS: the first pandemic of the 21st century. Pediatr Res. 2004; 56(1):1–5.
10. Centers for Disease C, Prevention. Preliminary clinical description of severe acute respiratory syndrome. MMWR Morb Mortal Wkly Rep. 2003; 52(12):255–6.
11. Peiris JS, Yuen KY, Osterhaus AD, Stohr K. The severe acute respiratory syndrome. N Engl J Med. 2003; 349(25):2431–41.
12. Tsang KW, Ho PL, Ooi GC, Yee WK, Wang T, Chan-Yeung M, et al. A cluster of cases of severe acute respiratory syndrome in Hong Kong. N Engl J Med. 2003; 348(20):1977–85.
13. Zaki AM, van Boheemen S, Bestebroer TM, Osterhaus AD, Fouchier RA. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med. 2012; 367(19):1814–20.
14. Guery B, Poissy J, el Mansouf L, Sejourne C, Ettahar N, Lemaire X, et al. Clinical features and viral diagnosis of two cases of infection with Middle East Respiratory Syndrome coronavirus: a report of nosocomial transmission. Lancet. 2013; 381(9885):2265–72.
15. Assiri A, Al-Tawfiq JA, Al-Rabeeah AA, Al-Rabiah FA, Al-Hajjar S, Al-Barrak A, et al. Epidemiological, demographic, and clinical characteristics of 47 cases of Middle East respiratory syndrome coronavirus disease from Saudi Arabia: a descriptive study. Lancet Infect Dis. 2013; 13(9):752–61.
16. Assiri A, McGeer A, Perl TM, Price CS, Al Rabeeah AA, Cummings DA, et al. Hospital outbreak of Middle East respiratory syndrome coronavirus. N Engl J Med. 2013; 369(5):407–16.
17. Zumla A, Hui DS, Perlman S. Middle East respiratory syndrome. Lancet. 2015; 386(9997):995–1007.
18. Deng SQ, Peng HJ. Characteristics of and Public Health Responses to the Coronavirus Disease 2019 Outbreak in China. J Clin Med. 2020; 9(2):
19. Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci. 2020; 63(3):457–60.
20. Lam TT, Shum MH, Zhu HC, Tong YG, Ni XB, Liao YS, et al. Identifying SARS-CoV-2 related coronaviruses in Malayan pangolins. Nature. 2020.
21. Ou X, Liu Y, Lei X, Li P, Mi D, Ren L, et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nat Commun. 2020; 11(1):1620.
22. Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020; 181(2):281–92. e6.
23. Kirchdoerfer RN, Cottrell CA, Wang N, Pallesen J, Yassine HM, Turner HL, et al. Pre-fusion structure of a human coronavirus spike protein. Nature. 2016; 531(7592):118–21.
24. Tresoldi I, Sangiuolo CF, Manzari V, Modesti A. SARS-COV-2 and infectivity. J Med Virol. 2020.
25. Cascella M, Rajnik M, Cuomo A, Dulebohn SC, Di Napoli R. Features, Evaluation and Treatment Coronavirus (COVID-19). In StatPearls. Treasure Island (FL);2020.
26. WHO. Coronavirus disease (COVID-19) outbreak situation. https://www.who.int/emergencies/diseases/novel-coronavirus-2019 2020.
27. Central disease control headquaters. COVID-19 cases in Korea. http://ncov.mohw.go.kr/en/ 2020.
28. Yeo C, Kaushal S, Yeo D. Enteric involvement of coronaviruses: is faecal-oral transmission of SARS-CoV-2 possible? Lancet Gastroenterol Hepatol. 2020; 5(4):335–7.
29. Hindson J. COVID-19: faecal-oral transmission? Nat Rev Gastroenterol Hepatol. 2020.
30. COVID-19 National Emergency Response Center EaCMT; Korea Centers for Disease Control and Prevention. Coronavirus Disease-19: Summary of 2,370 Contact Investigations of the First 30 Cases in the Republic of Korea. Osong Public Health and Research Perspectives. 2020; 11(2):81–4.
31. Liu Y, Gayle AA, Wilder-Smith A, Rocklov J. The reproductive number of COVID-19 is higher compared to SARS coronavirus. J Travel Med. 2020; 27(2):
32. Fine PE. Herd immunity: history, theory, practice. Epidemiol Rev. 1993; 15(2):265–302.
33. Luman ET, Barker LE, Simpson DM, Rodewald LE, Szilagyi PG, Zhao Z. National, state and urban-area vaccination-coverage levels among children aged 19-35 months, United States, 1999. Am J Prev Med. 2001; 20(4 Suppl):88–153.
34. Jiles RB, Fuchs C, Klevens RM. Vaccination coverage among children enrolled in Head Start programs or day care facilities or entering school. MMWR CDC Surveill Summ. 2000; 49(9):27–38.
35. Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann Intern Med. 2020.
36. Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, et al. Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis. Int J Infect Dis. 2020.
37. Zou L, Ruan F, Huang M, Liang L, Huang H, Hong Z, et al. SARSCoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N Engl J Med. 2020; 382(12):1177–9.
38. UK E. Loss of sense of smell as marker of COVID-19 infection. https://www.entuk.org/sites/default/files/files/Loss%20of%20sense%20of%20smell%20as%20marker%20of%20COVID.pdf 2020.
39. Guan WJ, Liang WH, Zhao Y, Liang HR, Chen ZS, Li YM, et al. Comorbidity and its impact on 1590 patients with Covid-19 in China: A Nationwide Analysis. Eur Respir J. 2020.
40. COVID-19 National Emergency Response Center EaCMT; Korea Centers for Disease Control and Prevention. Coronavirus Disease-19: The First 7,755 Cases in the Republic of Korea. Osong Public Health and Research Perspectives. 2020; 11(2):85–90.
41. Choi E, Ha KS, Song DJ, Lee JH, Lee KC. Clinical and laboratory profiles of hospitalized children with acute respiratory virus infection. Korean J Pediatr. 2018; 61(6):180–6.
42. Touzard-Romo F, Tape C, Lonks JR. Co-infection with SARS-CoV-2 and Human Metapneumovirus. R I Med J (2013). 2020; 103(2):75–6.
43. Wahidi MM, Lamb C, Murgu S, Musani A, Shojaee S, Sachdeva A, et al. American Association for Bronchology and Interventional Pulmonology (AABIP) Statement on the Use of Bronchoscopy and Respiratory Specimen Collection in Patients with Suspected or Confirmed COVID-19 Infection. J Bronchology Interv Pulmonol. 2020.
44. Yu F, Yan L, Wang N, Yang S, Wang L, Tang Y, et al. Quantitative Detection and Viral Load Analysis of SARS-CoV-2 in Infected Patients. Clin Infect Dis. 2020.
45. Li Y, Yao L, Li J, Chen L, Song Y, Cai Z, et al. Stability Issues of RT-PCR Testing of SARS-CoV-2 for Hospitalized Patients Clinically Diagnosed with COVID-19. J Med Virol. 2020.
46. Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, et al. Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. J Med Virol. 2020.
47. Gao Y, Li T, Han M, Li X, Wu D, Xu Y, et al. Diagnostic Utility of Clinical Laboratory Data Determinations for Patients with the Severe COVID-19. J Med Virol. 2020.
48. Pedersen SF, Ho YC. SARS-CoV-2: A Storm is Raging. J Clin Invest. 2020.
49. Yoon SH, Lee KH, Kim JY, Lee YK, Ko H, Kim KH, et al. Chest Radiographic and CT Findings of the 2019 Novel Coronavirus Disease (COVID-19): Analysis of Nine Patients Treated in Korea. Korean J Radiol. 2020; 21(4):494–500.
50. Chua F, Armstrong-James D, Desai SR, Barnett J, Kouranos V, Kon OM, et al. The role of CT in case ascertainment and management of COVID-19 pneumonia in the UK: insights from high-incidence regions. Lancet Respir Me. 2020.
51. Bernheim A, Mei X, Huang M, Yang Y, Fayad ZA, Zhan N, et al. Chest CT Findings in Coronavirus Disease-19 (COVID-19): Relationship to Duration of Infection. Radiolog. 2020:200463.
52. Kanne JP, Little BP, Chung JH, Elicker BM, Ketai LH. Essentials for Radiologists on COVID-19: An Update-Radiology Scientific Expert Panel. Radiolog. 2020:200527.
53. Liu KC, Xu P, Lv WF, Qiu XH, Yao JL, Gu JF, et al. CT manifestations of coronavirus disease-2019: A retrospective analysis of 73 cases by disease severity. Eur J Radiol. 2020; 126:108941.
54. Pan F, Ye T, Sun P, Gui S, Liang B, Li L, et al. Time Course of Lung Changes On Chest CT During Recovery From 2019 Novel Coronavirus (COVID-19) Pneumonia. Radiolog. 2020:200370.
55. Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, et al. Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiolog. 2020:200642.
56. Yuan M, Yin W, Tao Z, Tan W, Hu Y. Association of radiologic findings with mortality of patients infected with 2019 novel coronavirus in Wuhan, China. PLoS One. 2020; 15(3):e0230548.
57. Liang T. Handbook of COVID-19 Prevention and Treatment. The First Affiliated Hospital, Zhejiang University School of Medicine. Complied According to Clinical Experience. 2020.
58. Wu J, Li W, Shi X, Chen Z, Jiang B, Liu J, et al. Early antiviral treatment contributes to alleviate the severity and improve the prognosis of patients with novel coronavirus disease (COVID-19). J Intern Med. 2020.
59. Deng L, Li C, Zeng Q, Liu X, Li X, Zhang H, et al. Arbidol combined with LPV/r versus LPV/r alone against Corona Virus Disease 2019: A retrospective cohort study. J Infect. 2020.
60. Zhao ZW, Zhang FC, Xu M, Huang K, Zhong WN, Cai WP, et al. [Clinical analysis of 190 cases of outbreak with atypical pneumonia in Guangzhou in spring, 2003]. Zhonghua Yi Xue Za Zhi. 2003; 83(9):713–8.
61. Meng QH, Dong PL, Guo YB, Zhang K, Liang LC, Hou W, et al. [Use of glucocorticoid in treatment of severe acute respiratory syndrome cases]. Zhonghua Yu Fang Yi Xue Za Zhi. 2003; 37(4):233–5.
62. Jin YH, Cai L, Cheng ZS, Cheng H, Deng T, Fan YP, et al. A rapid advice guideline for the diagnosis and treatment of 2019 novel coronavirus (2019-nCoV) infected pneumonia (standard version). Mil Med Res. 2020; 7(1):4.
63. Zhang R, Wang X, Ni L, Di X, Ma B, Niu S, et al. COVID-19: Melatonin as a potential adjuvant treatment. Life Sci. 2020:117583.
64. Day M. Covid-19: ibuprofen should not be used for managing symptoms, say doctors and scientists. BMJ. 2020; 368:m1086.
65. Rabito EI, Marcadenti A, da Silva Fink J, Figueira L, Silva FM. Nutritional Risk Screening 2002, Short Nutritional Assessment Questionnaire, Malnutrition Screening Tool, and Malnutrition Universal Screening Tool Are Good Predictors of Nutrition Risk in an Emergency Service. Nutr Clin Pract. 2017; 32(4):526–32.
66. Casadevall A, Pirofski LA. The convalescent sera option for containing COVID-19. J Clin Invest. 2020; 130(4):1545–8.
67. Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, et al. In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020.
68. Mitja O, Clotet B. Use of antiviral drugs to reduce COVID-19 transmission. Lancet Glob Health. 2020.
69. de Wit E, Feldmann F, Cronin J, Jordan R, Okumura A, Thomas T, et al. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection. Proc Natl Acad Sci U S A. 2020; 117(12):6771–6.
70. Sarma P, Kaur H, Kumar H, Mahendru D, Avti P, Bhattacharyya A, et al. Virological and clinical cure in COVID-19 patients treated with hydroxychloroquine: A systematic review and meta-analysis. J Med Virol. 2020.
71. Grein J, Ohmagari N, Shin D, Diaz G, Asperges E, Castagna A, et al. Compassionate Use of Remdesivir for Patients with Severe Covid-19. N Engl J Med. 2020.
72. WHO. “Solidarity” clinical trial for COVID-19 treatments. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-clinical-trial-for-covid-19-treatments. 2020.
73. Leon Caly JDD, Mike G. Catton, David A. Jans, Kylie M. Wagstaff. The FDA-approved Drug Ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Research 2020; In press.
74. Prevention HPCfDCa. A Phase I Clinical Trial in 18-60 Adults (APICTH). Hubei Provincial Center for Disease Control and Prevention. https://clinicaltrials.gov/ct2/show/NCT04313127. 2020.
75. Oxford Uo. A Study of a Candidate COVID-19 Vaccine (COV001). University of Oxford. https://clinicaltrials.gov/ct2/show/NCT04324606. 2020.
76. Institute MCR. BCG Vaccination to Protect Healthcare Workers Against COVID-19 (BRACE). Murdoch Childrens Research Institute. https://clinicaltrials.gov/ct2/show/NCT04327206. 2020.
77. NIH. NIH ClinicalTrials.gov. https://clinicaltrials.gov/ct2/results?recrs=e&cond=COVID-19 2020.
78. Feng S, Shen C, Xia N, Song W, Fan M, Cowling BJ. Rational use of face masks in the COVID-19 pandemic. Lancet Respir Med. 2020.
79. Liu X, Zhang S. COVID-19: Face Masks and Human-to-human Transmission. Influenza Other Respir Viruses. 2020.
80. Feng S, Shen C, Xia N, Song W, Fan M, Cowling BJ. Rational use of face masks in the COVID-19 pandemic. Lancet Respir Med. 2020; 8(5):434–6.
81. Schweon SJ, Edmonds SL, Kirk J, Rowland DY, Acosta C. Effectiveness of a comprehensive hand hygiene program for reduction of infection rates in a long-term care facility. Am J Infect Control. 2013; 41(1):39–44.
82. Lewnard JA, Lo NC. Scientific and ethical basis for social-distancing interventions against COVID-19. Lancet Infect Dis. 2020.
83. Koo JR, Cook AR, Park M, Sun Y, Sun H, Lim JT, et al. Interventions to mitigate early spread of SARS-CoV-2 in Singapore: a modelling study. Lancet Infect Dis. 2020.
Go to : 




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download