Abstract
Transfusion-related acute lung injury (TRALI) is defined as a new episode of acute lung injury that occurs during or within 6 hours of a completed transfusion, which is one of the leading causes of transfusion-related morbidity and mortality. We present a case of TRALI in a 29-year-old parturient with myelodysplastic syndrome scheduled for cesarean section. The parturient developed hypoxemia and dyspnea after preoperative transfusion of platelets following apheresis to eliminate a unit of leucocyte in order to correct thrombocytopenia. She underwent emergent caesarean section for fetal distress. After surgery, the chest radiograph showed diffuse haziness of both lung fields. Direct and indirect antiglobulin tests were negative, and hemolytic transfusion reaction was ruled out. Pro-BNP 347.3 pg/ml also excluded transfusion-associated circulatory overload. The parturient completely recovered after oxygen support for 2 days. It is important to recognize TRALI as soon as possible to minimize perioperative morbidity and mortality.
Go to : 
수혈 관련 급성폐손상(transfusion-related acute lung injury, TRALI)은 수혈과 연관된 중요한 합병증이다. 이 질환은 1983년 Popovsky 등[1]에 의해 처음으로 TRALI이라 명명되었다. TRALI는 수혈하는 동안 혹은 수혈 후 6시간 이내에 발생하는 일종의 비심장성 폐부종을 말한다. 예전에는 수혈의 드문 합병증으로 생각하였으나 여러 후향적 연구에 나타난 바 이 질환의 인식 부족으로 그동안 진단이 잘 이루어지지 못해서 보고율이 낮은 것으로 알려졌다[2]. 국내에서도 2012년까지 보고된 TRALI는 8개의 보고의 증례 10예가 있다[3]. 임산부에서 발생한 TRALI 국내 보고는 2011년 전치태반 및 조기산통으로 응급 제왕절개술 중 농축적혈구 3 unit을 투여 받고 생긴 급성폐손상 증례[4]와 같은 해 임신 특발성 혈소판 감소 자반병(gestational idiopathic thrombocytopenic purpura)을 진단 받은 임산부에서 수술 전 8 unit의 혈소판 농축액 수혈로 유발된 급성폐손상 증례[5] 정도로 드물다.
본 증례는 골수이형성증후군이 있는 임산부에서 제왕절개술을 대비해서 수술 전 백혈구여과제거 성분채집 혈소판(leucocyte eliminated apheresis platelets) 1 unit을 수혈 후 발생한 TRALI 증례이다. 이를 문헌고찰과 함께 보고하고자 한다.
Go to : 
골수이형성증후군을 진단 받은 29세 36주 4일 임산부가 제왕절개술을 받기 위해 입원하였다. 임산부는 키 170 cm, 몸무게 103 kg, 임신 전 체중 85 kg, 혈액형은 Rh(+) A형이었으며, 임신 20주차부터 4개월간 매주 외래를 통해 경과관찰을 하면서 백혈구제거 농축 적혈구 4차례, 농축 혈소판 11차례, 성분채집 혈소판 5차례 수혈을 받은 과거력이 있었다. 입원 시 시행한 흉부 방사선 사진, 심전도, 생화학검사에서 특이소견은 관찰되지 않았으나 혈액검사에서 백혈구 2,800 /µl, 헤모글로빈 7.9 g/dl, 혈소판 7,000 /µl로 범혈구감소증을 보였다.
혈소판감소증을 교정하기 위해 혈소판 수혈이 계획되었고, 수혈 전처치로 chlorpheniramine 4 mg을 정주하였다. 환자는 0.9% normal saline 시간당 20 ml로 입원 시부터 수혈 전까지 16시간 동안 320 ml가 투여되었다. 수혈 전 혈압은 수축기 140 mmHg, 이완기 90 mmHg였고, 심박수 88회/분, 호흡수 20회/분, 고막체온 37.0°C였다. 환자의 혈액형 Rh(+) A형과 일치하는 백혈구여과제거 성분채집 혈소판 250 ml 1 unit을 30분간 수혈하였으며 수혈 직후 부작용은 관찰되지 않았다. 수혈 4시간 후 흉부 불편감, 호흡곤란을 호소하였으며, 경피적 산소포화도 57%, 심박수 170회/분으로 측정되어 앰부백(bag valve mask)을 적용하고 furosemide 10 mg과 dexamethasone 10 mg을 정주하였다. 증상 지속되어 후두경을 이용한 기관내삽관을 시도하였으나 환자가 진정되지 않아 midazolam 3 mg을 투여 후 기관내삽관을 재시도하였으나 저작근 이완이 되지 않아 succinylcholine 50 mg 추가로 투여 후 video laryngoscope (GlideScope GVL®, Verathon, USA)을 이용하여 기관내삽관을 하였다. 이송 전 복부 초음파상 태아 심박수 72–80회/분으로 측정되어 태아절박가사(fetal distress)로 응급 제왕절개술을 시행하기로 결정하였으며 기관내삽관 직후 수술실로 환자를 이송하였다.
수술실 입실 후 첫 측정 혈압은 수축기 178 mmHg, 이완기 103 mmHg였고, 심박수 117회/분, 호흡수 18회/분으로 측정되었다. 마취유도는 thiopental 200 mg으로 시행되었고, 신경근 차단을 위해 rocuronium 50 mg을 정주하였다. 흉부청진상 양측 폐에서 수포음이 들렸으며, 기관내 튜브 흡인 시 분홍색의 삼출액이 흡인되었다. 인공호흡기는 압력조절환기(pressure controlled ventilation mode)로 흡입 시 압력(peak inspiratory pressure) 30 cmH2O로 하였으며 일회 환기량 600–700 ml, 호흡수 분당 16회, 호기말양압 10 cmH2O으로 적용하였다. 마취유지는 O2 2 L/min-air 1 L/min-sevoflurane 1–2 vol%로 시행하였으며 이중분광지수(bispectral index scale, BIS)는 40–60으로 유지하였다. 수술시작 2분 후 2.5 kg 여아 만출되었으며 1분 APGAR 점수 1점, 5분 APGAR 점수 4점이었다. 태아 만출 후 carbetocin 100 µg을 정주하였고, 수술 후 중환자실 집중치료와 주기적인 동맥혈 가스분석을 고려하여 동맥 내 도관을 삽관하였다. 태아 만출 후 FiO2 0.73에서 시행한 동맥혈 가스분석 결과 pH 7.043, PaCO2 37.6 mmHg, PaO2 205.7 mmHg, HCO3– 10.3 mmol/L, base excess (BE) −20.5 mmol/L, SaO2 99.2%였고, PaO2/FiO2는 281.8로 경한 급성호흡곤란증후군(acute respiratory distress syndrome: ARDS)을 보였고(Table 1), 대사성 산증을 교정하기 위해 sodium bicarbonate 80 mEq를 투여하였다. 통증조절을 위해 태아 만출 후 fentanyl 50 µg을, 수술 후 fentanyl 50 µg을 정주하였다. 수술 중 출혈량은 800 ml였고, 소변량은 325 ml였다. 수술 중 plasma solution 300 ml를 투여하였다. 수술은 60분간 진행되었고, 마취시간은 70분이었다.
Change of Arterial Blood Gas Analysis Results
수술 중 혈압은 수축기 105–161 mmHg, 이완기 58–104 mmHg로 유지되었다. 호기말 이산화탄소 분압은 32–34 mmHg로 유지되었고, 심박수는 114–125회/분으로 유지되었으며 심전도상 부정맥 소견은 나타나지 않았다. 산소포화도는 92–100%로 유지되었다. 수술 종료 시 고막에서 측정한 체온은 35.7°C였다. 수술 종료 후 sevoflurane 투여를 중단하였고, 인공호흡기를 이용한 기계적 환기를 위해 기관내 튜브는 발관을 하지 않은 채 환자를 중환자실로 이송하였다.
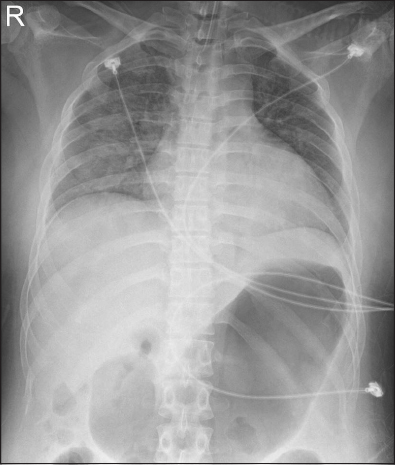
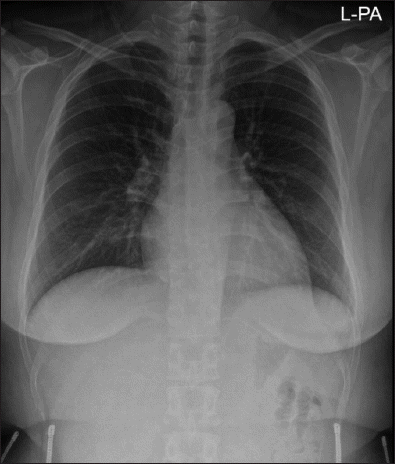
중환자실 도착 직후 환자는 흡입기산소농도 100%로 흡기유발 호흡(assisted controlled mandatory ventilation)으로 인공호흡을 하였다. 수술 종료 후 FiO2 1.0에서 시행한 동맥혈 가스분석 결과는 pH 7.463, PaCO2 29.8 mmHg, PaO2 142.2 mmHg, HCO3– 21.5 mmol/L, BE −2.5 mmol/L, SaO2 99.4%이었다(Table 1). 수술 종료 1시간 후 흡입기산소농도를 40%로 줄였으며 이 때 환자는 자발호흡을 하였다. 수술 후 촬영한 흉부방사선사진에서 양쪽 폐 전반의 간유리 음영이 보여 폐부종이 의심되었다(Fig. 1). 용혈성 수혈 부작용(hemolytic transfusion reaction)을 감별하기 위해 시행한 직접 항글로불린 검사(direct antiglobulin test), 간접 항글로불린 검사(indirect antiglobulin test)는 음성이었으며, 수혈과 연관된 순환과부하(transfusion associated circulatory overload, TACO)를 감별하기 위해 시행한 Pro-BNP는 347.3 pg/ml로(참고치: 50세 이하에서 450 pg/ml 이하 정상) 순환과부하는 배제할 수 있었다. 수술 1일 후 환자는 자발호흡이 원활하였고, 흉부 방사선 사진에서 폐부종이 호전되어 기관내 튜브를 발관하였다. 발관 후 호흡낭이 있는 마스크(mask reservoir bag)를 통해 산소를 분당 10 L로 투여하였고, 이 후 시행한 동맥혈 가스분석 결과는 pH 7.462, PaCO2 31.5 mmHg, PaO2 261.6 mmHg, HCO3– 23.4 mmol/L, BE −0.4 mmol/L, SaO2 99.9%였다(Table 1). 환자는 수술 2일 후 병실로 이동하였으며 비강 캐뉼라를 통해 산소를 분당 2 L로 투여하였고, 수술 3일 후 산소치료를 중단하였고 환자는 특별한 합병증 없이 퇴원하였다(Fig. 2).
Go to : 
수혈 중 혹은 수혈 후 수 시간 내 발생하는 수혈 관련 급성폐손상(TRALI)은 드물게 발생하는 비심장성 폐부종이다. 최근 수혈에 의한 합병증 중 감염이나 부적합한 수혈 등은 줄어들고, TRALI가 중요한 합병증으로 대두되고 있다.
TRALI를 일으킬 수 있는 혈액제제로는 전혈에서 뽑아낸 농축혈소판(whole blood derived platelet concentrates, WB-PLTs)이 가장 흔하고, 그 다음이 신선동결혈장, 농축적혈구, 전혈, 성분채집혈소판, 백혈구제제, 동결침전제제, 면역글로불린(intravenous immunoglobulin, IVIG) 등에 의해서도 유발된 경우가 보고된 바 있다[6]. 본 증례는 골수이형성증후군(myelodysplastic syndrome) 임산부에서 골수이식에 대비해서 수술 전에 백혈구여과제거 성분채집 혈소판에 의해 유발된 경우이다.
TRALI의 발생률은 수혈한 환자의 보고자에 따라 0.1–15% 정도까지 다양하다. 정확한 발생빈도가 잘 알려져 있지 않은 이유는 평가나 진단이 잘 이루어지지 않아 질환 자체를 잘 인식하지 못하는 것이 주된 이유이다. 신선동결혈장의 경우 7,900 unit당 1건, 전혈의 경우 432 unit당 1건 정도로 보고되었다[7].
European Haemovigilance Network (EHN)에서 TRALI를 임상적으로 진단하기 위해서는 몇 개의 요건들이 필요하다고 제시하였다: 1) 수혈 중 혹은 수혈 후 6시간 이내에 급성호흡곤란증후군이 발생하고; 2) 좌심실의 용적 과부하의 증후가 동반되지 않아야 하며; 3) 방사선학적으로 양측성 폐침윤 소견이 보여야 한다[8].
2004년 Toronto에서 있었던 Canadian Consensus Conference에서는 위의 세가지 요건에 추가하여 1) 저산소증: PaO2/FiO2 300 이하 또는 실내 공기에서 측정한 맥박산소측정(pulse oximetry)에서 산소포화도 90% 미만; 2) 이전에 급성폐손상이 존재하지 않아야 한다는 조건을 제시 하였다[9].
임상 증상은 수혈 동안 혹은 수혈 1–2시간 후부터 6시간 이내에 천명음, 기침, 호흡곤란, 흉부 불편감 등의 증상과 함께 빈맥과 저산소혈증을 보인다. 수혈 받은 혈액에 대한 알레르기 반응으로 피부발진, 두드러기가 나타날 수 있으며 심한 경우 저혈압을 동반한다[10]. 단순 흉부 X-선 촬영상에서 양측성 폐 침범을 보이기 때문에 수혈과 연관된 순환과부하와 감별이 어렵다[2]. TRALI를 진단하기 위한 특이검사는 없다. 대개 다른 원인의 폐부종과 감별진단이 필요하다. 본 환자의 경우 백혈구여과제거 성분채집 혈소판 250 ml 1 unit을 수혈한 후 수혈 4시간 후 흉부 불편감, 경도의 호흡곤란을 호소하였고, 동맥혈 가스 검사 결과 FiO2 0.73에서 pH 7.043, PaCO2 37.6 mmHg, PaO2 205.7 mmHg, HCO3– 10.3 mmol/L, BE −20.5 mmol/L, SaO2 99.2% 소견을 보였다(Table 1). PaO2/FiO2 281.8이고 흉부 X선 검사 결과 양측으로 급성비심장성 폐부종이 관찰되었고, 용혈성 수혈 부작용(hemolytic transfusion reaction)을 감별하기 위해 시행한 직접 항글로불린 검사(direct antiglobulin test), 간접 항글로불린 검사(indirect antiglobulin test)가 음성이었으며, 수혈과 연관된 순환과부하를 감별하기 위해 시행한 Pro-BNP는 정상이어서 TRALI의 진단기준에 합당하였다.
수혈 자체가 급성폐손상의 원인적 요인으로 작용할 수 있으나, 수혈을 적게 받은 경우에 비해 많이 받을 경우 TRALI를 일으킬 위험도가 높게 나타났다[11]. 따라서, 수혈을 시행할 때 수혈로 인한 여러 합병증을 고려하여 불필요한 수혈을 줄이는 것이 TRALI 예방을 위해 중요하다.
TRALI의 발병기전은 아직 정확하게 밝혀지지 않았으나, 두 종류의 가설이 관여한다고 알려져 있다[7].
하나는 two-hit 모델 가설로 첫 번째 손상은 수혈자의 병의 중증도나 건강 상태 등이 점화효과(priming effect)로 작용하여 폐혈관 내피세포 활성화를 일으킬 수 있다는 것이다. 두 번째 손상은 수혈된 혈액제재에 있는 매개자들에 의해 폐혈관 내피세포를 손상시키고 결과적으로 모세혈관의 누출과 폐부종을 일으킨다는 것이다. 두 번째 손상에 의해 면역성(antibody-mediated) TRALI와 비면역성(non-antibody-mediated) TRALI로 구분된다. 비면역성 TRALI는 혈액제재의 저장 동안 축적된 전염증성(proinflammatoty) 매개자들과 적혈구와 혈소판의 노화 등에 의해 야기되고, 반면 면역성 TRALI는 human leukocyte antigen (HLA)나 HLA 수혈자의 항원에 대한 공여자의 항체수동적 수혈에 의해 일어난다.
다른 하나는 역치가설(threshold model)로 건강한 사람에서 발생한 TRALI를 설명하는 가설이다. 이는 건강한 사람이 초기 점화(priming)없이 두 번째 손상이 강해서 발생하는 TRALI이다. 즉, 공혈자의 혈장 내의 상당한 양의 항체가 건강한 수혈자에게 TRALI를 야기시킨다. 실온 보관 시 생물학적 반응 조절물질 또한 축척되기 쉬워 수혈자의 폐혈관 내피세포에 염증을 유발할 수 있다는 것이다[12]. 동종 간 항체가 있는 공혈자, 특히 여러 번 임신을 반복한 여성 공혈자의 혈장 수혈 시 TRALI 발생률이 높다[13].
대부분의 면역성 TRALI는 수혈혈액의 항체에 의해 유발되지만 드물게 환자의 혈장에 있는 수혈혈액의 백혈구에 대한 항체에 의한 경우도 있다. 따라서 TRALI를 일으킨 원인 항체를 규명하기 위해서는 환자와 헌혈자의 혈액으로 과립구에 대한 항체검사를 시행해야 하고 이 때 헌혈자의 혈장에서 환자의 항원에 대한 특이 항체가 확인되면 해당 헌혈자는 이후 헌혈을 하지 않도록 해야 한다[9].
TRALI는 특별한 치료 방법이 없다. 일반적인 급성폐손상이나 급성호흡곤란증후군처럼 corticos춗eroid를 쓸 수도 있지만 치료 결과는 의문이다. 성공적인 치료 보고도 있지만 급성폐손상 초기에 corticosteroid는 도움이 되지 않을 수 있다[14]. 본 증례와 경우와 마찬가지로 다른 원인의 급성폐손상과는 달리 TRALI는 대부분의 환자가 인공환기 1–2일 내에 이탈이 되므로 corticosteroid는 사용하지 않는다[13]. TRALI가 의심되면 수혈을 즉시 중단하고 혈액은행에 알려서 수혈반응을 평가해서 재발되지 않도록 한다. TRALI의 치료는 결국 산소공급을 비롯한 보존적 요법이다. TRALI는 급성폐손상이나 급성호흡곤란증후군처럼 이들 환자에게 유리한 제한된 일회 호흡량 환기법(low tidal volume ventilation)이 추천된다. 심한 경우 extracorporeal membrane oxygenation (ECMO)도 적용하기도 한다[7].
미국에서는 1985년 이후 TRALI에 대한 이해가 높아지면서 최근 보고사례가 현저히 증가하였다[6]. 그러나 우리나라의 경우 TRALI의 진단이 잘 이루어지지 않고 보고율도 떨어져 있다. 앞으로 TRALI 진단이 정확하게 이루어지고 그때마다 보고도 적절히 이루어지면 적절한 치료가 효과적으로 이루어져서 이 질환으로 인한 유병률과 사망률을 낮출 것으로 기대한다.
Go to : 
No potential conflict of interest relevant to this article was reported.
Go to : 
Tae-Yun Sung: https://orcid.org/0000-0002-0714-1477
Seok-jin Lee: https://orcid.org/0000-0001-7894-8510
Hwang Ju You: https://orcid.org/0000-0001-9921-4241
Ki Soon Jeong: https://orcid.org/0000-0002-0183-5603
Po-Soon Kang: https://orcid.org/0000-0002-5000-1517
Go to : 
REFERENCES
1. Popovsky MA, Abel MD, Moore SB. Transfusion-related acute lung injury associated with passive transfer of antileukocyte antibodies. Am Rev Respir Dis. 1983; 128:185–9. DOI: 10.1164/arrd.1983.128.1.185. PMID: 6603182.
2. Toy P, Popovsky MA, Abraham E, Ambruso DR, Holness LG, Kopko PM, et al. Transfusion-related acute lung injury: definition and review. Crit Care Med. 2005; 33:721–6. DOI: 10.1097/01.CCM.0000159849.94750.51. PMID: 15818095.
3. Jin SM, Jang MJ, Huh JY, Park MH, Song EY, Oh D. A case of transfusion-related acute lung injury induced by anti-human leukocyte antigen antibodies in acute leukemia. Korean J Hematol. 2012; 47:302–6. DOI: 10.5045/kjh.2012.47.4.302. PMID: 23320011. PMCID: PMC3538804.
4. Lee HJ, Jeong MA, Jeong JS, Han MK, Jun JH. Case reports: a case of acute lung injury after transfusion during cesarean section. Korean J Crit Care Med. 2011; 26:184–7. DOI: 10.4266/kjccm.2011.26.3.184.
5. Kim KW, Park JS, Kim JW, Choe WJ, Kim KT, Kim JY, et al. A suspected case of transfusion-related acute lung injury in a 30-year old parturient with gestational ITP – a case report? Anesth Pain Med. 2011; 6:275–9.
6. Silliman CC, McLaughlin NJ. Transfusion-related acute lung injury. Blood Rev. 2006; 20:139–59. DOI: 10.1016/j.blre.2005.11.001.
7. Kim J, Na S. Transfusion-related acute lung injury;clinical perspectives. Korean J Anesthesiol. 2015; 68:101–5. DOI: 10.4097/kjae.2015.68.2.101. PMID: 25844126. PMCID: PMC4384395.
8. Bux J. Transfusion-related acute lung injury (TRALI): a serious adverse event of blood transfusion. Vox Sang. 2005; 89:1–10. DOI: 10.1111/j.1423-0410.2005.00648.x. PMID: 15938734.
9. Kleinman S, Caulfield T, Chan P, Davenport R, McFarland J, McPhedran S, et al. Toward an understanding of transfusion-related acute lung injury: statement of a consensus panel. Transfusion. 2004; 44:1774–89. DOI: 10.1111/j.0041-1132.2004.04347.x. PMID: 15584994.
10. Kim MO. Transfusion-related acute lung injury. Korean J Crit Care Med. 2012; 27:1–4. DOI: 10.4266/kjccm.2012.27.1.1.
11. Hébert PC, Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion requirements in critical care investigators, Canadian Critical Care Trials Group. N Engl J Med. 1999; 340:409–17. DOI: 10.1056/NEJM199902113400601. PMID: 9971864.
12. Rubenfeld GD, Caldwell E, Peabody E, Weaver J, Martin DP, Neff M, et al. Incidence and outcomes of acute lung injury. N Engl J Med. 2005; 353:1685–93. DOI: 10.1056/NEJMoa050333.
13. Popovsky MA, Moore SB. Diagnostic and pathogenetic considerations in transfusion-related acute lung injury. Transfusion. 1985; 25:573–7. DOI: 10.1046/j.1537-2995.1985.25686071434.x. PMID: 4071603.
14. Steinberg KP, Hudson LD, Goodman RB, Hough CL, Lanken PN, Hyzy R, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med. 2006; 354:1671–84. DOI: 10.1056/NEJMoa051693. PMID: 16625008.
Go to : 




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download