증례
키 165 cm, 몸무게 70 kg의 70세 남자 환자가 후두개곡 양성 종양(vallecular benign neoplasm)으로 덩이 제거술(mass removal)을 위해 입원하였다. 과거력상 환자는 고혈압과 당뇨로 약물치료 중이었으며 2년 전 왼쪽 상하지 근력약화가 발생하였고 검사결과 오른쪽 목동맥협착(carotid artery stenosis)으로 인한 뇌의 다병소성 허혈(multifocal ischemia) 진단하에 오른쪽 목동맥 내막절제술(carotid endarterectomy)을 시행받았다. 이후 clopidogrel을 복용 중이었으며 수술 1주 전부터 복용을 중단하였다. 고혈압으로 경구복용 중이던 hydrochlorothiazide와 안지오텐신 II 수용체 길항제인 telmisartan은 수술 당일 아침까지 복용하였다. 입원 시 검사한 심전도는 심박수 분당 64회로 정상 동율동(normal sinus rhythm)이었고(
Fig. 1) 병동에서의 혈압은 120–150/80–100 mmHg였다. 심초음파 상에서 박출률(ejection fraction) 72%로 심장벽의 운동은 정상이었고 약간의 삼첨판 역류와 함께 우심방 수축기압력(right ventricular systolic pressure, RVsP)이 44 mmHg으로 폐동맥 고혈압이 관찰되었으며 좌심방 확장의 소견은 보이지 않았다. 수술 2일전 시행한 적혈구침강속도(erythrocyte sedimentation rate), C-반응단백(C-reactive protein), 갑상선 기능 검사를 포함한 혈액검사 상 특이사항은 없었고 칼륨 4.9 mEq/L이며 기타 전해질도 정상범위였다. 흉부방사선 소견에서도 특이사항은 발견되지 않았다. 환자는 수술 전 약 8시간 금식하였고 금식 시작시간부터 탈수 방지를 위해 Hartman solution을 시간당 100 ml 주입받았다. 마취전 투약으로 수술실 도착 30분 전에 famotidine 20 mg 정주, glycopyrrolate 0.2 mg을 근주하였고 수술 당일 아침 체온은 36.3°C였다.
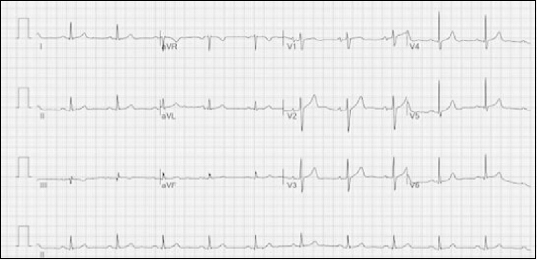 | Fig. 1Electrocardiogram taken one day before surgery. Regular sinus rhythm without arrhythmia was observed. 
|
수술실 도착 후 심박수가 분당 103회로 동성빈맥(sinus tachycardia)을 보였고 혈압은 133/95 mmHg, 경피적 산소 포화도(SpO
2)는 94%였다. 마취유도를 위해 fentanyl 50 μg과 midazolam 1 mg을 정주하였고 lidocaine 40 mg을 정주 후 propofol 80 mg을 투여하였다. propofol과 rocurinium 투여 시 환자가 통증을 느낄 때 보이는 움직임은 보이지 않았고 마취유도 과정에서 Hartman solution 약 200 ml가 투여되었다. 의식 소실과 함께 자발호흡 감소를 확인하고 rocuronium 40 mg을 정주하였다. 안면 마스크를 이용해 100% 산소로 용수환기를 시행하였는데 약 30초 후 갑자기 심박수가 분당 155회로 상승하며 혈압이 80/50 mmHg로 감소하였다. 이에 esmolol 20 mg을 투여 후 phenylephrine 100 μg씩 2회 분할 정주하였으나 심박수는 여전히 분당 149–155회를 유지하였고 수축기 혈압은 일시적으로 65–70 mmHg로 감소하다 즉시 80 mmHg 이상으로 회복되었다. 아나필락시스(anaphylaxis)를 의심할만한 피부발진이나 기도내압의 증가는 관찰되지 않았으나 마취유도 약제에 의한 아나필락시스의 가능성을 완전히 배제할 수 없고 마취약제와 항고혈압제제, 저혈량증 등에 의한 일시적인 혈역학적 반응의 가능성도 있어 일단 기도확보를 위해 근이완 확인 후 기관삽관을 시행하였다. 기관삽관 직후 심박수는 분당 166회, 혈압은 165/110 mmHg로 일시적으로 상승하였으나 점차 감소하여 삽관 5분 후에는 심박수 분당 149회, 혈압 87/54 mmHg로 감소하였으며 흡입산소농도(FIO
2) 1.0에서 SpO
2 99%였다. 요골 동맥에 20 G 카테터를 거치하여 동맥압을 지속해서 관찰하였고 마취 모니터에 부착된 lead II의 심전도 출력장치가 없어 일단 모니터상으로만 심전도를 관찰하게 되었다(
Fig. 2).
Fig. 2의 심전도 리듬은 마취유도 직후 처음 발생한 리듬과 변함없이 동일하였다. 저자들은 처음에는 발작성 상심실성 빈맥으로 생각하고 esmolol 20 mg을 추가 투여하였으나 전혀 반응이 없어 adenosine 3 mg과 6 mg을 1분 간격으로 순차적으로 정주하여도 반응하지 않아 1분 후 adenosine 6 mg을 추가 정주하였으나 심박수는 여전히 분당 150–160회였고 혈압은 75–90/40–60 mmHg였다. 이후 부정맥이 심방조동임을 의심하여 amiodarone 150 mg을 식염수 100 cc에 혼합하여 약 10분에 걸쳐 주입하였으나 심박수와 혈압의 변화는 보이지 않았다. 저자들은 수술진과 상의 후에 수술을 연기하고 순환기내과와 협진하여 부정맥을 치료하기 위해 회복실로 환자를 옮기기로 결정하였다. 환자의 자발호흡을 확인한 후 sugammadex 100 mg을 정주하였고 완전한 각성을 확인하고 기관내 튜브를 발관하였다. 수술실 퇴실 직전 심박수는 분당 154회, 혈압 128/68 mmHg, SpO
2 99%였다. 마취유지는 sevoflurane 1.5%로 하였으며 마취시간은 총 40분이었다.
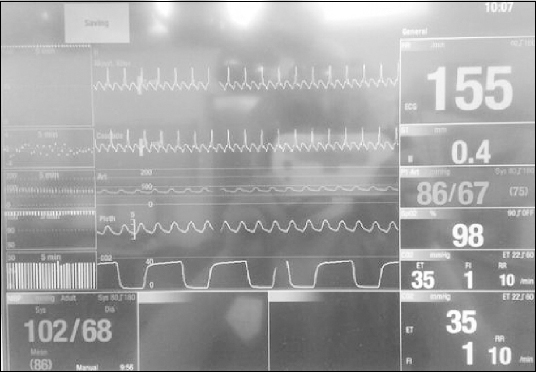 | Fig. 2Monitoring screen with lead II electrocardiography during anesthesia in operating room. 
|
회복실 도착 시 심박수는 분당 154회, 혈압 115/75 mmHg, SpO
2 99%였으며 환자는 두근거림 외에 다른 증상은 호소하지 않았다. 회복실 도착 직후 시행한 12 전극 심전도에서 규칙적인 RR 간격과 QRS파 사이에 상어 이빨모양(saw-toothed)의 빠른 P파로 보아 2:1의 방실전도를 갖는 심방조동으로 진단하였다(
Fig. 3). 회복실에서 시행한 동맥혈가스검사상 pH 7.387, pO
2 75.2 mmHg, pCO
2 32.5 mmHg였고 칼륨(3.76 mmol/L), 마그네슘(0.50 mmol/L)을 포함한 모든 검사수치는 정상범위였다. 회복실 도착 10여분 후 심리듬의 변화가 관찰되었는데 심박수가 분당 160회 이상 증가되면서 불규칙한 RR 간격을 보이는 심방세동으로 전환되었고 혈압은 100–110/45–60 mmHg이었다(
Fig. 4). 이에 5% dextrose soultion 500 ml 수액에 amiodarone 600 mg을 혼합하여 시간당 24 mg을 주입하였으나 amiodarone 투여에도 지속적인 심방세동을 보여 순환기내과 의사의 판단 하에 전기율동전환을 시행하기로 하였다. Midazolam 2.5 mg과 heparin 5,000 unit를 정주한 후 100 J로 전기율동전환을 시행하였으나 효과가 없어 150 J로 다시 시행한 후에 심박수가 분당 81회의 정상 동율동으로 전환되었고(
Fig. 5) 혈압은 140/80 mmHg였다. 이후 환자가 호소하던 두근거림 증상은 소실되었고 회복실에서 시행한 전해질 및 CK-MB, troponin I와 T 등의 심장효소 검사상에서도 특이사항은 없었다. 회복실에서 약 3시간 머무르는 동안 지속적인 정상 동율동과 함께 활력징후도 안정적이었고 다음 날 환자요구에 의해 다른 병원으로 전원될 때까지 특이사항은 관찰되지 않았다.
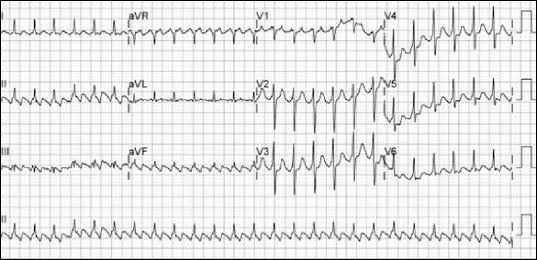 | Fig. 3Electrocardiogram taken immediately after arrival at recovery room. Atrial flutter with 2:1 atrioventricular block and saw-toothed P wave was observed. 
|
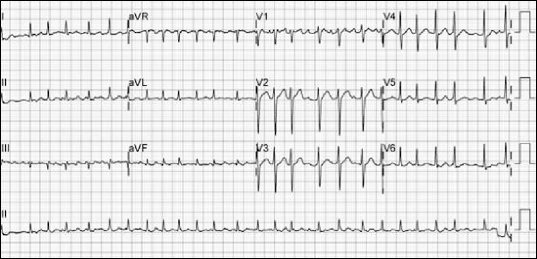 | Fig. 4Electrocardiogram before electric cardioversion. Atrial flutter changed to atrial fibrillation with rapid ventricular responses (ventricular rate: 160–170 bpm). 
|
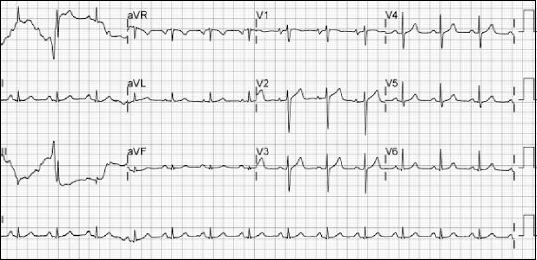 | Fig. 5Electrocardiogram after electric DC cardioversion. Regular sinus rhythm was restored. 
|
Go to :

고찰
부정맥의 기왕력이 없는 환자에서 비심장 수술을 위한 전신마취 전후에 심방조동이 새롭게 발생하는 경우는 비슷한 증례를 찾기 어려울 만큼 드문 일이다[
1]. 본 증례에서는 후두개곡 양성종양 수술을 위한 전신마취 유도 직후 심방조동이 발생하였고 약물치료에도 지속된 심방조동은 회복실 퇴실 이후에는 심방세동으로 자발적인 전환을 보였다.
심방조동은 삼첨판륜과 하대정맥 사이에 형성된 협부(cavotricuspid isthmus)를 포함하는 심방중격과 우심방 자유벽 사이의 거대 회귀로(macroreentry)에 의해 발생하는데[
2] 심방박동이 분당 240회 이상이며 방실결절(atrioventricular node)을 통해 1:1에서 8:1에 이르는 다양한 방실전도 양상을 보인다. 심방조동은 혈역학적으로 불안정할 때에는 전기적 율동전환을 시행하여야 하나 혈압이 어느 정도 안정되어 있는 경우에는 약물학적 치료를 시도해 볼 수 있다. 하지만 본 증례에서처럼 심방조동은 약물치료에는 잘 반응하지 않는 것으로 알려져 있다.
심방세동은 심방조동에 비해 주술기에 발생하는 경우가 상대적으로 많이 보고되어 있다. 하지만 이전에 없던 심방세동이 심장 및 흉부수술 이외의 수술 후 새로이 발생하는 경우 역시 흔하지 않으며(0.37%) 이는 사망률의 유의한 증가를 야기하므로 신중히 치료되어야 한다[
5]. 심방조동이 하나의 거대 회귀로에 의해 발생하는 반면에 심방세동은 다수의 회귀파면(reentrant wave fronts)에 의해 발생한다[
2,
3].
심방조동과 심방세동은 흔한 부정맥으로써 인구 고령화에 비해서도 그 유병률이 더 많이 증가하고 있다. 최근 20세 이상의 환자들을 대상으로 한 대규모 연구에서 일시적인 리듬을 제외한 심방조동 및 심방세동의 유병률은 1.12%였으며 이중 91.6%가 심방세동 단독으로 진단되었고 2%는 심방조동, 나머지는 심방조동과 심방세동을 모두 가진 것으로 보고하였다[
4]. 또한, 대조군과 비교했을 때 심방조동 혹은 심방세동을 가진 환자군에서 심부전, 판막질환, 관상동맥 질환 등의 심장 질환뿐 아니라 허혈성 뇌졸중, 말초 혈관 질환, 폐질환, 당뇨병, 고혈압, 갑상선 항진증을 제외한 갑상선질환의 유병률이 유의하게 높은 것으로 나타났으며 65세 이상에서는 나이 증가에 따라 급격히 증가하였고 남성에서 더 많은 빈도를 보였다[
4]. Amar는[
6] 주술기에 이러한 빈맥성 심방 부정맥을 야기하는 악화인자로써 심방과 동방결절을 지배하는 자율신경 섬유에 대한 수술에 의한 직접적인 손상, 교감신경계의 항진을 의미하는 수술 전후의 높은 심박수, 노화에 의한 심근의 염증성 변화, 조기심방수축 등을 제기하였다.
본 증례에서 심방조동 발생과 관련된 위험요인으로는 고령, 고혈압, 당뇨, 경미한 삼첨판 역류와 동반된 폐동맥고혈압, 마취유도 전 빈맥을 생각해 볼 수 있다. 자율신경계의 작용도 심방조동의 발생과 연관이 있다고 알려져있는데 Kwak 등[
1]은 부정맥의 심혈관적 위험요소가 없고 술전 정상 심전도 소견의 55세 환자에서 복강경 위절제술 시 복압이 증가하면서 심방조동이 발생한 경우를 보고하였다. 이는 기저질환이 없는 경우에도 자율신경계의 활성에 의해 심방조동이 발생할 수 있음을 의미한다. 발작성 심방조동이 나타나는 환자들을 대상으로 시행한 심박수 변동성(heart rate variability, HRV)을 분석한 결과, 심방조동이 발생하기 수분 전에 교감신경의 활동성을 시사하는 저주파 요소(low frequency component)와 고주파 요소(high frequency component)에 대한 저주파 요소의 비가 증가하였고 부교감신경의 활동성을 시사하는 고주파 요소는 감소를 보였다[
7]. 정신적 스트레스도 교감신경계의 활성화를 가져오는 norepinephrine, epinephrine을 증가시키면서 부교감신경의 억제와 관계된 고주파 요소를 감소시키게 된다[
8]. 이러한 자율신경계의 변화는 심근탈분극의 변화를 야기시켜 부정맥의 원인이 될 수 있다. 본 증례의 환자는 수술 전날 방문하였을 때 수술에 대한 불안이나 긴장은 없어 보였다. 그러나 수술실 도착 전후 환자 및 수술 확인과정과 감시장비를 부착하는 과정에서 불안과 스트레스가 증가할 수 있으며 마취 유도 전 100회 이상의 빈맥을 보인 것으로 보아 불안에 의해 교감신경계가 항진되어 있을 가능성이 있고 이로 인해 심방조동의 발생이 촉진되었을 것으로도 추정할 수 있으나 명확하지는 않다. 마취유도 전에 빈맥을 유발할 수 있는 원인으로 불안에 의한 교감신경계의 항진 이외에 금식 등에 따른 저혈량증을 완전히 배제할 수 없다. 그 외 고열, 감염, 갑상선 기능 항진증 등이 빈맥을 유발할 수 있으나 본 환자의 혈액검사 및 활력징후 상 정상이어서 이는 배제할 수 있을 것으로 생각된다. 통증 또한 교감신경계를 항진시킬 수 있는데 마취유도에 사용된 약제 중 propofol과 rocuronium은 투여시 통증을 유발할 수 있다. 본 환자의 경우 propofol 투여 전에 lidocaine을 먼저 투여하였고 propofol, rocuronium 투여 중에 환자가 통증을 느낄 때 발생할 수 있는 움직임이 없었으므로 약제로 인한 통증이 교감신경계를 항진시켰을 가능성은 낮아 보인다. 그 외에도 마취전 투약으로 glycopyrrolate가 근주되었는데 이로 인한 미주신경의 작용 약화도 심방조동 발생에 영향을 줄 수 있었을 것이다. 본원에서는 고령의 환자에서 마취전 방문 시 불안을 호소하는 경우에만 benzodiazepine 계열의 진정제를 마취 전 투약하고 있다. 이는 진정제의 투여가 종종 과다진정을 보이며 저명한 불안해소 효과는 없다고 판단하기 때문이다[
9]. 하지만 부정맥의 고위험 환자에서는 수술 전 스트레스로 인해서도 심방성 부정맥이 발생할 수 있으므로 수술 전 불안의 정도를 평가하여 적절한 마취전 진정요법을 시행하는 것이 도움이 될 수 있을 것으로 생각된다.
심방조동과 심방세동은 비슷한 발생위험 인자를 가지고 있고 병태생리학적으로 밀접한 상관관계가 있다고 여겨지고 있으며 한 환자에서 서로 전환되어 나타날 수 있다. 대부분 심방세동이 심방조동에 선행하여 나타나나 본 증례처럼 심방조동이 먼저 나타나고 심방세동이 발생할 수 있다. 심방조동에서 심방세동으로의 자발적 전환의 정확한 기전은 아직 명확하지 않다. 그러나 여러 동물실험 및 임상연구의 결과, 우심방 자유벽에 위치한 기능성 차단선길이(length of line of functional block)의 변화나 서행 전도구역(slow conduction zone)의 소실[
2], 심방조동 회로의 갑작스런 활성순서의 변화[
10], 폐정맥이나 분계능선(crista terminalis) 및 상대정맥 부근의 이소성 박동(ectopic beats)의 활성화[
11] 등이 관여하는 것으로 알려져 있다. 또한 심방조동 회귀로의 순환길이가 짧아지면서 매우 빠른 심방속도를 갖는 심방조동이 지속될 경우, 심방의 세동성 전도를 활성화시켜 심방세동을 유발시킬 수 있는 것으로 밝혀졌는데[
12] 본 증례에서도 심박수 분당 149회 이상의 심방조동이 40분 이상 지속된 후 심방세동으로의 전환을 보여 빠른 심방박동으로 인해 심방세동이 야기되었을 가능성을 생각해 볼 수 있겠다.
심방조동과 심방세동의 치료는 크게 심박수 조절, 동율동 전환과 유지, 혈전 예방으로 나눌 수 있다. 심박수 조절 약물로 베타차단제, 칼슘통로차단제, amiodarone, digoxin 등이 있으며 혈역학적으로 불안정한 경우에는 전기율동전환이 효과적이다. 동율동 전환은 심박수 조절 약물을 사용하였음에도 불구하고 심실박동 횟수가 빠른 경우 추천되며 화학적 율동전환과 전기적 율동전환으로 나눌 수 있다. 화학적 율동전환에 쓰이는 약물로는 flecainide, dofetilide, propafenone, ibutilide, amiodarone 등이 있다. 본 증례에서 마취유도 직후 심방조동이 발생하였을 때와 그 이후에도 수축기 혈압이 80 mmHg 이하로 떨어진 것은 일시적이었고 지속적으로 수축기 혈압이 80 mmHg, 평균 동맥혈압이 60 mmHg 이상 유지되어 수술실에서는 전기 율동전환을 시행하지 않았으나 혈역학적으로 더 불안정하였다면 전기 율동전환을 시행하여야 했을 것으로 보인다. 본 환자는 과거력상 부정맥의 경력이 없고 수술 전에 시행한 심전도와 심초음파 상에도 심방성 부정맥이 없고 구조적 이상이 없었기 때문에 수술실에서 발생한 심방조동이 회복실에서 전환되어 처음으로 심방세동이 발생한 것으로 보았으며 amiodarone의 지속정주에도 반응하지 않아 즉각적인 동성리듬의 회복을 위해 순환기내과와의 협진하에 전기적 율동전환을 시행하였다.
전기적 율동전환을 시도할 때에는 환자 상태에 따른 적절한 혈전 예방이 필요하다. 심방조동이나 심방세동의 발생이 48시간 이상 지났거나 발생 시간을 알지 못할 때에는 동율동 전환 전 3주, 동율동 전환 후 4주 동안의 wafarin (INR 2.0–3.0) 사용이 추천되고 있다. 발생 시간이 48시간 미만일 때에는 뇌졸중 위험이 높은 환자에게는 항혈전 치료가 필요하나 위험성이 낮은 환자에게는 동율동 전환 전후 뿐 아니라 이후에도 항응고 요법이 필요치 않다[
13]. 판막질환 없이 심방조동이나 심방세동이 발생한 환자에서 뇌졸중의 위험을 평가하는 지표로써 울혈성심부전(congestive heart failure), 고혈압, 고령(65세 이상), 당뇨, 뇌졸중 과거력, 이전의 심근경색 등의 혈관질환 과거력, 성별(여성)로 이루어진 CHA2DS2-VASc 점수를 활용하는데 2점 이상이면 고위험군에 속한다[
13]. 본 증례의 환자는 65이상의 고령으로 1점, 고혈압 1점, 당뇨 1점, 뇌졸중 과거력 2점으로 총 5점이기 때문에 전기적 율동전환 전후로 항혈전제 사용이 필요하였다. 따라서 전기적 율동전환 직전 midazolam과 함께 heparin을 정주한 후에 전기적 율동전환을 시행하였고 시술 후에는 원래 복용하던 clopidogrel을 복용하였으므로 추가로 항혈전제를 복용하지는 않았다.
본 증례에서는 지속적인 심방조동으로 심박수가 조절되지 않는 상황에서 부정맥에 미치는 영향을 최소화하기 위해 근이완 역전용으로 sugammadex를 사용하였다. 통상적으로 근이완 역전을 위해 사용되는 항콜린에스테라제-항콜린성 약물(anticholinesterase-anticholinergic durgs)의 조합은 심박수에 영향을 줄 수 있으므로 심혈관질환이 있는 환자에서는 주의가 요구된다. Dahl 등은[
14] 심장질환이 있는 환자에서 sugammadex를 4 mg/kg까지 투여하였을 때 QTc간격과 심전도에 영향을 주지 않았고, 2 mg/kg 투여 시에는 위약대조군에 비해 초기에는 심박수를 유의하게 낮추며 투여 30분 후에는 혈압을 증가시키는 작용이 있는 것으로 보고하였다. 이는 sugammadex가 심혈관 질환을 가진 수술 환자에서 근이완 역전을 위해 안전하게 사용될 수 있음을 의미한다.
결론적으로 저자들은 후두개곡 양성종양 제거술을 위한 전신마취 환자에서 마취유도 직후 술전에 발견되지 않은 심방조동이 새로이 발생하였고 이후 심방세동으로의 전환을 경험하였다. 마취유도 직후 새로이 발생한 심방조동은 본 증례보고가 처음이며 이러한 심방조동이 심방세동으로의 자발적인 전환을 보인 보고도 처음으로 사료된다. 여러 요인들에 의해 주술기에 새롭게 발생하는 심방조동과 심방세동은 서로 전환될 수 있음을 인지하고 이에 적절한 평가와 처치를 할 수 있도록 숙지하여야겠다. 부정맥의 위험인자가 있는 환자에서는 기저질환에 의해서 뿐만 아니라 술전 긴장이나 불안, 자율신경계의 변화 등에 의해서도 빈맥성 심방 부정맥이 나타날 수 있으리라 사료된다. 따라서 환자 개개인에 맞게 진정제와 항콜린성 약제의 이익과 위험성을 평가하여 마취전 투약에 신중을 기하여야 하겠다.
Go to :


