Abstract
Chronic rhinosinusitis is a common chronic inflammatory condition of sinonasal cavities and occurs with or without nasal polyps. Uncontrolled chronic rhinosinusitis with nasal polyp (CRSwNP) has a negative impact on an individual’s quality of life. Many studies have been conducted for novel treatments targeting type 2 cytokines involved in CRSwNP such as interleukin (IL)-4, IL-5, IL-13 and immunoglobulin E. Biologics have recently been proven to improve the nasal symptoms of CRSwNP and reduce the need for systemic glucocorticosteroids. Recently dupilumab, omalizumab and mepolizumab were approved by Food and Drug Administration for CRSwNP, and other biologics are under investigation. Large-scale and long-term clinical trials are needed for therapeutic effectiveness, and several questions remain regarding patient selection, treatment algorithm, and cost-effectiveness. Nevertheless, emerging biologics may offer a new therapeutic option for uncontrolled CRSwNP.
만성 비부비동염은 비과 질환에서 흔한 염증성 질환으로 전 세계 성인의 5%-12%에 영향을 미치며, 우리나라에서도 유병률이 전체 인구의 약 8.4%로 알려져 있다[1,2]. 일반적으로 만성 비부비동염은 표현형에 따라 비용종을 동반하는 만성 비부비동염(chronic rhinosinusitis with nasal polyp, CRSwNP)과 비용종을 동반하지 않는 만성 비부비동염(chronic rhinosinusitis without nasal polyp, CRSsNP)으로 분류한다[2]. 만성 비부비동염의 약 80%에서 비용종을 동반하지 않지만, 비용종을 동반하는 만성 비부비동염에서는 임상증상이 심하고 치료가 어렵다[3]. 수술과 약물 등의 고전적인 치료만으로 조절되는 경우도 있지만, 부비동 내시경수술 후에 16.2%에서 비용종이 재발하며[4], 경구 스테로이드는 장기간 사용으로 인한 부작용 때문에 지속적으로 사용 가능하지 않다. 이처럼 조절되지 않는 CRSwNP의 치료에서 발생하는 어려움 때문에 기존의 치료 방법 외에 새로운 치료 방법을 개발하고자 하는 노력이 계속되고 있다.
생물학적 제제는 생물체에서 유래한 물질이나 생물체를 이용하여 생성한 물질을 함유한 의약품으로서 염증성 질환의 병태생리 내에서 특정 분자경로를 표적으로 한다. 지난 15년간 생물학적 제제는 호산구성 천식이나 아토피 피부염, 만성 두드러기 등과 같은 만성 염증성 질환에서 승인되어 사용되어 왔으며, 특히 항immunoglobulin E (IgE) 제제는 중증 천식 환자의 1차 요법으로 사용되고 있다[5]. 천식을 동반한 비부비동염 환자는 천식을 동반하지 않은 환자보다 비부비동염의 중증도 점수가 높고 비용종 발생률이 더 높으며[6,7], 비용종과 천식 사이의 강한 연관성으로 인하여 천식 환자에서 좋은 결과를 보인 생물학적 제제가 천식을 동반한 CRSwNP 환자의 치료로 제시되었다[8]. 이후 다양한 단일클론항체에 대하여 CRSwNP의 치료 효과를 분석하는 연구가 진행되었고, 항interleukin (IL)-4 receptor α 단일클론항체인 dupilumab과 항IgE 단일클론항체인 omalizumab, 그리고 항IL-5 단일클론항체인 mepolizumab가 미국 Food and Drug Administration (FDA)에서 승인을 받았다. 생물학적 제제가 시장에 출시됨에 따라 현재의 CRSwNP의 치료 알고리즘이 바뀌어야 할 필요가 있고, 생물학적 제제에 적합한 환자를 선정하고 비용-효과적인 면을 고려하여 현재의 의료 시스템을 반영해야 할 필요가 있다[9].
만성 비부비동염은 하나의 획일화된 질환이 아니라 다양한 내재형으로 구성된 질환으로, CRSwNP에서도 내재형이 서로 다르며 임상양상 및 치료에 반응하는 정도도 다양하다[10]. 따라서 CRSwNP의 병태생리와 내재형을 이해하는 것이 생물학적 제제를 연구하는 출발점이다. 본 종설에서는 CRSwNP의 병태생리와 내재형에 대하여 기술하고 현재까지 연구 중인 생물학적 제제와 미래의 연구 대상이 될 생물학적제제에 대해 살펴보고, 앞으로의 치료 알고리즘과 연구 방향 등을 제시하고자 한다.
만성 비부비동염과 비용종의 병태생리는 아직 완전히 밝혀지지 않았지만, 만성 비부비동염의 면역반응은 크게 세 가지의 염증경로와 내재형으로 분류한다. T helper cell type 1 (Th1), Th2 그리고 Th17 등 3가지의 조력 T세포는 각각 특정 사이토카인의 생성을 촉진하여 만성 염증상태로 이어지며, 각각을 제1형, 제2형 및 제3형 염증반응이라고 한다(Fig. 1) [11]. 제1형 염증반응의 활성화는 비용종을 동반하지 않는 만성 비부비동염의 주요한 기전으로, 호중구 침윤이 특징이고 myeloperoxidase, interferon (IFN)-γ, IL-2 및 tumor necrosis factor (TNF)-α 등과 연관이 있다[12,13]. 제2형 염증반응은 호산구성 비용종을 동반하는 만성 비부비동염의 주요 병태생리로서 호산구 혹은 IL-4, IL-5, IL-13 그리고 IgE와 같은 신호 전달물질의 불균형 또는 과잉 생산이 특징이다[11]. 최근에는 Th2 세포뿐만 아니라 type 2 innate lymphoid cell (ILC2)가 CRSwNP 조직에서 발현되고, thymic stromal lymphopoietin (TSLP), IL-25, IL-33 등에 의하여 자극받아 IL-4, IL-5와 IL-13을 생산하는 등 Th2 세포와 매우 비슷한 기능을 하는 것으로 밝혀졌다[14]. 따라서 IL-4, IL-5와 IL-13 등은 Th2 사이토카인보다는 제2형 사이토카인으로 불리는 것이 더 적합하며, CRSwNP에서 매우 중요한 바이오마커이다[11]. 제3형 염증반응은 Th17 세포에 의한 IL-6, IL-17, IL-22 및 TNF-α 등의 높은 수치와 연관이 있고, 호중구 세포의 침윤이 두드러진 비호산구성 비용종을 동반한 만성 비 부비동염과 관련 있다[12,13].
CRSwNP은 서양인에서 대부분 제2형 염증반응에 의하여 호산구성 비용종을 동반한 만성 비부비동염으로 나타나며 천식이 주로 동반되는 특성을 지니고 있지만, 동양인의 CRSwNP은 40%-60%에서 제3형 염증반응에 의한 비호산구성 비용종을 동반한 만성 비부비동염으로 나타나며 천식을 잘 동반하지 않는다[15,16]. 우리나라를 포함한 동양인의 경우 CRSwNP 내에서도 다른 내재형을 갖고 있어 그에 따라 질병의 본질, 임상양상 및 치료 방법 등이 완전히 달라질 수 있다. 따라서 CRSwNP의 내재형을 이해하고 이를 통해 환자를 분류하는 것은 환자 개개인에 맞춤화된 치료에 중요하다.
CRSwNP의 고전적인 치료방법으로는 전신 혹은 비강내 국소 스테로이드제 사용과 부비동 내시경수술이 있으나, 추후 재발하는 등 조절하기 어려운 경우가 많아 대체요법이 필요하다. CRSwNP 병태생리에 대한 이해가 발전하면서 만성 염증의 연결고리를 끓을 잠재력을 갖고 있는 효과기 세포나 염증 매개체를 밝히고 이를 표적으로 하는 단일클론항체에 대한 연구가 진행되고 있다.
생물학적 제제는 천식이나 아토피 피부염 등과 같은 다양한 알레르기-매개 질환에 대한 혁신적인 치료법으로 사용되어 지난 15년 동안 고무적인 결과를 보였고[7], CRSwNP의 병태생리는 천식의 병태생리와 겹치는 부분이 많다. 두 질환의 병태생리가 모두 제2형 염증반응 및 호산구 침윤이라는 부분이 공통점이며, 최근 수년간 CRSwNP에 대하여 개발되고 있는 여러 생물학적 제제는 제2형 염증반응을 억제하는 역할을 한다[17-19]. 현재 호산구성 CRSwNP에 대한 여러 단일클론항체가 연구 중이며, 조절되지 않는 CRSwNP에서 치료 효과를 보이고 있다(Table 1). 대표적으로 IL-4 receptor α에 대한 단일클론항체인 dupilumab은 치료 효과를 인정받아 2019년 6월에 미국 FDA의 승인을 받았으며, 조절되지 않는 성인 CRSwNP에서 사용할 수 있다. 이후 IgE를 표적으로 작용하는 단일클론항체인 omalizumab과 IL-5에 대한 단일클론항체인 mepolizumab도 성인 CRSwNP 환자를 치료하기 위한 보조요법으로 각각 2020년 12월과 2021년 7월에 미국 FDA의 승인을 받았다. 그 외 다른 단일클론항체들은 아직 FDA의 승인을 받지는 못하였으나 효능과 안전성에 대해 평가 중이다.
현재까지 비호산구성 CRSwNP에 대하여 연구중인 생물학적 제제는 없다. 앞서 언급했듯이 우리나라 CRSwNP 환자의 절반 정도가 호중구 침윤이 특징인 비호산구성 비용종을 동반한 CRSwNP 환자이다. 따라서 현재 개발 중인 생물학적 제제가 우리나라 CRSwNP 환자의 치료에 갖고 있는 한계점이 있으며, 현재 개발된 생물학적 제제를 치료로 사용할 때 적합한 내재형의 환자를 선별하는 것이 중요하다.
IgE는 항원에 대한 반응으로 B세포에 의하여 생성되며, Th2 세포에 의하여 분비되는 사이토카인인 IL-4와 IL-13의 영향을 받는다. IgE는 비만세포에 발현하는 FcεRI와 CD23 등의 수용체에 결합하여 히스타민 등 기형성된 매개체를 분비하고 cysteinyl leukotriene과 prostaglandin 등을 생성한다[20]. Omalizumab은 IgE에 대한 단일클론항체로서 유리 IgE에 부착하여 IgE가 비만세포에 결합하는 것을 억제한다. Omalizumab은 비교적 연구가 많이 진행된 생물학적 제제로 천식과 같은 알레르기 질환의 치료에 효과적이며[21], 2003년에는 코르티코스테로이드 흡입치료로 적절히 조절되지 않는 12세 이상의 중등도 및 중증 천식 환자에게 omalizumab을 사용할 수 있도록 FDA 승인을 받았다. 이후 CRSwNP에 대한 omalizumab의 치료 효과를 발표한 연구 중 대표적인 무작위 대조군 연구는 다음과 같다. Gevaert 등[18]은 이중맹검 무작위 대조군 연구에서 24명의 중증 천식이 있는 CRSwNP 환자를 대상으로 2주 또는 4주 간격으로 총 16주 동안 혈청 총 IgE와 체중에 따라 omalizumab을 피하주사하여(최대 375 mg) 8명의 대조군과 비교하였다. 대조군에 비하여 치료군에서 비용종 점수가 감소하고 코증상 점수가 호전되는 등 유의미한 치료 효과를 보였다. 하지만 이 연구는 천식을 동반한 CRSwNP 환자를 대상으로 하였기 때문에 결과를 모든 CRSwNP 환자로 일반화할 수 없는 한계점이 있다[18].
지난 2020년 12월에 omalizumab은 18세 이상의 CRSwNP 환자를 치료하기 위한 보조 유지치료로 FDA 승인을 받았다. 이를 가능하게 한 것이 Gevaert 등[22]이 보고한 대규모 3상 임상시험인 POLYP-1과 POLYP-2이다. 비강 내 스테로이드 치료에 치료 효과가 없는 CRSwNP 환자 138명과 127명을 대상으로 하여 omalizumab 치료군과 위약군을 비교하였다. 24주간의 치료 후에 두 그룹 모두 omalizumab 치료군에서 대조군에 비해 비용종 점수 및 코막힘 점수가 유의하게 감소하였고, Sino-Nasal Outcome Test 22 (SNOT-22), University of Pennsylvania Smell Identification Test (UPSIT) score, 총 코증상 점수 및 후각 소실, 후비루, 콧물 점수 등에서도 유의한 치료 효과를 보였다. 부작용으로는 두통, 비인두염, 주사부위의 문제(발적, 통증 등) 및 천식 악화 등이 보고되었으나, 치료군과 대조군에서 유의한 차이를 보이지 않았다.
IL-5는 호산구의 국소 유입, 성숙 및 생존을 조절하는 제2형 사이토카인으로서, Th2 세포, 비만세포 및 ILC2 세포 등에 의하여 분비된다[23]. Tomassen 등[24]은 만성 비부비동염의 표현형과 다양한 면역 사이토카인과의 관계에 대하여 분석하여 비용종과 IL-5의 연관성을 확인하였다. 만성 비부비동염 환자를 IL-5의 수치에 따라 높은 군, 중등도 군 및 낮은 군 등 3개의 군으로 분류하였고, 높은 군에서 비용종 및 천식의 유병률이 가장 높았고, 낮은 군에서는 대부분 비용종을 동반하지 않았다. 따라서 천식 환자의 치료와 마찬가지로 CRSwNP 환자에 대하여 생물학적 치료의 타겟으로 IL-5를 연구하였다.
CRSwNP 환자의 치료제로 연구된 IL-5에 대한 항체는 mepolizumab, reslizumab, 그리고 benralizumab 등이 있다. Mepolizumab과 reslizumab은 IL-5에 대한 단일클론항체로서 IL-5에 결합하여 신호를 억제하고, 반면 benralizumab은 IL-5 수용체에 작용한다[25]. 2006년에 Gevaert 등[26]이 CRSwNP 환자에 대한 reslizumab의 치료 효과를 실험한 연구에서 대조군에 비교하여 치료군의 비용종 점수와 혈액 내 호산구가 유의하게 감소하였다. 또한 치료 효과를 보인 환자에서 치료 효과가 없는 환자에 비해 코 분비물의 IL-5가 증가하였고, 따라서 증가되어 있는 IL-5는 항IL-5의 치료 효과를 예측할 수 있는 요인이라고 설명하였다. 2011년 보고된 mepolizumab에 대한 연구에서는 mepolizumab 750 mg을 28일 간격으로 2차례 정맥주사한 후 48주간 추적 관찰하며 대조군과 비교하였고, 치료군에서 비용종 크기와 CT 점수 모두 대조군에 비교하여 현저히 감소하였다[27]. 이후 2017년에 Bachert 등[28]은 mepolizumab을 이용한 더 큰 규모의 임상연구를 보고하였다. 국소 스테로이드제 치료에 반응이 없는 105명의 CRSwNP 환자에 mepolizumab 750 mg을 4주 간격으로 24주간 정맥 주사하여 대조군과 비교하였고, 치료군에서 내시경 비용종 점수, 비용종 시각 아날로그척도 점수, 코증상 점수 및 SNOT22 등에서 유의한 호전을 보였고 궁극적으로 수술이 필요한 환자의 수가 감소하였다[28].
Mepolizumab과 benralizumab은 12세 이상의 심한 호산구성 천식 환자에서 추가 유지치료로 사용할 수 있도록 각각 2015년과 2017년에 FDA로부터 승인을 받았고, reslizumab은 18세 이상의 심한 천식 환자에 대한 유지치료제로서 2016년에 FDA의 승인을 받았다. 이후 Han 등[29]의 대규모의 3상 임상시험의 결과를 바탕으로 mepolizumab은 2021년 7월에 성인 CRSwNP 환자의 보조치료로 사용할 수 있도록 미국 FDA의 승인을 받았다. 조절되지 않는 CRSwNP 환자 407명을 대상으로 206명은 mepolizumab을 4주 간격으로 총 52주간 100 mg 피하주사하였고 201명은 위약을 투약하였다. Mepolizumab 치료군에서 대조군에 비교하여 비용종 점수가 유의하게 감소하였고 비폐색 점수도 유의하게 호전되었다. 그리고 대조군에서 부비동 수술과 전신적 스테로이드 투약이 필요한 경우가 유의하게 적었으며, SNOT-22, 코증상 시각 아날로그 척도 점수 및 후각 소실 등에서도 유의하게 호전되었다. 그러나 mepolizumab 치료를 받은 그룹에서 치료와 관련된 중대 이상반응은 보고되지 않았다.
IL-4와 IL-13은 IL-5와 마찬가지로 제2형 염증반응의 사이토카인으로 B세포 활성화와 IgE와 같은 면역글로불린의 국소 생산을 통해 Th2 반응을 촉진한다[30,31]. Dupilumab은 IgG4 단일클론항체로서, IL-4 receptor α 수용체 서브유닛에 특이적으로 결합하여 IL-4 및 IL-13 신호전달을 차단한다[32]. 제2형 염증반응의 조절에 효과적이며 2019년 6월에 dupilumab은 조절되지 않는 성인 CRSwNP 환자의 치료로 FDA 승인을 받았다. 이는 CRSwNP 환자의 치료에 대하여 가장 먼저 FDA 승인을 받은 생물학적 제제이다.
Bachert 등[33]은 2016년도에 처음으로 CRSwNP 환자에서 dupilumab 치료 효과를 보고하였다. 미국과 영국에서 양측 비강의 심한 비용종 소견을 보이는 60명의 성인 CRSwNP 환자를 대상으로 연구하였고, 대조군에 비하여 치료군에서 유의하게 SNOT-22, 후각, 코막힘 및 울혈, 비용종 점수 및 천식 조절 등의 항목에서 개선을 보였고 심각한 부작용은 없었다. 2019년에는 dupilumab의 효능과 안전성을 조사한 두 개의 대규모 다기관 무작위 대조군 연구가 보고되었다[34]. SINUS-24 임상연구에는 총 276명의 환자가 등록되었고, 143명은 dupilumab을 2주마다 24주간 투약하였고 133명은 위약군이었다. SINUS-52 임상연구에는 448명의 환자가 등록되었으며, 150명의 환자는 2주마다 52주 동안, 145명의 환자는 2주마다 24주 투약 후 4주씩 총 52주, 나머지 153명은 위약군이었다. Dupilumab으로 치료를 받은 그룹에서 위약군에 비하여 비용종 크기, Lund-Mackey 점수, 코막힘, 울혈 및 후각 등에서 유의하게 좋은 결과를 보여 추가적인 전신 스테로이드제 사용이나 수술적 치료의 필요성이 감소하였다. 비인두염, 천식 악화, 두통, 코피 등의 부작용이 오히려 위약군에서 더 많이 보였다. 그러나 임상시험에 대한 포함 기준은 경구 스테로이드제 혹은 부비동수술에 실패한 중증 CRSwNP 환자로 제한되었기 때문에 경증 및 중등도 CRSwNP 환자에서 dupilumab 치료의 효과나 역할에 대한 것은 명확하지 않다. 따라서 최선의 치료 과정을 결정하기 위해서는 사전에 받은 치료나 환자의 선호도, 치료 비용 및 질병 중증도 등을 고려하여 심층적이고 개별화된 논의가 필요하다.
생물학적 제제의 치료효과를 보고한 임상시험의 결과를 바탕으로 각 생물학적 제제를 비교하고자 하는 연구가 보고되었다. 비록 생물학적 제제들을 직접적으로 비교한 것은 아니지만, Helling 등[35]은 omalizumab, mepolizumab, 그리고 dupilumab에 대한 2상 및 3상 임상시험의 결과를 바탕으로 세 가지 생물학적 제제의 치료 효과를 간접적으로 비교 분석하였다. SNOT-22, 코막힘 점수, 후각 소실 점수, 후각 검사 점수, Lund-Mackay CT 점수 및 비용종 점수 등 6가지 항목을 이용하였고, 세 가지 생물학적 제제 모두 조절되지 않는 CRSwNP 환자에서 각 항목에 대한 유의한 치료 효과가 있다고 결론지었다. 그 중에서 후각은 후각 소실 점수 및 후각 검사 점수 모두에 대하여 dupilumab의 효과가 다른 두 생물학적 제제보다 우수하다고 보고하였다. 각 연구들에서 사용한 증상의 측정 방법과 검사 방법들이 다르다는 한계점이 있고 후각 외에는 치료 효과가 의미 있는 차이를 보이지는 않 았지만, 궁극적으로 생물학적 제제 간의 직접적인 비교는 치료 프로토콜을 개선하는 데에 필요하며 추후 연구해야 할 부분이다.
TSLP는 상피세포-유래 사이토카인으로서 아토피 피부염, 기관지 천식 및 CRSwNP와 같은 Th2 관련 염증성 질환의 병인에 관여한다[36]. Wang 등[37]은 호산구성 CRSwNP 환자의 코상피세포를 분석하여, TSLP가 STAT3의 인산화를 촉진하여 Th2 염증 마커인 eotaxin-1의 발현을 증가시킴을 보고하였다. Nagarkar 등[36]은 TSLP가 비용종에서 증가하고 부비동 점막조직의 Th2 염증 마커와 상관관계가 있음을 분석하여 TSLP의 과잉생산이 CRSwNP의 병태생리에 기여한다고 보고하였다. Liu 등[38]도 94명의 CRSwNP 혹은 알레르기비염 환자를 대상으로 분석하여 비용종 환자의 코상피세포에서 TSLP가 높은 수준으로 관찰되며 CRSwNP의 병태생리에 TSLP가 관여한다고 주장하였다. 항TSLP 단일클론항체인 tezepelumab은 중등도 및 중증 천식 환자에서 효과가 있다는 2상 이중맹검 무작위 대조군 연구가 보고된 바는 있지만, 아직 CRSwNP 환자 내에서 효과를 조사한 연구는 없다[39].
CRSwNP 환자에서 생물학적 제제의 처방에 대한 가이드라인은 2019년에 European Forum for Research and Education in Allergy and Airway Diseases (EUFOREA)에서 제시하였다[9]. 크게는 부비동 수술을 받은 병력이 중요하며, 그 외에 다음 5가지의 기준을 근거로 생물학적 제제 사용을 결정하도록 가이드라인을 제시하였다. 세부적인 기준으로는 제2형 염증반응의 근거(생물학적 바이오마커)가 있는지, 과거 2년간 전신 스테로이드제 치료를 받은 적이 있는지, 심각한 삶의 질 장애가 발생하였는지, 후각 저하 유무, 천식 동반 유무 등의 5가지이다. 이후 European Position Paper on Rhinosinusitis and Nasal Polyps 2020 (EPOS 2020)에서 각각의 기준들에 대하여 구체적인 세부기준을 보완하여 처방 가이드라인을 다시 제시하였다(Fig. 2) [43].
부비동 수술을 받은 병력이 있는 CRSwNP 환자는 5가지 세부기준 중 3가지를 만족하면 생물학적 제제 치료의 적응증이 되며, 이는 EUFOREA와 EPOS 2020에서 모두 동일하다. 그러나 수술을 받은 병력이 없는 경우는 다소 논란의 여지가 있으며, 생물학적 제제가 수술의 필요성을 줄여줄 수 있을 정도로 치료 효과가 있는지가 불분명하기 때문이다. 최근 생물학적 제제로 치료하여 비용종의 크기와 정도에서 효과가 있었다는 연구들이 있으나, 실제로 많은 수의 환자에서 여전히 수술적 치료가 추가적으로 필요하다[44-46]. 그럼에도 불구하고 반복적인 수술적 치료만으로 제2형 염증반응에 의한 CRSwNP 환자의 재발성 비용종을 완전히 치료하거나 예방할 수 없기 때문에 생물학적 제제는 현재 수행되고 있는 부비동 수술의 대안이 될 것이라는 의견도 있다. 실제로 천식을 동반한 CRSwNP 환자에게 omalizumab과 수술군으로 나누어 비교한 연구에서 omalizumab 치료 16주 후에 SNOT-22 감소 정도는 수술군과 대등한 치료 효과를 보였다[47]. EUFOREA에서는 수술을 받은 병력이 없는 CRSwNP 환자에서 생물학적 제제의 역할은 어느정도 논란이 있을 수 있겠으나, 앞선 5가지 세부기준 중 4가지를 만족하면 생물학적 제제를 고려해볼 수 있다고 제시하였다. 반면에, EPOS 2020에서는 생물학적 제제의 적응증을 내시경 부비동수술을 받은 병력이 있는 CRSwNP 환자로 제한하고 있다. 한편, EUFOREA에서 제시한 생물학적 제제 치료의 대상이 될 수 없는 환자는 CRSsNP이거나 제 2형 염증반응의 증거가 없는 경우, 낭포성 섬유증 환자, 일측 비용종 환자, 점액낭종 환자, 면역저하자 등 생물학적 치료의 금기증이 있는 환자, 치료에 순응도가 좋지 않은 환자이다.
치료에 대한 반응을 평가하는 것도 치료에 적합한 환자를 선정하는 것만큼이나 중요하며, 생물학적 제제의 치료에 효과가 없는 경우에는 치료를 불필요하게 지속하는 것은 피해야 한다. EUFOREA에는 생물학적 제제 사용 중 평가포인트에 대한 가이드라인도 제시하였다[9]. 다섯 가지의 항목, 즉 비용종 크기 감소, 경구 코르티코스테로이드제 사용 감소, 삶의 증 향상, 후각 향상, 동반 질환들의 영향 감소 등을 제시하였고, 치료 16주 후에 측정하여 만족시키는 항목 수에 따라 치료반응 정도를 평가할 것을 제안하였다. 치료반응의 결과에 따라 치료를 유지할지 결정할 수 있으며, 16주라는 기준은 추후 연구에 따라 변경될 수 있다.
CRSwNP 환자의 치료제로 우리나라에서 사용 가능한 생물학적 제제는 DupixentⓇ (dupilumab; Regeneron Pharmaceuticals Inc., Tarrytown, NY, USA)과 XolairⓇ (omalizumab; Novartis, Basel, Switzerland) 두 가지이며, 둘 다 만 18세 이상 성인에서 기존치료에 적절하게 조절되지 않는 비용종을 동반한 만성 비부비동염의 추가 유지치료에 적용이 허가되었다. DupixentⓇ는 2주 간격으로 300 mg을 피하 주사하며 총 투여 기간은 정해져 있지 않다. XolairⓇ는 체중 및 초기 혈중 IgE 수치에 따라 1회 투여 용량이 75-600 mg으로 다르며, 2주 혹은 4주 간격으로 피하 주사한다. 아직까지 CRSwNP 환자에 대하여 두 약제는 모두 보험 비급여이며, 아토피 피부염 혹은 천식에 대해서만 조건을 만족할 경우 급여가 가능하다. 비급여 수가는 DupixentⓇ 300 mg이 710000원, XolairⓇ 150 mg이 271700원이며, 치료 간격이나 기간에 따라 상이하겠으나 1년에 400-1000만 원 이상의 비용이 드는 비교적 고가 치료 방법이다. 적응증은 비교적 폭넓게 제시가 되어 있지만 수술에 비하여 비용-효과적인 면에서 좋지 않은 것은 사실이며, 어떠한 환자군을 대상으로 투약할 지에 대하여 신중한 접근이 필요하다.
앞으로는 CRSwNP 환자 치료로 생물학적 제제의 역할을 정립하고 투약 방법, 투약 기간 및 종료 기준 등에 대한 연구가 필요하다. 여러 연구에서 2주 혹은 4주 간격으로 투약을 하였으나 치료 기간은 16주, 24주 및 52주 등으로 매우 상이하며, 총 치료 기간을 얼마로 예상하고 치료를 시작할지, 그리고 어떠한 기준으로 치료를 종료하는지 등에 대하여는 아직 제시되어 있지 않다. 따라서 이에 대한 추가적인 임상연구가 필요하고 우리나라 의료실정 및 환자 성격에 맞게 정립해야 할 필요가 있다. 그 외에도 수술 전에 대체치료로 시행하는 것과 수술 후에 유지치료로 시행하는 것에 대한 효과를 비교하고 환자에 따라 선택할 수 있는 기준을 제시하는 연구도 필요하다.
제2형 염증반응을 보이는 CRSsNP에 대한 생물학적 제제의 치료 효과, 생물학적 제제에 반응이 좋은 환자에서 바이오마커가 보이는 특징, 동양인에게 많은 비호산구성 CRSwNP 환자에 대한 효과적인 타겟 사이토카인 연구 등도 장기적으로 풀어야 할 숙제이다.
고전적인 치료로 조절하기 어려운 CRSwNP 환자 치료는 이비인후과 의사에게는 해결해야 할 과제이다. 생물학적 제제가 이러한 환자에게 새로운 치료가 될 수 있음을 보여주는 긍정적인 연구결과가 보고되고 있으며, dupilumab과 omalizumab은 잘 조절되지 않는 CRSwNP 환자를 대상으로 사용되기 시작하였다. 하지만 환자 선택과 치료 프로토콜 등에 대한 보완이 필요하며, 대규모의 장기간 추적 관찰 기간을 갖는 전향적인 연구가 향후 필요하다. 그럼에도 불구하고, CRSwNP의 치료 내에서 생물학적 제제의 역할과 치료 알고리즘이 정립되고 비용-효과적인 측면이 개선된다면, 생물학적 제제는 고전적인 치료로 조절되지 않는 CRSwNP 환자에 있어서 새롭고 효과적인 치료이다.
Notes
Author Contribution
Conceptualization: all authors. Data curation: Jee Won Moon. Formal analysis: all authors. Investigation: Su-Jong Kim, Jee Won Moon. Methodology: Heung-Man Lee. Project administration: Su-Jong Kim, Heung-Man Lee. Software: Jee Won Moon. Supervision: Heung-Man Lee. Validation: Heung-Man Lee. Visualization: Su-Jong Kim, Jee Won Moon. Writing—original draft: Su-Jong Kim. Writing—review & editing: Heung-Man Lee, Jee Won Moon.
REFERENCES
1. Ahn JC, Kim JW, Lee CH, Rhee CS. Prevalence and risk factors of chronic rhinosinusitus, allergic rhinitis, and nasal septal deviation: Results of the Korean National Health and Nutrition Survey 2008-2012. JAMA Otolaryngol Head Neck Surg. 2016; 142(2):162–7.
2. Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. EPOS 2012: European position paper on rhinosinusitis and nasal polyps 2012. A summary for otorhinolaryngologists. Rhinology. 2012; 50(1):1–12.

3. Benjamin MR, Stevens WW, Li N, Bose S, Grammer LC, Kern RC, et al. Clinical characteristics of patients with chronic rhinosinusitis without nasal polyps in an academic setting. J Allergy Clin Immunol Pract. 2019; 7(3):1010–6.
4. Loftus CA, Soler ZM, Koochakzadeh S, Desiato VM, Yoo F, Nguyen SA, et al. Revision surgery rates in chronic rhinosinusitis with nasal polyps: Meta-analysis of risk factors. Int Forum Allergy Rhinol. 2020; 10(2):199–207.

5. Busse WW. Anti-immunoglobulin E (omalizumab) therapy in allergic asthma. Am J Respir Crit Care Med. 2001; 164(8 Pt 2):S12–7.

6. Pauwels B, Jonstam K, Bachert C. Emerging biologics for the treatment of chronic rhinosinusitis. Expert Rev Clin Immunol. 2015; 11(3):349–61.

7. Fajt ML, Wenzel SE. Biologic therapy in asthma: Entering the new age of personalized medicine. J Asthma. 2014; 51(7):669–76.

8. Langdon C, Mullol J. Nasal polyps in patients with asthma: Prevalence, impact, and management challenges. J Asthma Allergy. 2016; 9:45–53.
9. Fokkens WJ, Lund V, Bachert C, Mullol J, Bjermer L, Bousquet J, et al. EUFOREA consensus on biologics for CRSwNP with or without asthma. Allergy. 2019; 74(12):2312–9.

10. Song Y, Cho SW. Biomarkers in chronic rhinosinusitis with nasal polyp: Personalized medicine based on endotype. Korean J Otorhinolaryngol-Head Neck Surg. 2019; 62(8):427–34.

11. Bachert C, Gevaert P, Hellings P. Biotherapeutics in chronic rhinosinusitis with and without nasal polyps. J Allergy Clin Immunol Pract. 2017; 5(6):1512–6.

12. Huang Z, Nayak JV, Sun Y, Huang Q, Zhou B. Peripheral blood T-helper cells and eosinophil populations in patients with atopic and nonatopic chronic rhinosinusitis. Am J Rhinol Allergy. 2017; 31(1):8–12.

13. Akdis CA, Bachert C, Cingi C, Dykewicz MS, Hellings PW, Naclerio RM, et al. Endotypes and phenotypes of chronic rhinosinusitis: A PRACTALL document of the European Academy of Allergy and Clinical Immunology and the American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2013; 131(6):1479–90.
14. Poposki JA, Klingler AI, Tan BK, Soroosh P, Banie H, Lewis G, et al. Group 2 innate lymphoid cells are elevated and activated in chronic rhinosinusitis with nasal polyps. Immun Inflamm Dis. 2017; 5(3):233–43.

15. Mahdavinia M, Suh LA, Carter RG, Stevens WW, Norton JE, Kato A, et al. Increased noneosinophilic nasal polyps in chronic rhinosinusitis in US second-generation Asians suggest genetic regulation of eosinophilia. J Allergy Clin Immunol. 2015; 135(2):576–9.

16. Yang JH, Kim DK. New discoveries regarding endotypes of chronic rhinosinusitis with nasal polyp. Korean J Otorhinolaryngol-Head Neck Surg. 2017; 60(9):431–6.

17. Hong CJ, Tsang AC, Quinn JG, Bonaparte JP, Stevens A, Kilty SJ. Anti-IgE monoclonal antibody therapy for the treatment of chronic rhinosinusitis: A systematic review. Syst Rev. 2015; 4:166.

18. Gevaert P, Calus L, Van Zele T, Blomme K, De Ruyck N, Bauters W, et al. Omalizumab is effective in allergic and nonallergic patients with nasal polyps and asthma. J Allergy Clin Immunol. 2013; 131(1):110–6. e1.

19. Pinto JM, Mehta N, DiTineo M, Wang J, Baroody FM, Naclerio RM. A randomized, double-blind, placebo-controlled trial of antiIgE for chronic rhinosinusitis. Rhinology. 2010; 48(3):318–24.

20. Bachert C, Zhang N, Hellings PW, Bousquet J. Endotype-driven care pathways in patients with chronic rhinosinusitis. J Allergy Clin Immunol. 2018; 141(5):1543–51.

21. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001; 108(2):184–90.

22. Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, et al. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020; 146(3):595–605.

23. Dennis SK, Lam K, Luong A. A review of classification schemes for chronic rhinosinusitis with nasal polyposis endotypes. Laryngoscope Investig Otolaryngol. 2016; 1(5):130–4.

24. Tomassen P, Vandeplas G, Van Zele T, Cardell LO, Arebro J, Olze H, et al. Inflammatory endotypes of chronic rhinosinusitis based on cluster analysis of biomarkers. J Allergy Clin Immunol. 2016; 137(5):1449–56.e4.

25. Kim C, Han J, Wu T, Bachert C, Fokkens W, Hellings P, et al. Role of biologics in chronic rhinosinusitis with nasal polyposis: State of the art review. Otolaryngol Head Neck Surg. 2021; 164(1):57–66.

26. Gevaert P, Lang-Loidolt D, Lackner A, Stammberger H, Staudinger H, Van Zele T, et al. Nasal IL-5 levels determine the response to anti–IL-5 treatment in patients with nasal polyps. J Allergy Clin Immunol. 2006; 118(5):1133–41.

27. Gevaert P, Van Bruaene N, Cattaert T, Van Steen K, Van Zele T, Acke F, et al. Mepolizumab, a humanized anti–IL-5 mAb, as a treatment option for severe nasal polyposis. J Allergy Clin Immunol. 2011; 128(5):989–95. e1-8.

28. Bachert C, Sousa AR, Lund VJ, Scadding GK, Gevaert P, Nasser S, et al. Reduced need for surgery in severe nasal polyposis with mepolizumab: Randomized trial. J Allergy Clin Immunol. 2017; 140(4):1024–31.e14.

29. Han JK, Bachert C, Fokkens W, Desrosiers M, Wagenmann M, Lee SE, et al. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2021; 9(10):1141–53.
30. Bakhshaee M, Fereidouni M, Nourollahian M, Movahed R. The presence of fungal-specific IgE in serum and sinonasal tissue among patients with sinonasal polyposis. Eur Arch Otorhinolaryngol. 2014; 271(11):2871–5.

31. Kariyawasam HH, James LK, Gane SB. Dupilumab: Clinical efficacy of blocking IL-4/IL-13 signalling in chronic rhinosinusitis with nasal polyps. Drug Des Devel Ther. 2020; 14:1757–69.
32. Bachert C, Zhang L, Gevaert P. Current and future treatment options for adult chronic rhinosinusitis: Focus on nasal polyposis. J Allergy Clin Immunol. 2015; 136(6):1431–40.

33. Bachert C, Mannent L, Naclerio RM, Mullol J, Ferguson BJ, Gevaert P, et al. Effect of subcutaneous dupilumab on nasal polyp burden in patients with chronic sinusitis and nasal polyposis: A randomized clinical trial. JAMA. 2016; 315(5):469–79.
34. Bachert C, Han JK, Desrosiers M, Hellings PW, Amin N, Lee SE, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): Results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019; 394(10209):1638–50.

35. Hellings PW, Verhoeven E, Fokkens WJ. State-of-the-art overview on biological treatment for CRSwNP. Rhinology. 2021; 59(2):151–63.

36. Nagarkar DR, Poposki JA, Tan BK, Comeau MR, Peters AT, Hulse KE, et al. Thymic stromal lymphopoietin activity is increased in nasal polyps of patients with chronic rhinosinusitis. J Allergy Clin Immunol. 2013; 132(3):593–600.e12.

37. Wang WW, Lu DM, Zheng M, Zhang JG, Zhang B. TSLP regulates eotaxin-1 production by nasal epithelial cells from patients with eosinophilic CRSwNP. Rhinology. 2018; 56(4):370–7.

38. Liu T, Zhao F, Xie C, Liu AM, Li TL, Chen X, et al. Role of thymic stromal lymphopoietin in the pathogenesis of nasal polyposis. Am J Med Sci. 2011; 341(1):40–7.

39. Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med. 2017; 377(10):936–46.

40. Kim DK, Jin HR, Eun KM, Mo JH, Cho SH, Oh S, et al. The role of interleukin-33 in chronic rhinosinusitis. Thorax. 2017; 72(7):635–45.

41. Song W, Wang C, Zhou J, Pan S, Lin S. IL-33 expression in chronic rhinosinusitis with nasal polyps and its relationship with clinical severity. ORL J Otorhinolaryngol Relat Spec. 2017; 79(6):323–30.

42. Luo X, Li C, Wang Y, Yang G, Xu Y, Li G, et al. Interleukin-33 promotes Th2/Th17 response in eosinophilic and non-eosinophilic nasal polyps. ORL J Otorhinolaryngol Relat Spec. 2020; 82(1):34–9.

43. Fokkens WJ, Lund VJ, Hopkins C, Hellings PW, Kern R, Reitsma S, et al. Executive summary of EPOS 2020 including integrated care pathways. Rhinology. 2020; 58(2):82–111.

44. Castro M, Corren J, Pavord ID, Maspero J, Wenzel S, Rabe KF, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018; 378(26):2486–96.

45. Farne HA, Wilson A, Powell C, Bax L, Milan SJ. Anti-IL5 therapies for asthma. Cochrane Database Syst Rev. 2017; (9):CD010834.

Fig. 1.
Overwiew of the pathophysiology of chronic rhinosinusitis and the target at which referred monoclonal antibodies act as inhibitors. CRSsNP, chronic rhinosinusitis without nasal polyps; CRSwNP, chronic rhinosinusitis with nasal polyps; IFN, interferon; Th1, T helper cell type 1; Th2, T helper cell type 2; Th17, T helper cell type 17; IL, interleukin; IgE, immunoglobulin E.
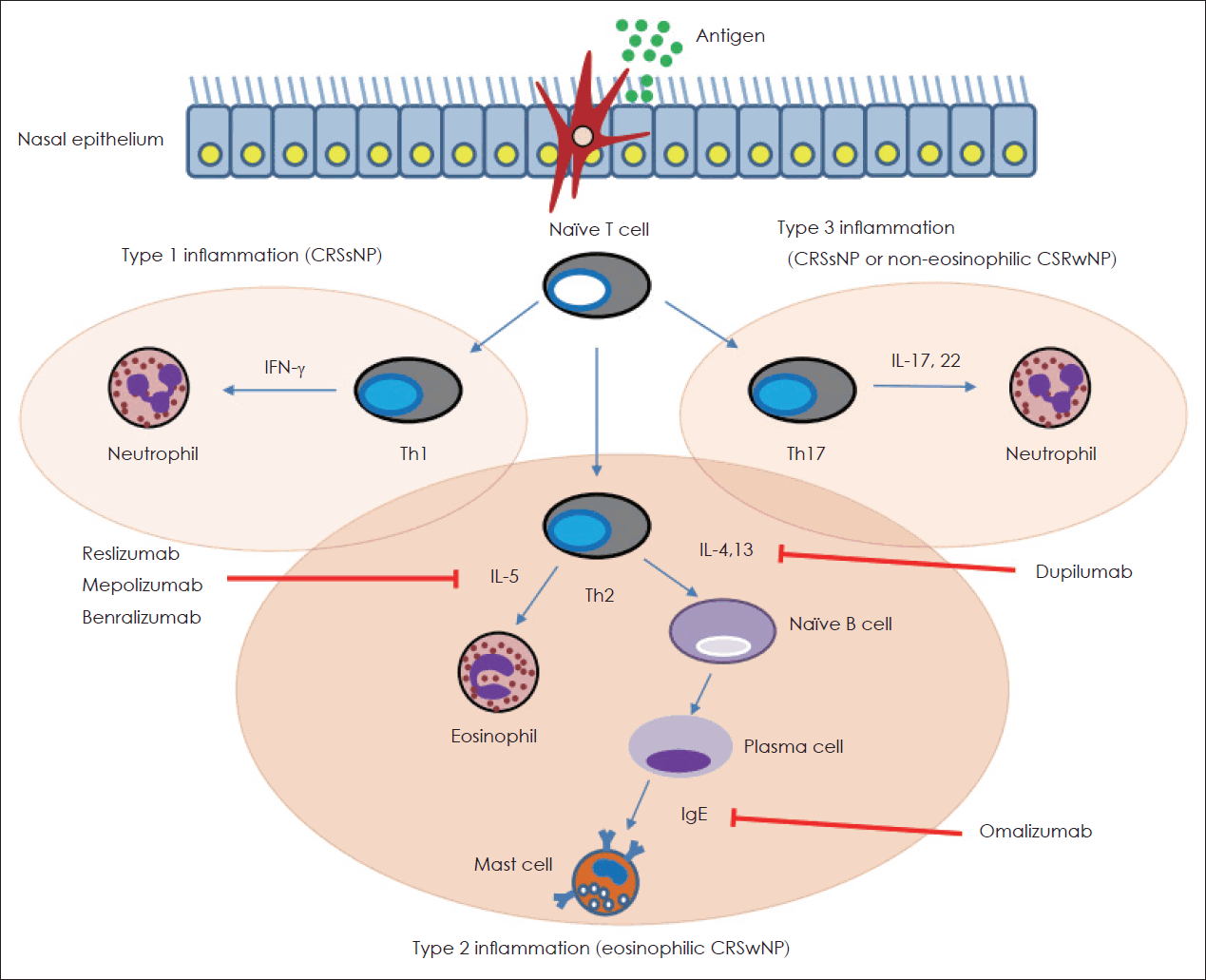
Fig. 2.
Indications for biologics in the treatment of CRSwNP; guideline of the EUFOREA and EPOS 2020. CRSwNP, chronic rhinosinusitis with nasal polyp; EUFOREA, European Forum for Research and Education in Allergy and Airway Diseases; EPOS, European Position Paper on Rhinosinusitis and Nasal Polyps.
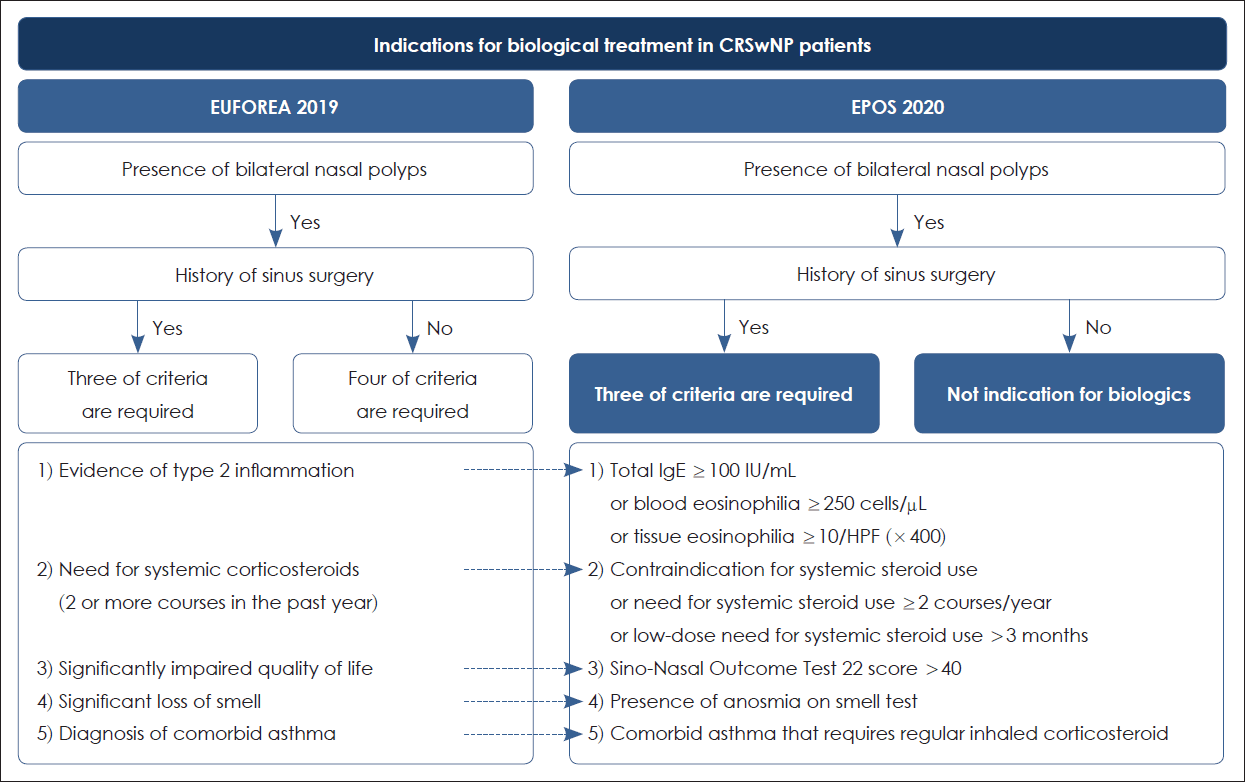
Table 1.
Studies on the treatment effects of biologics in chronic rhinosinusitis with nasal polyp
| Target | Monoclonal antibody | Author (years) | No. of subjects | Dosing frequency & period | Study design | Level of evidence | Outcomes |
|---|---|---|---|---|---|---|---|
| IgE | Omalizumab | Gevaert, et al. [18] (2013) | 24 | Every 2 weeks for a total of 16 weeks | RDBPC | 2b | ↓ NPS |
| ↓ Nasal symptom score | |||||||
| ↓ Quality of life score | |||||||
| Omalizumab | Gevaert, et al. [22] (2020) | POLYP-1 (138) | Every 2 or 4 weeks for a total of 24 weeks | RDBPC | 1b | ↓ NPS | |
| POLYP-2 (127) | ↓ Nasal congestion score | ||||||
| ↓ SNOT-22 score | |||||||
| ↑ UPSIT score | |||||||
| IL-5 | Reslizumab | Gevaert, et al. [26] (2006) | 24 | Initial single dose & follow-up for 36 weeks | RDBPC | 2b | ↓ NPS |
| ↓ Blood eosinophil counts | |||||||
| ↓ Concentrations of eosinophil cationic protein | |||||||
| Mepolizumab | Gevaert, et al. [27] (2011) | 30 | 2 single injection & follow-up for 48 weeks | RDBPC | 2b | ↓ NPS | |
| ↓ CT score | |||||||
| Mepolizumab | Bachert, et al. [28] (2017) | 105 | Every 4 weeks for a total of 24 weeks | RDBPC | 1b | ↓ NPS | |
| ↓ Requiring surgery | |||||||
| ↓ VAS symptom scores | |||||||
| ↓ SNOT-22 score | |||||||
| Mepolizumab | Han, et al. [29] (2021) | 407 | Every 4 weeks for a total of 52 weeks | RDBPC | 1b | ↓ NPS | |
| ↓ Nasal obstruction score | |||||||
| ↓ Risk of nasal surgery | |||||||
| ↓ SNOT-22 score | |||||||
| ↓ Requiring systemic corticosteroids | |||||||
| IL-4Rα | Dupilumab | Bachert, et al. [33] (2016) | 60 | Weekly for a total of 16 weeks | RDBPC | 2b | ↓ NPS |
| ↓ SNOT-22 score | |||||||
| ↓ Lund-Mackay score | |||||||
| ↑ UPSIT score | |||||||
| Dupilumab | Bachert, et al. [34] (2019) | SINUS-24 (276) | Every 2 or 4 weeks for a total of 52 weeks | RDBPC | 1b | ↓ NPS | |
| SINUS-52 (448) | ↓ Nasal congestion or obstruction score | ||||||
| ↓ Lund-Mackay score |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download