1. Ishii T, Warabi E, Yanagawa T. Novel roles of peroxiredoxins in inflammation, cancer and innate immunity. J Clin Biochem Nutr. 2012; 50(2):91–105.

2. Jin MH, Lee YH, Kim JM, Sun HN, Moon EY, Shong MH, et al. Characterization of neural cell types expressing peroxiredoxins in mouse brain. Neurosci Lett. 2005; 381(3):252–7.

3. Ali MS, Pearson JP. Upper airway mucin gene expression: A review. Laryngoscope. 2007; 117(5):932–8.

4. Fischer BM, Voynow JA. Neutrophil elastase induces MUC5AC gene expression in airway epithelium via a pathway involving reactive oxygen species. Am J Respir Cell Mol Biol. 2002; 26(4):447–52.
5. Hewson CA, Edbrooke MR, Johnston SL. PMA induces the MUC5AC respiratory mucin in human bronchial epithelial cells, via PKC, EGF/TGF-alpha, Ras/Raf, MEK, ERK and Sp1-dependent mechanisms. J Mol Biol. 2004; 344(3):683–95.
6. Ahn JH, Kim HG, Seo BH, Choi YS, Song SY, Bae CH, et al. Effect of multi-walled carbon nanotubes on MUC5AC and MUC5B expression in airway epithelial cells. Korean J OtorhinolaryngolHead Neck Surg. 2015; 58(8):552–7.

7. Lee YH, Kim YD, Song YS, Bae CH, Choi YS, Shin KC, et al. High concentration of glucose induces MUC5B expression via reactive oxygen species in human airway epithelial cells. Korean J Otorhinolaryngol-Head Neck Surg. 2017; 60(8):369–403.

8. Ishida YI, Ichinowatari Y, Nishimoto S, Koike S, Ishii K, Ogasawara Y. Differential oxidation processes of peroxiredoxin 2 dependent on the reaction with several peroxides in human red blood cells. Biochem Biophys Res Commun. 2019; 518(4):685–90.

9. Matté A, Pantaleo A, Ferru E, Turrini F, Bertoldi M, Lupo F, et al. The novel role of peroxiredoxin-2 in red cell membrane protein homeostasis and senescence. Free Radic Biol Med. 2014; 76:80–8.

10. Lee TH, Jin JO, Yu KJ, Kim HS, Lee PC. Inhibition of peroxiredoxin 2 suppresses Wnt/β-catenin signaling in gastric cancer. Biochem Biophys Res Commun. 2019; 512(2):250–5.

11. Lim SK, Kim JC, Moon CJ, Kim GY, Han HJ, Park SH. Formaldehyde induces apoptosis through decreased Prx 2 via p38 MAPK in lung epithelial cells. Toxicology. 2010; 271(3):100–6.

12. Moon EY, Kang JS, Han SH, Yang KH, Pyo S, Lee MY, et al. Differential role of peroxiredoxin II (PrxII) on the expression of toll-like receptor 4 (TLR4) and B-cell activating factor (BAFF) in ovalbumin (OVA)-induced mouse asthma. Int Immunopharmacol. 2008; 8(6):935–44.

13. Murphy MP. How mitochondria produce reactive oxygen species. Biochem J. 2009; 417(1):1–13.

14. Wiegman CH, Michaeloudes C, Haji G, Narang P, Clarke CJ, Russell KE, et al. Oxidative stress-induced mitochondrial dysfunction drives inflammation and airway smooth muscle remodeling in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2015; 136(3):769–80.

15. Na HG, Kim YD, Choi YS, Bae CH, Song SY. Allethrin and prallethrin stimulates MUC5AC expression through oxidative stress in human airway epithelial cells. Biochem Biophys Res Commun. 2018; 503(1):316–22.

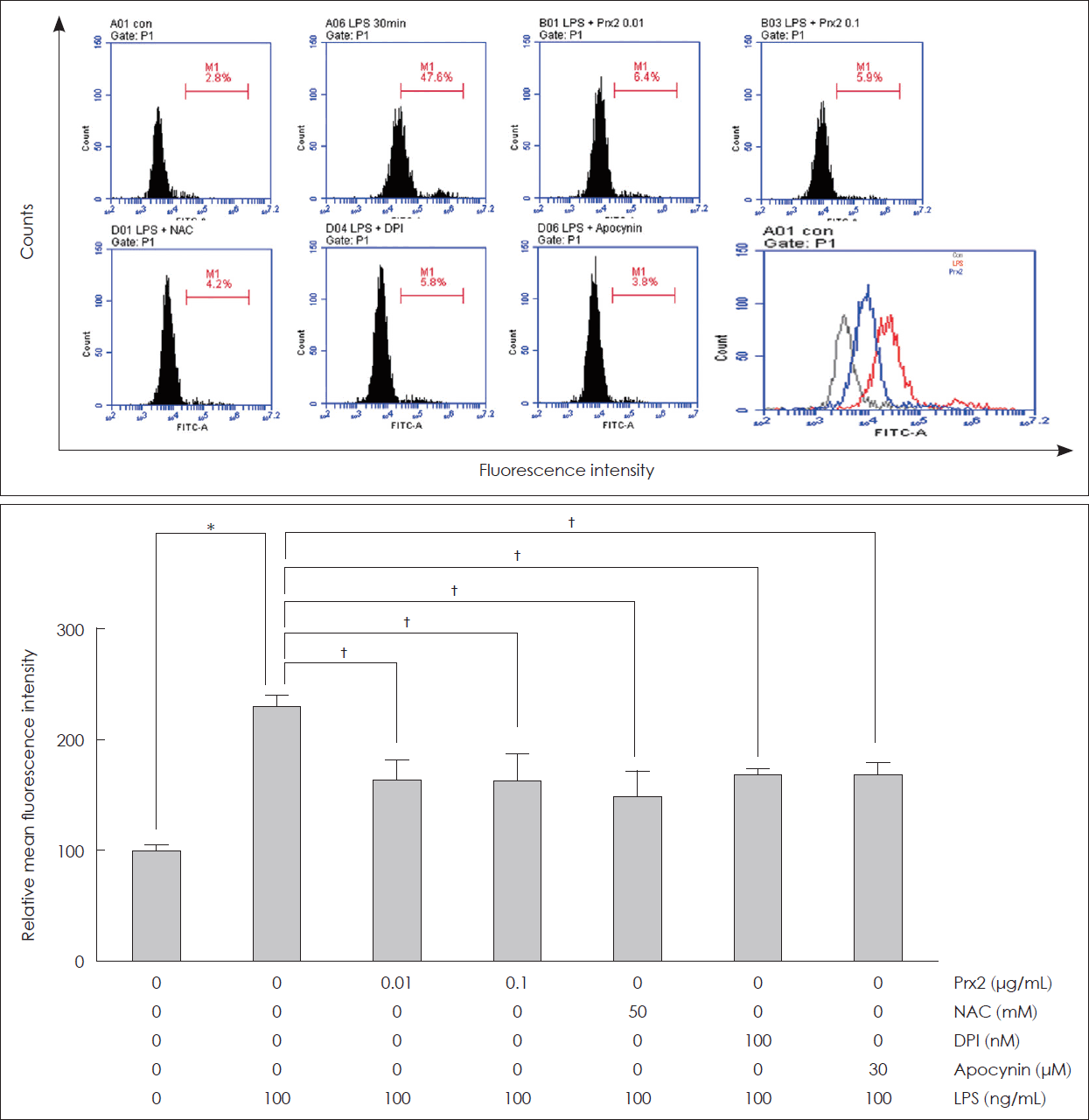
16. Yan F, Li W, Jono H, Li Q, Zhang S, Li JD, et al. Reactive oxygen species regulate Pseudomonas aeruginosa lipopolysaccharideinduced MUC5AC mucin expression via PKC-NADPH oxidase-ROS-TGF-alpha signaling pathways in human airway epithelial cells. Biochem Biophys Res Commun. 2008; 366(2):513–9.
17. Rada B, Gardina P, Myers TG, Leto TL. Reactive oxygen species mediate inflammatory cytokine release and EGFR-dependent mucin secretion in airway epithelial cells exposed to Pseudomonas pyocyanin. Mucosal Immunol. 2011; 4(2):158–71.

18. Smirnova MG, Guo L, Birchall JP, Pearson JP. LPS up-regulates mucin and cytokine mRNA expression and stimulates mucin and cytokine secretion in goblet cells. Cell Immunol. 2003; 221(1):42–9.

19. Hsu HY, Wen MH. Lipopolysaccharide-mediated reactive oxygen species and signal transduction in the regulation of interleukin-1 gene expression. J Biol Chem. 2002; 277(25):22131–9.

20. Yang D, Jin M, Bai C, Zhou J, Shen Y. Peroxiredoxin 6 suppresses Muc5ac overproduction in LPS-induced airway inflammation through H2O2-EGFR-MAPK signaling pathway. Respir Physiol Neurobiol. 2017; 236:84–90.
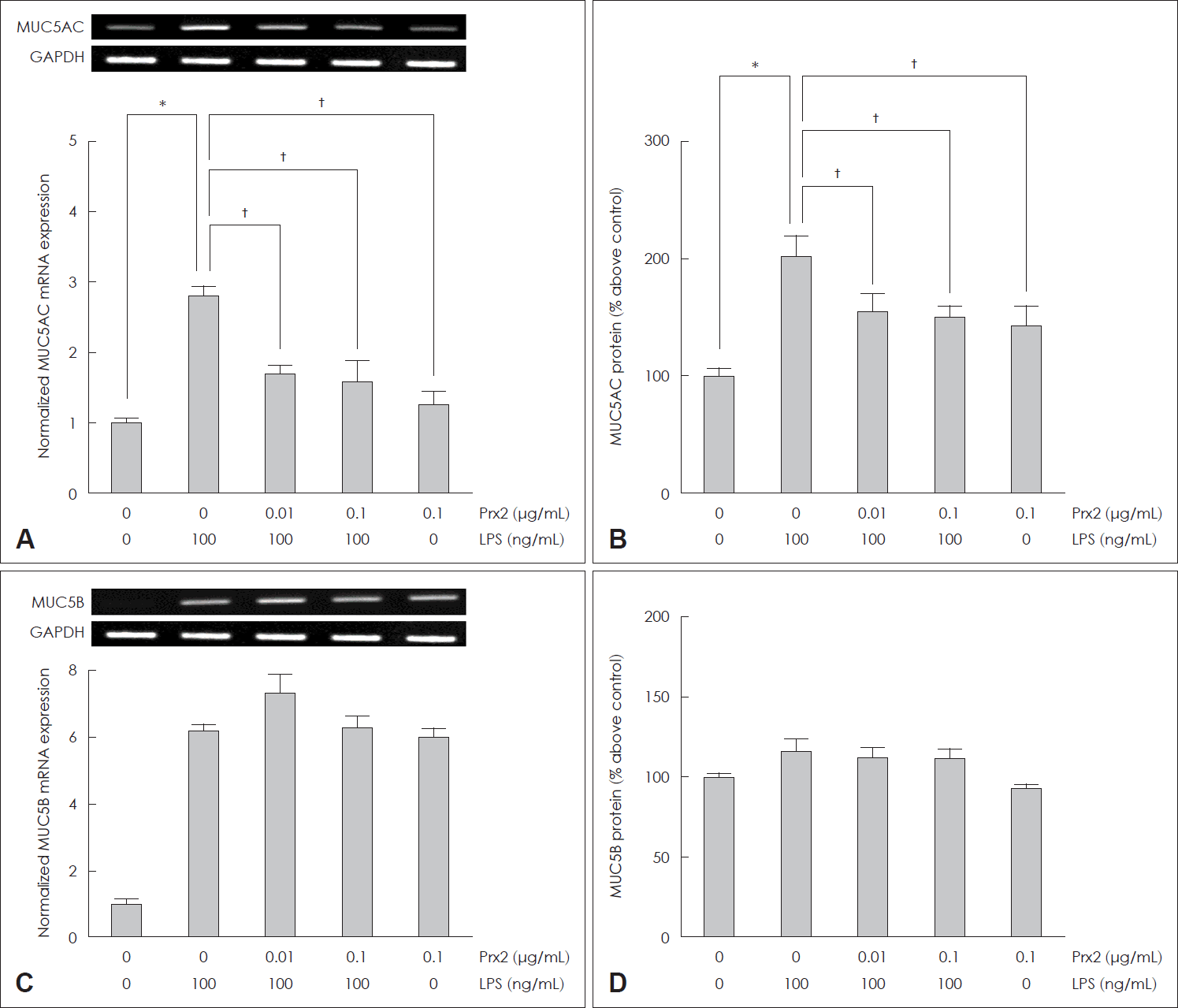
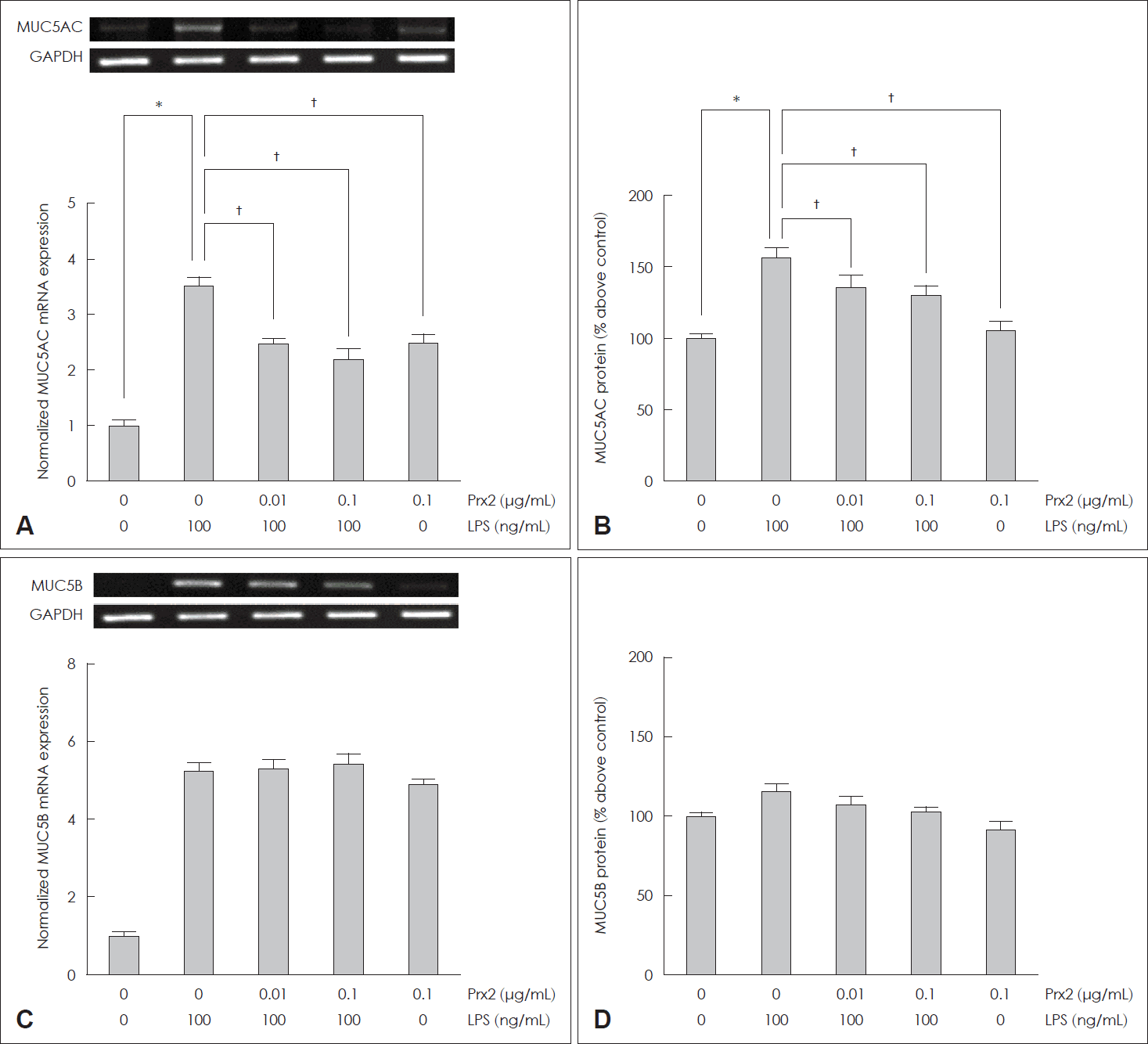
21. Bonser LR, Erle DJ. Airway mucus and asthma: The role of MUC5AC and MUC5B. J Clin Med. 2017; 6(12):112.

22. Lachowicz-Scroggins ME, Yuan S, Kerr SC, Dunican EM, Yu M, Carrington SD, et al. Abnormalities in MUC5AC and MUC5B protein in airway mucus in asthma. Am J Respir Crit Care Med. 2016; 194(10):1296–9.

23. Roy MG, Livraghi-Butrico A, Fletcher AA, McElwee MM, Evans SE, Boerner RM, et al. Muc5b is required for airway defence. Nature. 2014; 505(7483):412–6.

24. Ridley C, Thornton DJ. Mucins: The frontline defence of the lung. Biochem Soc Trans. 2018; 46(5):1099–106.

25. Petrônio MS, Zeraik ML, Fonseca LM, Ximenes VF. Apocynin: Chemical and biophysical properties of a NADPH oxidase inhibitor. Molecules. 2013; 18(3):2821–39.

26. Kim SK, Rho SJ, Kim SH, Kim SY, Song SH, Yoo JY, et al. Protective effects of diphenyleneiodonium, an NADPH oxidase inhibitor, on lipopolysaccharide-induced acute lung injury. Clin Exp Pharmacol Physiol. 2019; 46(2):153–62.






 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download