1. Faber CE, Grymer L. Available techniques for objective assessment of upper airway narrowing in snoring and sleep apnea. Sleep Breath. 2003; 7(2):77–86.

2. Guilleminault C, Hill MW, Simmons FB, Dement WC. Obstructive sleep apnea: Electromyographic and fiberoptic studies. Exp Neurol. 1978; 62(1):48–67.

3. Goding GS Jr, Eisele DW, Testerman R, Smith PL, Roertgen K, Schwartz AR. Relief of upper airway obstruction with hypoglossal nerve stimulation in the canine. Laryngoscope. 1998; 108(2):162–9.

4. Mwenge GB, Rombaux P, Dury M, Lengelé B, Rodenstein D. Targeted hypoglossal neurostimulation for obstructive sleep apnoea: A 1-year pilot study. Eur Respir J. 2013; 41(2):360–7.

5. Strollo PJ Jr, Soose RJ, Maurer JT, de Vries N, Cornelius J, Froymovich O, et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 2014; 370(2):139–49.

6. Rathi VK, Kondamuri NS, Naunheim MR, Gadkaree SK, Metson RB, Scangas GA. Use and cost of a hypoglossal nerve stimulator device for obstructive sleep apnea between 2015 and 2018. JAMA Otolaryngol Head Neck Surg. 2019; 145(10):975–7.

7. Schwab RJ, Gefter WB, Hoffman EA, Gupta KB, Pack AI. Dynamic upper airway imaging during awake respiration in normal subjects and patients with sleep disordered breathing. Am Rev Respir Dis. 1993; 148(5):1385–400.

8. Morrell MJ, Badr MS. Effects of NREM sleep on dynamic withinbreath changes in upper airway patency in humans. J Appl Physiol (1985). 1998; 84(1):190–9.
9. Kryger MH, Roth T, Dement WC. Principles and practice of sleep medicine. 5th ed. Philadelphia, PA: Saunders/Elsevier;2011.
10. Isono S, Remmers JE, Tanaka A, Sho Y, Sato J, Nishino T. Anatomy of pharynx in patients with obstructive sleep apnea and in normal subjects. J Appl Physiol (1985). 1997; 82(4):1319–26.

11. Badr MS, Toiber F, Skatrud JB, Dempsey J. Pharyngeal narrowing/occlusion during central sleep apnea. J Appl Physiol (1985). 1995; 78(5):1806–15.

12. Chi L, Comyn FL, Mitra N, Reilly MP, Wan F, Maislin G, et al. Identification of craniofacial risk factors for obstructive sleep apnoea using three-dimensional MRI. Eur Respir J. 2011; 38(2):348–58.

13. Okubo M, Suzuki M, Horiuchi A, Okabe S, Ikeda K, Higano S, et al. Morphologic analyses of mandible and upper airway soft tissue by MRI of patients with obstructive sleep apnea hypopnea syndrome. Sleep. 2006; 29(7):909–15.

14. Malhotra A, Huang Y, Fogel RB, Pillar G, Edwards JK, Kikinis R, et al. The male predisposition to pharyngeal collapse: Importance of airway length. Am J Respir Crit Care Med. 2002; 166(10):1388–95.
15. Isono S, Tanaka A, Tagaito Y, Ishikawa T, Nishino T. Influences of head positions and bite opening on collapsibility of the passive pharynx. J Appl Physiol (1985). 2004; 97(1):339–46.

16. Van de Graaff WB. Thoracic influence on upper airway patency. J Appl Physiol (1985). 1988; 65(5):2124–31.

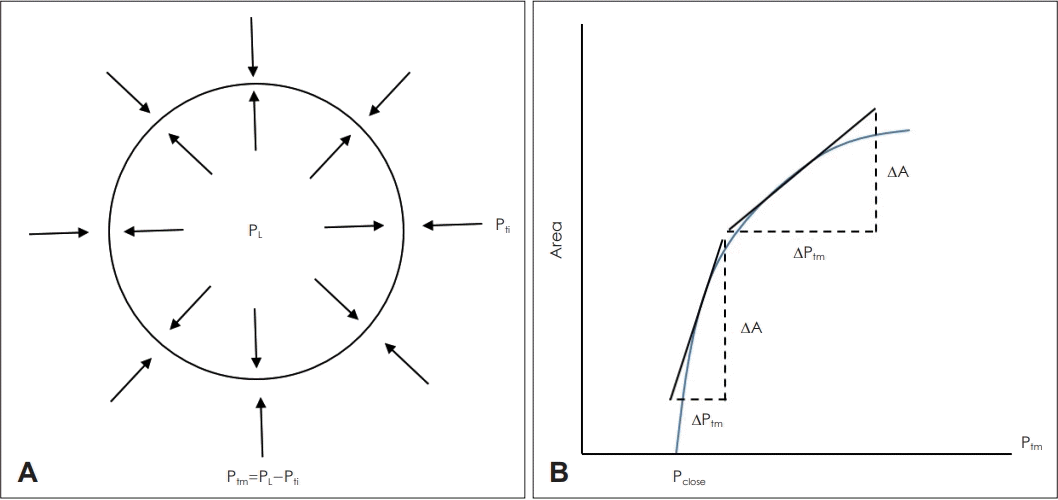
17. Genta PR, Edwards BA, Sands SA, Owens RL, Butler JP, Loring SH, et al. Tube law of the pharyngeal airway in sleeping patients with obstructive sleep apnea. Sleep. 2016; 39(2):337–43.

18. Rowley JA, Sanders CS, Zahn BR, Badr MS. Effect of REM sleep on retroglossal cross-sectional area and compliance in normal subjects. J Appl Physiol (1985). 2001; 91(1):239–48.

19. Rowley JA, Zahn BR, Babcock MA, Badr MS. The effect of rapid eye movement (REM) sleep on upper airway mechanics in normal human subjects. J Physiol. 1998; 510(Pt 3):963–76.

20. Schwartz AR, O’Donnell CP, Baron J, Schubert N, Alam D, Samadi SD, et al. The hypotonic upper airway in obstructive sleep apnea: Role of structures and neuromuscular activity. Am J Respir Crit Care Med. 1998; 157(4 Pt 1):1051–7.
21. Suratt PM, McTier RF, Wilhoit SC. Upper airway muscle activation is augmented in patients with obstructive sleep apnea compared with that in normal subjects. Am Rev Respir Dis. 1988; 137(4):889–94.

22. Kryger MH, Roth T, Dement WC. Principles and practice of sleep medicine. 6th ed. Philadelphia, PA: Elsevier;2017. p.xlv, 1, p.1080.
23. Carrera M, Barbé F, Sauleda J, Tomás M, Gómez C, Agustí AG. Patients with obstructive sleep apnea exhibit genioglossus dysfunction that is normalized after treatment with continuous positive airway pressure. Am J Respir Crit Care Med. 1999; 159(6):1960–6.

24. Kimoff RJ, Sforza E, Champagne V, Ofiara L, Gendron D. Upper airway sensation in snoring and obstructive sleep apnea. Am J Respir Crit Care Med. 2001; 164(2):250–5.

25. Kim SW, Park HW, Won SJ, Jeon SY, Jin HR, Lee SJ, et al. Palatal sensory threshold reflects nocturnal hypoxemia and airway occlusion in snorers and obstructive sleep apnea patients. J Clin Sleep Med. 2013; 9(11):1179–86.

26. Nguyen AT, Jobin V, Payne R, Beauregard J, Naor N, Kimoff RJ. Laryngeal and velopharyngeal sensory impairment in obstructive sleep apnea. Sleep. 2005; 28(5):585–93.

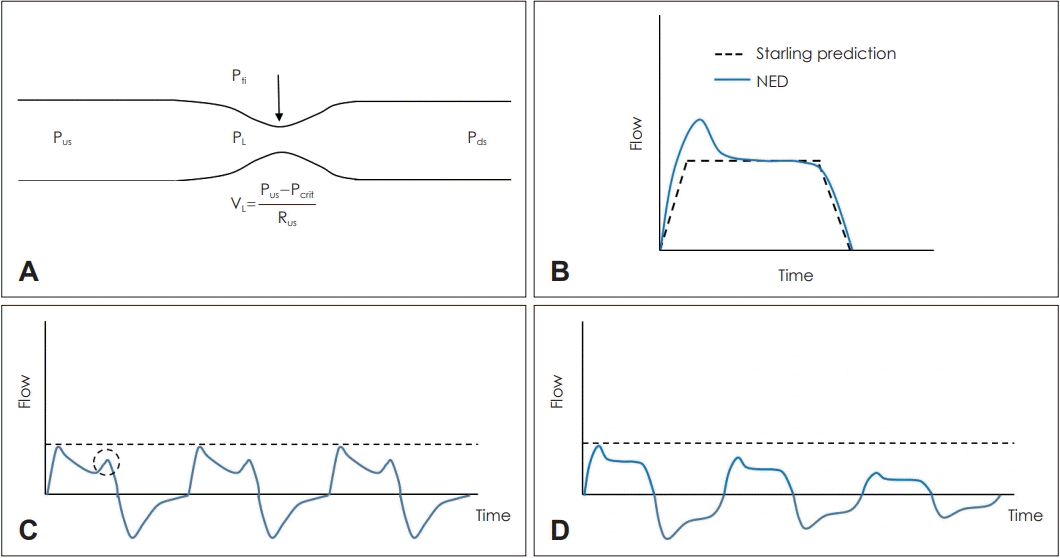
27. Smith PL, Wise RA, Gold AR, Schwartz AR, Permutt S. Upper airway pressure-flow relationships in obstructive sleep apnea. J Appl Physiol (1985). 1988; 64(2):789–95.

28. Aittokallio T, Saaresranta T, Polo-Kantola P, Nevalainen O, Polo O. Analysis of inspiratory flow shapes in patients with partial upperairway obstruction during sleep. Chest. 2001; 119(1):37–44.

29. Owens RL, Edwards BA, Sands SA, Butler JP, Eckert DJ, White DP, et al. Upper airway collapsibility and patterns of flow limitation at constant end-expiratory lung volume. J Appl Physiol (1985). 2012; 113(5):691–9.

30. Eckert DJ, White DP, Jordan AS, Malhotra A, Wellman A. Defining phenotypic causes of obstructive sleep apnea. Identification of novel therapeutic targets. Am J Respir Crit Care Med. 2013; 188(8):996–1004.

31. Sands SA, Edwards BA, Terrill PI, Taranto-Montemurro L, Azarbarzin A, Marques M, et al. Phenotyping pharyngeal pathophysiology using polysomnography in patients with obstructive sleep apnea. Am J Respir Crit Care Med. 2018; 197(9):1187–97.

32. Sands SA, Terrill PI, Edwards BA, Taranto-Montemurro L, Azarbarzin A, Marques M, et al. Quantifying the arousal threshold using polysomnography in obstructive sleep apnea. Sleep. 2018; 41(1):zsx183.

33. Mann DL, Terrill PI, Azarbarzin A, Mariani S, Franciosini A, Camassa A, et al. Quantifying the magnitude of pharyngeal obstruction during sleep using airflow shape. Eur Respir J. 2019; 54(1):1802262.

34. Genta PR, Schorr F, Edwards BA, Wellman A, Lorenzi-Filho G. Discriminating the severity of pharyngeal collapsibility in men using anthropometric and polysomnographic indices. J Clin Sleep Med. 2020; 16(9):1531–7.

35. Azarbarzin A, Sands SA, Marques M, Genta PR, Taranto-Montemurro L, Messineo L, et al. Palatal prolapse as a signature of expiratory flow limitation and inspiratory palatal collapse in patients with obstructive sleep apnoea. Eur Respir J. 2018; 51(2):1701419.





 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download