Abstract
Background and Objectives
MUC5AC is one of the major secretory mucin genes in the human airway epithelium. MUC5AC expression is increased by a variety of inflammatory mediators. Protopanaxadiol (PPD), one of the major active metabolites in ginseng, is known to have anti-inflammatory, antitumor and antioxidant properties. However, the effects of PPD on mucin secretion of airway epithelial cells still have not been reported. Therefore, the aim of this study is to investigate the effect of PPD on lipopolysaccharide (LPS)-induced MUC5AC expression in human airway epithelial cells.
Materials and Method
In the mucin-producing human NCI-H292 airway epithelial cells, the effect of PPD on MUC5AC expression was investigated using reverse transcription-polymerase chain reaction and enzyme immunoassay after treated with LPS. N-acetylcysteine (NAC) as a reactive oxygen species (ROS) scavenger, and apocynin as a nicotinamide adenine dinucleotide phosphate oxidase inhibitor were used to compare the inhibitory effect of PPD on LPSinduced ROS production in human NCI-H292 cells.
Results
LPS significantly increased MUC5AC mRNA expression and protein production. LPS also increased ROS production. PPD inhibited LPS-induced MUC5AC mRNA expression and protein production as well as ROS production. In addition, NAC and apocynin inhibited LPS-induced MUC5AC mRNA expression and protein production.
Conclusion
These results demonstrate that PPD inhibits LPS-induced MUC5AC expression via ROS in human airway epithelial cells and the inhibitory effect of PPD was similar to that of NAC and apocynin. These findings indicate that PPD may be a therapeutic agent for control of mucus secretion and oxidative stress in human airway epithelial cells.
인삼의 공식 학명인 Panax ginseng 에서 Panax는 그리스어로 모든 것을 뜻하는 pan과 의약을 뜻하는 axos가 결합된 것으로 만병통치약을 의미하여 한국, 중국, 일본 등지에서 가장 오랫동안 사용되어온 약초이다. 인삼에 포함된 사포닌(saponin)은 인삼의 약리 작용에 중요한 역할을 한다고 알려져 있다. 인삼 사포닌(ginsenoside)은 protopanaxadiol(PPD), protopanaxatril, oleanolic acid 세 종류로 분류되며, 이 중 C30H52O3의 화학식을 가지는 PPD는 항염증과 항당뇨, 항암, 항산화 등을 포함한 다양한 생물학적 작용을 가지고 있어 다양한 연구가 시행되고 있다[1-4]. 하지만 호흡기 상피세포에서 점액 유전자 발현과 단백 생성에 있어서 어떠한 영향을 미치는지에 대한 연구는 아직까지 보고된 바가 없다.
사람의 비강 상피세포는 거짓중층상피이며 이는 원주세포와 배상세포, 기저세포로 구성되고, 점액의 분비, 점액섬모청소의 활성화, 염증매개체의 분비, 면역세포의 동원 등을 통하여 상기도를 보호한다. 하지만 정상적인 상피세포가 손상을 입게 되면 배상세포의 과형성과 화생, 상피의 박피, 섬모세포의 감소 또는 기능이상, 기저막의 비후 등의 재형성이 발생할 수 있다[5]. 특히 만성 염증성 호흡기질환에서는 점액의 과분비는 병의 경과를 악화시킬 수 있어, 점액의 과다 분비를 조절하는 것이 매우 중요하다[6]. 점액의 여러 가지 성분 중에서 점소는 당단백으로 점액 유전자에 의해 생성이 조절되고 이 점액 유전자는 현재까지 20여 개가 발견되었다. 이 중에서 분비형 점소의 하나인 MUC5AC는 중요한 호흡기 점액유전자이며 사이토카인이나 염증성 매개물질, 활성산소(reactive oxygen species, ROS) 등에 의해 발현이 조절되어 유전자의 발현과 관련된 상기도 질환의 연구에 활발히 이용되고 있다[7-9].
점막 상피세포에서 점액 유전자의 발현과 점액 분비를 증가시키는 물질은 다양하게 존재한다. 그 중 하나인 lipopolysaccharide(LPS)는 대부분의 그람음성세균의 세포외막에 위치하는 물질로, 이는 대식세포를 자극하여 염증성 사이토카인인 Interleukin-1 beta(IL-1β)와 종양괴사인자(tumor necrosis factor, TNF)를 분비하게 하고, 활성산소 생성을 유도한다[10,11]. 이러한 다양한 반응들은 선천 면역반응과 염증반응을 매우 강하게 자극하여 점액의 과분비를 유도한다.
본 연구는 호흡기 상피세포인 NCI-H292 세포에서 PPD가 LPS에 의해 유도된 MUC5AC의 유전자 발현과 단백 생성에 미치는 영향에 대해 알아보고자 하였다.
사람 호흡기 점액상피양 암 세포주(human pulmonary mucoepidermoid carcinoma cell line)인 NCI-H292 세포(American Type Culture Collection, Manassas, VA, USA)에 100 U/mL penicillin, 100 μg/mL streptomycin, 10% fetal bovine serum(FBS; GIBCO, Grand Island, NY, USA)이 포함된 RPMI 1640 배지(Invitrogen, Carlsbad, CA, USA)를 이용하여 5%의 이산화탄소 조건하에서 37℃의 온도로 배양하였다. 6-well plate에 1×106 cells/well의 밀도로 세포를 도포하여 배양하였으며, 70~80% 정도 배양이 이루어지면 세포를 0.5% FBS가 포함된 RPMI 1640 배지로 교체한 후 24시간 동안 배양하였다.
PPD에 의한 MUC5AC 점액 유전자 발현과 단백 생성을 알아보기 위해서 NCI-H292 세포에 각기 다른 농도의 PPD(Sigma-Aldrich, St. Louis, MO, USA)를 전처리한 후 1시간 뒤에 100 ng/mL 농도의 LPS(from Pseudomonas aeruginosa 10, L8643, Sigma-Aldrich)를 투여하였다. 또한 각 PPD의 농도에서 LPS에 의해 유도된 ROS 과생성과 MUC5AC 점액 유전자 발현 및 단백 생성에 대한 억제효과를 비교하기 위해 활성산소 억제제인 N-acetylcystein( NAC; Sigma-Aldrich)과 nicotinamide adenine dinucleotide phosphate 산화효소 억제제인 apocynin(Sigma-Aldrich), PPD를 각각 LPS에 노출되기 1시간 전에 전처리하였다. 대조군은 0.5% FBS가 포함된 RPMI 1640 배지에서 NCI-H292 세포를 단독으로 배양하였다.
본 연구는 본원 임상 시험 심사 위원회(Institutional Review Board)의 승인을 받아 시행하였다(YUMC 2017-07-015).
NCI-H292 세포를 2×104 cells/well를 9 6 w ell c ulture plate에 분주한 후, 37℃, 5% CO2 조건으로 10% FBS가 포함된 RPMI에 24시간 동안 배양하였다. 세포가 80~90% 차면 배양용액을 제거한 다음 FBS가 포함되지 않은 배지에 PPD 또는 PPD와 LPS(100 ng/mL)를 섞어 각 well에 24시간 동안 처리하였으며, 그 후 EZ-Cytox Cell Viability Assay kit(Daeil Lab, Seoul, Korea)를 이용하여 세포독성평가를 시행하였으며, 방법을 간략히 설명하면, 각 well당 water-soluble tetrazolium salt-1 용액을 10 μL씩 처리하여 2시간 동안 37℃에서 배양하여 반응시키고 450 nm 흡광도로 측정하였다.
RNA에 대한 분석은 Gene Amp RNA Polymerase chain reaction(PCR) core kit와 MyCycler(Bio-Rad, Hercules, CA, USA) PCR 기계를 사용하여 제조사의 방법대로 시행하였다. PCR에 사용된 oligonucleotide primer는 밝혀진 염기서열에 의해 제작하였으며, 각 반응의 내부 양성 대조군(internal positive control)은 glyceraldehyde-3-phosphate dehydrogenase(GAPDH)를 사용하였다. 실험에 사용된 MUC5AC primer의 염기배열은 sense는 5’-ATC ACC GAA GGC TGC TTC TGT C-3’, antisense는 5’-GTT GAT GCT GCA CAC TGT CCA G-3’이며, GAPDH의 경우 sense는 5’-CCT CCA AGG AGT AAG ACC CC-3’, antisense는 5’-AGG GGT CTA CAT GGC AAC TG-3’이었다. 실험에 사용되어 증폭된 MUC5AC mRNA 산물의 크기는 410 bp이고 GAPDH는 145 bp이었다. Reverse transcription(RT)-PCR 과정은, NCI-H292 세포에 0 μM와 10 μM, 20 μM 농도의 PPD를 전처리한 후 1시간 뒤에 100 ng/mL 농도의 LPS를 투여였으며, 20 μM 농도의 PPD를 단독 투여하여 양성 대조군으로 사용하였다. 8시간 후에 배양된 세포를 phosphate buffered saline(PBS)로 3회 세척한 후 TrizolⓇ(Invitrogen)을 이용하여 총 mRNA를 추출하였다. MUC5AC mRNA에 대한 PCR은 95℃에서 60초간 변성과정과 60℃에서 60초간 결합반응, 72℃에서 60초간 연장반응을 33회 반복한 후 72℃에서 20분간 최종 연장반응을 시행하였다. 증폭된 중합효소연쇄반응의 산물은 SYBR green이 함유된 2% agarose gel을 통한 전기영동을 이용하여 분리 관찰하였다. 확인된 띠(band)의 세기는 Fusion FX Image software (Vilber Lourmat, Eberhardzell, Germany)를 이용하여 반정량적으로 분석하였고, 대조군의 density를 100으로 하였을 때 실험군의 density값을 비율로 나타내어 relative density로 나타내었다.
MUC5AC 점액단백의 함량을 측정하기 위해서 Enzymelinked immunosorbent assay(ELISA)를 이용하였다. NCIH292 세포에 0, 10, 20 μM 농도의 PPD를 전처리한 후 1시간 뒤에 100 ng/mL 농도의 LPS를 투여였으며, 20 μM 농도의 PPD를 단독 투여하여 양성 대조군으로 사용하였다. 투여하여 배양하였다. 24시간 후에 배양된 세포에서 Radioimmunoprecipitation assay buffer로 단백을 추출하여 정량하였다. 추출한 단백 100 μg을 96-well plate에 담고 4℃에서 하루 동안 도포한 후 PBS로 3회 세척하였다. 비특이적 결합을 방지하기 위해 2% b ovine s erum a lbumin(BSA)이 함유된 PBS with Tween 20(PBST)에 1시간 동안 차단한 후 PBS로 3회 세척한 다음 2% BSA가 함유된 PBST에 1:200으로 희석된 MUC5AC 일차항체(Santa Cruz Biotechnology, Santa Cruz, CA, USA)로 반응시켰다. 다시 PBS로 3회 세척한 후 HRP-conjugated 이차항체(Santa Cruz Biotechnology)를 2% BSA가 함유된 PBST에 1:5000으로 희석하여 각 well에 첨가하였고, 1시간 후에 각 well을 PBS로 3회 세척하였다. 3,3’, 5,5’-tetramethyl benzidine 용액으로 발색한 후, 2N-H2SO4를 이용하여 중단시켰다. ELISA reader(EL800Ⓡ, BIO-TEK Instruments, Winooski, VT, USA)로 450 nm에서 흡광도를 측정한 후 표준곡선을 이용하여 단백의 양을 정량하였다.
생성된 활성산소의 함량을 측정하기 위해서 flow cytometry를 이용하였다. NCI-H292 세포에 50 μM의 2,7-dichlorodihydrofluorescein diacetate와 aredox-sensitive fluorescent dye를 40분 동안 처리한 후 PBS로 3회 세척하였다. Flow cytometry를 시작하기 전까지 얼음에 담긴 1 mL PBS suspension에서 세포를 유리하였다. BD Accuri C6 Plus(BD Bioscience, Rutherford, NJ, USA)에서 488 nm excitation beam을 이용하여 flow cytometry를 시행하였다. LPS에 의해 유도되는 활성산소의 함량은 시간대별로 측정하였으며(30분, 1시간, 2시간, 4시간), 30분 이후부터 증가한 활성산소의 함량이 4시간까지 유지됨을 확인하였고, LPS에 의해 유도된 활성산소의 생성양과 PPD의 활성산소의 생성 억제 효과분석은 LPS 처리 후 1시간 뒤의 활성산소 생성을 측정하여 분석하였다. ROS 신호는 530 nm 투과 밴드를 이용하여 추출하였으며, 5000개 세포에서의 평균 형광강도를 기준으로 삼았다.
NCI-H292 세포에서 PPD 또는 PPD와 LPS(100 ng/mL)를 함께 투여하였을 때 미치는 세포독성을 확인하기 위해 WST법을 이용하여 평가하였으며, 20 μM 농도의 PPD 투여까지는 세포독성이 관찰되지 않았다(Fig. 1).
NCI-H292 세포에서 PPD가 LPS로 유도된 MUC5AC 발현에 미치는 영향을 RT-PCR과 ELISA를 통하여 분석하였다. NCI-H292 세포에서 LPS로 유도된 MUC5AC의 mRNA 발현과 점액단백의 생성량은 PPD를 전처리한 군에서는 통계학적으로 의미있게 감소하였다. PPD 투여 용량이 많을수록 mRNA의 발현이 감소하였으나, 점액단백의 경우에는 고용량(20 μM)을 투여한 군과 저용량(10 μM)을 투여한 군에서는 큰 차이가 없었다(Fig. 2).
NCI-H292 세포에서 PPD의 농도에 따른 활성산소 생성을 알아보기 위하여 flow cytometry를 통하여 분석하였다. LPS에 의해 유도된 활성산소 생성이 PPD를 전처리하였을 때 활성산소 생성은 통계학적으로 의미있게 감소하였으나, PPD의 농도에 따른 활성산소 생성의 차이는 없었다. 또한 LPS를 처리하지 않았을 때에는 PPD의 유무에 따른 활성산소 생성의 차이는 없었다(Fig. 3A). LPS로 유도된 MUC5AC와 활성산소 생성 간의 관련성을 확인하기 위하여 NCIH292 세포에 PPD와 NAC, apocynin을 전처리한 후 flow cytometry를 통하여 분석하였다. PPD와 NAC, apocynin을 전처리한 모든 경우에서 LPS로 유도된 활성산소 생성이 통계학적으로 의미 있게 감소하였다(Fig. 3B).
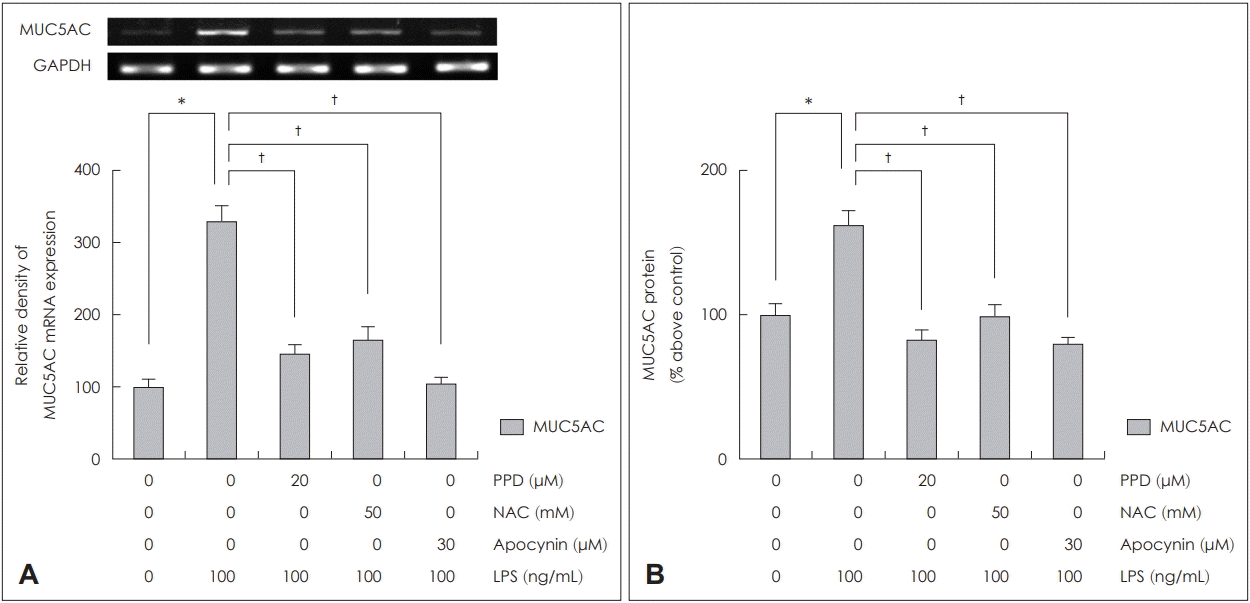
NCI-H292 세포에서 PPD, NAC, apocynin이 LPS로 유도된 MUC5AC 발현에 미치는 영향을 RT-PCR과 ELISA로 분석하였다. NCI-H292 세포에서 LPS로 유도된 MUC5AC의 mRNA 발현과 점액단백의 생성양은 PPD, NAC, apocynin을 투여한 군 모두에서 통계학적으로 의미있게 감소하였다(Fig. 4).
인삼은 수천 년 전부터 중국, 한국, 일본 등지에서 약초로 사용되어 왔다. 많은 연구들에서 인삼은 항암과 항염증, 항산화, 항당뇨, 항자가면역, 항노화 작용 등이 있는 것으로 밝혀져 있다[12-14]. 인삼은 파낙스종(genus Panax)에 속하는 식물로, 13여 개의 파낙스종 중에서 5개만이 치료적으로 사용되고 있다. 이 5개의 파낙스종 중에서도 치료적 목적으로 가장 많이 사용되는 것이 파낙스 인삼(Panax ginseng)이다. 인삼에서 다양한 약물학적 효과를 나타내는 몇 가지 활성 성분 중에서 인삼 사포닌(ginseng saponin, ginsenoside)이 가장 주요한 활성 성분이다. 알려진 인삼 사포닌은 100개 이상이며, 화학 구조에 따라서 PPD와 protopanxatriol, oleanoic acid로 나눌 수 있다[15]. 이 중 PPD는 화학적으로 비당부분(aglycone) 골격구조의 3번과 12번 탄소에 각각 하이드록시기(-OH)가 있고, 3번과 20번 탄소에 포도당(glucose)과 자일로오스(xylose), 아라비노오스(arabinose), 람노스(rhamnose) 등의 당이 결합된 형태로 총 19종이 존재하며, Rb1과 Rb2, Rc, Rd가 대표적이다[3]. PPD의 생물학적 역할로는 간세포에서 5 ’ adenosine monophosphate-activated protein kinase(AMPK) 발현을 증가시키고, forkhead transcription factor 1 활성을 억제하여 포도당신생합성을 억제하여 항당뇨 작용과 matrix metalloproteinase(MMP)-2의 발현 및 활성의 하향 조절을 통해 자궁내막 암세포의 기저막에 대한 침습성을 감소시키는 항암 작용이 보고되고 있다[2]. 또한 PPD는 상피성장인자와 파이브로넥틴(fibronectin), 콜라겐(collagen) 등과 같은 세포 증식과 관련된 단백질인자의 발현을 상향 조절함으로써 표피세포의 증식을 통해 혈관 신생을 억제하여 상처 치유를 향상시키고, TNF-α와 IL-1β, IL-6, IL-8, MMP-9, 활성산소, nuclear factor kappa-light-chain-enhancer of activated B cells, inhibitor of nuclear factor kappa-B kinase subunit beta, mitogen-activated protein kinase(MAPK) 생성을 억제시켜 면역 반응을 조절함으로써 항염증 작용도 보고되고 있다[4,16]. 최근의 연구에서는 인삼 사포닌이 활성산소-매개 항암 작용에도 관계하며, 여기에는 AMPK 신호전달과 MAPK 신호전달 등의 다양한 신호전달체계가 작용을 하는 것으로 보고하고 있다[17]. 본 연구에서는 호흡기염증 반응에 중요한 매개물인 활성산소 생성과 MUC5AC 점액단백 과생성에 대한 PPD의 억제효과를 확인하고, 이를 통해 염증성 호흡기 질환에서 PPD의 치료제로서의 가능성을 확인해보고자 하였다.
활성산소는 주로 세포의 미토콘드리아 대사의 부산물로 발생하며, 비·부비동염과 천식, 만성 폐쇄성 폐질환, 낭종성 섬유증과 같은 염증성 호흡기 질환 악화의 중요인자 중 하나로 알려져 있고, 상피화생(epithelial metaplasia), 조직재생(tissue repair)에 관여하며, 배상세포 화생(goblet cell metaplasia), 점막하샘 증식(submucosal gland hypertrophy), 섬유화(fibrosis) 등을 증가시켜 기도 재생성(airway remodeling)을 유도하는 것으로 알려져 있다[18]. 특히, 최근 연구에서 LPS, 다중벽 탄소 나노튜브와 살충제 성분들과 같은 외부 독성물질이나 neutrophil elastase와 같은 체내 효소물질들이 활성산소 유도를 통해 MUC5AC 발현에 영향을 미치는 것으로 밝혀져 있다[5,6,19-21].
MUC5AC는 호흡기 점막의 배상세포에서 주로 분비되는 당단백질로 점액의 점도에 영향을 미치는 중요한 성분이며, 호흡기 상피에서 점막섬모 운동 기능을 유지하는 중요한 역할을 하는 것으로 알려져 있다. 그러나 비정상적인 MUC5AC의 과분비와 축적이 비·부비동염과 천식, 만성 폐쇄성 폐질환, 낭종성 섬유증 등과 같은 염증성 호흡기 질환에서 관찰되며 이는 질병의 악화와 밀접한 연관이 있는 것으로 알려져 있다[6]. MUC5AC 점액단백의 생성을 증가시키는 물질로 LPS, phorbol myristate acetate, 다양한 IL 등이 알려져 있으며, 다양한 신호전달 체계에 의해 조절되는 것으로 알려져 있다[8,10,11]. 본 연구에서도 NCI-H292 세포에서 LPS에 의해 MUC5AC 점액유전자의 발현과 단백생성이 유도됨을 확인 할 수 있었고, 활성산소 생성을 억제하는 효과가 있는 NAC와 apocynin과 같은 항산화 물질이 MUC5AC 점액단백의 과생성을 억제하는 효과가 있음을 확인할 수 있었다. 또한 항산화 및 항염증 효과가 있는 것으로 알려진 PPD 역시 NAC, apocynin과 같은 물질들과 유사하게 활성산소 생성을 억제하고, LPS에 의해 유도된 MUC5AC 점액단백의 과생성을 억제하는 효과가 있음을 확인할 수 있었다. 이를 통해 LPS의해 유도된 MUC5AC mRNA 과발현과 점액단백 생성에 활성산소와 관련된 신호전달 체계가 관여하고 PPD는 활성산소의 억제를 통해 LPS에 의해 유도된 MUC5AC 점액단백 과생성을 조절하는 효과가 있음을 확인할 수 있었다. 하지만 PPD에 의한 MUC5AC 발현 억제 효과가 PPD의 상용 복용에 의한 혈중 농도로 MUC5AC 발현에 효과를 나타내는지를 확인하기 위해서는 다른 종류의 세포나 동물, 사람을 이용한 다양한 연구가 필요할 것으로 생각된다.
결론적으로 이 연구는 호흡기 상피세포에서 PPD가 점액 과분비 조절과 활성산소 생성 조절에 관여함을 확인하였으며, 이를 통해 PPD가 점액 과분비를 억제할 수 있는 새로운 조절제로서의 활용가능성이 있음을 확인할 수 있었다.
ACKNOWLEDGMENTS
This research was supported by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education (NRF-2017R1D1A3B03029607).
REFERENCES
1. Oh SJ, Kim K, Lim CJ. Ginsenoside rb2 attenuates UV-B radiationinduced reactive oxygen species and matrix metalloproteinase-2 through upregulation of antioxidant components in human dermal fibroblasts. Pharmacology. 2015; 96(1-2):32–40.

2. Oh SJ, Kim K, Lim CJ. Suppressive properties of ginsenoside Rb2, a protopanaxadiol-type ginseng saponin, on reactive oxygen species and matrix metalloproteinase-2 in UV-B-irradiated human dermal keratinocytes. Biosci Biotechnol Biochem. 2015; 79(7):1075–81.

3. Bai L, Gao J, Wei F, Zhao J, Wang D, Wei J. Therapeutic potential of ginsenosides as an adjuvant treatment for diabetes. Front Pharmacol. 2018; 423(9):1–14.

4. Shergis JL, Di YM, Zhang AL, Vlahos R, Helliwell R, Ye JM, et al. Therapeutic potential of Panax ginseng and ginsenosides in the treatment of chronic obstructive pulmonary disease. Complement Ther Med. 2014; 22(5):944–53.

5. Liu J, Li YY, Andiappan AK, Yan Y, Tan KS, Ong HH, et al. Role of IL-13Rα2 in modulating IL-13-induced MUC5AC and ciliary changes in healthy and CRSwNP mucosa. Allergy. 2018; 73(8):1673–85.

6. Ali MS, Pearson JP. Upper airway mucin gene expression: A review. Laryngoscope. 2007; 117(5):932–8.

7. Fischer BM, Voynow JA. Neutrophil elastase induces MUC5AC gene expression in airway epithelium via a pathway involving reactive oxygen species. Am J Respir Cell Mol Biol. 2002; 26(4):447–52.
8. Kim HS, Choi YS, Lee JH, Park NK, Park CH, Lee YH, et al. Effect of betulinic acid on MUC5AC and MUC5B expression in airway epithelial cells. Korean J Otorhinolaryngol-Head Neck Surg. 2014; 57(8):526–32.

9. Ahn JH, Kim HG, Seo BH, Choi YS, Song SY, Bae CH, et al. Effect of multi-walled carbon nanotubes on MUC5AC and MUC5B expression in airway epithelial cells. Korean J Otorhinolaryngol-Head Neck Surg. 2015; 58(8):552–7.

10. Lee JG, Moon HJ, Kim SS, Kim CW, Yoon JH. Expression and regulation of MUC8 & MUC5AC by various cytokines in normal human nasal epithelial cells. Korean J Otorhinolaryngol-Head Neck Surg. 2001; 44(6):600–5.
11. Kim YD, Bai CH, Woo HJ. Interleukin-1beta-mediated MUC5AC gene expression and mucin secretion via PKC-ERK/p38-COX-2-PGE2 in human airway epithelial cells. Korean J Otorhinolaryngol-Head Neck Surg. 2003; 46(1):27–34.
12. Ben-Eltriki M, Deb S, Hassona M, Meckling G, Fazli L, Chin MY, et al. 20(S)-protopanaxadiol regio-selectively targets androgen receptor: Anticancer effects in castration-resistant prostate tumors. Oncotarget. 2018; 9(30):20965–78.

13. Chen T, Li B, Qiu Y, Qiu Z, Qu P. Functional mechanism of ginsenosides on tumor growth and metastasis. Saudi J Biol Sci. 2018; 25(5):917–22.

14. Li J, Li R, Li N, Zheng F, Dai Y, Ge Y, et al. Mechanism of antidiabetic and synergistic effects of ginseng polysaccharide and ginsenoside Rb1 on diabetic rat model. J Pharm Biomed Anal. 2018; 158:451–60.

15. Kim JH, Yi YS, Kim MY, Cho JY. Role of ginsenosides, the main active components of Panax ginseng, in inflammatory responses and diseases. J Ginseng Res. 2017; 41(4):435–43.
16. Joh EH, Lee IA, Jung IH, Kim DH. Ginsenoside Rb1 and its metabolite compound K inhibit IRAK-1 activation--the key step of inflammation. Biochem Pharmacol. 2011; 82(3):278–86.

17. Sodrul IMD, Wang C, Chen X, Du J, Sun H. Role of ginsenosides in reactive oxygen species-mediated anticancer therapy. Oncotarget. 2017; 9(2):2931–50.

18. Wiegman CH, Michaeloudes C, Haji G, Narang P, Clarke CJ, Russell KE, et al. Oxidative stress-induced mitochondrial dysfunction drives inflammation and airway smooth muscle remodeling in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2015; 136(3):769–80.

19. Na HG, Kim YD, Choi YS, Bae CH, Song SY. Allethrin and prallethrin stimulates MUC5AC expression through oxidative stress in human airway epithelial cells. Biochem Biophys Res Commun. 2018; 503(1):316–22.

Fig. 1.
Cell viability of human NCI-H292 cells after PPD or PPD with LPS (100 ng/mL) treatment. PPD or PPD with LPS (100 ng/mL) at low concentration did not display significant cell killing activity up to 20 μM. Images are representative of three separate experiments performed in triplicate. Bars indicate the mean±standard deviation of three independent experiments performed in triplicate. *p<0.05 compared with zero value. PPD: protopanaxadiol, LPS: lipopolysaccharide.
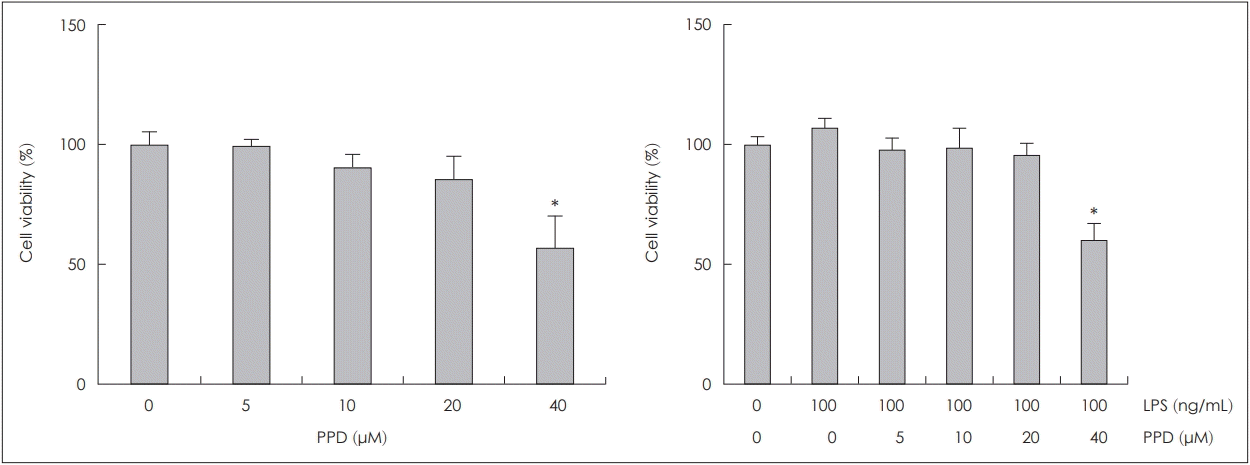
Fig. 2.
The effects of PPD on LPS-induced MUC5AC expression in human NCI-H292 cells. PPD significantly attenuated LPS-induced MUC5AC mRNA expression in RT-PCR (A) and glycoprotein level in ELISA (B). Images are representative of three separate experiments performed in triplicate. Bars indicate the mean±standard deviation of three independent experiments performed in triplicate. *p<0.05 compared with zero value, †p<0.05 compared with LPS (100 ng/mL). ELISA: enzyme-linked immunosorbent assay, LPS: lipopolysaccharide, PPD: protopanaxadiol, RT-PCR: reverse transcription-polymerase chain reaction, GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
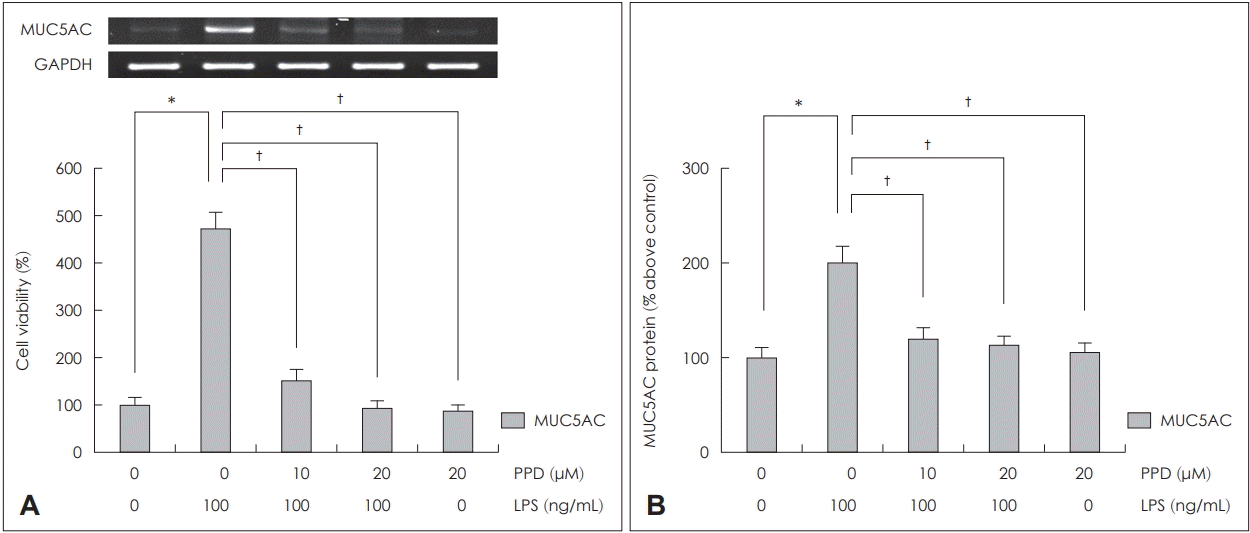
Fig. 3.
The effects of PPD on LPS-induced ROS production in human NCI-H292 cells. PPD significantly decreased LPS-induced ROS production in flow cytometry (A). PPD, NAC, and apocynin significantly decreased LPS-induced ROS production (B). Images are representative of three separate experiments performed in triplicate. Bars indicate the mean±standard deviation of three independent experiments performed in triplicate. *p<0.05 compared with zero value, †p<0.05 compared with LPS (100 ng/mL). LPS: lipopolysaccharide, NAC: N-acetylcysteine, PPD: protopanaxadiol, ROS: reactive oxygen species, FITC-A: fluorescein isothiocyanate-A.
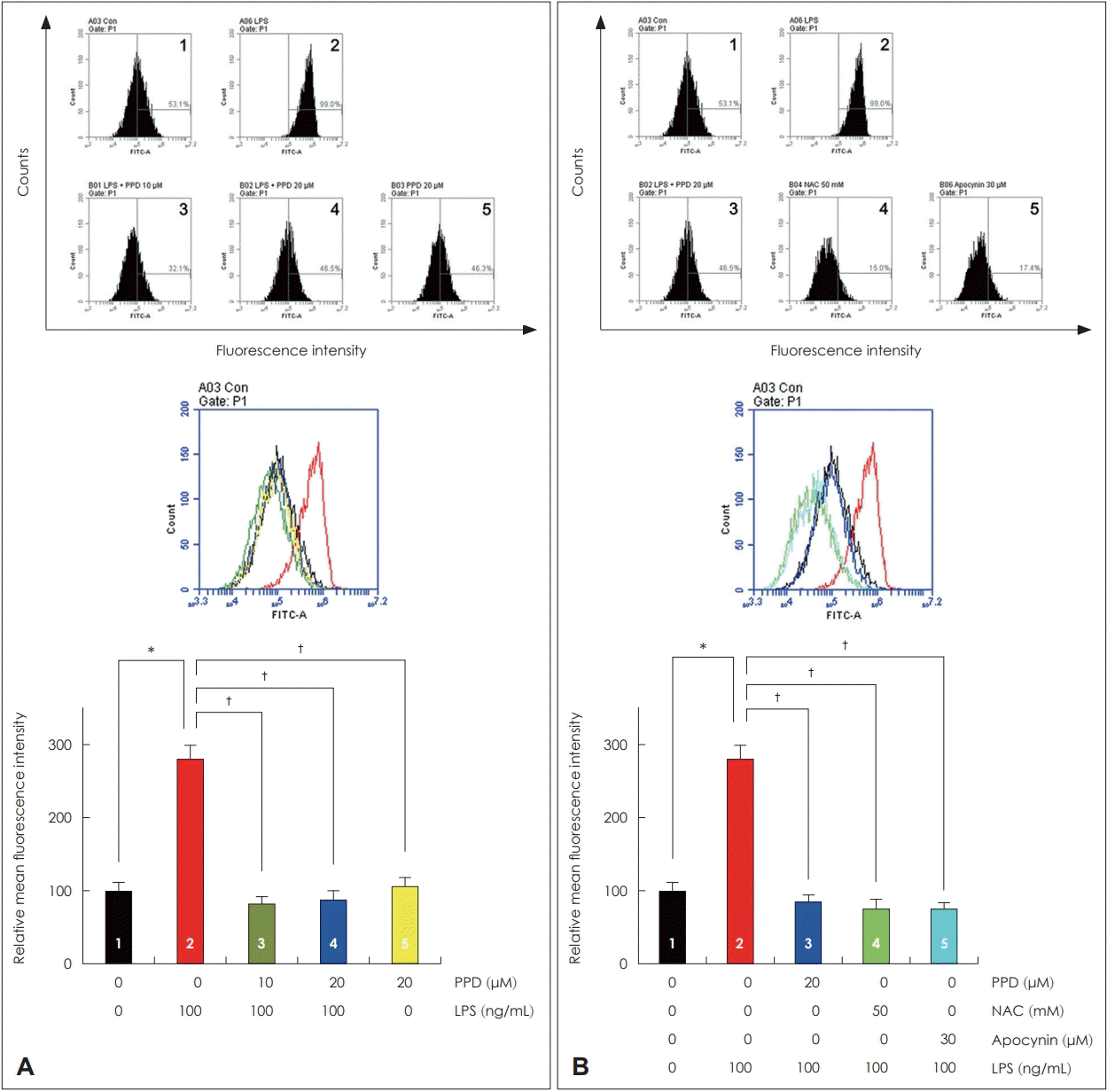
Fig. 4.
The effects of PPD, NAC and apocynin on LPS-induced MUC5AC expression in human NCI-H292 cells. PPD, NAC, and apocynin attenuate LPS-induced MUC5AC mRNA expression in RT-PCR (A). PPD, NAC, and apocynin decrease LPS-induced MUC5AC glycoprotein level in ELISA (B). Images are representative of three separate experiments performed in triplicate. Bars indicate the mean±standard deviation of three independent experiments performed in triplicate. *p<0.05 compared with zero value. †p<0.05 compared with LPS (100 ng/mL). ELISA: enzyme-linked immunosorbent assay, LPS: lipopolysaccharide, NAC: N-acetylcysteine, PPD: protopanaxadiol, RT-PCR: reverse transcription-polymerase chain reaction, GAPDH: glyceraldehyde-3-phosphate dehydrogenase.




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download