Abstract
The sensory function of the trigeminal nerve is to provide tactile, proprioceptive, and nociceptive afference by chemical stimulation. Various physical responses of the trigeminal nerve to stimuli help to defend against harmful substances. Recently, many studies have been conducted on solitary chemoreceptor cells innervated by trigeminal nerve. Most volatile organic compounds stimulate both the olfactory and trigeminal nervous systems. In general, the trigeminal nervous system is less sensitive than the olfactory nervous system. Studies have shown that sensation of the trigeminal nerve by chemical stimulation results in inhibition of olfaction. This indicates that the olfactory and trigeminal nerves interact with each other in the central nervous system. It is important to study various noxious stimuli acting on the trigeminal nerve in modern society where environmental concerns are intensifying.
비강은 후각신경(olfactory nerve)과 삼차신경(trigeminal nerve), 두 뇌신경의 지배를 받고, 이 두 신경은 후각물질(odorant)과 비자극(nasal pungency; irritation)을 전달한다. 19세기 초까지는 후각신경과 삼차신경의 역할을 구분하지 못하였었다. 이후 후각기능은 상실하였으나 비자극은 인지하는 사례들이 보고되었고, 1912년 Parker [1]가 척추동물의 점막에서 나타나는 후각이나 미각이 아닌 화학적 감응을 “common chemical sense”라고 명명하면서 후각과 비강의 삼차신경 화학수용이 구별되기 시작하였다. 1990년 Green 등[2]은 피부의 삼차신경이 통증뿐 아니라, 촉감, 온도 감각 같은 비통증 감각 모두를 전달한다고 하였으며 이를 “화학감각(chemesthesis)”이라고 언급하였다. 오늘날에는 대부분의 후각성 화학물질(odorous chemicals)들이 직간접적으로 비전정(nasal vestibule)과 비강에 위치한 삼차신경 말단을 자극시켜 간지럼증, 따뜻함, 시원함, 찌르는 듯한 느낌 등을 느끼게 되는 것임이 밝혀졌다[3].
음식이나 화장품 등의 비자극은 좋은 기분을 일으킬 수 있고 인간의 기억과도 관련이 있다. 반면에 공해 및 독성 물질 같은 비자극에 대한 감지를 통해 우리 몸을 보호 및 방어할 수 있다. 이렇듯 비강의 삼차신경 기능은 인간의 일상생활에 기능적으로 중요함에도 불구하고, 후각이나 미각에 비해 상대적으로 많은 과학적인 관심을 받지는 못해왔다. 따라서 본 종설에서는 기존 문헌을 검토하여 비강내의 삼차신경의 해부 및 생리를 정리하고, 비자극에 대한 삼차신경 화학수용과 관련한 연구들에 대하여 기술하고자 한다.
삼차신경의 가지(branch)에서 나온 감각신경 말단은 얼굴을 덮는 피부, 비강 및 구강의 점막, 눈꺼풀 그리고 각막에서 발견된다(Fig. 1). 삼차신경의 ophthalmic division의 nasociliary branch에서 나온 ethmoidal nerve가 비강의 전측방을 지배하고, 삼차신경의 maxillary division의 branch인 nasopalatine nerve가 비강의 후면을 지배한다. 발생학적으로 삼차신경의 신경절과 세 분지는 태생기 6주에 이미 완성이 되고, 신생아는 출생 시에 이미 삼차신경의 화학자극에 반응한다[4].
삼차신경에서는 여러 종류의 신경섬유가 발견되는데, 미세한 unmyelinated(C) 또는 small-diameter myelinated(Aδ) fiber는 substance P와 calcitonin gene-related peptide를 포함하고 있고, 피부뿐만 아니라 코와 호흡기에서의 자극 반응에 관여한다. 삼차신경의 유리종말(free ending)은 점막 상피 표면의 바로 아래, 즉, 1 micrometer 아래의 tight junction 위치에 존재하고, 이 유리종말에는 화학자극에 반응하는 다양한 수용체들이 있다. 특정 수용체가 활성 되면 이후 여러 이온채널들이 순차적으로 열리면서 탈분극이 일어나 활성전위(action potential)가 발생하게 된다[5]. 대표적으로, C fiber의 일부(subset)에서 발견되는 vanilloid 수용체는 capsaicin에 강한 친화도를 가지고 있어서 피부나 점막에 국소 capsaicin 자극을 주면 burning pain과 함께 주변 상피세포에 신경인성 염증반응을 일으킨다[6]. 이 수용체는 해로운 열자극(noxious heat)과 다양한 지방산 유도체에도 반응을 한다[7,8].
Silver와 Finger [9]는 화학물질이 유리종말을 자극하기 위해서는 자극 입자가 비강을 통과한 후 점막을 통과해 분산(diffuse)되고, 상피세포막과 세포간(tight junction)을 통과할 수 있어야 한다고 하였다. 최근에는 비강을 비롯하여 기도 및 소화관에도 흩어져 있는 변형된 형태의 상피세포인 solitary chemoreceptor cells(SCC)과 삼차 구심성(afferent) 신경이 서로 시냅스 하는 것이 발견되었다[9-13]. 즉, 전통적으로는 화학자극이 코의 상피 내에 있는 삼차신경의 유리종말을 직접 자극하는 것으로만 알려졌지만, 삼차신경과 함께 비강 전체에 퍼져 있는 SCC가 이중 화학감지체계(dual chemodetector systems)를 이루는 것으로 생각된다(Fig. 2) [14].
삼차신경의 말단에는 전기생리학적인 검사에서 nicotine에 의해 용량 의존적 입체선택 활성(dose dependent stereoselective activation)을 보이는 nicotinic acetylcholine 수용체가 있다[15-17]. 이 nicotinic acetylcholine 수용체를 막았을 때 SCC 매개 신경인성 염증반응이 예방되는데, 이것은 SCC가 콜린성 신경전달물질을 통해 삼차신경을 자극시켜서 염증반응이 일어난다는 것을 의미한다[14].
SCC는 삼차신경의 유리종말과는 다르게 미각 수용체를 가지고 있다. Tizzano 등[13]은 사람 코의 SCC에 쓴맛 수용체(bitter taste receptor)가 존재함을 밝혀냈다. SCC는 삼차신경과 연접해 있으므로 쓴맛 수용체의 화학자극을 미각으로 느끼지 않고 irritation 또는 통증으로 느끼게 된다[11]. 또한 쓴맛 수용체는 화학자극만 아니라 bacteria에도 반응하여 biofilm을 형성하기 전에 상피세포의 염증반응을 유도하는 역할을 한다[18].
쥐를 대상으로 한 연구에서는 비강으로 들어가는 입구에 SCC가 조밀하게 위치하고, 과도한 비자극 및 유해 물질의 접근을 제한하는 데에 중요한 역할을 한다는 것을 밝혔다[19]. 또한 삼차신경 섬유를 제거한 쥐 모델에서 SCC의 분화 및 생존은 삼차신경 섬유의 영향을 받지 않고 독립적임을 알 수 있었다[20].
이처럼 SCC는 삼차신경 감각에 보조적인 역할을 하면서 독자적인 특징들도 가지고 있다. 비강 질환의 병태 생리와의 연관성과 관련하여 SCC의 역할에 대한 연구는 앞으로도 진행될 것이라 예상된다.
수많은 휘발성 화학물질(volatile chemicals)들은 정교히 맞춰진 삼차신경 수용체에 반응한다. 이들은 어느 농도 이상에서 모두 코와 눈에 자극을 줄 수 있다. 휘발성 화학물질은 삼차신경을 자극하여 1) 호흡이나 비분비(nasal secretion)에 변화를 주거나 2) cooling, burning, irritation, pain 등을 인지하게 하거나 3) 후각신경의 냄새 인지에 영향을 끼친다[3].
순수한(pure) 후각 자극물질이란 어떤 농도에서도 삼차신경을 자극시키지 않는 냄새로서 인간의 후각연구에 매우 중요하다. 깨끗한 공기조차 흐름속도(flow rate), 온도, 습도에 따라 삼차신경을 자극할 수 있지만, 어떤 화학물질은 깨끗한 공기 이상으로 삼차신경을 거의 자극하지 않거나, 자극이 없는 것으로 알려졌다. 1925년 von Skramlik [21]은 anethole, cadinene( juniper), eugenol, geraniol, indole, limonene, phenyl ethyl alcohol, pinene, skatol, terpineol을 포함하여 약 50가지의 순수한 후각자극 물질을 제시하였다. 1975년 Doty [22]가 무후각증 환자를 통해 알아낸 11가지 순수한 후각자극 물질 역시 von Skramlik [21]가 제시한 것과 대부분 일치하였으나, 이 후 진행된 연구에서는 순수한 후각자극 물질이라고 생각되었던 이들 중 대부분을 일부 무후각증 환자나 삼차감각에 집중한 피험자들이 감지하는 것을 확인하였다[23].
von Skramlik [21]은 후각신경과 삼차신경을 함께 자극시키는 순수하지 않은(impure) 물질도 분류하였다. 냄새와 달콤한 느낌이 나는 물질(bromoform, chloroform, ethyl chloride, iodoform, nitrobenzol), 냄새와 신 느낌이 나는 물질(acetic acid, butyric acid, propionic acid, valerianic acid), 냄새와 시원한 느낌이 나는 물질(camphor, eucalyptol, menthol, phenol, safrol), 냄새와 따뜻한 느낌이 나는 물질(ethanol, pentanol, propanol), 그리고 냄새와 통증 또는 찌르는 느낌이 나는 후각물질(acetone, acetic acid, ammonia, bromine, chlorine, formic acid, iodine, nicotine, pyridine, SO2, thiophene, tolol, xylol)이 있다고 보고하였다[21]. 최근 유해환경과 관련하여 중요시되는 휘발성 유기 화합물(volatile organic compounds, VOCs)의 대부분은 자극을 주는 조건과 농도에 따라 후각신경과 삼차신경을 모두 자극하는 것으로 밝혀졌다[3].
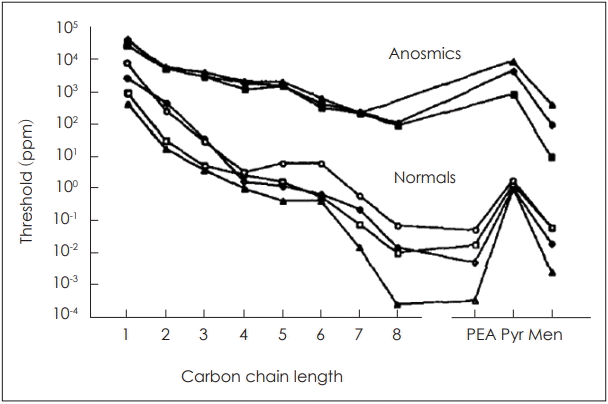
여러 연구들을 통해 후각계가 삼차신경계보다 더 예민함이 확인되었다[23,24]. 즉, 처음에는 냄새만 감지하다가 화학 물질의 농도가 증가할수록 삼차신경의 화학감각을 함께 느끼는 지점이 발생한다. 또한 두 신경이 함께 자극되면 후각 자극이 삼차신경 자극에 대한 반응을 방해하는 후각 간섭이 발생하게 된다. 따라서 비강에서 삼차신경 화학감각의 역치를 확인할 때에는 무후각증 환자를 대상으로 측정해야 한다[24].
후각 간섭을 제외한 삼차신경 감각 연구는 안점막(ocular mucosa) 자극을 이용하여 시행할 수도 있다[25]. 코와 눈의 삼차신경 화학 감수성은 대체적으로 유사하다[26]. 특정 화학물질이나 특정 조건에서는 눈에서의 반응이 코보다 덜하거나 더 할 수도 있으나 눈과 코에서의 삼차신경 감각의 감수성 차이는 후각과 코의 삼차신경 감각의 감수성 차이보다는 훨씬 작은 것으로 알려져 있다[27].
독성학(toxicology)에서는 후각신경과 삼차신경을 모두 자극하는 VOCs의 자극 정도(degree), 양(dose) 등이 중요한 이슈이다. 냄새를 인지하는 최소농도, 삼차신경 자극을 인지하는 최소농도, 두 가지 모두 느끼는 최소농도 등으로 구별하여, 향수제조, 음식, 실내공기 질(indoor air quality) 평가에 매우 유용한 정보를 제공한다. 하지만 많은 VOCs 관련 연구들에서 사용하는 강제 선택적 정신물리학적 검사(forced-choice psychophysical test)로는 정확한 역치를 확인하는 데에 한계가 있다.
일상생활에서 화학적 감각은 복합적인 성분이 혼합된 상태로 자극되며, 이는 삼차신경계도 마찬가지이다. 그러나 화학혼합물(chemical mixture)에 대해 삼차신경계가 반응하는 원리는 아직 많이 알려진 바가 없다. 쏘는 듯한(pungent) 자극이 있는 4단계 농도의 formaldehyde와 ammonia를 섞은 혼합물들을 비교한 연구에서 저, 중, 고농도로 변함에 따라 혼합물의 총 인지 강도는 저가산성(hypoadditivity), 단순 가산성(simple additivity), 고가산성(hyperadditivity)으로 나타난다는 것이 밝혀진 바 있다[29]. 즉, 두 성분의 농도가 증가할수록 그 혼합물은 각각의 성분에 대한 자극을 합친 것보다 더 높은 강도의 반응을 보인다는 것이다. 이 결과는 삼차신경계가 점차적으로 많은 개입을 한다는 점을 보여준다. 같은 성분과 혼합물을 이용한 후속 연구에서는, 주어지는 자극에 대해 피험자가 후각 자극과 삼차신경 자극으로 그 속성을 구분하도록 하였다. 그 결과 후각 자극은 혼합물에서 항상 저가산성을 보였으나, 삼차신경 자극은 주로 가산성을 보였고 고가산성을 보인 경우도 있었다[30].
후각계와 삼차신경계는 생리적인 상호작용을 한다. 1868년에 Alexander Bain은 “만약 탄산 흐름(current)이 냄새 자극과 마주치게 되면, 냄새 자극은 사라진다”라 보고하였고, 1930년 Katz와 Talbert [33]는 후각과 통각 성분을 모두 가진 냄새를 높은 농도로 주었을 때, 통각 성분이 우위를 차지하는 것을 밝혔다. 이는 삼차신경이 후각신경으로 전달되는 자극을 차폐한다는 사실을 시사한다.
Cain과 Murphy [34]는 각 4단계 농도의 n-amyl butyrate와 CO2를 혼합한 총 16가지의 혼합물을 이용하여 피험자가 추정하는 전반적인 감각 강도와 냄새와 통각 강도를 나누어 표시하도록 하였다. 또한 이어지는 시험에서 피험자의 한쪽 콧구멍에서 CO2를 자극하였고, 다른 쪽 콧구멍에는 n-amyl butyrate를 자극하였다. 두 시험 결과 모두에서 n-amyl butyrate의 자극이 CO2로 인해 억제되는 것으로 밝혀졌다. 이는 중추신경계에서 후각계와 삼차신경계의 상호작용이 이루어진다는 점을 시사한다. 따라서 특정 화학 물질 또는 혼합물에 대한 반응을 예측할 때는 후각계와 삼차신경계의 상호작용으로 인한 억제 패턴에 대한 이해가 선행되어야 한다.
유해환경 노출은 크게 직업적(산업적) 노출과 주거적(비산업적) 노출로 나눌 수 있다. American Conference of Industrial Hygienists에 따르면 산업적 유해환경 노출에서 40%의 허용한계점(threshold limit values, TLVs)은 감각계의 자극 정도에 따른 것으로, 이는 눈과 코, 목의 자극을 포함한다[35]. 산업적 유해환경 노출은 각 산업체에서 사용하는 물질과 생산법에 따라 좌우되며, 문제를 일으키는 것이 별개의 성분으로 인한 것인지, 혼합물로 인한 것인지, 의식할 수 있는 정도의 냄새가 나는지에 따라 달라진다. 이에 따라 유해반응을 피하기 위해 용인할 수 있는 노출 정도를 TLVs로 지정하게 된다.
환경분야에서 볼 때 공수적(airborne) 화학물질의 삼차신경 자극을 후각적 자극에서 분리한다는 점은 여러 시사점을 가진다. 쥐를 이용하여 자극물질에 따른 호흡곤란을 생물학적 정량법으로 측정한 연구가 시행된 바 있으나, 이것을 사람에게 적용될 수 있는지는 논란이 된 바 있다[36]. 삼차신경 자극을 후각적 자극과 분리시킬 수 있다면, 공수적 화학물질의 유해자극을 사람에게 직접적으로 평가할 수 있는 방법이 될 것이다.
최근에는 오피스건물, 학교, 주거지 등 실내에서 발생하는 비산업적 유해환경 노출에 대하여 많은 관심이 생기고 있다. 실내에서 생활하는 많은 사람들이 눈과 코, 목의 자극과 함께 두통, 집중하기 어려움, 무기력함 등을 호소하고, 이러한 일련의 증상들은 “sick building syndrome”으로 정의된 바 있다[37]. 이러한 증상들은 여러 가지 다양한 화학적, 물리학적 원인들로 인한 것이지만, 그중 VOCs가 가장 중요한 역할을 한다[38]. 이러한 증상들이 삼차신경계와 관련 있음을 생각해볼 때, 이에 대한 화학수용체를 연구하는 것이 관련 증상을 이해하고, 조절 및 예방하는 데에 도움이 될 것이다. 이와 가장 관련 있는 이슈는 1) 원인 공수물질의 자극을 물리화학적으로 파악하여 미리 예방하는 것 2) 혼합물의 각 화학적 성분이 어떻게 복합적인 삼차신경 자극을 나타내는지를 규명하는 것이다.
이전에 삼차신경계와 후각계의 역치는 “squeeze bottles”로 많이 측정되었는데, 이 방법으로 여러 화학물질의 상대적인 화학감각 강도(chemosensory potency)를 간단하고 편리하게 알 수 있었다. 최근의 연구에서는 squeeze bottles 대신 nosepiece가 달린 glass vessels을 이용하여 비자극 물질을 희석 없이 전달하였고, 이때 역치가 일괄적으로 의미 있게 낮게 측정되었다[39,40]. 그러나 이렇게 계산된 역치를 전신 노출과 같은 실제 환경 조건의 절대치로 적용하는 것은 무리가 있다. 또한 자극물질이 주어지는 온도에 따라서도 포화 증기 농도가 다르므로 역치가 달라질 수 있다[40]. 측정된 역치와 실제 환경에서의 노출과의 관계는 앞으로 더 많은 연구가 필요하겠다.
REFERENCES
1. Parker GH. The relation of smell, taste, and the common chemical sense in vertebrates. J Acad Nat Sci Phila. 1912; 15:219–34.
2. Green BG, Mason JR, Kare MR. Chemical senses, vol. 2: irritation. New York: Marcel Dekker;1990.
3. Doty RL, Cometto-Muñiz JE. Handbook of olfaction and gustation. 2nd ed. New York: Marcel Dekker;2003. p. 981–1000.
4. Kehrli P, Maillot C, Wolff MJ. Anatomy and embryology of the trigeminal nerve and its branches in the parasellar area. Neurol Res. 1997; 19(1):57–65.

6. Rentmeister-Bryant H, Green BG. Perceived irritation during ingestion of capsaicin or piperine: comparison of trigeminal and non-trigeminal areas. Chem Senses. 1997; 22(3):257–66.

7. Sekizawa SI, Tsubone H. Nasal receptors responding to noxious chemical irritants. Respir Physiol. 1994; 96(1):37–48.

8. Vriens J, Appendino G, Nilius B. Pharmacology of vanilloid transient receptor potential cation channels. Mol Pharmacol. 2009; 75(6):1262–79.

9. Silver WL, Finger TE. The anatomical and electrophysiological basis of peripheral nasal trigeminal chemoreception. Ann N Y Acad Sci. 2009; 1170:202–5.

10. Sbarbati A, Osculati F. Solitary chemosensory cells in mammals? Cells Tissues Organs. 2003; 175(1):51–5.

11. Finger TE, Böttger B, Hansen A, Anderson KT, Alimohammadi H, Silver WL. Solitary chemoreceptor cells in the nasal cavity serve as sentinels of respiration. Proc Natl Acad Sci U S A. 2003; 100(15):8981–6.

12. Braun T, Mack B, Kramer MF. Solitary chemosensory cells in the respiratory and vomeronasal epithelium of the human nose: a pilot study. Rhinology. 2011; 49(5):507–12.

13. Tizzano M, Cristofoletti M, Sbarbati A, Finger TE. Expression of taste receptors in solitary chemosensory cells of rodent airways. BMC Pulm Med. 2011; 11:3.

14. Saunders CJ, Christensen M, Finger TE, Tizzano M. Cholinergic neurotransmission links solitary chemosensory cells to nasal inflammation. Proc Natl Acad Sci U S A. 2014; 111(16):6075–80.

15. Alimohammadi H, Silver WL. Evidence for nicotinic acetylcholine receptors on nasal trigeminal nerve endings of the rat. Chem Senses. 2000; 25(1):61–6.

16. Schreiner BS, Lehmann R, Thiel U, Ziemba PM, Beltrán LR, Sherkheli MA, et al. Direct action and modulating effect of (+)- and (-)-nicotine on ion channels expressed in trigeminal sensory neurons. Eur J Pharmacol. 2014; 728:48–58.

17. Thuerauf N, Kaegler M, Dietz R, Barocka A, Kobal G. Dosedependent stereoselective activation of the trigeminal sensory system by nicotine in man. Psychopharmacology (Berl). 1999; 142(3):236–43.

18. Tizzano M, Gulbransen BD, Vandenbeuch A, Clapp TR, Herman JP, Sibhatu HM, et al. Nasal chemosensory cells use bitter taste signaling to detect irritants and bacterial signals. Proc Natl Acad Sci U S A. 2010; 107(7):3210–5.

19. Ogura T, Krosnowski K, Zhang L, Bekkerman M, Lin W. Chemoreception regulates chemical access to mouse vomeronasal organ: role of solitary chemosensory cells. PLoS One. 2010; 5(7):e11924.

20. Gulbransen B, Silver W, Finger TE. Solitary chemoreceptor cell survival is independent of intact trigeminal innervation. J Comp Neurol. 2008; 508(1):62–71.

21. von Skramlik E. Über die Lokalisation der Empfindungen bei den niederen Sinnen. Zeitschrift für Sinnesphysiologie. 1925; 56:69–140.
22. Doty RL. Intranasal trigeminal detection of chemical vapors by humans. Physiol Behav. 1975; 14(6):855–9.

23. Doty RL, Brugger WE, Jurs PC, Orndorff MA, Snyder PJ, Lowry LD. Intranasal trigeminal stimulation from odorous volatiles: psychometric responses from anosmic and normal humans. Physiol Behav. 1978; 20(2):175–85.

24. Cometto-Muñiz JE, Cain WS. Thresholds for odor and nasal pungency. Physiol Behav. 1990; 48(5):719–25.

25. Doty RL, Cometto-Muñiz JE, Jalowayski AA, Dalton P, Kendal-Reed M, Hodgson M. Assessment of upper respiratory tract and ocular irritative effects of volatile chemicals in humans. Crit Rev Toxicol. 2004; 34(2):85–142.

26. Cometto-Muñiz JE, Cain WS, Abraham MH. Chemosensory additivity in trigeminal chemoreception as reflected by detection of mixtures. Exp Brain Res. 2004; 158(2):196–206.

27. Cometto-Muñiz JE, Cain WS, Abraham MH, Kumarsingh R. Trigeminal and olfactory chemosensory impact of selected terpenes. Pharmacol Biochem Behav. 1998; 60(3):765–70.

28. Cometto-Muñiz JE, Cain WS, Abraham MH. Nasal pungency and odor of homologous aldehydes and carboxylic acids. Exp Brain Res. 1998; 118(2):180–8.

29. Cometto-Muñiz JE, García-Medina MR, Calviño AM. Perception of pungent odorants alone and in binary mixtures. Chem Senses. 1989; 14(1):163–73.

30. Cometto-Muñiz JE, Hernández SM. Odorous and pungent attributes of mixed and unmixed odorants. Percept Psychophys. 1990; 47(4):391–9.
31. Cometto-Muñiz JE, Cain WS, Abraham MH, Gola JM. Chemosensory detectability of 1-butanol and 2-heptanone singly and in binary mixtures. Physiol Behav. 1999; 67(2):269–76.
32. Cometto-Muñiz JE, Cain WS, Abraham MH, Gola JM. Ocular and nasal trigeminal detection of butyl acetate and toluene presented singly and in mixtures. Toxicol Sci. 2001; 63(2):233–44.
33. Katz SH, Talbert EJ. Intensities of odors and irritating effects of warning agents for inflammable and poisonous gases. US Govt Print Off. 1930; 480:1–37.
34. Cain WS, Murphy CL. Interaction between chemoreceptive modalities of odour and irritation. Nature. 1980; 284(5753):255–7.

35. Alarie Y. Dose-response analysis in animal studies: prediction of human responses. Environ Health Perspect. 1981; 42:9–13.

36. Bos PM, Zwart A, Reuzel PG, Bragt PC. Evaluation of the sensory irritation test for the assessment of occupational health risk. Crit Rev Toxicol. 1991; 21(6):423–50.

37. Apter A, Bracker A, Hodgson M, Sidman J, Leung WY. Epidemiology of the sick building syndrome. J Allergy Clin Immunol. 1994; 94(2 Pt 2):277–88.

38. Hodgson M, Levin H, Wolkoff P. Volatile organic compounds and indoor air. J Allergy Clin Immunol. 1994; 94(2 Pt 2):296–303.

39. Cometto-Muñiz JE, Cain WS, Hiraishi T, Abraham MH, Gola JM. Comparison of two stimulus-delivery systems for measurement of nasal pungency thresholds. Chem Senses. 2000; 25(3):285–91.
Fig. 1.
Trigeminal nerve. Adapted from Mosby, et al. Mosby’s medical dictionary. 10th ed. St. Louis: Elsevier;2016. p.1985.
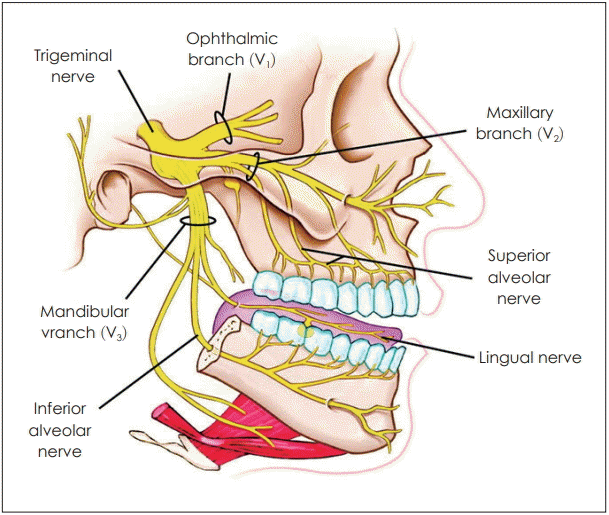
Fig. 2.
Diagram of the nasal respiratory epithelium showing respiratory epithelial cells and a SCC. Peptidergic TN fibers come close to the surface of the respiratory epithelium and end below a line of tight junctions. Lipid soluble chemicals should be able to reach the free nerve endings below the tight junctions. Water soluble compounds in the lumen of the nasal cavity can stimulate SCCs directly. The SCC would, in turn, activate peptidergic TN fibers. SCC: solitary chemoreceptor cell, TN: trigeminal nerve. Adapted from Silver and Finger. Ann N Y Acad Sci 2009;1170:202-5 [9].
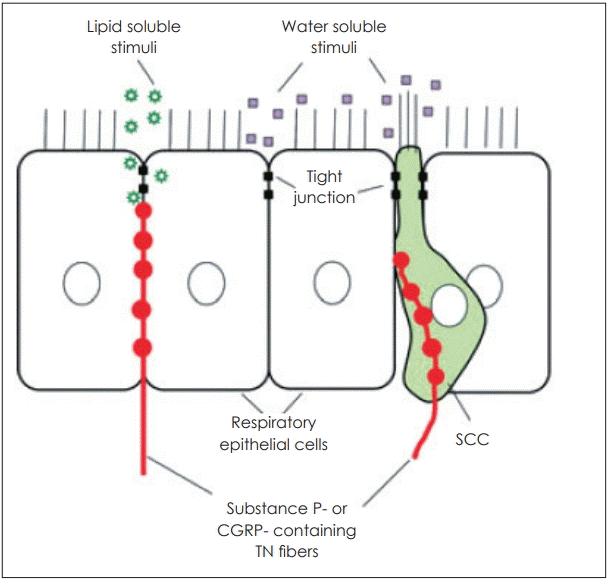
Fig. 3.
The thresholds decreased log-arithmically with increasing carbon chain length of the alcohols, both for normosmics (odor thresholds) and for anosmics (pungency thresholds). The numbers 1 to 8 stand for the aliphatic alcohols from methanol to 1-octanol. PEA: phenyl ethyl alcohol, Pyr: pyridine, Men: menthol. Adapted from Cometto-Muñiz and Cain. Physiol Behav 1990;48(5):719-25 [24].




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download