Abstract
Natural orifice transluminal endoscopic surgery (NOTES) is the latest surgical technique for inserting an endoscope through the mouth, anus, vagina etc., and for performing surgery with mucosal incision only, i.e., without skin incision. Recently, a number of researchers have applied NOTES to thyroid surgery in several trials, with the aim of removing the thyroid gland through oral cavity. The transoral endoscopic thyroid surgery became widely known after Anuwong et al. reported successful results for their first 60 patients and it has become increasingly recognized as a feasible novel surgical procedure. The purpose of this article is to review and summarize the existing literature, and describe in detail the preoperative considerations, rationale for patient selection, surgical method and postoperative management for transoral thyroid surgery.
자연 개구부 내시경 수술(natural orifice transluminal endoscopic surgery, NOTES)은 입, 항문, 질 등을 통해 내시경을 삽입하고 피부 절개 없이 점막 절개만으로 수술을 수행하는 최신 수술 기법이다. 최근에 많은 연구자들이 NOTES를 갑상선 수술에 적용하여 구강을 통해 갑상선을 제거하고자 노력을 해왔다[1]. 갑상선 구강내시경 수술(transoral endoscopic thyroid surgery)의 접근 경로는 크게 두 가지로 나눌 수 있다. 첫 번째는 설하 경로(sublingual route), 두 번째는 전정 경로(vestibular route)이다. 지금까지 보고된 바에 의하면 설하 경로는 조직 손상이 크고 합병증이 비교적 많았다[2-5]. 한편, 전정 경로는 2016년에 Anuwong [6]이 60명의 환자에서 성공적인 결과를 보고한 이후에 널리 알려지게 되었다. 그는 수술 방법을 정리하여 transoral endoscopic thyroidectomy vestibular approach(TOETVA)라고 명칭을 하였다. 다양한 국가의 많은 연구자들이 TOETVA 또는 이와 유사한 방법으로 수술을 시도하고 성공적인 초기 결과를 보고하였다[7-14]. TOETVA는 전세계의 여러 의사들이 많은 관심을 가지고 있으며 멀지 않은 미래에 갑상선 수술의 새로운 대안이 될 것으로 기대된다. 최근에 국내에서도 이비인후과와 외과에서 갑상선 구강내시경 수술 또는 로봇 수술에 관심을 가지고 활발히 시행하고 있다. 갑상선 구강내시경 수술을 시작하는 수술자를 위해 기존 문헌을 검토하여 수술 전 고려사항, 환자 선택, 수술 방법 및 술 후 관리에 대해 정리하고자 한다.
갑상선 구강내시경 수술은 임상에서 사용된 지 얼마 되지 않은 최신의 수술 방법이므로 아직 명확한 적응증이나 금기의 기준이 확립되지 않았으나, 최근 Razavi와 Russell [15]은 영어 기반의 문헌들을 검토하여 갑상선 구강내시경 수술의 적응과 금기를 요약하여 발표하였다. 대다수의 저자들이 가장 중요한 적응증으로 ‘새로운 접근 경로를 통해 갑상선을 제거하고자 하는 환자의 동의’라고 의견의 일치를 보였으나 절제에 적합한 갑상선의 부피나 주요결절의 크기에 대해서는 아직 충분한 합의가 이루어지지 않았다. 그들이 제시한 적응증을 보면, 양성이거나 중등도인 경우(Bethesda II, III, IV)에는 갑상선의 직경 10 cm 미만과 결절 크기는 6 cm 미만, 악성이 의심되는 경우(Bethesda V, VI)에는 주요결절 직경 2 cm 미만으로 하였다. 그레이브스병을 가진 환자들도 적응증에 조심스럽게 포함시켰다. 한편, Anuwong 등[16]은 그의 다른 논문에서 양성종양이 의심되는 경우에는 약 6~8 cm 이하일 경우에도 TOETVA의 대상이 될 수 있다고 하였다. 이전에 두경부 수술이나 방사선 치료(종격동 포함)를 받은 환자, 전신마취를 할 수 없는 환자, 급성 갑상선 기능 항진증, 반회후두 신경 마비, 갑상선 흉골하 확장, 수술 전 림프절 전이, 갑상선외 확장, 구강 농양, 그리고 위에서 언급한 적응증을 만족하지 않는 환자는 절대적 금기로 권고하였으며 상대적 금기는 하시모토 갑상선염과 비만으로 하였다[15]. 또 다른 연구에서 중심경부림프절 절제술은 예방적 관점(수술자를 포함한 의료진이 중심경부림프절제로 얻는 병리학적 정보가 주는 이득이 수술로 인한 위험보다 크다고 판단하는 경우)에서 혹은 치료적 관점(림프절 전이가 수술 도중에 새로 발견되었을 경우)에서 시행할 수 있다고 하였다[17].
직경 10 mm, 30° 경성 내시경을 일반적으로 사용한다. 일반적인 내시경 기구에는 Babcock forceps, Johann forceps, right-angled forceps, short Maryland forceps, ultrasonic device 등을 사용한다. 기구 삽입을 위해 5 mm 캐뉼러 두 개, 내시경 삽입을 위한 10 mm 캐뉼러 하나를 사용한다. 처음 수술 공간을 만들 때 hydro-dissection을 하기 위해 Veress needle을 사용하고, vascular tunneller와 Kelly clamp 같은 끝이 뾰족하지 않은 기구들을 이용하여 수술 공간을 넓힌다(Fig. 1). 절제된 검체는 내시경용 주머니(endoscopic pouch)에 넣어서 제거한다.
저자는 일반적으로 근전도(electromyogram) 튜브를 사용해 경구기관삽관을 통해 전신마취를 한다. 튜브는 좌우측 입가장자리에 고정하여(마취 장비와 같은 방향) 수술 중에 빠지지 않게 한다. Anuwong을 비롯한 여러 저자들은 수술 중 구강의 튜브가 수술을 방해하거나 빠지는 것을 예방하기 위해 경비기관삽관을 한다고 하였다[6,7,10,16]. 저자도 초기에는 경비기관삽관을 하였으나 이후 경구기관삽관으로 변경하였으며, 변경 후 수술을 방해하거나 문제를 일으킨 경우는 없었다[9]. 환자의 자세는 앙와위를 취하게 하고 등 밑에 베개를 넣어 목이 약간 신전 되도록 한다. 환자의 머리를 접착반창고로 침대에 단단히 고정하여 수술 중 머리가 돌아가지 않도록 한다(Fig. 2A). 구강과 경부 전방부를 포비돈 용액(povidine/water solution)으로 소독한다. 수술 부위 준비는 일반적인 방법으로 시행하며 위로는 윗입술이, 아래로는 흉골절흔(sternal notch)이 충분히 노출되게 한다(Fig. 2B). 집도의, 보조의사 2명, 간호사(scrub nurse)로 이루어진 4명의 의료인이 수술을 한다. 집도의가 환자의 머리 쪽에 위치하고 보조의사가 양옆에, 간호사는 환자의 다리 쪽에 위치한다(Fig. 2C).
이산화탄소 색전증을 예방하기 위해서 이산화탄소를 낮은 압력으로 주입하는 것이 매우 중요하다[18]. 저자는 이산화탄소의 초기압력을 6 mm Hg가 넘지 않게 하며 수술 중에는 보통 3~4 mm Hg 정도로 유지하고, 유량(flow rate)은 12 L/min으로 설정한다. Anuwong [19]은 유량을 15 L/min로 설정하고 가스 압력은 6 mm Hg를 초과하지 않아야 한다고 하였으며, 갑상선 종양이 큰 경우에는 넓은 공간 확보를 위해 유량을 20 L/min 정도로 높일 수 있다고 하였다. 마취과 의사와 긴밀히 협력하여 호기 말 이산화탄소 분압(end-tidal carbon dioxide, ETCO2)을 지속적으로 측정하며 가능하면 40 mm Hg를 초과하지 않도록 한다. 이산화탄소의 흡수율은 담낭 수술 등 복강경 수술을 할 때(이산화탄소를 복강내 주입할 때)보다 갑상선 내시경 수술을 할 때(이산화탄소를 복강외 주입할 때) 더 높게 나타나므로 주의해야 한다[20]. ETCO2 측정은 가스 색전증을 진단하는 데 매우 민감하고 비침습적인 좋은 방법이다. 이산화탄소 색전이 발생하면 ETCO2 수치가 증가하거나 감소할 수 있다. ETCO2의 일시적인 증가는 혈중에 용해된 이산화탄소의 증가 때문이며 ETCO2의 급격한 감소는 색전이 폐 혈관계의 일부를 막아서 발생한다[21]. 이산화탄소 색전을 예방하기 위한 프로토콜이 아직까지는 명확히 확립되지 않았다. 저자는 수술 도중에 ETCO2가 40 mm Hg 이상으로 올라가면 일단 CO2 가스 압력을 낮추어 보고, 그래도 ETCO2가 40mm Hg 미만으로 떨어지지 않으면 수술을 중단하고 CO2 가스 밸브를 막고 ETCO2가 떨어질 때까지 기다린다. 수술이 끝나고 나면 이산화탄소 관련 합병증을 항상 염두에 두어야 한다. 환자에게 마스크를 통해 산소를 공급하고, 호흡곤란의 징후를 점검하며, 피하기종을 확인한다.
잇몸에서 1 cm 떨어진 전정 중앙에, Bovie를 이용하여 2 cm의 곡선 절개를 만들고, 안쪽으로 박리하여 턱끝근(mentalis muscle)의 내측 부분을 절개하여 하악의 아래쪽 경계가 노출되도록 한다(Fig. 3A). 하악의 아래쪽 경계가 노출되면 Veress needle을 사용하여 40~50 mL의 생리식염수를 활경근 아랫면(subplastysma plane)에 주입하여 수술 공간을 확보한다(hydro-dissection)(Fig. 3B). Kelly clamp를 사용하여 턱끝밑(submental)의 작업 공간을 조심스럽게 넓힌다. 다음으로, vascular tunneller와 같은 끝이 뾰족하지 않은 기구를 절개 부위를 통해 삽입하여 활경근 아랫면에서 부채꼴 형태로 박리하여 역삼각형 모양의 수술 공간을 만들어 준다(Fig. 3C). 즉, 흉골절흔(sternal notch)이 하단 경계를 이루고 양쪽 흉쇄유돌근(sternocleidomastoid) 앞쪽 선이 측면 경계를 이룬다. 직경 10 mm 캐뉼러를 삽입하여 이산화탄소 가스를 압력 6 mm Hg, 유속 12 L/min로 유지한다. 10 mm, 30° 내시경을 캐뉼러에 삽입하여 수술 공간이 잘 형성되었는지 확인한다. 다음으로, 제2 소구치와 제1 대구치 근처 전정에 양쪽 측면 절개를 하고, 각 절개를 통해 직경 5 mm 캐뉼러를 삽입한다(Fig. 3D). 턱끝신경(mental nerve)이 턱끝구멍(mental foramen: 제1 소구치와 제2 소구치 사이 정도에 위치)에서 나와 앞쪽으로 주행하므로 이보다 후방에 측면 절개를 가하는 것이 안전하다. Maryland forceps, L-hook 소작기와 초음파장비를 각 측면 캐뉼러로 삽입하여 활경근 아랫면을 따라 하방으로 흉골절흔까지, 양쪽 측면으로 흉쇄유돌근까지 수술 공간을 확장한다.
초음파 절삭기, L-hook 소작기를 이용하여 피대근(strap muscle)의 중앙봉선(median raphe)을 분리하여 갑상선 협부를 노출시키고 피대근을 갑상선에서 분리한다(Fig. 4A). 경부 피부로부터 2-0 black silk를 삽입하고 피대근을 관통해서 다시 경부로 빼낸 후에 측면으로 당겨서 갑상선을 노출시킨다(개방 갑상선 수술에서 피대근을 Army와 Navy로 견인하는 것과 같은 효과가 있다). 박리를 내측으로 진행하여, 초음파 절삭기를 이용하여 협부를 절제한다. 이후, 기구를 외측으로 옮겨 무혈관 흉골설골-후두삼각(sternohyoid-laryngeal triangle)을 확인하고 상극을 Babcock이나 Johann forceps로 잡아 내측으로 당겨서 상갑상선 혈관을 노출시킨다. 이어서 초음파 절삭기를 이용하여 상갑상선 혈관을 절제한다(Fig. 4B).
ACKNOWLEDGMENTS
This work was supported by the National Research Foundation of Korea(NRF) grant funded by the Korea government (No. NRF2014R1A2A2A03004802).
REFERENCES
1. Moris DN, Bramis KJ, Mantonakis EI, Papalampros EL, Petrou AS, Papalampros AE. Surgery via natural orifices in human beings: yesterday, today, tomorrow. Am J Surg. 2012; 204(1):93–102.

2. Wilhelm T, Metzig A. Endoscopic minimally invasive thyroidectomy (eMIT): a prospective proof-of-concept study in humans. World J Surg. 2011; 35(3):543–51.

3. Wang Y, Xie QP, Yu X, Xiang C, Zhang ML, Zhao QZ, et al. [Preliminary experience with transoral endoscopic thyroidectomy via vestibular approach: a report of 150 cases in a single center]. Zhonghua Wai Ke Za Zhi. 2017; 55(8):587–91.
4. Karakas E, Steinfeldt T, Gockel A, Westermann R, Kiefer A, Bartsch DK. Transoral thyroid and parathyroid surgery. Surg Endosc. 2010; 24(6):1261–7.

5. Nakajo A, Arima H, Hirata M, Mizoguchi T, Kijima Y, Mori S, et al. Trans-oral video-assisted neck surgery (TOVANS). a new transoral technique of endoscopic thyroidectomy with gasless premandible approach. Surg Endosc. 2013; 27(4):1105–10.

6. Anuwong A. Transoral endoscopic thyroidectomy vestibular approach: a series of the first 60 human cases. World J Surg. 2016; 40(3):491–7.

7. Chai YJ, Chung JK, Anuwong A, Dionigi G, Kim HY, Hwang KT, et al. Transoral endoscopic thyroidectomy for papillary thyroid microcarcinoma: initial experience of a single surgeon. Ann Surg Treat Res. 2017; 93(2):70–5.

8. Dionigi G, Tufano RP, Russell J, Kim HY, Piantanida E, Anuwong A. Transoral thyroidectomy: advantages and limitations. J Endocrinol Invest. 2017; 40(11):1259–63.

9. Park JO, Sun DI. Transoral endoscopic thyroidectomy: our initial experience using a new endoscopic technique. Surg Endosc. 2017; 31(12):5436–43.

10. Dionigi G, Bacuzzi A, Lavazza M, Inversini D, Boni L, Rausei S, et al. Transoral endoscopic thyroidectomy: preliminary experience in Italy. Updates Surg. 2017; 69(2):225–34.

11. Peng XW, Li H, Li Z, Zhou X, Song DJ, Zhou B, et al. Modified transoral endoscopic thyroid surgery for treatment of thyroid cancer: operative steps and video. Gland Surg. 2017; 6(6):742–4.

12. Kim HY, Chai YJ, Dionigi G, Anuwong A, Richmon JD. Transoral robotic thyroidectomy: lessons learned from an initial consecutive series of 24 patients. Surg Endosc. 2018; 32(2):688–94.

13. Jitpratoom P, Ketwong K, Sasanakietkul T, Anuwong A. Transoral endoscopic thyroidectomy vestibular approach (TOETVA) for Graves’ disease: a comparison of surgical results with open thyroidectomy. Gland Surg. 2016; 5(6):546–52.

14. Chai YJ, Kim HY, Kim HK, Jun SH, Dionigi G, Anuwong A, et al. Comparative analysis of 2 robotic thyroidectomy procedures: transoral versus bilateral axillo-breast approach. Head Neck. 2017; Dec. 14. [Epub ahead of print]. https://doi.org/10.1002/hed.25034.

15. Razavi CR, Russell JO. Indications and contraindications to transoral thyroidectomy. Ann Thyroid. 2017; 2(5):pii: 12.

16. Anuwong A, Sasanakietkul T, Jitpratoom P, Ketwong K, Kim HY, Dionigi G, et al. Transoral endoscopic thyroidectomy vestibular approach (TOETVA): indications, techniques and results. Surg Endosc. 2018; 32(1):456–65.

17. Razavi CR, Fondong A, Tufano RP, Russell JO. Central neck dissection via the transoral approach. Ann Thyroid. 2017; 2(5):pii: 11.

18. Kim SH, Park KS, Shin HY, Yi JH, Kim DK. Paradoxical carbon dioxide embolism during endoscopic thyroidectomy confirmed by transesophageal echocardiography. J Anesth. 2010; 24(5):774–7.

19. Anuwong A. Strategy to prevent subcutaneous emphysema and gas insufflation-related complications in transoral endoscopic thyroidectomy vestibular approach: reply. World J Surg. 2017; 41(10):2649–50.

20. Cunningham AJ. Laparoscopic surgery--anesthetic implications. Surgical endoscopy. Surg Endosc. 1994; 8(11):1272–84.
Fig. 1.
The usual instruments for transoral endoscopic thyroid surgery. *vascular tunneller for creating and widening working space.
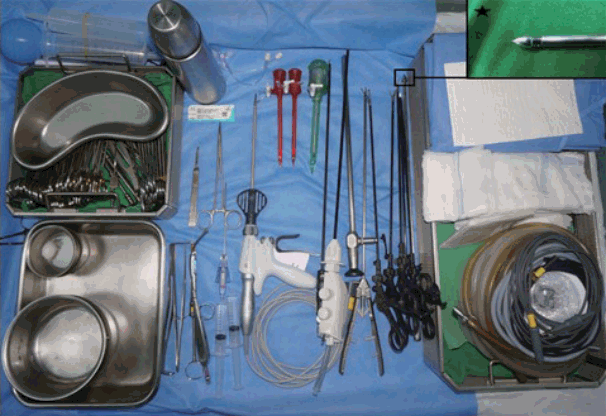
Fig. 2.
Patient’s position. The patient’s head is fixed to the bed firmly using adhesive plaster so that the head does not turn during surgery (arrows, arrowhead: orotracheal tube) (A). The usual draping is done so that the upper lip is sufficiently exposed superiorly and the sternal notch inferiorly (B). Surgical team consists of four medical staff (C). S: surgeon (operator), AS1: first assistant surgeon, AS2: second assistant surgeon, SN: scrub nurse.
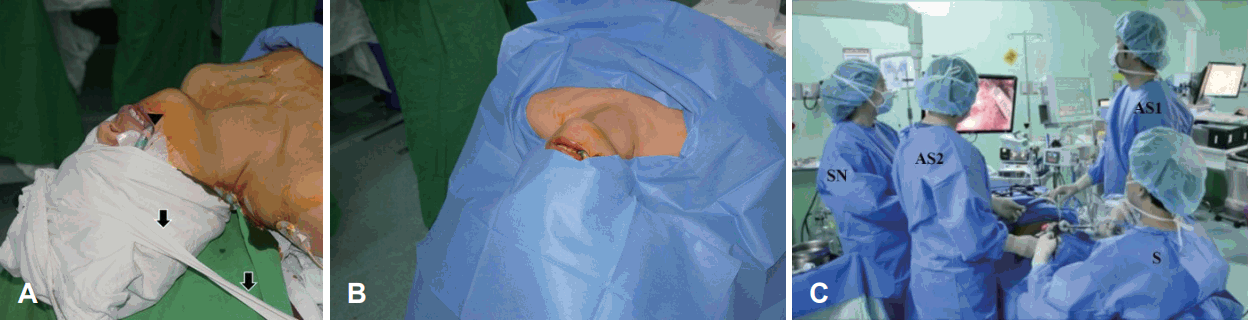
Fig. 3.
Creation of a working space for transoral endoscopic thyroidectomy. A 2-cm-long curvilinear incision in the midline of the vestibule (A). Injection of normal saline into the subplatysmal space to widen the space (B). Widening of the working space in the submental and anterior neck using a blunt instrument (C). Insertion of 5-mm-diameter cannula through right lateral incision in the vestibule near the first molars (D).
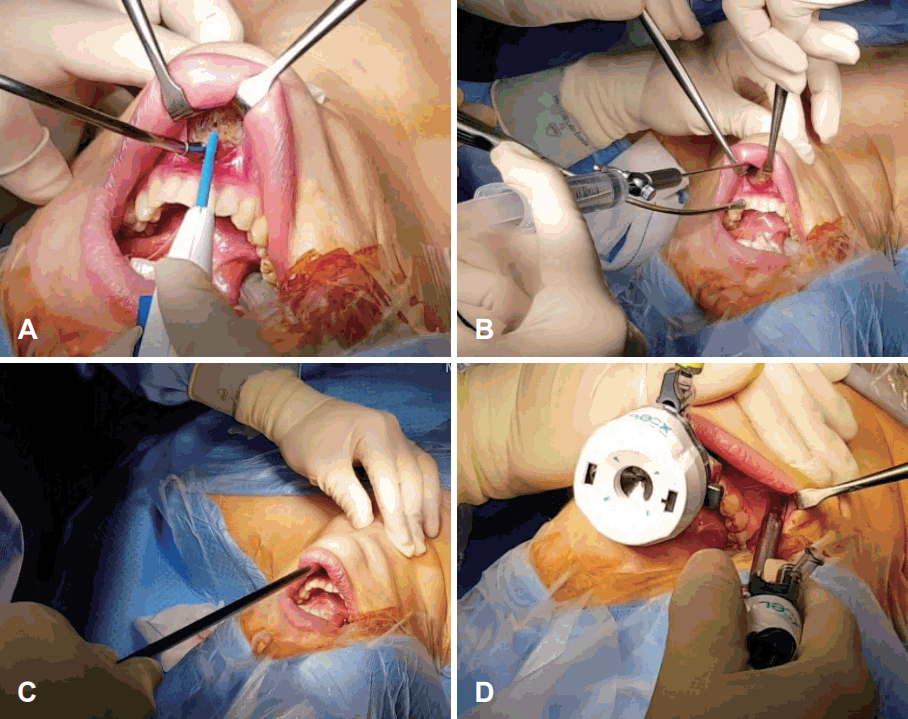
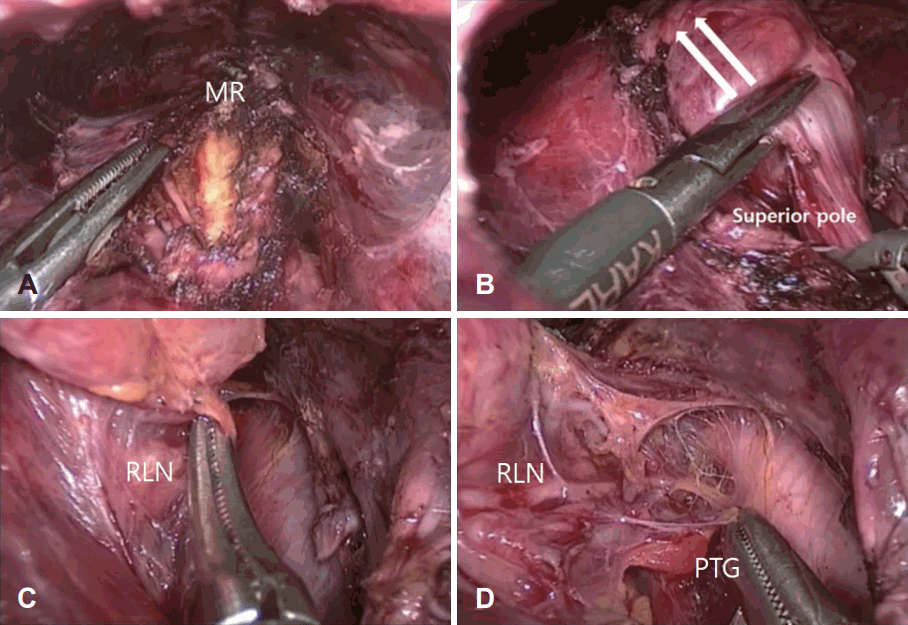
Fig. 4.
Transoral endoscopic right thyroid lobectomy. Division of the MR (A). Division of the superior lobe (arrows: the direction of traction) (B). Identification of the RLN (C). Identification of all the important anatomical structures such as RLN and PTG (D). MR: median raphe, RLN: recurrent laryngeal nerve, PTG: parathyroid gland.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download