1. Taylor MJ, Ponikau JU, Sherris DA, Kern EB, Gaffey TA, Kephart G, et al. Detection of fungal organisms in eosinophilic mucin using a fluorescin-labelled chitin specific binding protein. Otolaryngol Head Neck Surg. 2002; 127(5):377–83.
2. Bachert C, Gevaert P, van Cauwenberge P. Staphylococcus aureus superantigens and airway disease. Curr Allergy Asthma Rep. 2002; 2(3):252–8.

3. Zhang N, Van Zele T, Perez-Novo C, Van Bruaene N, Holtappels G, DeRuyck N, et al. Different types of T-effector cells orchestrate mucosal inflammation in chronic sinus disease. J Allergy Clin Immunol. 2008; 122(5):961–8.

4. Fokkens W, Lund V, Mullol J; European Position Paper on Rhinosinusitis and Nasal Polyps group. European position paper on rhinosinusitis and nasal polyps 2007. Rhinol Suppl. 2007; 20:1–136.
5. Sharma S, Watanabe S, Sivam A, Wang J, Neuwirth SJ, Perez RI, et al. Peripheral blood and tissue T regulatory cells in chronic rhinosinusitis. Am J Rhinol Allergy. 2012; 26(5):371–9.

6. Shen Y, Tang XY, Yang YC, Ke X, Kou W, Pan CK, et al. Impaired balance of Th17/Treg in patients with nasal polyposis. Scand J Immunol. 2011; 74(2):176–85.

7. Xu J, Han R, Kim DW, Mo JH, Jin Y, Rha KS, et al. Role of interleukin-10 on nasal polypogenesis in patients with chronic rhinosinusitis with nasal polyps. PLoS One. 2016; 11(9):e0161013.

8. Kapasi ZF, Burton GF, Shultz LD, Tew JG, Szakal AK. Induction of functional follicular dendritic cell development in severe combined immunodeficiency mice: influence B and T cells. J Immunol. 1993; 150(7):2648–58.
9. Yoshida K, van den Berg TK, Dijkstra CD. The functional state of follicular dendritic cells in severe combined immunodeficient (SCID) mice: role of the lymphocytes. Eur J Immunol. 1994; 24(2):464–8.

10. Lee JS, Kwon BS, Cho HR. Prevention of allograft rejection by immune tolerance. J Korean Soc Transplant. 2006; 20(1):1–13.
11. Sin E, Anand P, Frieri M. A link: allergic rhinitis, asthma & systemic lupus erythematosus. Autoimmun Rev. 2016; 15(5):487–91.
12. Noh G, Lee JH. Regulatory B cells and allergic diseases. Allergy Asthma Immunol Res. 2011; 3(3):168–77.

13. Driscoll KE, Carter JM, Howard BW, Hassenbein D, Burdick M, Kunkel SL, et al. Interleukin-10 regulates quartz-induced pulmonary inflammation in rats. Am J Physiol. 1998; 275(5 Pt 1):L887–94.
14. Kühn R, Löhler J, Rennick D, Rajewsky K, Müller W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell. 1993; 75(2):263–74.

15. Braat H, Peppelenbosch MP, Hommes DW. Immunology of Crohn’s disease. Ann N Y Acad Sci. 2006; 1072:135–54.

16. Lee JH, Byun JA, Yeo SW, Kim JK, Park YS. Role of interleukin-10 on mouse otitis media model using lipopolysaccharide. Korean J Otorhinolaryngol-Head Neck Surg. 2011; 54(1):43–7.

17. Fokkens WJ, Lund VJ, Mullol J, Bachert C, Alobid I, Baroody F, et al. European position paper on rhinosinusitis and nasal polyps 2012. Rhinol Suppl. 2012; 23:1–298.
18. Kim JW, Hong SL, Kim YK, Lee CH, Min YG, Rhee CS. Histological and immunological features of noneosinophilic nasal polyps. Otolaryngol Head Neck Surg. 2007; 137(6):925–30.

19. Kang JM, Kim SW, Auo HJ, Park CS, Kim BG, Kim SW, et al. [Clinical significance of serum eosinophil cationic protein (ECP) in chronic rhinosinusitis with nasal polyposis]. Korean J Otorhinolaryngol-Head Neck Surg. 2008; 51(8):712–6.
20. Ickrath P, Kleinsasser N, Ding X, Ginzkey C, Beyersdorf N, Hagen R, et al. Characterization of T-cell subpopulations in patients with chronic rhinosinusitis with nasal polyposis. Allergy Rhinol (Providence). 2017; 8(3):139–47.

21. Liu J, Zhan W, Kim CJ, Clayton X, Zhao H, Lee E, et al. IL-10-producing B cells are induced early in HIV-1 infection and suppress HIV-1-specific T cell responses. PLoS One. 2014; 9(2):e89236.

22. Schneider P, MacKay F, Steiner V, Hofmann K, Bodmer JL, Holler N, et al. BAFF, a novel ligand of the tumor necrosis factor family, stimulates B cell growth. J Exp Med. 1999; 189(11):1747–56.

23. Bossen C, Schneider P. BAFF, APRIL and their receptors: structure, function and signaling. Semin Immunol. 2006; 18(5):263–75.

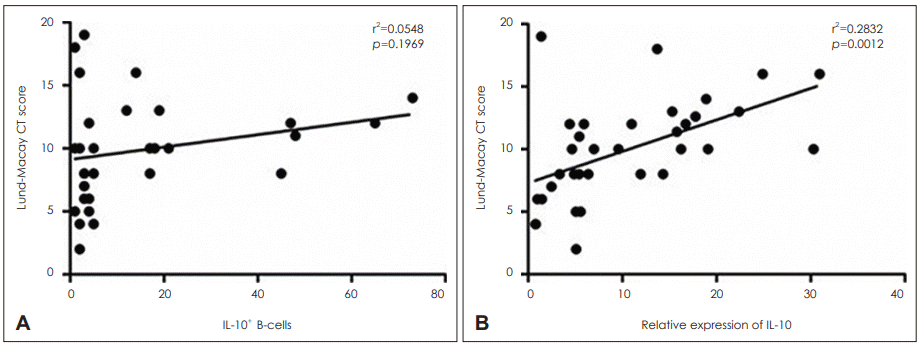
24. Hopkins C, Browne JP, Slack R, Lund V, Brown P. The Lund-Mackay staging system for chronic rhinosinusitis: how is it used and what does it predict? Otolaryngol Head Neck Surg. 2007; 137(4):555–61.





 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download