Abstract
Epiphora is an overflow of tears onto the face and mainly occurs secondary to abnormal excretory system such as nasolacrimal duct obstruction (NLDO), which could be congenital or acquired. In past years, patients with NLDO have been usually managed by ophthalmologists using external dacryocystorhinostomy (EX-DCR) which has been considered the gold standard of treatment. Recently, the advancement of nasal endoscope and endoscopic sinus surgery has contributed to perform endoscopic DCR (EN-DCR), which now offers comparable success rate to EX-DCR with many advantages. ENT surgeons are familiar with intranasal anatomy and nasal endoscope handling rather than ophthalmologists. Therefore, these advantages lead to more ENT surgeons performing endoscopic DCR. However, the learning curves exist to reach a favorable success rate because surgical technique should be delicate in the narrow nasal cavity. This paper attempts to describe management of epiphora from ENT perspective, focus on surgical anatomy, evaluation modalities and update on endoscopic technique and surgical outcome compared with EX-DCR. This present review would serve as a guide for beginners and increase their confidence with endoscopic anatomy and correct management of epiphora including EN-DCR procedures.
유루증(epiphora)은 눈물이 안면부로 넘치는 증상으로 약간의 불편함을 호소하는 것부터 사회 생활에 지장을 줄 정도까지 다양하게 발현된다. 눈물의 생성과 배액 사이의 균형이 깨진 경우에 발생할 수 있는데, 이 중 비루관 계통(nasolacrimal system)이 폐쇄가 가장 흔한 원인이다. 비루관의 폐쇄는 특발성인 경우가 대부분이며, 고령층에서 호발하는 경향이 있다. 또한 비루관 계통의 폐쇄 없이 유루증을 호소하는 경우를 기능적 폐쇄(functional obstruction)라 하며, 해부학적 폐쇄 없이 눈물 펌프 기능 장애, 결막 이완(conjunctivochalasis) 등 생리적인 기능 저하로 발생한다[1].
비루관의 해부학적 폐쇄에 의한 유루증 치료법은 약 100년 전부터 시행되어 왔다. 초기에 비강 내 접근법과 피부 절개를 통한 외부 접근법이 시도되었으나, 비강의 상부 구조가 좁아 수술 시야가 좋지 않고 많은 합병증이 발생하여 비강 내 접근법은 사장된 반면, 외부 접근법에 의한 수술법이 주로 안과 의사들에 의해 시행되어 대세를 이루었다. 이후 내시경이 소형화되고 수술 기구들이 발달됨에 따라 과거 비강 내 접근법의 한계점을 극복하게 되면서 현재는 만성 비루관 폐쇄의 치료법으로 내시경을 이용한 비강 내 접근법이 안전하고 치료 성적이 좋은 방법으로 입지를 굳히게 되었다[2,3].
부비동 내시경 수술이 도입된 초기에는 내시경적 비강 내 누낭비강문합술(endoscopic endonasal dacryocystorhinostomy)이 고난이도 수술법으로 여겨졌지만, 최근에는 보편화되어 안과 의사들도 외부 접근법보다 비강 내 내시경적 접근법을 선호하는 추세이다. 이비인후과 의사는 비강 내 해부학과 내시경 사용에 친숙하고 술 후 경과 관찰 및 비강 내 처치에 더 능숙한 장점이 있는 반면, 대체적으로 수련 과정에서 경험할 기회가 적다는 한계가 있다. 따라서 이비인후과 의사로서 유루증 환자를 평가하고 치료하여 영역을 확장시키는 데 도움을 주고자 최신 지견을 종합하여 기술하고자 한다.
성인 유루증의 원인은 다음과 같이 범주로 나눌 수 있다. 첫 번째로 누점(lacrimal punctum)의 이상으로 약 35%를 차지한다[4,5]. 선천성 혹은 후천적 외상이나 염증으로 발생한 누점의 협착이 흔한 원인이고, 하안검 성형술 후 발생하는 누점의 외반증(ectropion)도 원인이 될 수 있다. 또한 누점의 협착은 단독으로 발생할 수도 있지만, 누소관(lacrimal canaliculi)의 협착, 안검의 이완(blepharochalasis)이나 위치 이상과 동반되어 발생할 수 있다[6-8]. 두 번째 흔한 원인은 비루관(nasolacrimal duct)의 이상으로 약 24% 정도를 차지하며, 내시경적 비강 내 누낭비강문합술의 가장 좋은 적응증이 된다. 원인이 명확하지 않은 특발성인 경우가 대부분이나 비루관 점막의 반복된 염증이나 반복적인 소식자술(probing)로 인한 만성 흉터로 인해 발생할 수 있다[9]. 세 번째는 누소관의 이상으로(15%), 외상이나 염증, 협착, 감염, 녹내장 치료 안약 등이 원인이 된다[10]. 그 외 유루증의 원인으로는 노화나 안면신경 마비로 인한 눈물 펌프의 기능 장애(11%), 염증이나 안구건조증으로 인한 가성유루증(pseudoepiphora, 11%), 알레르기 비염이나 비용 혹은 외비성형술 후 발생할 수 있다(4%)[4]. 위에 언급한 바와 같이 다양한 원인에 의해 발생할 수 있기 때문에 병력 청취와 신체검사를 통해 원인을 추정하고 수술에 적합한지를 평가하는 것이 필수적이다.
눈물을 과다하게 흘린다고 호소하는 환자를 평가할 때 우선적으로 눈물의 과다분비로 인한 것인지, 비루관 계통의 폐쇄로 인한 유루증인지를 감별하는 것이 필요하다. 눈물의 과다분비는 반사적 눈물 흘림이나 눈물샘의 직접적인 자극, 혹은 중추신경 계통 이상에 의해 환자가 증상을 느낄 만큼 눈물 생성을 의미하며, 일반적으로 얼굴로 눈물이 넘치는 경우는 거의 없고 하원개(inferior fornix)에 눈물이 고여 있는 경우가 대부분이다. 과거 환자의 병력이 감별에 도움이 되는데 눈물의 과다분비는 눈물막(tear film)의 질 저하와 연관이 있어 이로 인해 안구의 자극이나 반사적 눈물 흘림을 야기한다. 바람 불 때나 차가운 공기에 노출될 때 더 악화되는 경우는 대부분이 안구건조증(keraticonjunctivitis sicca)과 부분적 눈물관 폐쇄에 기인한다. 또한 한쪽 눈에만 유루증 증상이 심하거나 실내에서도 눈물 흘림이 심하다면 눈물의 과다분비보다는 비루관 계통의 폐쇄로 인한 유루증을 좀 더 의심해 볼 수 있다.
비루관 상부 계통(upper lacrimal system)이 폐쇄된 경우에는 눈물이 깨끗하고, 하부 계통인 비루관(nasolacrimal duct)의 폐쇄인 경우에는 점액화농성 분비물이 동반되는 경우가 흔한 경향이 있어 환자 평가에 도움이 된다. 또한 편측성 증상은 종종 국소제제 사용과 연관이 있는데, 편측 안구에만 녹내장 점안액을 사용하는 경우가 이에 속한다. 이외에도 알레르기 결막염이나 비염, 부비동염이 있는 경우에 누점과 비루관의 비강 내 개방부에 폐쇄를 야기하여 이차적인 유루증을 야기할 수 있어 문진에 포함해야 한다. 외비성형술이나 부비동 내시경 수술 같은 비수술력이나 과거 안면부 외상력도 평가해야 한다. 여기에는 반복적인 소식자술(probing)도 포함되는데, 과거에 유루증으로 반복적인 시술을 받은 경우에는 누계의 점막에 손상을 초래해 해부학적 폐쇄를 야기하는 경우가 많기 때문이다.
안검외반증(ectropion)이나 내반증(entropion), 하안검 이완증이나 안면신경 마비에 의한 안검의 해부학적 이상이 있는지를 시진(inspection)을 통해 평가해야 한다. 이런 환자에게는 누낭비강문합술의 단독 효과가 떨어지기 때문이다.
내안각인대 부위를 눌러 누낭을 압박하는 촉진이 진단에 도움이 되기도 한다. 누낭에 종물이 있는 경우에는 촉지가 가능하며, 점액화농성이나 혈성 분비물이 관찰이 되는 경우는 누낭 내부나 비루관에 문제가 있음을 시사한다.
모든 검사를 이비인후과에서 할 수 없을 뿐만 아니라 안과에서 시행하는 검사도 있기 때문에, 이에 대한 해석 능력을 갖추는 것으로 충분하다.
유루증을 평가하는 방법은 다양하며, 검사 방법을 크게 구분한다면 기능적 검사법과 해부학적 검사법으로 나눌 수 있다.
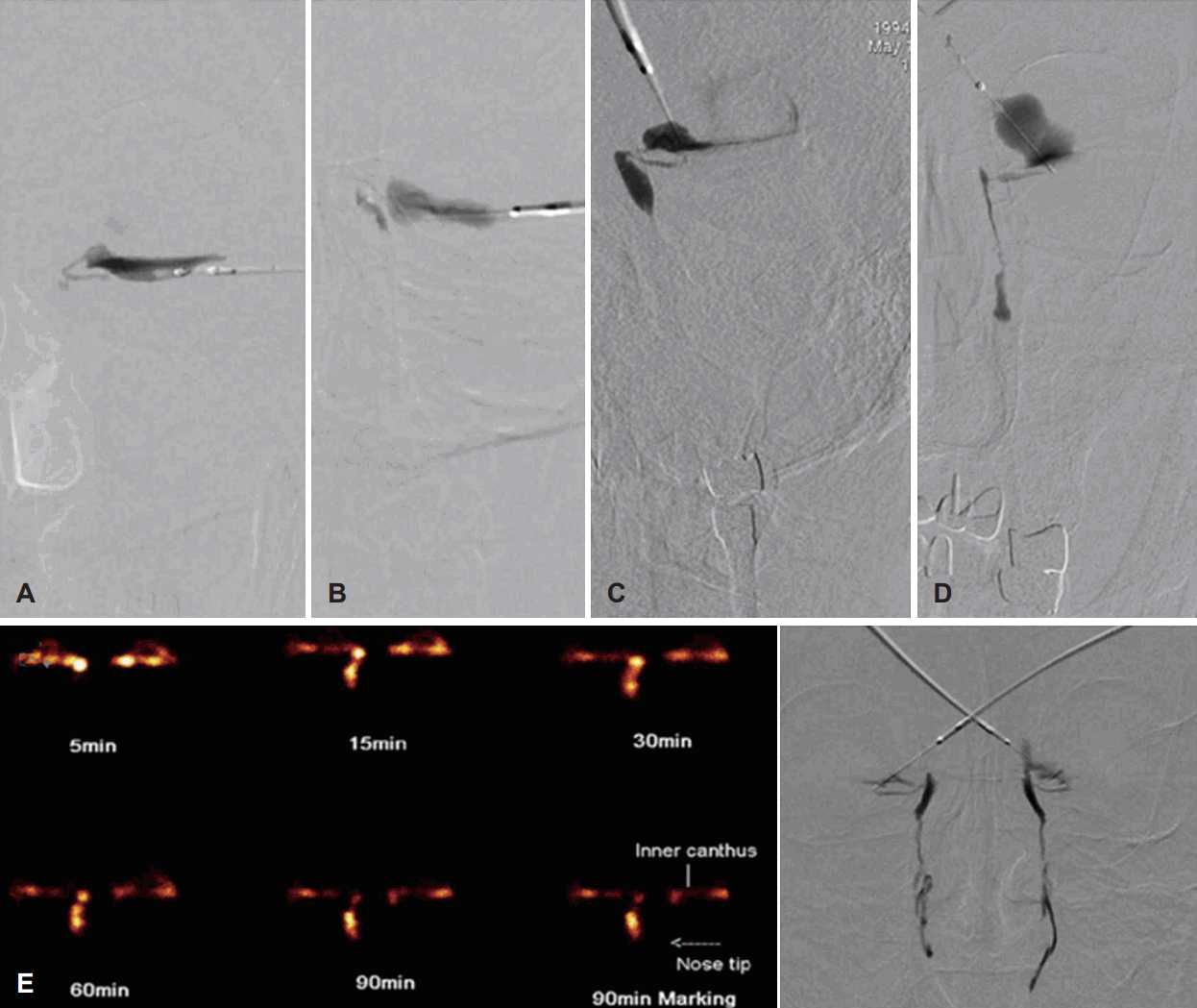
기능적 검사는 기능적 또는 해부학적 폐쇄 부위를 평가할 수 있을 뿐만 아니라 생리적인 조건하에서 눈물의 흐름을 평가하는 데 유용하다. 가장 간편하고 유용한 검사가 색소 소실 검사(dye disappearance test)인데, 2% fluorescein을 결막낭(conjunctival sac)에 넣은 후 소실되는 시간을 측정하는 방법으로 5분 이내에 색소가 없어지면 정상으로 판정한다. 이 소실이 지연되면 눈물이 배액되는 누계의 이상을 의심할 수 있다. 다른 검사 방법으로 Jones 일차 색소 검사가 있는데, fluorescein을 결막낭에 넣은 후 색소가 하비도로 나오는지를 측정하는 방법이다. 하비도에서 측정이 되면 양성이라 판정하고 정상을 의미하는 반면, 측정이 되지 않으면 음성으로 판정하고 누계의 기능적 혹은 해부학적 이상을 의미한다. 누도신티그래피(dacryoscintigraphy)는 sodium pertechnetate (99mTc) 시약을 결막낭에 점안한 후 감마카메라로 눈물에 섞인 방사선추적자가 누도(lacrimal pathway)로 흘러내려가는지를 촬영하는 핵의학적 검사이다. 생리적인 정상 환경에서 눈물의 배출 과정을 평가할 수 있는 검사로 해부학적 폐쇄 부위에 대한 평가도 가능하지만, 기능적 폐색이 의심되는 환자에서 시행하는 것이 더 바람직하고 유용하다(Fig. 1)[11].
해부학적 검사법에는 소식자검사(probing test), 누소관 관류법(lacrimal irrigation test) 그리고, 누낭조영술(dacryocystography) 등이 있다. 소식자검사는 누점이나 누소관의 문제를 평가할 수 있는데, 23 G나 Bowman 소식자를 이용하여 누소관에 진입시킨 후 누낭의 내측까지 진행시켜 보는 검사이다. 삽입한 소식자가 누낭 내측의 딱딱한 뼈에 닿으면 “hard stop”이라 하며, 이는 누소관의 폐쇄는 없다는 것을 의미한다. 이에 반해 누소관이 막혀 있는 경우 소식자가 직접 뼈에 닿지 않고 막힌 누소관 부위를 같이 밀고 가기 때문에 뼈에 닿는 느낌을 느낄 수 없어 “soft stop”이라고 한다. 이 검사 시 주의점은 누소관으로 소식자를 진입시킬 때 외안각을 외측으로 당겨야 좀 더 정확히 판정할 수 있는데, 외안각을 외측으로 당기지 않으면 소식자가 누소관의 점막에 걸려 누소관 부위의 폐쇄가 없음에도 불구하고 soft stop을 느낄 수 있기 때문이다. 소식자검사 시에는 누소관 부위에 의인성(iatrogenic) 손상을 초래할 수 있다는 점을 간과해서는 안 되며, 손상을 주지 않도록 조심스럽게 시행하는 것이 바람직하다. 저자는 술 전에 외래에서 시행하지 않고 다른 검사들로 종합하여 판단한 후, 수술 중에 소식자검사를 시행하여 누소관의 협착이나 폐쇄를 재평가한다. 누소관 관류법은 2 cc 주사기에 끝이 뭉툭한 26 G 바늘이나 관류용 도관을 끼워 누소관 내로 삽입한 후 압력을 가해 식염수를 누도로 통과시키는 검사이다. 식염수가 역류 없이 목뒤로 넘어가면 해부학적 폐쇄가 없다고 판단한다. 비루관이나 누낭, 공통 누소관에 완전 폐쇄가 있다면 위 혹은 아래쪽 누점을 통해 식염수를 관류시켰을 때 반대쪽 누점을 통해 식염수가 역류해 나오게 되며, 관류하는 누소관으로만 역류한다면 삽입한 쪽 누소관의 폐쇄를 의미한다. 누소관 관류법은 환자에게 통증을 거의 초래하지 않아 외래에서 쉽게 시행할 수 있는 검사로 위아래 누점을 통해 각각 시행하는 것이 바람직하며, 소식자검사를 어느 정도 대체할 수 있는 검사이다. 누낭조영술(dacryocystography)은 조영제를 하부 누소관으로 주입하고 Caldwell view와 lateral view를 찍어 누도의 폐쇄 부위를 확인할 수 있는 검사이다(Fig. 1). 누낭 내에 결석이나 종물이 존재하는 경우에는 조영 결손으로 관찰되고, 누낭의 크기와 누낭 게실(diverticulum)의 유무를 확인하고, 누소관부터 누낭, 비루관 내의 정확한 폐쇄나 협착 부위를 알 수 있는 검사이다. 이 검사는 압력을 주어 조영제를 누소관 내로 주입하기 때문에 생리적인 검사가 아니라는 단점이 있는 반면, 누소관 이하의 해부학적 폐쇄 부위를 평가할 수 있는 검사이다[12]. 대부분이 하부 누소관을 통해서만 검사하기 때문에 상부 누소관에 대한 평가는 어렵고, 검사자의 숙련도에 많이 좌우된다[12].
Jones 이차 색소 검사는 비루관의 해부학적 폐쇄 여부를 평가하는 방법으로 Jones 일차 색소 검사에서 음성이 나왔을 경우 결막낭에 남아 있는 염색약을 세척해 내고, 아래 누점을 통해 식염수를 관류하여 평가하는 방법이다. 관류액이 역류 없이 누관을 통과하고 하비도에 위치시킨 면봉에서 색소가 검출되면 양성으로 평가하고 비루관의 부분적 협착이 있거나 기능적 폐쇄가 있음을 의미하며, 관류는 되나 염색약이 관찰되지 않으면 음성이라 평가하고 누점이나 누소관의 협착을 의미한다. 관류액이 코로 내려가지 않고 반대쪽 누점으로 역류되면 누낭이나 누낭보다 하방부의 완전 폐쇄를 의심해야 한다. 삽입한 누점 부위로 관류액이 역류되어 나오면 동측의 누소관 혹은 공통 누소관의 폐쇄를 의심해야 한다.
비강 내부를 내시경을 통해 평가하여 비중격 만곡증, 하비갑도를 폐색할 정도의 하비갑개 비후증의 유무, 비용 그리고 종양 등과 같은 비눈물의 배액에 영향을 주는 인자들이 있는지를 평가하여 수술 전에 치료 방침을 정하는 데 고려해야 한다.
결론적으로 유루증을 평가하고 진단하는 검사법은 위에서 언급한 바와 같이 다양하지만, 이비인후과 의사로서 외래 진료 시에 모든 검사를 다 시행하기에는 제약이 따른다. 대부분의 환자에서는 모든 검사가 필요하지 않으며 몇몇 간단한 검사만으로도 진단이 가능할 때가 많다. 외래에서 쉽고 간단히 시행해 볼 수 있는 검사는 내안각 부위에 대한 압박 검사와 더불어 누소관 관류법을 각각 상하 누점을 통해 시행하는 것이다. 이를 바탕으로 하여 해부학적 폐쇄가 의심되면 누낭조영술을 시행하고, 기능적 폐쇄가 의심이 되면 누도신티그래피를 시행한 후 종합적으로 판단하면 치료법을 결정하는 데 충분한 경우가 대부분이다.
비강 내 접근법은 1889년 Killian에 의해 처음 기술되었고, 내시경을 이용한 술식은 1893년 Caldwell에 의해 처음 시행되었다[2]. 하지만 비강의 상부 구조가 좁기 때문에, 수술 시야가 좋지 않고 많은 합병증이 발생하여 곧 사장되었다. 이후 내시경 장비의 발달로 인해 한계점을 극복하면서 1989년 McDonogh와 Meiring [3]이 처음으로 내시경을 이용한 비강 내 접근법을 기술한 이후 현재는 만성 비루관 폐쇄의 치료법으로 내시경을 이용한 비내 접근법이 안전하고 효과적인 방법으로 입지를 굳혔다. 내시경을 이용한 비내 접근법의 장점은 얼굴 피부에 반흔이 남지 않고, 내안각 인대의 손상을 초래하지 않으며, 수술 후 부종 및 혈종이 거의 없어 회복 기간이 짧다는 것이다. 안륜근(orbicularis muscle)의 펌프 기능을 보존할 수 있고, 수술 소요 시간이 짧고 수술 중 출혈도 적다[13]. 또한 비강 내에 비중격 만곡증이나 만성 부비동염 등으로 수술이 필요한 경우 같은 수술 시야 내에서 동시에 이루어질 수 있다는 것도 장점이다.
누낭 이하 부위의 해부학적 폐쇄가 있는 경우가 가장 일반적인 내시경적 비강 내 누낭비강문합술의 적응증이다. 이전 부비동 내시경 수술력이 있는 환자와 안면 외상력이 있는 환자 또는 외부 접근법으로 누낭비강문합술을 시행한 후 실패한 환자들이 좋은 적응증이 되는데, 내시경하에서 이전 수술에 의한 반흔이나 유착을 정확히 평가하여 수술할 수 있기 때문이다. 최근에는 적응증의 범위가 넓어지고 있는 추세이다. 급성 누낭염이 있는 경우에는 외부 접근법이 금기이지만, 내시경적 접근법으로 가능하며 치료법으로 선호되고 있다[14,15]. 원위부의 공통 누소관의 협착이나 폐쇄인 경우에도 내시경적 비강 내 누낭비강문합술을 시행하면서 실리콘관(Canaliculus intubation set tube, Xomed Co., Jacksonville, FL, USA)을 추가로 삽입하거나 폐쇄된 부위의 섬유밴드를 절개하여 공통 누소관을 누낭으로 연결한 후 실리콘관을 삽입하여 스텐트 역할을 해줌으로써 기존의 술식인 결막누낭비강문합술(conjunctivodacryocystorhinostomy)을 대체할 수 있는 가능성도 제시되고 있다[16,17]. 또한 기능적 비루관 폐쇄 환자에서도 내시경적 누낭비강문합술이 기존의 표준 치료법인 실리콘관 삽입술과 비교하여 증상의 조기 개선과 더불어 치료 성적이 높다고 보고되었다[18]. 따라서 금기증에 해당하는 누낭 내 악성종양이 의심되어 외부 접근법이 필요한 경우나 결막누낭비강문합술의 적응증인 누소관의 완전 폐쇄 등을 제외하면 내시경적 비강 내 문합술을 시도해 볼 수 있을 것이다. 다만, 혈관이 풍부한 협소한 공간에서 수술이 진행되고 해부학적 지식에 기반하여 정확한 수술을 진행해야 하기 때문에, 숙련되기까지 학습곡선(learning curve)이 존재하며, 숙련도에 따라 수술 결과가 유의하게 차이가 난다는 연구들도 보고된 바 있다[19,20].
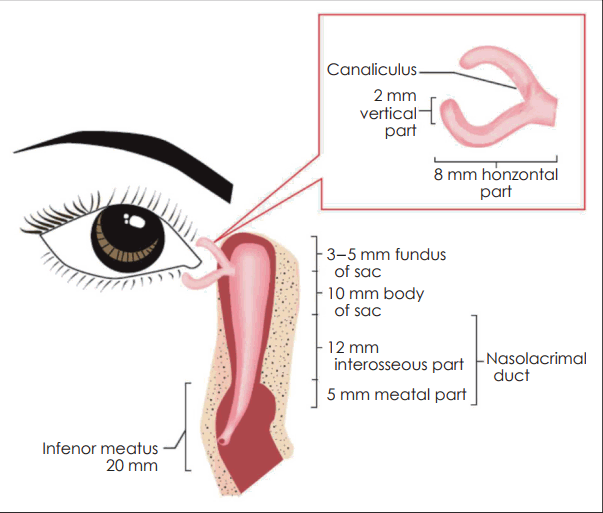
누선(lacrimal gland)에서 분비된 눈물은 상하 누점(lacrimal punctum)으로 들어간 다음, 누소관(canaliculi), 누낭(lacrimal sac), 비루관(nasolacrimal duct)을 지나 하비도로 배출된다. 누점은 0.2~0.3 mm 직경의 작은 구멍으로 상누점과 하누점은 내안각(medial canthal angle)에서 각각 6 mm와 6.5 mm 떨어진 상하 안검연에 각각 위치한다. 누소관은 상하안검에 각각 존재하며 누점으로부터 수직으로 2 mm, 수평으로 8 mm 정도를 각각 주행하여 합쳐진 후 총 누소관(common canaliculus)을 이룬 다음, 누낭의 외벽에 존재하는 Rosenmu¨ller valve를 통해 누낭으로 연결된다. 약 10%에서는 총 누소관의 형태로 누낭으로 연결되지 않고, 상하 누소관이 각각 별도로 누낭으로 연결된다[21]. 누낭은 전누낭릉(anterior lacrimal crest)과 후누낭릉(posterior lacrimal crest) 사이의 누낭와(lacrimal fossa) 내에 존재하며, 전누낭릉은 상악골 전두돌기의 일부분이며, 후누낭릉은 누골의 일부분으로 구성된다. 누낭은 원주상피로 구성된 표층과 편평상피로 구성된 심층으로 이중막 구조로 이루어져 있고, 상하 12~15 mm, 전후 4~8 mm, 좌우 3~5 mm 크기이다. 누낭이 하방으로 내려오며 갑자기 좁아지면서 비루관이 된다. 비루관의 방향은 내안각과 동측의 비익을 연결하는 선과 평행하며, 길이는 15~24 mm로 하비갑개의 전방경계에서 약 1.5 cm 후방에 존재하는 Hasner’s valve를 통해 하비도로 열린다. 신생아의 약 70%에서는 출생 시 Hasner’s membrane이 뚫리지 않은 상태이나 출생 후 13개월 이내에 90% 이상이 자연적으로 뚫리게 된다[22-24]. 따라서 신생아에서 유루증이 있는 경우에는 생후 1년간은 보존적인 치료로 충분하고 수술적 처치는 피해야 한다[22-24].
또한 눈물은 하누소관을 통해 65%가 배액되고, 상누소관을 통해 35%가 배액되는 것으로 알려져 있다[25]. 하지만 일부 환자들에서는 상누소관으로 더 많이 배액되기도 하므로 개인간 편차는 고려되어야 한다.
수술 전에 비중격 만곡증 여부와 비강이 수술하기에 좁은 지를 평가해야 한다. 수술 범위인 중비갑개 전단부의 비강이 좁거나 비중격 만곡증 등의 문제점이 있는 경우에는 이를 먼저 교정한 후에 수술을 시행해야 한다.
0°나 30° 내시경을 이용하여 전신마취하에서 시행하는 것이 일반적이지만, 진정 후 국소마취하에서도 시행할 수 있다. 우선 비점막의 수축과 표면 마취를 위해 부비동 내시경 수술을 시행할 때와 마찬가지로 4% 리도카인(lidocaine)과 1:1000 에피네프린(epinephrine) 혼합액으로 적신 거즈를 중비도와 상악선(maxillary line) 부위 점막에 패킹한다. 10분 후 거즈를 제거하고, 2% 리도카인과 1:100000 에피네프린으로 혼합된 마취액을 이용하여 구상돌기 주변 점막과 상악선 점막 부위에 침윤마취를 시행한다.
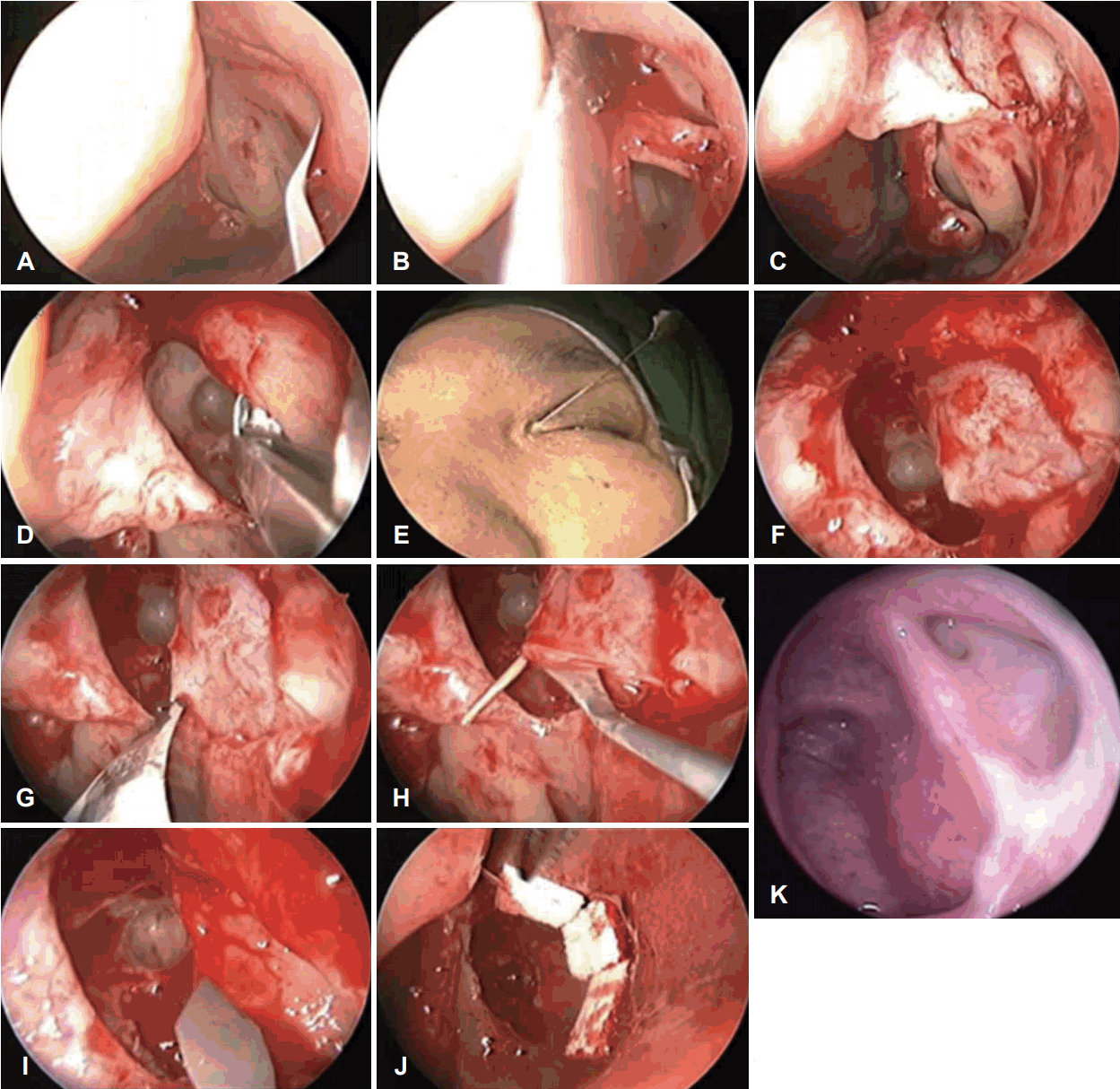
내시경 누낭비강문합술은 구상돌기 전방에 위치한 비강 외측벽의 융기된 부위인 상악선(maxillary line) 점막 부위에 canal knife나 slit knife를 이용하여 절개를 가하는 것으로부터 시작한다(Fig. 3A). 누낭과 비루관이 상악선 하방에 존재하기 때문에 중비갑개의 부착부 상방 1 cm 정도에서부터 상악선 점막의 전방에 수직으로 정확하게 절개를 가하는 것이 중요하다. 이보다 너무 전방에 절개를 가하는 경우에는 수술 후 점막으로 덮을 수 없는 골 부위가 많이 남게 되며, 너무 후방에 절개를 가하면 누낭의 노출과 개방 시에 수술 시야가 확보되지 않기 때문이다. 이후 freer elevator를 이용하여 구상돌기의 비강 외측벽 접합부까지 점막피판을 거상하고 노출된 구상돌기의 상부를 절제한다(Fig. 3B). 구상돌기를 보존한 채로 수술을 진행할 수도 있지만, 누낭이 위치하는 부분의 구상돌기 상부를 절제하는 방법이 누낭을 최대한 노출하고 개방하는 것에 유리하다. 위의 과정을 거치면 누낭이 위치한 골 부위가 노출되는데 내안각(medial canthal area) 부위를 손으로 촉지하여 압박하면 누낭 부위를 확인할 수 있다(Fig. 3C). 해부학적으로 누낭의 전방은 두꺼운 상악골의 전두돌기가 덮고 있고 후방은 종이처럼 얇은 누골이 덮고 있기 때문에, 내안각을 압박하면 누골이 덮고 있는 누낭 부위의 확인이 가능하다. 그 다음 단계는 누낭을 덮고 있는 상악골의 전두돌기와 누골을 제거하는 과정으로 저자는 누낭의 전방부가 노출될 때까지 3 mm 골겸자를 이용해 상악골의 전두돌기를 제거하고, 누골은 얇아 freer elevator를 이용하여 제거한 후 누낭을 최대한 노출시킨다(Fig. 3D). 술자에 따라서는 드릴을 사용하여 상악골의 전두돌기를 제거하는데, 사용하기 편안한 기구를 선택하여 제거하는 것이 좋을 듯하다. 누낭의 위치는 사람마다 약간의 편차가 있기 때문에, 최대한 상부까지 누낭을 덮는 골을 제거하는 것이 유리하다. 앞에서 언급한 비루관의 주행에 따른 해부학적 특징을 이용하여 누도탐침자를 누점(lacrimal punctum)으로 통해 삽입한 후(Fig. 3E), 누소관(canaliculi)을 지나 누낭의 후하단부까지 삽입하여 누낭을 내측으로 들어올려 누낭의 절개할 부분을 확인한다(Fig. 3F). 누도탐침자는 끝이 날카롭지 않은 것을 사용하는 것이 좋은데, 그 이유는 날카로운 것을 사용하는 경우에 비루관에 인위적인(iatrogenic) 손상을 주어 수술 실패의 원인이 되기 때문이다. 저자도 이런 경험을 한 이후로는 기존의 누도탐침자 대신에 끝이 동그랗게 처리된 Canaliculus Intubation Set tube 내의 stylette probe를 사용한다. 탐침자로 누낭을 내측으로 들어올린 부분의 정점에서 No. 12 knife를 이용해 누낭을 앞쪽으로 절개하고(Fig. 3G), slit knife를 이용해 후방부에 하방에서 상방으로 수직으로 절개를 가한다(Fig. 3H). 이후 전방기저 점막피판(anterior-based mucosal flap)을 만들어 전방부의 노출된 골 부분을 덮어주면 누낭이 비강 쪽으로 열리게 된다(Fig. 3I). 누낭은 이중막 구조의 상피로 구성되어 있기 때문에 누낭을 개방하는 과정에서 불완전하게 열릴 가능성이 있다. 따라서 probing을 다시 시행해 보거나 생리식염수 관주 등의 방법을 통해 누낭이 확실히 개방되었는지에 대한 평가가 필요하다. 이후 총 누소관이 비강 내공(rhinostomy)을 통해 관찰되는 것을 확인한 다음, 누점을 통해 주입한 식염수가 비강 내공을 통해 잘 배출되는지 다시 확인한다. 수술 중에 시행되는 probing test나 생리식염수 관주법(saline irrigation test)을 통해 누소관이나 총 누소관 부위에 저항이 느껴지거나 생리식염수가 일부 역류하는 경우에 한해서만 추가적으로 누소관에 실리콘관을 삽입하여 누낭 개방부를 통해 비강으로 통과시킨 후 결찰하여 비강 내에 위치시키고 3~6개월간 유지시킨 후 제거한다. 보통은 튜브를 여러 번 결찰하여 비강 내에 위치시키는데, 결찰부가 긴 경우에는 술 후 비점막을 지속적으로 자극할 수 있어 지혈클립(hemoclip) 을 사용하여 두 군데 정도를 clipping 해주면 결찰부의 길이를 조절하여 비강 내에 위치시킬 수 있어 비점막 자극을 예방할 수 있다. Gelfoam으로 전방기저 점막피판의 변연을 눌러주어 피판이 골부에 잘 붙고 이동하지 않도록 처치한 후 수술을 종료한다. 술 후 비강 패킹은 사용하고 남은 Gelfoam을 중비도에 넣어주는 정도로 충분하다(Fig. 3J).
결막누낭비강문합술의 수술 과정은 내시경하에서 누낭을 절개한 후 전방기저 점막피판을 이용해 누낭의 비강 내공을 만드는 과정까지는 내시경 누낭비강문합술의 수술 과정과 동일하다. 이후 비내시경을 비강 내에 위치시킨 후, 16 G needle을 medial canthal angle에 있는 medial fornix를 통해 삽입하여 미리 만들어 놓은 누낭의 비강 내공 부위로 나오게 한다. Sharp mosquito forcep을 이용하여 16 G needle로 만든 medial fornix와 비강 내 연결 통로를 확장시킨다. 이후 확장된 연결 통로를 통해 lacrimal probe를 비강 내로 삽입하여 존스관을 probe에 끼워서 삽입한다. 비내시경으로 비강 내에서의 존스관의 위치를 확인한 후에 Vicryl No. 5를 이용하여 존스관을 내안각 부위에 고정하고 수술을 마친다.
Mitomycin-C(MMC)는 Streptomyces caespitosus에서 추출한 항대사물질로 섬유아세포(fibroblast)에 의한 콜라겐 생성을 방해하는 성상을 이용해 비강 문합부(rhinostomy)의 폐쇄를 예방하고자 사용되고 있다. 일차 수술과 재수술 환자들을 대상으로 효과를 검증하고자 다수의 연구가 진행되었지만, 연구자마다 효과 유무에 대해서는 서로 상반된 결과들을 보고하고 있어 증거 중심 의학적인 면에서는 아직까지 효과에 대한 명확한 결론은 내리지 못하고 있는 상태이다[30-34]. 또한 기존 연구들마다 MMC의 용량(range: 0.2~0.5 mg/mL)과 적용 시간(range: 2~15 minutes)이 상이하기 때문에, MMC의 효과를 입증하기 위해서는 우선적으로 표준 농도와 시간 그리고 많은 환자들을 대상으로 하는 전향적 연구가 필요하다[31]. 하지만 아직까지 MMC와 관련된 합병증은 보고된 바가 없기 때문에, 임상적으로 술자 판단하에 필요한 경우라면 안전하게 사용할 수 있는 장점이 있다[31]. 저자의 경우에는 재수술인 경우나 초수술이라도 점막피판이 손상된 경우 등 일부 경우에 한해 0.4 mg/mL 농도로 5분간 사용하고 있다.
과거에는 수술 시에 스텐트를 삽입하는 것이 원칙인 것으로 인식되어서 약 5000예를 분석한 결과에서도 이 중 85%에서 시행하였고, 술 후 1~6개월이 지난 다음 제거하는 것으로 보고되었다[35]. 하지만 이 중 대조군과 비교한 후향적 연구만을 분석한 결과에서는 스텐트 삽입의 이득이 없었으며[36-39], 한 연구에서는 스텐트를 삽입하지 않은 경우에 수술 성적이 더 좋았다고 보고하였다[40]. 따라서 최근에는 누낭 하방부(post-saccal obstruction)의 폐쇄인 경우에는 스텐트 삽입의 유용성은 없으며[35], 최근에 보고된 메타분석에서도 실리콘 스텐트 삽입의 추가적인 이점은 없는 것으로 보고되었다[41]. 하지만 누낭의 상부인 누소관(canaliculi) 부위의 협착이 있거나 Rosenmu¨ller valve 부위에 협착이 있는 경우와 이전 누낭염 등의 원인으로 누낭의 수축이 발생하여 점막피판이 잘 안 만들어진 경우 등에서는 스텐트의 삽입이 도움된다. 2.1%의 환자들에서 스텐트 삽입으로 인한 합병증이 발생하는데, 안구 부위로 스텐트의 돌출(extrusion)과 각막 자극이 가장 흔한 합병증이다.
누낭과 비점막 사이에 루(fistula)를 만들기 위해 레이저를 이용하는데, 주변 조직에 대한 손상을 최소화하고 수술 소요 시간을 줄일 수 있는 장점이 있다[42]. 하지만 골겸자나 드릴 등을 이용하는 내시경적 비강 내 수술법이나 외부 접근법에 비해 수술 성적이 유의하게 떨어지는 단점이 있다[43]. 그 이유는 레이저를 이용하여 수술하는 경우 개방창(ostia)의 크기가 상대적으로 작게 만들어지고 레이저에서 인한 골과 점막의 열손상으로 인해 섬유화와 개방창의 협착이 야기되기 때문이다[44]. 따라서 내시경적 비강 내 누낭비강문합술에서 레이저를 사용하는 것보다는 골겸자나 드릴을 사용하여 누낭을 최대한 노출시킨 후에 비점막피판이나 누낭피판을 이용하여 최대한 누낭을 열어주는 술식이 바람직하다고 하겠다.
일차 내시경적 수술 성적은 외부 접근법으로 시행한 수술 성적과 비슷하다고 보고하고 있다. 외부 접근법으로 시행한 993명과 내시경적 비강 내 접근법으로 시행한 1068명을 대상으로 시행한 메타분석(4 randomized controlled trials and 15 cohort studies)에서도 골겸자나 드릴을 사용하여 시행한 내시경적 비강 내 수술법이 외부 접근법과 동일하게 87%의 성공률을 보이며, 최근에 시행한 연구들일수록 내시경적 비강 내 수술법의 성공률을 더 높게 보고하고 있다[43]. 이에 비해 레이저를 이용한 비강 내 수술법은 수술 성적이 떨어지는 것으로 분석되었다[43]. 특히, 장기간 추적 결과에서 성공률이 술 후 1년째 81%에서 술 후 5년째에는 38%로 급격히 떨어져 최근에는 레이저를 사용하지 않고 골겸자나 드릴(cold instruments) 을 이용하여 수술하는 경향이 대세이다.
재수술인 경우에도 내시경적 비강 내 접근법의 수술 성적이 69~100%로 외부 접근법보다 비슷하거나 더 좋은 결과를 보이고 있으며[35,45,46], 레이저 이용 수술법의 성적이 43%로 보고되어 가장 성적이 좋지 않은 것으로 보고되고 있다[35]. 따라서 재수술인 경우에는 내시경을 이용한 비강 내 접근법이 가진 여러 장점을 활용하여 시행하는 것이 바람직하다.
본원에서도 약 200예를 시행하였으며, 누낭 이하 부위에 해부학적 폐쇄가 있는 경우의 치료 성적이 90%였고, 이를 폐쇄 부위로 세분화하면 누낭 부위(sac level) 폐쇄인 경우가 86%, 누낭과 비루관 접합부(sac-ductal junction) 폐쇄인 경우가 93%, 비루관(ductal level) 폐쇄인 경우가 100%의 성적을 보였다. 이에 비해 누낭보다 근위부(pre-sac level)의 협착이 있는 경우는 73%의 수술 성공률을 보여 해부학적 폐쇄 위치에 따른 치료 성적의 차이가 관찰되었다. 또한 기능성 폐쇄 소견을 보인 환자들에서는 94.4%의 치료 성적을 보였지만, 증상이 완전 소실되는 경우보다 부분 호전되는 비율이 상대적으로 더 높게 관찰되었다. 따라서 폐쇄 양상 및 폐쇄 부위별로의 수술 성적의 차이가 존재하기 때문에 환자의 선정 및 상담 과정에서도 이에 대해 환자에게 충분히 설명하고 수술을 시행하는 것이 바람직하다고 판단된다.
수술 중 특별한 합병증이 발생하지 않는다면 술 후 출혈 위험 때문에 하루 정도 입원 후 퇴원시킨다. 수술 후 처치 및 관리에 대해선 뚜렷이 정해진 것은 없지만, 일반적으로 부비동 내시경 수술 후 관리와 유사하게 하면 된다. 술 후 2주간은 일주일 간격으로 외래에서 경과관찰하고 이후에는 술 후 상처에 따라 경과 주기를 정한다. 술 후 1주일째 가피와 분비물을 조심스럽게 제거하는데 개구부의 확인을 위해서 수술 부위의 가피를 무리하게 제거하기보다는 생리식염수로 누소관 관류를 시행하여 개방 여부를 확인하는 것이 더 바람직하다. 상처 범위가 작은 것을 감안하여 생리식염수 세척의 횟수와 양을 조절하고, 퇴원 시 점안 항생제와 비강 스테로이드 분무액을 2주 정도 투여하도록 한다. 술 후에 육아종이 관찰되지만 개방창을 완전히 막지 않은 경우에는 개방창의 상처가 어느 정도 안정화 단계에 접어든 후에 육아종을 제거한다. 실리콘관을 넣은 경우에 이를 제거하는 시점은 술 후 1개월에서 6개월까지 개인차가 있지만[35], 실리콘관을 넣은 목적과 술 후 환자 증상 변화 및 비강 내 개방창(rhinostomy)의 안정화 정도를 종합적으로 판단하여 제거 시점을 정하는 것이 바람직하다고 생각된다.
수술 중 합병증의 발생 빈도는 약 1% 정도이다. 수술 부위에서의 출혈이 가장 흔하고, 안와 주위 지방의 노출이 그 다음으로 흔한 합병증이다. 술 후 합병증의 빈도는 6.4%이며, 안와 주위 혈종, 유착, 육아종 생성 등이 가장 흔하다. 외부 접근법이나 레이저를 사용하여 시행한 것과 비교해 비강 내 내시경 누낭비강문합술을 시행한 경우에서 합병증의 빈도가 높은 것으로 보고되어 합병증의 예방을 위해서는 좀 더 주의깊게 수술하는 것이 필요하다.
내시경을 포함한 비강 내 수술 기구들의 발달과 수술법의 향상으로 인해 내시경적 비강 내 누낭비강문합술이 기존 외부 접근법의 치료 성적과 동등하게 됨에 따라 이를 대체하여 보편화되었다. 비록 대부분의 병원에서 유루증 환자들의 평가와 치료가 안과에서 시행되지만, 이비인후과 의사 입장에서도 유루증에 대한 평가 및 수술이 충분히 가능하다고 생각된다. 비록 수술법을 익히고 원하는 치료 성적을 얻기까지는 초기에 학습 곡선(learning curve)을 경험하게 되지만, 이를 극복하면 비강 내부의 해부학과 내시경수술에 친숙한 장점을 살려 영역을 더 확장시킬 수 있을 것으로 판단된다.
REFERENCES
1. Rosenstock T, Hurwitz JJ. Functional obstruction of the lacrimal drainage passages. Can J Ophthalmol. 1982; 17(6):249–55.
2. Tsirbas A, Wormald PJ. Endonasal dacryocystorhinostomy with mucosal flaps. Am J Ophthalmol. 2003; 135(1):76–83.

3. McDonogh M, Meiring JH. Endoscopic transnasal dacryocystorhinostomy. J Laryngol Otol. 1989; 103(6):585–7.

4. Kashkouli MB, Beigi B, Murthy R, Astbury N. Acquired external punctal stenosis: etiology and associated findings. Am J Ophthalmol. 2003; 136(6):1079–84.

5. Mathew RG, Olver JM. Mini-monoka made easy: a simple technique for mini-monoka insertion in acquired punctal stenosis. Ophthal Plast Reconstr Surg. 2011; 27(4):293–4.

6. Billing K, Karagiannis A, Selva D. Punctal-canalicular stenosis associated with mitomycin-C for corneal epithelial dysplasia. Am J Ophthalmol. 2003; 136(4):746–7.

7. Esmaeli B, Valero V, Ahmadi MA, Booser D. Canalicular stenosis secondary to docetaxel (taxotere): a newly recognized side effect. Ophthalmology. 2001; 108(5):994–5.
8. Weston BC, Loveless JW. Canalicular stenosis due to topical use of fortified antibiotics. Can J Ophthalmol. 2000; 35(6):334–5.

9. Zapala J, Bartkowski AM, Bartkowski SB. Lacrimal drainage system obstruction: management and results obtained in 70 patients. J Craniomaxillofac Surg. 1992; 20(4):178–83.

10. Lüchtenberg M, Berkefeld J, Bink A. [Presaccal stenosis as a cause of epiphora]. Radiologe. 2008; 48(12):1164–8.
11. Edelstein J, Reiss G. The wedge punctoplasty for treatment of punctal stenosis. Ophthalmic Surg. 1992; 23(12):818–21.

12. Peter NM, Pearson AR. Comparison of dacryocystography and lacrimal scintigraphy in the investigation of epiphora in patients with patent but nonfunctioning lacrimal systems. Ophthal Plast Reconstr Surg. 2009; 25(3):201–5.

13. Hartikainen J, Grenman R, Puukka P, Seppä H. Prospective randomized comparison of external dacryocystorhinostomy and endonasal laser dacryocystorhinostomy. Ophthalmology. 1998; 105(6):1106–13.

14. Lee TS, Woog JJ. Endonasal dacryocystorhinostomy in the primary treatment of acute dacryocystitis with abscess formation. Ophthal Plast Reconstr Surg. 2001; 17(3):180–3.

15. Chisty N, Singh M, Ali MJ, Naik MN. Long-term outcomes of powered endoscopic dacryocystorhinostomy in acute dacryocystitis. Laryngoscope. 2016; 126(3):551–3.

16. Kim DW, Choi MY, Shim WS. Endoscopic dacryocystorhinostomy with canalicular marsupialization in common canalicular obstruction. Can J Ophthalmol. 2013; 48(4):335–9.

17. Kong YJ, Choi HS, Jang JW, Kim SJ, Jang SY. Surgical outcomes of canalicular trephination combined with endoscopic dacryocystorhinostomy in patients with distal or common canalicular obstruction. Korean J Ophthalmol. 2015; 29(6):368–74.

18. Cho WK, Paik JS, Yang SW. Surgical success rate comparison in functional nasolacrimal duct obstruction: simple lacrimal stent versus endoscopic versus external dacryocystorhinostomy. Eur Arch Otorhinolaryngol. 2013; 270(2):535–40.

19. Onerci M, Orhan M, Ogretmenoğlu O, Irkeç M. Long-term results and reasons for failure of intranasal endoscopic dacryocystorhinostomy. Acta Otolaryngol. 2000; 120(2):319–22.
20. Malhotra R, Norris JH, Sagili S, Al-Abbadi Z, Avisar I. The learning curve in endoscopic dacryocystorhinostomy: outcomes in surgery performed by trainee oculoplastic surgeons. Orbit. 2015; 34(6):314–9.

21. Jones LT. An anatomical approach to problems of the eyelids and lacrimal apparatus. Arch Ophthalmol. 1961; 66:111–24.

22. Petersen RA, Robb RM. The natural course of congenital obstruction of the nasolacrimal duct. J Pediatr Ophthalmol Strabismus. 1978; 15(4):246–50.

23. Paul TO. Medical management of congenital nasolacrimal duct obstruction. J Pediatr Ophthalmol Strabismus. 1985; 22(2):68–70.

24. Nelson LB, Calhoun JH, Menduke H. Medical management of congenital nasolacrimal duct obstruction. Pediatrics. 1985; 76(2):172–5.

25. Rabinovitch J, Hurwitz J, Chin-Sang H. Quantitative evaluation of canalicular flow using lacrimal scintillography. Orbit. 1984; 3(4):263–6.
26. Green R, Gohil R, Ross P. Mucosal and lacrimal flaps for endonasal dacryocystorhinostomy: a systematic review. Clin Otolaryngol. 2017; 42(3):514–20.

27. Soyka MB, Treumann T, Schlegel CT. The agger nasi cell and uncinate process, the keys to proper access to the nasolacrimal drainage system. Rhinology. 2010; 48(3):364–7.

28. Yang JW, Oh HN. Success rate and complications of endonasal dacryocystorhinostomy with unciformectomy. Graefes Arch Clin Exp Ophthalmol. 2012; 250(10):1509–13.

29. Shams PN, Wormald PJ, Selva D. Anatomical landmarks of the lateral nasal wall: implications for endonasal lacrimal surgery. Curr Opin Ophthalmol. 2015; 26(5):408–15.
30. Camara JG, Bengzon AU, Henson RD. The safety and efficacy of mi tomycin C in endonasal endoscopic laser-assisted dacryocystorhinostomy. Ophthal Plast Reconstr Surg. 2000; 16(2):114–8.
31. Cheng SM, Feng YF, Xu L, Li Y, Huang JH. Efficacy of mitomycin C in endoscopic dacryocystorhinostomy: a systematic review and meta-analysis. PLoS One. 2013; 8(5):e62737.

32. Ozkiriş M, Ozkiriş A, Göktaş S. Effect of mitomycin C on revision endoscopic dacryocystorhinostomy. J Craniofac Surg. 2012; 23(6):e608–10.
33. Prasannaraj T, Kumar BY, Narasimhan I, Shivaprakash KV. Significance of adjunctive mitomycin C in endoscopic dacryocystorhinostomy. Am J Otolaryngol. 2012; 33(1):47–50.

34. Tirakunwichcha S, Aeumjaturapat S, Sinprajakphon S. Efficacy of mitomycin C in endonasal endoscopic dacryocystorhinostomy. Laryngoscope. 2011; 121(2):433–6.

35. Leong SC, Macewen CJ, White PS. A systematic review of outcomes after dacryocystorhinostomy in adults. Am J Rhinol Allergy. 2010; 24(1):81–90.

36. Sadiq SA, Hugkulstone CE, Jones NS, Downes RN. Endoscopic holmium:YAG laser dacryocystorhinostomy. Eye (Lond). 1996; 10(Pt 1):43–6.

37. Sadiq SA, Ohrlich S, Jones NS, Downes RN. Endonasal laser dacryocystorhinostomy--medium term results. Br J Ophthalmol. 1997; 81(12):1089–92.

38. Unlu HH, Toprak B, Aslan A, Guler C. Comparison of surgical outcomes in primary endoscopic dacryocystorhinostomy with and without silicone intubation. Ann Otol Rhinol Laryngol. 2002; 111(8):704–9.

39. Zaman MB, Udachin K, Ripmeester JA, Smith MD, zur Loye HC. Synthesis and characterization of diverse coordination polymers. Linear and zigzag chains involving their structural transformation via intermolecular hydrogen-bonded, interpenetrating ladders polycatenane, and noninterpenetrating square grid from long, rigid N,N’-bidentate ligands: 1,4-bis[(x-pyridyl)ethynyl]benzene (x = 3 and 4). Inorg Chem. 2005; 44(14):5047–59.

40. Smirnov G, Tuomilehto H, Teräsvirta M, Nuutinen J, Seppä J. Silicone tubing is not necessary after primary endoscopic dacryocystorhinostomy: a prospective randomized study. Am J Rhinol. 2008; 22(2):214–7.

41. Sarode D, Bari DA, Cain AC, Syed MI, Williams AT. The benefit of silicone stents in primary endonasal dacryocystorhinostomy: a systematic review and meta-analysis. Clin Otolaryngol. 2017; 42(2):307–14.

42. Zengin MÖ, Eren E. The return of the jedi: comparison of the outcomes of endolaser dacryocystorhinostomy and endonasal dacryocystorhinostomy. Int Forum Allergy Rhinol. 2014; 4(6):480–3.

43. Huang J, Malek J, Chin D, Snidvongs K, Wilcsek G, Tumuluri K, et al. Systematic review and meta-analysis on outcomes for endoscopic versus external dacryocystorhinostomy. Orbit. 2014; 33(2):81–90.

45. Lin GC, Brook CD, Hatton MP, Metson R. Causes of dacryocystorhinostomy failure: external versus endoscopic approach. Am J Rhinol Allergy. 2017; 31(3):181–5.

46. Ali MJ, Psaltis AJ, Wormald PJ. Long-term outcomes in revision powered endoscopic dacryocystorhinostomy. Int Forum Allergy Rhinol. 2014; 4(12):1016–9.

Fig. 1.
DCG (A-D) and dacryoscintigraphy (E). DCG is helpful to detect the obstruction level. Left DCG shows obstruction of the common canaliculi (A), lacrimal sac (B), sac-ductal junction (C) and nasolacrimal duct (D) with reflux of contrast into conjunctiva, respectively. Dacryoscintigraphy can assess lacrimal pathway under physiological condition. Although bilateral DCGs show patency of the nasolacrimal system bilaterally with penetration of contrast into the nasal cavity, dacryoscintigraphy demonstrates left obstruction of tear flow with no nasal penetration of isotope into the nasal cavity (E). DCG: dacryocystography.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download