1. Oh KK, Lee GH, Lee YS, Shim YS. Neck masses: a clinical analysis. Korean J Otolaryngol-Head Neck Surg. 1992; 35(5):650–6.
2. Wang SG. Differential diagnosis and treatment of neck masses. J Korean Med Assoc. 2007; 50(7):613–25.

3. Müller von der Grün J, Tahtali A, Ghanaati S, Rödel C, Balermpas P. Diagnostic and treatment modalities for patients with cervical lymph node metastases of unknown primary site-current status and challenges. Radiat Oncol. 2017; 12(1):82.

4. Talmi YP, Wolf GT, Hazuka M, Krause CJ. Unknown primary of the head and neck. J Laryngol Otol. 1996; 110(4):353–6.
5. Greco FA, Hainsworth JD. Cancer of unknown primary site. In : DeVita VT, Hellman S, Rosenberg SA, editors. Cancer: Principles and Practice of Oncology. 7th ed. Philadelphia: Lippincott Williams & Wilkins;2005. p. 2213–36.
6. Strojan P, Ferlito A, Medina JE, Woolgar JA, Rinaldo A, Robbins KT, et al. Contemporary management of lymph node metastases from an unknown primary to the neck: I. a review of diagnostic approaches. Head Neck. 2013; 35(1):123–32.

7. Waltonen JD, Ozer E, Hall NC, Schuller DE, Agrawal A. Metastatic carcinoma of the neck of unknown primary origin: evolution and efficacy of the modern workup. Arch Otolaryngol Head Neck Surg. 2009; 135(10):1024–9.

8. Grau C, Johansen LV, Jakobsen J, Geertsen P, Andersen E, Jensen BB. Cervical lymph node metastases from unknown primary tumours. Results from a national survey by the Danish Society for Head and Neck Oncology. Radiother Oncol. 2000; 55(2):121–9.
9. Švajdler M Jr, Kašpírková J, Hadravský L, Laco J, Dubinský P, Straka L, et al. Origin of cystic squamous cell carcinoma metastases in head and neck lymph nodes: addition of EBV testing improves diagnostic accuracy. Pathol Res Pract. 2016; 212(6):524–31.

10. Jones AS, Cook JA, Phillips DE, Roland NR. Squamous carcinoma presenting as an enlarged cervical lymph node. Cancer. 1993; 72(5):1756–61.

11. Ahn Y, Han DH, Hah JH, Kwon TK, Sung MW, Kim KH. Analysis on diagnostic approach, management and prognosis of cervical metastatic carcinoma of unknown origin. Korean J Otorhinolaryngol- Head Neck Surg. 2007; 50(12):1125–9.
12. Mendenhall WM, Mancuso AA, Parsons JT, Stringer SP, Cassisi NJ. Diagnostic evaluation of squamous cell carcinoma metastatic to cervical lymph nodes from an unknown head and neck primary site. Head Neck. 1998; 20(8):739–44.

13. Fu TS, Foreman A, Goldstein DP, de Almeida JR. The role of transoral robotic surgery, transoral laser microsurgery, and lingual tonsillectomy in the identification of head and neck squamous cell carcinoma of unknown primary origin: a systematic review. J Otolaryngol Head Neck Surg. 2016; 45(1):28.

14. Pelosi E, Pennone M, Deandreis D, Douroukas A, Mancini M, Bisi G. Role of whole body positron emission tomography/computed tomography scan with 18F-fluorodeoxyglucose in patients with biopsy proven tumor metastases from unknown primary site. Q J Nucl Med Mol Imaging. 2006; 50(1):15–22.
15. Al-Ibraheem A, Buck A, Krause BJ, Scheidhauer K, Schwaiger M. Clinical applications of FDG PET and PET/CT in head and neck cancer. J Oncol. 2009; 2009:208725.

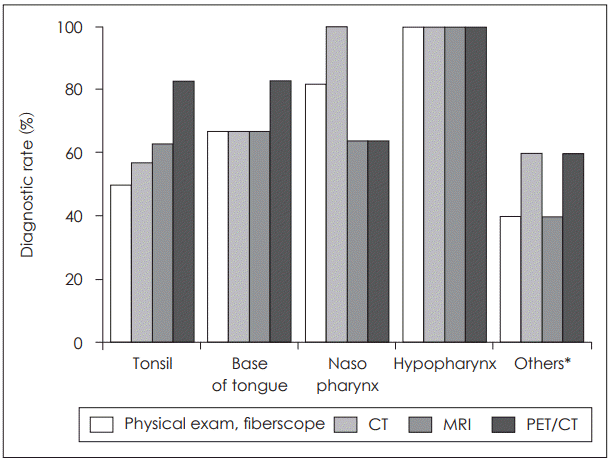
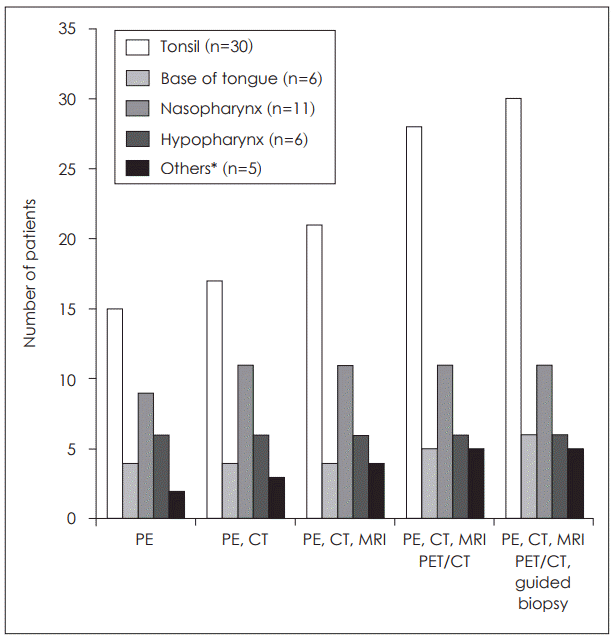
16. Roh JL, Kim JS, Lee JH, Cho KJ, Choi SH, Nam SY, et al. Utility of combined (18)F-fluorodeoxyglucose-positron emission tomography and computed tomography in patients with cervical metastases from unknown primary tumors. Oral Oncol. 2009; 45(3):218–24.

17. Keller F, Psychogios G, Linke R, Lell M, Kuwert T, Iro H, et al. Carcinoma of unknown primary in the head and neck: comparison between positron emission tomography (PET) and PET/CT. Head Neck. 2011; 33(11):1569–75.

18. Rusthoven KE, Koshy M, Paulino AC. The role of fluorodeoxyglucose positron emission tomography in cervical lymph node metastases from an unknown primary tumor. Cancer. 2004; 101(11):2641–9.

19. Kwee TC, Kwee RM. Combined FDG-PET/CT for the detection of unknown primary tumors: systematic review and meta-analysis. Eur Radiol. 2009; 19(3):731–44.

20. Waltonen JD, Ozer E, Schuller DE, Agrawal A. Tonsillectomy vs. deep tonsil biopsies in detecting occult tonsil tumors. Laryngoscope. 2009; 119(1):102–6.





 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download