서 론
대상 및 방법
말초혈액 단핵구의 분리 및 활성화
통계분석
결 과
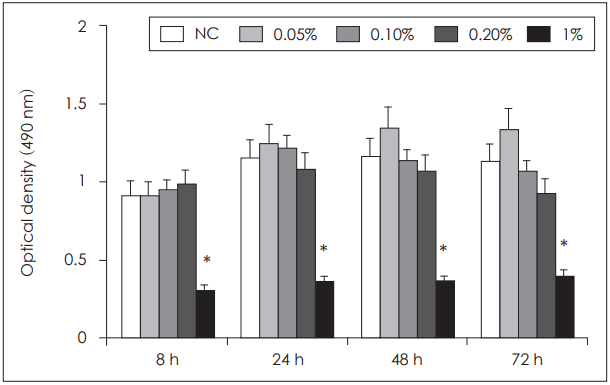 | Fig. 1.Cytotoxic effect of Chamaecyparis obtusa essential oil on PBMCs at variaious concentraions with CellTiter-96® aqueous cell proliferation assay. PBMCs from five healthy individuals were treated with essential oil for 72 hours. Essential oil at concentration over 1% decreased cell proliferation. *p<0.05 vs. NC. PBMCs: peripheral blood mononuclear cells, NC: negative control. |
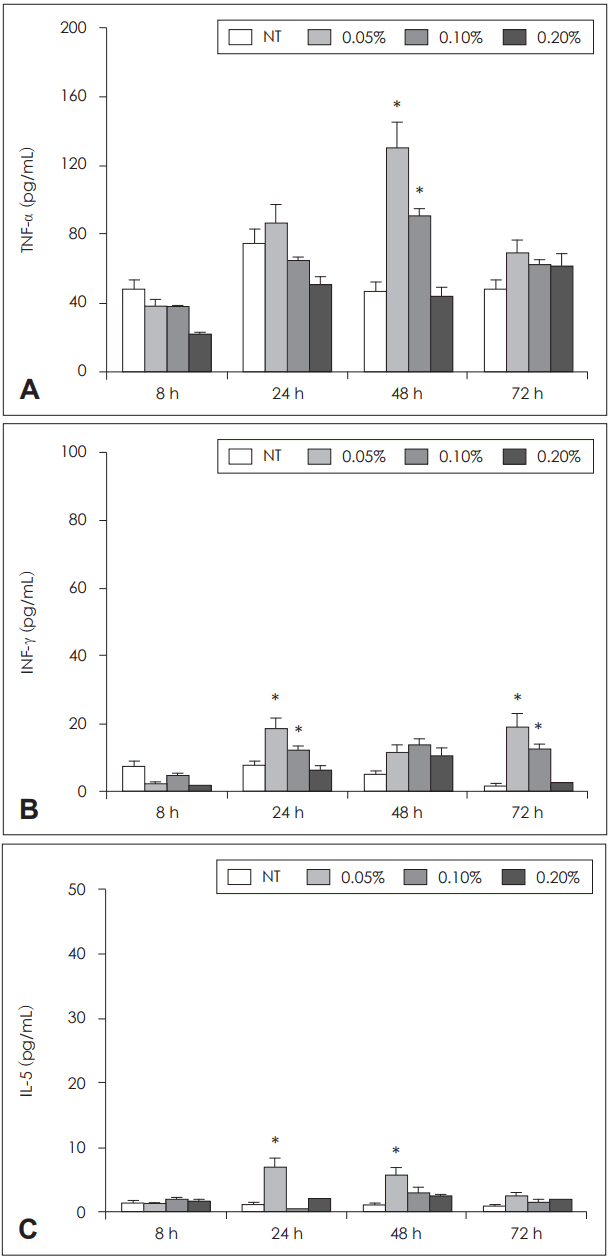 | Fig. 2.Influence of Chamaecyparis obtusa EO on cytokine production by peripheral blood mononuclear cells. 0.05% and 0.1% of EO enhanced TNF-α production at 48 hours (A). 0.05% and 0.1% of EO enhanced INF-γ production at 24 hours (B). 0.05% of EO enhanced IL-5 production at 24 and 48 hours (C). *p<0.05 vs. NT. EO: essential oil, TNF-α: tumor necrosis factor-α, INF-γ: interferon-γ, IL-5: interleukin-5, NT: non-treated group. |
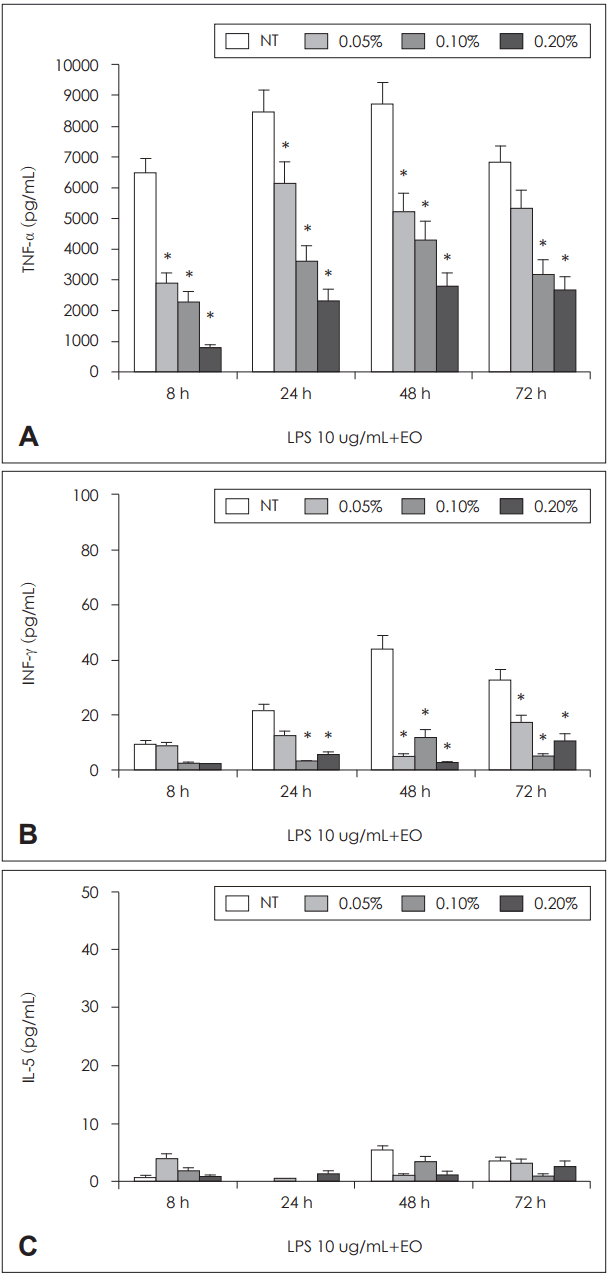 | Fig. 3.Effect of Chamaecyparis obtusa EO on cytokine production by PBMCs. Cells were stimulated 10 ug/mL of LPS with various conentration of EOs. LPS induced TNF-α productions were significantly inhibited with 0.05, 0.1, and 0.2 of EO at 24, 48, and 72 hours (A). LPS induced INF-γ productions were significantly inhibited with concentration over 0.05% of EO at 24, 48, and 72 hours (B). LPS did not influence IL-5 production and EO also did not influence IL-5 production of PBMCs (C). *p<0.05 vs. NT. EO: essential oil, PBMCs: peripheral blood mononuclear cells, LPS: lipopolysaccharide, TNF-α: tumor necrosis factor-α, INF-γ: interferon-γ, IL-5: interleukin-5, NT: non-treated group. |
 | Fig. 4.Effect of Chamaecyparis obtusa EO on cytokine production by peripheral blood mononuclear cells. Cells were stimulated 5 ug/mL of PHA with various conentration of EOs. PHA induced TNF-α productions were not inhibited with various concentrations of EOs (A). PHA induced INF-γ production were significantly inhibited at concentration over 0.05% of EOs at 48 and 72 hours incubation (B). PHA induced IL-5 productions tended to be inhibited with 0.2% of EO at 72 hours incubation, however it was not statistically significant (C). *p<0.05 vs. NT. EO: essential oil, PHA: phytohaemagglutinin, TNF-α: tumor necrosis factor-α, INF-γ: interferon-γ, IL-5: interleukin-5, NT: non-treated group. |




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download