Abstract
Background and Objectives
The effects of hyperglycemia on the mucin secretion in inflammatory respiratory diseases are not clear. Therefore, this study was conducted to characterize the effect of hyperglycemia, and the mechanism involved, on MUC5AC and MUC5B expression in human airway epithelial cells.
Materials and Method
The NCI-H292 cells and the primary cultures of human nasal epithelial cells were exposed to different concentration of glucose (5, 10, 15, 20, 30 mM) for 8 or 24 hours, the effects of high concentration of glucose (20 mM) on MUC5AC and MUC5B expression were determined using reverse transcriptase-polymerase chain reaction (PCR), real-time PCR and enzyme immunoassay. Measurement of reactive oxygen species (ROS) production was performed by flow cytometry. To investigate the role of ROS in high concentration of glucose-induced MUC5B expression, the cells were pretreated with N-acetyl-cysteine (NAC, 50 mM) as a ROS scavenger, or diphenyleneiodonium (DPI, 100 nM) as a nicotinamide adenine dinucleotide phosphate oxidase inhibitor for 1 hour.
Results
In the NCI-H292 cells and the primary cultures of human nasal epithelial cells, High concentration of glucose increased MUC5B expression but did not increase MUC5AC expression (p<0.05). ROS production was also increased by high concentration of glucose (20 mM) (p<0.05). In addition, high concentration of glucose (20 mM)-induced MUC5B expression and ROS production were significantly attenuated by pretreatment of NAC (50 mM) or DPI (100 nM) (p<0.05).
정상 사람의 기도는 외부 환경으로부터 유입된 흡기로부터 기도점막을 보호하기 위하여 점액 섬모 운반계(mucociliary transport system)가 발달되어 있다. 기도의 점액 섬모 운반계에서 점액은 수분과 이온, 점액단백(mucin)으로 구성되는데, 글리코실화된 고분자 당단백인 점액단백에 의해 점액의 성상이 결정된다. 점액단백은 점액유전자에 의해 생성이 조절되며, 현재까지 20여 개가 발견되었다. 특히 호흡기에서 발현되는 중요한 점액유전자는 MUC2와 MUC4, MUC5AC, MUC5B, MUC8로 알려져 있다[1,2].
MUC5AC 점액단백은 분비선관과 점막 상피 표면의 배세포(goblet cell)에서 분비되며, MUC5B 점액단백은 점막하 분비선과 보다 작은 범위의 점막 상피 표면 배세포에서 분비되어 젤(gel) 형태의 기도 점액 형성에 있어 주요 작용을 한다고 알려져 있어서[2-4], MUC5AC와 MUC5B 점액유전자의 발현 기전과 그 조절 방법에 대하여 기초적인 연구가 활발하게 이루어지고 있다[5-8]. 임상적으로도 만성 기관지염이나 천식과 같은 만성 호흡기 염증성 질환에서 점막하 분비선의 비대나 배세포의 수 또는 크기의 증가가 일어나, MUC5AC와 MUC5B 점액단백의 과분비가 관찰된다[9]. 이러한 MUC5AC와 MUC5B 점액유전자 발현의 변화로 점액의 성상이 변화하거나 그 분비가 과다해져 병의 경과가 악화될 수 있어, 호흡기 염증성 질환을 가진 환자의 치료에 있어 MUC5AC와 MUC5B 점액유전자 발현을 조절하는 것이 매우 중요하다.
고혈당증은 당뇨병의 합병증 발생에 있어 주된 인자이며 미토콘드리아에서 활성산소(reactive oxygen species)의 형성을 유발시켜서 산화 스트레스를 포함한 다양한 기전을 통해 체내 염증반응을 일으키며, 고혈당증에 의해 유도된 염증반응은 여러 조직과 장기에 영향을 미쳐 혈관질환, 신장질환, 신경질환, 심근질환 등 다양한 질환을 일으키는 것으로 알려져 있다[10-15]. 또한 당뇨병 환자에서도 호흡기 염증성 질환의 유병기간이 길어지고, 빈번하게 재발함이 보고되고 있다[16,17]. 하지만 고혈당증이 호흡기 염증성 질환에 미치는 영향 중 점액분비에 대해서는 아직까지 명확하게 알려져 있지 않은 실정이다.
이에 호흡기 염증성 질환에서 중요한 점액인 MUC5AC와 MUC5B 점액유전자 발현과 점액단백 생성에 고농도 포도당이 어떠한 영향을 미치는지 알아보고자 이 연구를 시행하였다.
사람 호흡기 상피세포의 점액상피양 암 세포주(human pulmonary mucoepidermoid carcinoma cell line)인 NCI-H292 세포(American Type Culture Collection, Manassas, VA, USA)를 6-well plate에 1×106 cells/well의 농도로 접종한 후 2 mM L-glutamine, 100 U/mL penicillin, 100 μg/mL streptomycin과 10% Fetal bovine serum(FBS; Hyclone Laboratories, Logan, UT, USA)이 포함된 RPMI 1640 배지(Invitrogen, Carlsbad, CA, USA)를 이용하여 95%의 산소와 5%의 이산화탄소가 혼합된 완전 습윤 환기된 배양기에서 37℃의 온도로 배양하였다. 70~80% 정도 배양이 이루어지면 세포를 0.5% fetal calf serum이 포함된 RPMI 1640 배지로 교체한 후 24시간 동안 배양하고, 다시 FBS가 포함되지 않은 RPMI 1640 배지로 세척하여 사용하였다.
고농도 포도당에 의한 MUC5AC와 MUC5B 점액유전자 발현과 MUC5B 단백 생성을 알아보고자 포도당을 이용하였다. 다양한 농도(5, 10, 15, 20, 30 mM)로 세포 배양 배지에 투여하였으며, 동일 농도(20 mM)에서는 노출 시간(0, 2, 4, 8, 24, 48시간)을 다르게 하여 관찰하였다. 또한 각 포도당 농도에서 MUC5B 점액유전자 발현에 관계하는 활성산소 생성을 알아보기 위하여 활성산소 억제제인 N-acetyl-cysteine(NAC; Sigma-Aldrich, St. Louis, MO, USA)과 nicotinamide adenine dinucleotide phosphate(NADPH) 산화효소 억제제인 diphenyleneiodonium(DPI; EMD Biosciences, Inc., San Diego, CA, USA)을 고농도 포도당에 노출되기 1시간 전에 전처치하였다. 사람의 혈액 내 생리학적 포도당 농도인 5 mM 농도에서 대조군 세포를 노출시켜 사용하였다[18].
사람 코점막 상피세포를 얻기 위해서 기저 당뇨병이나 알레르기 질환과 그 가족력이 없고, 피부단자시험(skin prick test)과 다중 알레르기항원검사(multiple allergen simultaneous test)에서 음성반응이 나온 10명을 대상으로 하여 융비술 시행중에 발생하는 비강 내 적출물 중 정상 하비갑개 조직을 얻었다. 일차배양을 하기 위해 하비갑개 점막조직을 phosphate-buffered saline(PBS)으로 세척한 후, 90분 동안 dispase(Boehringer Mannheim Biochemica, Mannheim, Germany)에 침전시켰다. 외과용 수술칼을 사용하여 하비갑개 점막의 표면을 벗겨내어, 1% PBS를 추가한 후 mesh를 통해 여과하였다. 이러한 과정을 통해 얻은 하비갑개 점막의 상피세포들을 24-well(2.5×105 cells/well) plate에 접종한 후, EpiLife medium(Cascade Biologics, Portland, OR, USA)과 keratinocyte growth supplement(5/500 mL of medium, Cascade Biologics, Portland, OR, USA)에서 배양하였다. 실험에서 사용한 NCI-H292 세포와 일차 배양한 사람 코점막 상피세포에 대한 포도당의 세포독성 유무는 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 분석(Sigma-Aldrich, St. Louis, MO, USA)과 현미경을 이용한 세포 형태 변화 유무를 확인하여 검증하였다.
본 연구는 본원 임상 시험 심사 위원회(Institutional Review Board: YUH-13-0375-O33)의 승인을 받아 시행하였다.
모든 RNA는 reverse transcription-polymerase chain reaction(PCR) kit(Roche Applied Science, Mannheim, Germany)를 이용하여 동정되었고, GeneAmp RNA PCR cored kit(Roche Applied Science)를 이용하여 cDNA로 역전사되었다. 실험에 사용된 primer의 염기서열은 MUC5AC 점액유전자의 경우 sense는 5’-TCA ACG GAG ACT GCG AGT ACA C-3’, antisense는 5’-CTT GAT GGC CTT GGA GCA-3’이고, MUC5B 점액유전자의 경우 sense는 5’-CAC ATC CAC CCT TCC AAC-3’, antisense는 5’-GGC TCA TTG TCG TCT CTG-3’이며, 각 반응의 내부 양성 대조군(internal positive control)은 glyceraldehyde-3-phosphate dehydrogenase(GAPDH)를 사용하였으며, 염기서열은 sense는 5’-CCT CCA AGG AGT AAG ACC CC-3’, antisense는 5’-AGG GGT CTA CAT GGC AAC TG-3이다.
각각의 중합효소연쇄반응 과정을 간략히 설명하면, 배양된 세포를 2% bovine serum albumin을 함유한 PBS로 3회 세척한 후 TrizolⓇ(Molecular Research Center, Cincinnati, OH, USA)을 이용하여 총 mRNA를 추출하였다. MUC5AC mRNA에 대한 PCR은 95℃에서 60초간 변성과정과 60℃에서 60초간 결합반응, 72℃에서 60초간 연장반응을 33회 반복한 후 72℃에서 20분간 최종 연장반응을 시행하였고, MUC5B mRNA에 대한 PCR은 95℃에서 60초간 변성과정과 72℃에서 60초간 결합반응, 72℃에서 60초간 연장반응을 33회 반복한 후 72℃에서 20분간 최종 연장반응을 시행하였다. 증폭된 중합효소연쇄반응의 산물은 SYBR green이 함유된 1% agarose gel을 통한 전기영동을 이용하여 분리 관찰하였다. 확인된 띠(band)의 세기는 Scion Image software(Scion Corporation, Frederick, MD, USA)를 이용하여 반정량적으로 분석하였다. MUC5AC 점액유전자와 MUC5B 점액유전자 각각의 띠의 세기는 GAPDH 대조군의 세기와 비교하여 상대적인 값으로 나타내었다.
합성된 cDNA 0.5 μL를 대상으로 LC Fast Start DNA Master SYBR Green kit(Roche Applied Science)를 사용하여 real-time PCR을 수행하였다. Real-time PCR은 최종량이 10 μL가 되게, 2.5 mM의 MgCl2와 그 최종 농도가 0.5 μM이 되게 primer를 투여하였으며, 25 ng의 RNA 1 μL를 이용하여 실험을 수행하였다. 정량적인 PCR은 Light-Cycler(Roche Applied Science)를 사용하여 95℃에서 10초간 변성(denaturation)과정을 거치고 60℃에서 5초간 결합(annealing) 반응을 시킨 후, 72℃에서 10초간 연장(extension) 반응하였고, 이러한 과정을 45회 반복하였다. 각 실험에서 증폭된 cDNA의 유무를 확인하기 위하여 GAPDH를 대조 유전자(internal control)로 사용하였다.
MUC5B 점액단백의 함량을 측정하기 위해서 enzyme-linked immunosorbent assay(ELISA)법을 이용하였다. 시료를 처리한 배양된 세포에서 lysis buffer[50 mM tris·Cl(pH 7.5), 1 mM ethylene glycol tetraacetic acid, 1% triton X-100, and 1 mM phenylmethylsulfonyl fluoride]로 단백을 추출하여 정량하였다. 추출한 단백 100 μg을 96-well plate에 담고 40℃에서 건조될 때까지 방치한 후 plate를 PBS로 3회 세척하였다. 비특이적 결합을 방지하기 위해 2% bovine serum albumin으로 실온에서 1시간 동안 차단한 후 PBS로 3회 세척한 다음 0.05% Tween 20을 함유한 PBS에 1:200으로 희석된 MUC5B 점액단백 일차항체(Santa Cruz Biotechnology, Santa Cruz, CA, USA)로 반응시켰다. 다시 PBS로 3회 세척한 후 HRP-conjugated 이차항체(Santa Cruz Biotechnology)를 0.05% Tween 20을 함유한 PBS에 1:5000으로 희석하여 각 well에 첨가하였고, 1시간 후에 각 well을 PBS로 3회 세척하였다. 3,3,5,5’-tetramethyl benzidine 용액으로 발색한 후, 2N-H2SO4를 이용하여 중단시켰다. ELISA reader(EL800Ⓡ; BIO-TEK Instruments, Winooski, VT, USA)로 450 nm에서 흡광도를 측정한 후 표준곡선을 이용하여 단백의 양을 정량하였다.
생성된 활성산소의 함량을 측정하기 위해서 flow cytometry법을 이용하였다. 대상 세포에 50 μM의 2,7-dichlorodihydrofluorescein diacetate와 aredox-sensitive fluorescent dye를 40분 동안 처리한 후 PBS로 3회 세척하였으며, Flow cytometry를 시작하기 전까지 얼음에 담긴 1 mL PBS suspension에서 세포를 유리하였다. FACSCanto II(BD Bioscience, Rutherford, NJ, USA)에서 488 nm excitation beam을 이용하여 flow cytometry를 시행하였다. 신호는 530 nm 투과 밴드를 이용하여 추출하였으며, 5000개 세포에서의 평균 형광강도를 기준으로 삼았다.
다양한 농도의 포도당(5, 10, 15, 20, 30 mM)에 8시간 노출시킨 후 분석한 MUC5AC mRNA와 MUC5B mRNA의 발현 정도를 확인해 본 결과, MUC5AC mRNA는 포도당의 농도 변화에 따라 발현 정도의 차이를 보이지 않은 반면, MUC5B mRNA의 경우 포도당 농도가 15 mM 이상에서 발현양의 유의한 증가를 확인할 수 있었다(Fig. 1A). 포도당 농도의 증가와 노출 시간에 따른 MUC5B mRNA 발현 정도를 정량적으로 확인하기 위해 real-time PCR을 이용하여 분석하였다. 포도당 농도에 따라 MUC5B mRNA 발현은 의미 있게 증가되었으며, 포도당 20 mM 농도에서 최대치를 이루고, 30 mM 농도에서는 감소하는 양상을 보였다(Fig. 1B). 노출 시간에 따른 MUC5B mRNA 발현 정도를 보는 실험에서는 20 mM 포도당에 대한 노출 시간이 증가함에 따라 MUC5B mRNA 발현이 증가하였으며, 8시간째 MUC5B mRNA 발현이 최대치를 이루는 양상을 보였으나, 시간 의존성은 관찰되지 않았다(Fig. 1C). 포도당 농도에 따른 MUC5B 당단백 생성변화를 확인하기 위해 다양한 농도의 포도당(5, 10, 15, 20, 30 mM)에 24시간 노출시킨 후 ELISA 검사를 시행하였으며, MUC5B 당단백의 생성이 노출된 포도당의 농도 증가에 따라 당단백생성이 증가됨을 확인할 수 있었다(Fig. 1D). 이러한 결과들은 선행연구를 통해 확인된 결과들과 유사한 경향성을 보였다[19].
포도당 20 mM 농도에 노출된 NCI-H292 세포에서 포도당에 노출된 시간이 증가함에 따라 control(포도당 5 mM)과 비교하여 활성산소 생성이 증가함을 확인할 수 있었다(Fig. 2).
활성산소 억제제인 NAC와 DPI의 효과를 확인하기 위해 고농도 포도당(20 mM)에 노출시키기 1시간 전에 NAC(50 mM)와 DPI(100 nM)를 각각 전처치하였다[20]. 고농도 포도당에 노출된 NCI-H292 세포에서 활성산소 억제제인 NAC(50 mM)에 의해 활성산소 생성이 의미 있게 감소되었고, NADPH 산화효소 억제제인 DPI(100 nM)에 의해서도 활성산소 생성이 의미있게 감소되었다(Fig. 3).
고농도 포도당에 노출된 NCI-H292 세포에서 활성산소 억제제인 NAC(50 mM)에 의해 MUC5B mRNA 발현과 당단백 생성이 의미 있게 감소되었고, NADPH 산화효소 억제제인 DPI(100 nM)에 의해서도 MUC5B mRNA 발현과 당단백 생성이 의미 있게 감소되었다(Fig. 4).
고혈당증은 호흡기 염증성 질환의 이환과 악화, 잦은 재발에 있어 관계하여 폐섬유증과 폐부종, 허파꽈리의 파괴 및 확장 등의 구조적인 변화를 일으켜 폐기능 저하를 유발하고, 호흡기 국소 염증반응을 유발하여 감염성, 염증성 호흡기 질환의 악화에 영향을 주는 것으로 알려져 있다[21-23]. 또한, 호흡기내 포도당 농도의 증가는 세균증식에 필요한 영양분을 공급함으로서 세균성 호흡기 질환의 발생에 중요한 위험요인으로 알려져 있다[24]. 정상인의 경우 호흡기 내강에 유지되는 포도당의 농도는 혈장 농도 비해 12배 정도 낮게 유지되는 것으로 알려져 있으며, 여기에는 능동적 포도당 운송체인 glucose transporter 1, 2, 10 등이 관여하는 것으로 알려져 있다. 이러한 능동적인 호흡기 내의 저포도당 상태는 호흡기 감염의 위험성을 낮춰 호흡기 항상성 유지에 중요한 생리적 환경을 제공하게 된다[24]. 그러나 Philips 등과 Wood 등의 연구 등을 통해 확인되었듯이 전신적인 고혈당증상태는 상하부 호흡기 내강의 포도당 농도의 증가를 발생시키며, 또한 고혈당증으로 인해 유발되는 염증반응으로 인해 호흡기 혈관내피세포 및 상피세포의 손상이 발생하여 호흡기내 혈장 누출이 발생하고 이는 호흡기 내강에 지속적인 포도당 농도의 상승을 발생시킨다[24-26]. 이러한 호흡기 내강의 포도당 농도의 증가는 호흡기 상피세포, 혈관내피세포, 면역세포, 기도평활근세포 등에 직접적인 영향을 주며 다양한 기전을 통해 감염성, 염증성 호흡기 질환의 발생과 악화의 위험요인이 된다[16].
대표적인 호흡기 염증성 질환에는 천식과 낭성 폐섬유증, 만성 폐쇄성 폐질환, 기관지 확장증 등이 있다. 이들 질환에서는 염증성 반응으로 점막하 분비선의 비대나 배세포의 수 또는 크기의 증가가 일어나서 MUC2와 MUC4, MUC5AC, MUC5B, MUC8 점액유전자의 발현이 증가한다[1,2]. 이 중 MUC5B 점액유전자는 호흡기 염증성 질환의 주요 분비형 점액유전자로, 천식 환자에서 흡입된 외부 물질이나 산화 스트레스, interleukin(IL)-6, IL-8, IL-13, IL-17 등에 의해 발현이 촉진된다[11,27,28]. 낭성 폐섬유증이나 간질성 폐질환 환자에서 활성산소나 사이토카인 등의 염증성 매개 물질의 작용에 의해 MUC5B 점액유전자의 발현이 증가되고[3,28], 만성 폐쇄성 폐질환 환자에서 IL-9과 IL-13, tumor necrosis factor의 활성화나 산화 스트레스가 MUC5B 점액유전자를 과발현시킨다[27,29-32]. 이에 고혈당증이 호흡기에서 염증반응을 일으키므로 호흡기 상피세포에서 점액유전자 발현 조절에 관여할 것으로 추정되어, 본 연구를 시행한 결과 고농도의 포도당이 인체 호흡기 상피세포에서 주요 분비형 점액유전자인 MUC5B 점액유전자의 발현을 증가시킴을 알 수 있었다.
MUC5B 점액유전자 발현에 관계하는 여러 염증 매개물질들 중 활성산소는 전자 전달계 혹은 에너지대사 과정 중에 산소가 불완전하게 환원되거나, 펩티드 성장인자와 사이토카인, 효소 등의 다양한 신호 전달계의 자극에 의해 발생하는 화학적 반응성이 높은 분자로, 과량 생성될 시 세포 구조의 손상을 야기하여 산화 스트레스를 조장한다[28,29]. 즉, 활성산소는 DNA와 단백질, 지질 등을 산화시킴으로써 직접적으로 세포를 손상시킬 뿐만 아니라 스트레스에 민감한 세포 내의 다양한 신호 전달체계를 활성화함으로써 간접적으로 세포에 손상을 일으켜서[27], 세포 내의 적절한 방어 기전에 문제가 생길 경우, 당뇨병을 포함하여, 다양한 염증성 질환, 노화 관련 변성, 종양의 생성 등의 병인으로 관여할 것으로 생각된다. 이에 고농도 포도당이 사람 호흡기 상피세포에서 활성산소를 생성하여 점액분비에 관여할 것으로 추정하였으며, 두 가지의 대표적인 호흡기 상피세포주(NCI-H292 세포와 사람 코 점막 상피세포)를 이용하여 상기도 및 하기도 호흡기 상피세포에서 고농도 포도당이 점액유전자 발현에 미치는 효과와 연관 기전으로 활성산소 발생의 역할에 대해 확인해 보고자 하였다. 본 실험의 결과를 통해 저자들은 고농도 포도당이 서로 다른 호흡기 상피세포에서 활성산소 생성을 유발시키며, 활성산소 억제제와 NADPH 산화효소 억제제가 활성산소 생성조절을 통해 MUC5B의 과발현을 감소시킴을 확인하였다. 이는 임상적으로 밀접한 연관성이 있는 것으로 알려진 고혈당증과 호흡기 질환의 악화와 관련하여 고농도 포도당 노출에 따른 점액과 분비가 하나의 이유가 될 수 있음을 확인한 연구였다. 하지만 고농도 포도당이 사람 호흡기 상피세포에서 점액유전자 발현에 미치는 영향을 보다 자세하게 이해하기 위해서는 점액유전자 발현에 관계되는 신호 전달 체계에 대한 연구와 더불어 실험 동물과 인체를 이용하여 포도당 혈중 농도에 따른 점액유전자 발현에 대한 추가적인 연구가 반드시 필요할 것으로 생각된다.
결론적으로 본 연구에서 사람 호흡기 상피세포에서 고농도 포도당이 활성산소를 통해 MUC5B 점액유전자 발현을 유도한다는 것을 알 수 있었으며, 이는 사람 호흡기에서 고혈당증이 점액 분비에 미치는 영향에 대한 기초적인 자료를 제공할뿐만 아니라 당뇨병을 동반한 호흡기 질환에서 점액 분비 조절 치료제 개발에 많은 도움을 제공할 것으로 생각된다.
ACKNOWLEDGMENTS
This research was supported by Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Science, ICT & Future Planning (NRF-2016R1A2B1012606).
REFERENCES
1. Ali MS, Pearson JP. Upper airway mucin gene expression: a review. Laryngoscope. 2007; 117(5):932–8.

2. Rose MC, Voynow JA. Respiratory tract mucin genes and mucin glycoproteins in health and disease. Physiol Rev. 2006; 86(1):245–78.

3. Groneberg DA, Eynott PR, Oates T, Lim S, Wu R, Carlstedt I, et al. Expression of MUC5AC and MUC5B mucins in normal and cystic fibrosis lung. Respir Med. 2002; 96(2):81–6.

4. Lee JG, Moon HJ, Kim SS, Kim CW, Yoon JH. Expression and regulation of MUC8 & MUC5AC by various cytokines in normal human nasal epithelial cells. Korean J Otolaryngol-Head Neck Surg. 2001; 44(6):600–5.
5. Kim KC. Role of epithelial mucins during airway infection. Pulm Pharmacol Ther. 2012; 25(6):415–9.

6. Yu H, Yang J, Xiao Q, Lü Y, Zhou X, Xia L, et al. Regulation of high glucose-mediated mucin expression by matrix metalloproteinase-9 in human airway epithelial cells. Exp Cell Res. 2015; 333(1):127–35.

7. Park NK, Choi YS, Lee JH, Kim HS, Kim JK, Ahn JH, et al. Effect of udenafil on MUC5B expression in human airway epithelial cells. Korean J Otorhinolaryngol-Head Neck Surg. 2013; 56(8):501–5.

8. Song EJ, Bae CH, Kim JY, Kim YW, Park SY, Song SY, et al. Effect of epigallocatechin-3-gallate on PMA-induced MUC5B expression in human airway epithelial cells. Clin Exp Otorhinolaryngol. 2013; 6(4):237–42.

9. Horsley A, Rousseau K, Ridley C, Flight W, Jones A, Waigh TA, et al. Reassessment of the importance of mucins in determining sputum properties in cystic fibrosis. J Cyst Fibros. 2014; 13(3):260–6.

10. Brownlee M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes. 2005; 54(6):1615–25.
11. Evans CM, Kim K, Tuvim MJ, Dickey BF. Mucus hypersecretion in asthma: causes and effects. Curr Opin Pulm Med. 2009; 15(1):4–11.

12. Wu D, Peng F, Zhang B, Ingram AJ, Kelly DJ, Gilbert RE, et al. EGFR-PLCgamma1 signaling mediates high glucose-induced PKCbeta1-Akt activation and collagen I upregulation in mesangial cells. Am J Physiol Renal Physiol. 2009; 297(3):F822–34.
13. Lan CC, Wu CS, Huang SM, Wu IH, Chen GS. High-glucose environment enhanced oxidative stress and increased interleukin-8 secretion from keratinocytes: new insights into impaired diabetic wound healing. Diabetes. 2013; 62(7):2530–8.
14. Kayama Y, Raaz U, Jagger A, Adam M, Schellinger IN, Sakamoto M, et al. Diabetic cardiovascular disease induced by oxidative stress. Int J Mol Sci. 2015; 16(10):25234–63.

15. Han L, Ma Q, Li J, Liu H, Li W, Ma G, et al. High glucose promotes pancreatic cancer cell proliferation via the induction of EGF expression and transactivation of EGFR. PLoS One. 2011; 6(11):e27074.

16. Baker EH, Wood DM, Brennan AL, Clark N, Baines DL, Philips BJ. Hyperglycaemia and pulmonary infection. Proc Nutr Soc. 2006; 65(3):227–35.

17. Baker EH, Bell D. Blood glucose: of emerging importance in COPD exacerbations. Thorax. 2009; 64(10):830–2.

18. Freeman JS. Review of insulin-dependent and insulin-independent agents for treating patients with type 2 diabetes mellitus and potential role for sodium-glucose co-transporter 2 inhibitors. Postgrad Med. 2013; 125(3):214–26.

19. Ye SB, Choi YS, Choi YH, Bae CH, Kim YW, Park SY, et al. Effect of high glucose on MUC5B expression in human airway epithelial cells. Clin Exp Otorhinolaryngol. 2017; 10(1):77–84.

20. Song SY, Jung EC, Bae CH, Choi YS, Kim YD. Visfatin induces MUC8 and MUC5B expression via p38 MAPK/ROS/NF-κB in human airway epithelial cells. J Biomed Sci. 2014; 21:49.

21. Tiengo A, Fadini GP, Avogaro A. The metabolic syndrome, diabetes and lung dysfunction. Diabetes Metab. 2008; 34(5):447–54.

22. Forgiarini LA Jr, Kretzmann NA, Porawski M, Dias AS, Marroni NA. Experimental diabetes mellitus: oxidative stress and changes in lung structure. J Bras Pneumol. 2009; 35(8):788–91.
23. Baker EH, Janaway CH, Philips BJ, Brennan AL, Baines DL, Wood DM, et al. Hyperglycaemia is associated with poor outcomes in patients admitted to hospital with acute exacerbations of chronic obstructive pulmonary disease. Thorax. 2006; 61(4):284–9.

24. Gill SK, Hui K, Farne H, Garnett JP, Baines DL, Moore LS, et al. Increased airway glucose increases airway bacterial load in hyperglycaemia. Sci Rep. 2016; 6:27636.

25. Philips BJ, Meguer JX, Redman J, Baker EH. Factors determining the appearance of glucose in upper and lower respiratory tract secretions. Intensive Care Med. 2003; 29(12):2204–10.

26. Wood DM, Brennan AL, Philips BJ, Baker EH. Effect of hyperglycaemia on glucose concentration of human nasal secretions. Clin Sci (Lond). 2004; 106(5):527–33.

27. Oyinloye BE, Adenowo AF, Kappo AP. Reactive oxygen species, apoptosis, antimicrobial peptides and human inflammatory diseases. Pharmaceuticals (Basel). 2015; 8(2):151–75.

28. Seibold MA, Wise AL, Speer MC, Steele MP, Brown KK, Loyd JE, et al. A common MUC5B promoter polymorphism and pulmonary fibrosis. N Engl J Med. 2011; 364(16):1503–12.
29. Dickinson BC, Chang CJ. Chemistry and biology of reactive oxygen species in signaling or stress responses. Nat Chem Biol. 2011; 7(8):504–11.

30. Song SY, Woo HJ, Bae CH, Kim YW, Kim YD. Expression of leptin receptor in nasal polyps: leptin as a mucosecretagogue. Laryngoscope. 2010; 120(5):1046–50.

Fig. 1.
Effects of high concentration of glucose on expression of mucin genes in human NCI-H292 cells. Results of RT-PCR showed that high concentration of glucose significantly increased MUC5B mRNA expression, but did not increase MUC5AC mRNA expression (A). Effects of high concentration of glucose on MUC5B expression in human NCI-H292 cells. Results of real-time PCR showed that high concentration of glucose significantly increased MUC5B mRNA expression (B) and MUC5B mRNA expression was significantly increased in all duration of time and peaked at 8 hours by treatment of 20 mM glucose in human NCI-H292 cells (C). And results of ELISA showed that high concentration of glucose increased MUC5B protein production and peaked at 20 mM glucose in human NCI-H292 cells (D). The images are representative of three separate experiments performed in triplicated. Bars indicate the mean±S.D. of three independent experiments performed in triplicate. *p<0.05 compared with 5 mM glucose, †p<0.05 compared with zero value. RT-PCR: reverse transcription-polymerase chain reaction, PCR: polymerase chain reaction, ELISA: enzyme-linked immunosorbent assay, GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
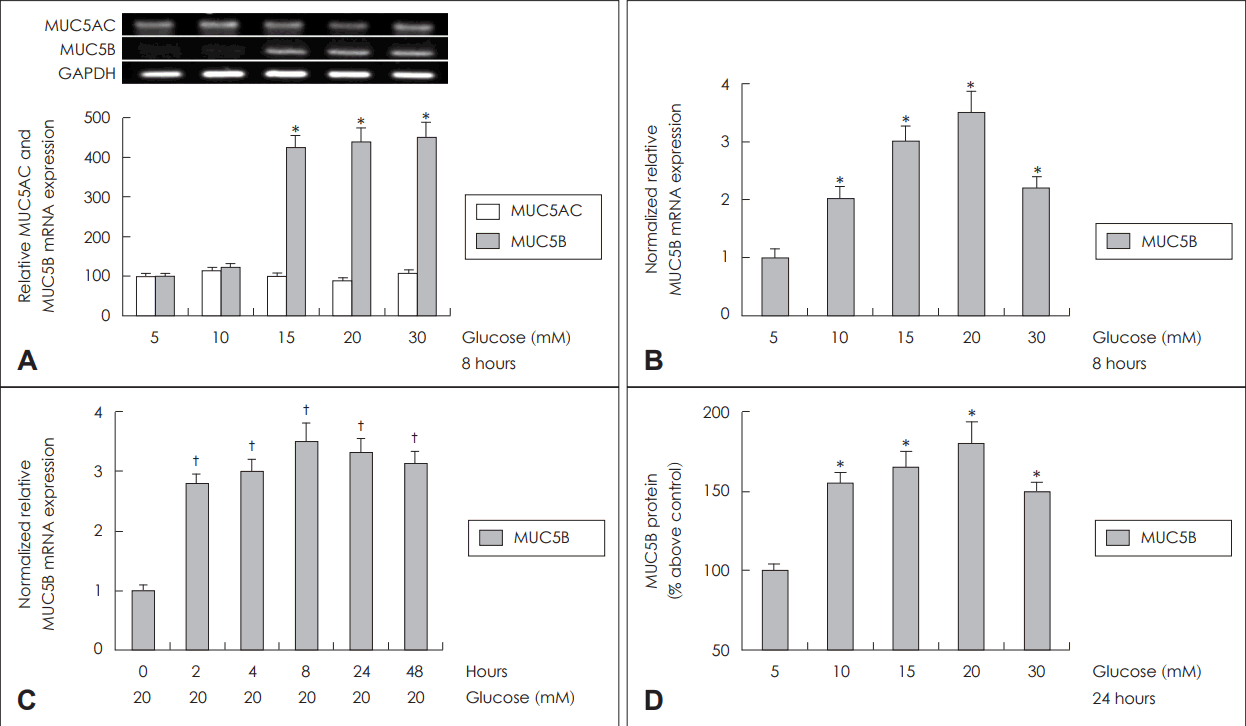
Fig. 2.
Effects of treatment duration of high concentration of glucose on ROS production in human NCI-H292 cells. Results of flow cytometry showed that ROS production was significantly increased at all times after exposure of glucose (20 mM) in human NCI-H292 cells. The images are representative of three separate experiments performed in triplicated. Bars indicate the mean±S.D. of three independent experiments performed in triplicate. *p<0.05 compared with zero value. ROS: reactive oxygen species, DCFDA: dichlorodihydrofluorescein diacetate.
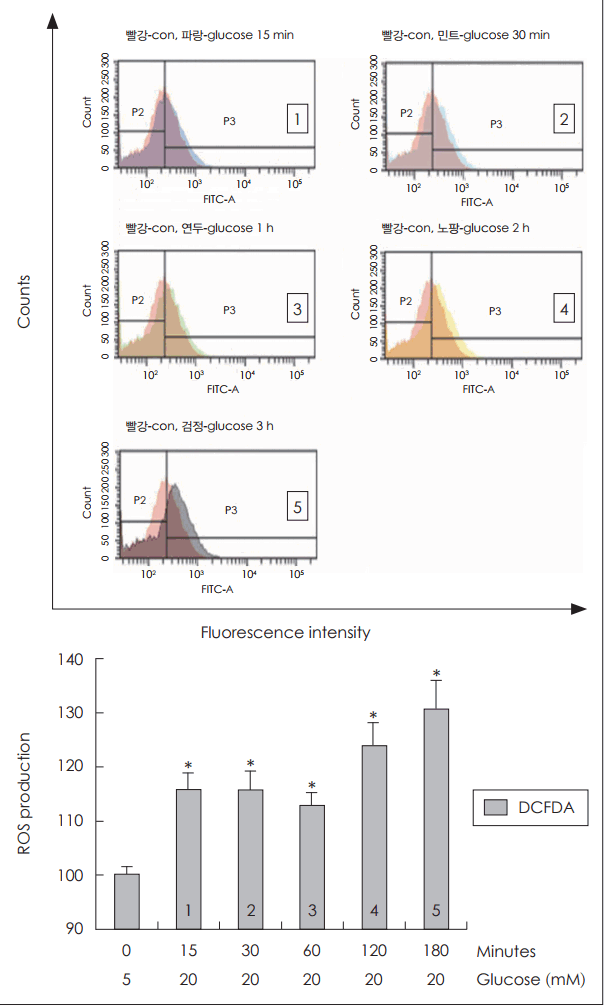
Fig. 3.
Effects of ROS inhibitor and NADPH oxidase inhibitor on ROS production in human NCI-H292 cells. Results of flow cytometry showed that treatment of NAC (ROS scavenger) and DPI (NADPH oxidase inhibitor) significantly blocked ROS production in human NCI-H292 cells. The images are representative of three separate experiments performed in triplicated. Bars indicate the mean±S.D. of three independent experiments performed in triplicate. *p<0.05 compared with 5 mM glucose, †p<0.05 compared with 20 mM glucose only. ROS: reactive oxygen species, DCFDA: dichlorodihydrofluorescein diacetate, NAC: N-acetyl-cystein, DPI: diphenyleneiodonium, NADPH: nicotinamide adenine dinucleotide phosphate.
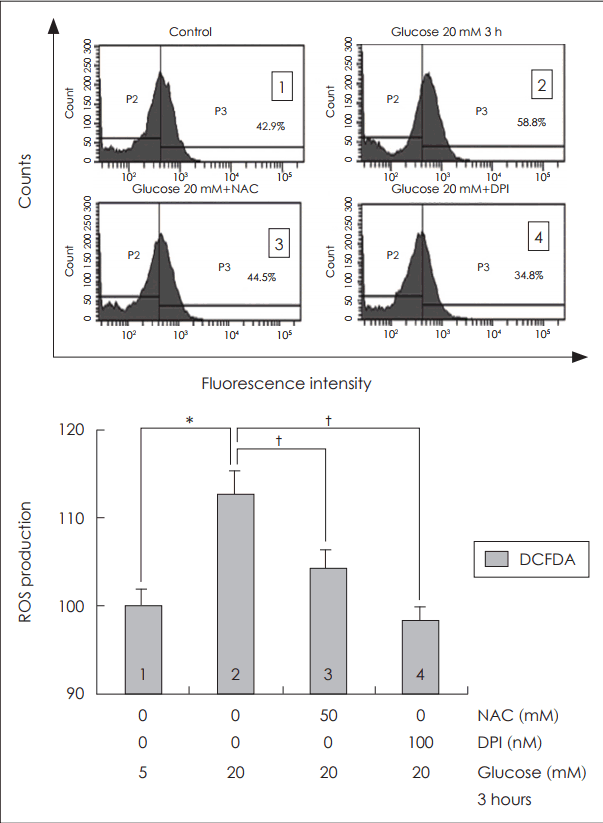
Fig. 4.
Effects of ROS inhibitor and NADPH oxidase inhibitor on MUC5B expression on human NCI-H292 cells. Results of RT-PCR and ELISA showed that treatment of NAC (ROS scavenger) and DPI (NADPH oxidase inhibitor) significantly blocked MUC5B expression in human NCI-H292 cells (A and B). The images are representative of three separate experiments performed in triplicated. Bars indicate the mean±S.D. of three independent experiments performed in triplicate. *p<0.05 compared with 5 mM glucose, †p<0.05 compared with 20 mM glucose only. ROS: reactive oxygen species, GAPDH: glyceraldehyde-3-phosphate dehydrogenase, NAC: N-acetyl-cystein, DPI: diphenyleneiodonium, NADPH: nicotinamide adenine dinucleotide phosphate, RT-PCR: reverse transcription-polymerase chain reaction, ELISA: enzyme-linked immunosorbent assay.
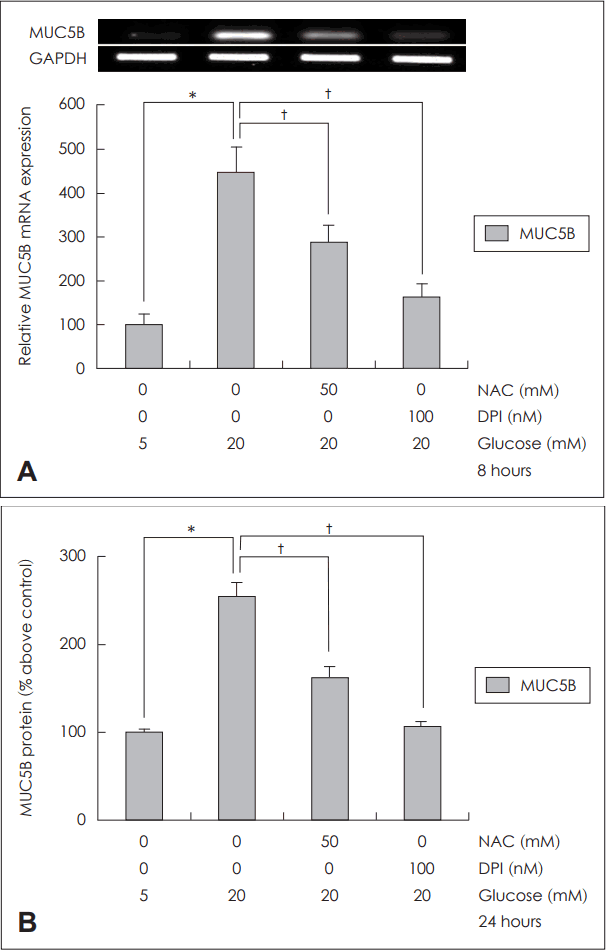
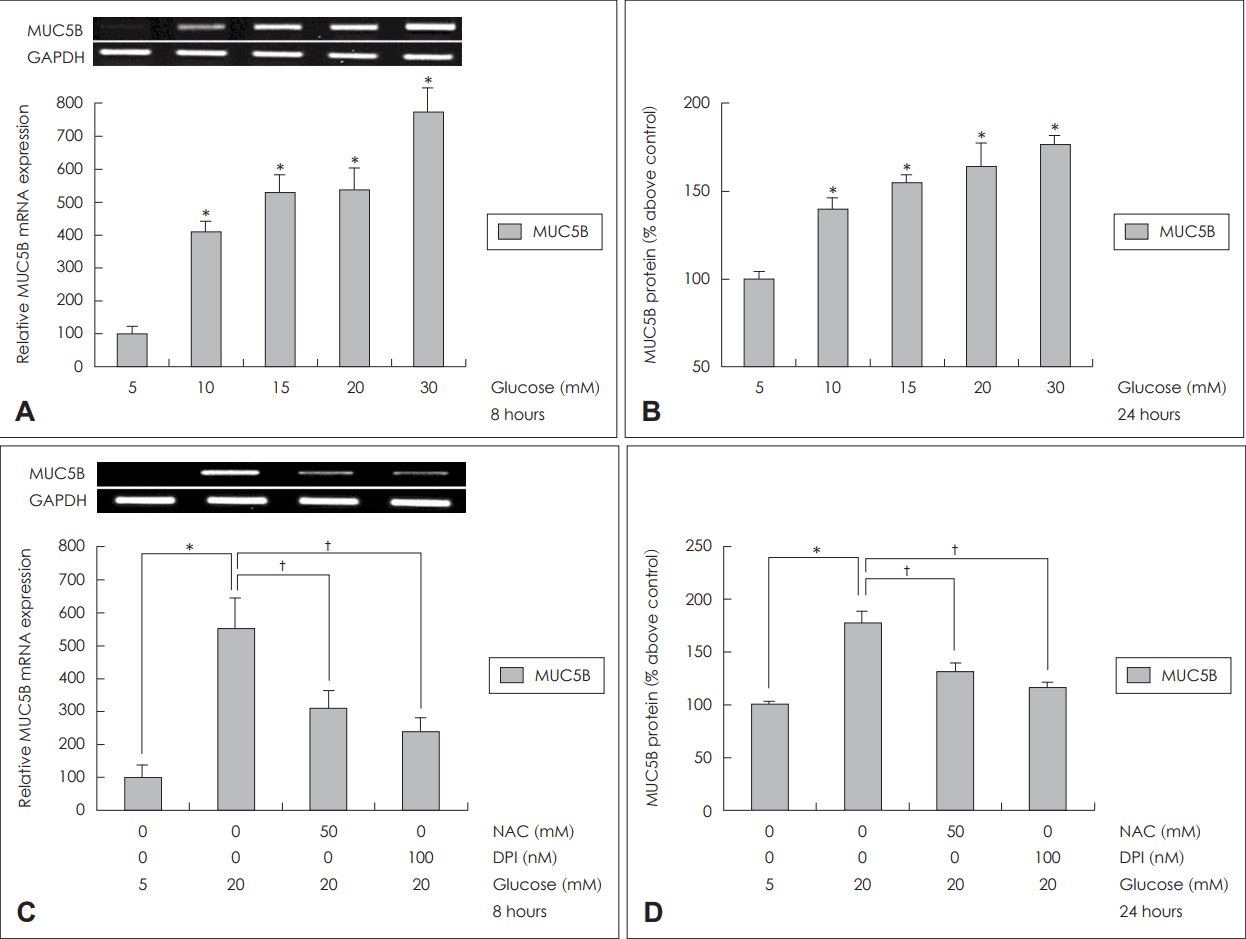
Fig. 5.
Effects of high concentration of glucose on MUC5B expression in the primary cultures of human nasal epithelial cells. Results of RT-PCR and ELISA showed that high concentration of glucose significantly increased MUC5B expression in the primary cultures of human nasal epithelial cells (A and B). Results of RT-PCR and ELISA showed that treatment of NAC (ROS scavenger) and DPI (NADPH oxidase inhibitor) significantly blocked MUC5B expression in the primary cultures of human nasal epithelial cells (C and D). The images are representative of three separate experiments performed in triplicated. Bars indicate the mean±S.D. of three independent experiments performed in triplicate. *p<0.05 compared with 5 mM glucose, †p<0.05 compared with 20 mM glucose only. ROS: reactive oxygen species, GAPDH: glyceraldehyde-3-phosphate dehydrogenase, NAC: N-acetyl-cystein, DPI: diphenyleneiodonium, NADPH: nicotinamide adenine dinucleotide phosphate, RT-PCR: reverse transcription-polymerase chain reaction, ELISA: enzyme-linked immunosorbent assay.




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download