Abstract
Background and Objectives
This study was to done to determine the value of PROPELLER diffusion-weighted imaging in detecting cholesteatoma.
Subjects and Method
Sixty-five patients were evaluated by preoperative magnetic resonance imaging (MRI) with PROPELLER diffusion-weighted imaging. Of 65 patients, 16 patients had chronic otitis media without cholesteatoma and 49 patients with cholesteatoma. Surgical and pathologic findings were compared with the preoperative findings by PROPELLER diffusion-weighted imaging to assess the sensitivity, specificity, positive and negative predictive values.
Results
In 49 patients with cholesteatoma, high signal intensity compatible with cholesteatoma was found in 46 patients, whereas in 16 patients without cholesteatoma, high signal intensity was not detected in any of them. The sensitivity, specificity, positive and negative predictive values for PROPELLER diffusion-weighted imaging were 94.1%, 100%, 100%, and 84.2%, respectively.
만성 진주종성 중이염은 점막으로 구성된 중이강 내로 각화한 편평상피가 침입하여 각질(keratin)을 축적하면서 주위의 골조직을 파괴하는 질환이다. 진주종의 진단은 대부분의 경우 이경, 현미경 또는 이내시경을 통해 중이에 있는 백색의 종물을 확인함으로써 이루어지며, 방사선학적 검사로는 측두골 전산화단층촬영(temporal bone CT, TBCT)을 시행하여 염증이나 진주종의 범위, 이소골 및 주변 골조직인 고실개(scutum), 안면신경관, 골미로, 유돌고실개(tegmen) 등의 파괴, 그리고 유양동과 S상 정맥동의 크기와 위치 등에 대한 정보를 얻게 된다. 그러나, 이경에서 특징적인 소견을 보이지 않거나, TBCT상에서 골파괴를 명확하게 관찰할 수 없는 초기의 병변, 혹은 추체 첨부에 발생한 진주종의 경우 진단이 어려울 수 있으며, 수술 후 재발한 경우에도 술후 고막의 비후로 인하여 그 진단이 어려워 필요시 시험적 고실 개방술을 시행하기도 한다[1,2].
자기공명영상(magnetic resonance imaging, MRI)의 경우 진주종은 다양한 신호강도를 보일 수 있으나, 일반적으로 T1 강조영상에서 뇌실질과 비슷하거나 약간 낮은 신호강도를 보이고 T2 강조영상에서는 다양한 신호강도를 보이며 조영제 주입 후 내부는 조영 증강을 보이지 않는 것으로 알려져 있다.
최근에 진주종성 중이염의 진단에 확산강조영상(diffusion-weighted image)을 이용한 연구가 보고되고 있다[3]. 이 중 프로펠러 확산강조영상(PROPELLER diffusion-weighted image)이란 multishot fast spin-echo 기반에 독특한 K-space sampling(Periodically Rotated Overlapping ParallEL Lines with Enhanced Reconstruction; General Electric) 방법으로 최근 임상에 소개되어 그 유용성에 관한 효과 및 응용에 대하여 많은 연구가 이루어져 왔다[4,5]. 프로펠러 확산강조영상은 고속 스핀 에코(fast spin echo)에 기반을 두고 있으므로 기존의 에코평면(echo-planar) 영상에 기반을 둔 확산강조영상에 비해 대상의 이질성(inhomogenity)으로 인한 susceptibility artifact의 영향을 덜 받기 때문에 임상적으로 더 유용하게 사용할 수 있으며, multishot 기법을 사용하므로 정상 신호대잡음비(signal-to-noise ratio)에서 고해상도의 영향을 다루기 쉬운 장점이 있다[6].
Koot 등[7]은 확산강조영상을 이용하여 기존의 촬영 기법으로는 진단이 어려운 뇌의 측뇌실에 발생한 유표피종을 진단하여 보고한 바가 있다. 유표피종은 진주종과 동일한 케라틴 성분으로 알려져 있으며 중이에 발생하였을 경우 진주종으로 불리기도 한다.
이에 저자들은 최근 프로펠러 확산강조영상을 이용하여 진주종성 중이염에 있어 그 진단적 가치를 알아보고, 영상과 병리조직학적 소견과의 관련성을 알아보고자 하였다.
2005년 1월부터 2015년 9월까지 계명대학교 동산의료원 이비인후과학 교실에서 진주종성 중이염이 의심되어 술전 MRI를 촬영한 67명의 환자를 대상으로 후향적으로 연구를 시행하였다. 67명의 환자 중 진주종성 중이염 환자는 51명이었고, 비진주종성 중이염 환자는 16명이었다. 51명의 진주종성 중이염 환자에는 선천성 진주종이 4예, 후천성 진주종이 47예였으며, 16명의 비진주종성 중이염에는 콜레스테롤 육아종이 3예, 만성 육아종성 중이염이 13예 관찰되었다. 양 군에서의 성별, 연령, 방향, 병변의 크기는 통계학적으로 유의한 차이를 보이지 않았다(Table 1).
환자들은 모두 술전에 TBCT, 3T MRI(Sigma Excite, General Electric, Milwaukee, WI, USA) 기기에서 T1 강조영상, T2 강조영상과 프로펠러 확산강조영상을 시행하였다. TBCT는 0.8 mm의 간격으로 촬영되었으며 T1, T2 강조영상은 1 mm 간격으로, 프로펠러 확산강조영상은 3 mm 간격으로 촬영되었고, 모든 영상은 축면(axial plane)에서 관찰하였다.
프로펠러 확산강조영상에서 중이강에 뇌의 실질과 확연히 구별되는 고강도의 신호가 관찰된 경우 MRI상의 양성 소견으로 판단하였고, 영상은 한 명의 영상의학과 전문의의 판독을 받아 술전 영상 소견만으로 진주종의 유무를 예측하였다. 또한 고강도의 신호가 관찰되는 모양에 따라 2개의 군으로 분류하였다. MRI상 고강도의 신호가 TBCT상의 연부 조직 음영을 그대로 반영하여 전체적으로 관찰되는 경우를 I군으로, TBCT에서 관찰되는 연부 조직 음영이 가장자리(rim)의 고강도 신호만 보이고, 내부에는 저음영의 신호를 보일 경우 II군으로 분류하였다.
수술은 한 명의 이비인후과 전문의에 의해 시행되었으며, 모든 환자는 전신마취하에 고실 성형술 및 유양돌기 삭개술을 시행하였다. 술 중에 영상 소견과 일치하는 부위에서 진주종으로 생각되는 백색 종물의 존재 여부를 육안적으로 관찰하였고 그 부위에서 조직 검사를 시행하였으며 병리 조직 검사상 각질(keratin)이 관찰될 경우 진주종으로 확진하였다.
영상 판독 소견과 수술 소견, 그리고 최종 병리 조직학적 검사 결과를 확인하여, 프로펠러 확산강조영상을 통한 진주종성 중이염 진단에 있어서의 민감도(sensitivity)와 특이도(specifivity), 양성 예측률(positive predictable value, PPV)과 음성 예측률(negative predictable value, NPV)을 조사하였다.
진주종의 경우 술전 시행한 프로펠러 확산강조영상에서 주위 뇌 실질과 확연히 구별되는 특징적인 고강도의 신호를 관찰할 수 있었으나 비진주종성 중이염에서는 고강도의 신호를 관찰할 수 없었다(Fig. 1).
총 67명의 환자 중 진주종성 중이염이 최종적으로 진단된 51명의 환자 48명에서 주위 뇌 실질과 구별되는 고강도의 신호를 관찰할 수 있었고, 진주종이 발견되지 않았던 16명의 환자에서는 모두 고강도의 신호가 나타나지 않았다(Table 2). 따라서 본 연구에서 조사된 민감도(sensitivity)는 94.1%였고, 특이도(specificity)는 100%였으며, 양성 예측률(PPV)과 음성 예측률(NPV)도 각각 100%, 84.2%로 나타났다.
MRI를 분석하여 보았을 때 고강도 신호의 형태에 따라 두 가지 군으로 분류를 시행하였다. TBCT상의 연부조직 음영이 프로펠러 확산강조영상에서 그대로 고강도 신호로 반영되어 전체적으로 고강도의 신호를 보인 경우가 43예에서 관찰되었으며 이를 I군으로 분류하였다(Fig. 2). 그리고 TBCT에서 관찰되는 연부 조직 음영이 프로펠러 확산강조영상에서 가장자리만 고강도의 신호가 관찰되고 내부의 저음영을 보인 경우가 6예에서 있었으며 이를 II군으로 분류하였다(Fig. 3).
또한 두 군의 조직학적 차이를 알아보기 위해 두 군의 병리학적 소견을 관찰해 보았다. I군의 경우 연부조직 음영이 모두 진주종의 기질인 각질(keratin)로 구성되어 있음을 알 수가 있었고(Fig. 4), 2군의 경우 육안적으로 관찰하여 보았을 때 표면은 회백색의 진주종 기질이 둘러싸고 있는 양상이었으며, 내부의 절단면은 화농성(suppurative)의 병변이 관찰되었다(Fig. 5). 현미경적 소견에서도 고강도 신호를 보인 주변 부위가 진주종의 실질이었고, 내부에 호중구(neutrophil)가 운집한 화농성의 변화가 있음을 알 수 있었다(Fig. 6).
진주종은 임상적으로 이경 소견을 통해 의심하게 되고, TBCT나 MRI는 병변의 범위 혹은 이소골이나 주위 골조직의 미란 파괴 등의 추가적인 정보를 제공하는 보조적인 역할을 하게 되며, TBCT나 MRI만으로 진주종을 진단하는 데는 논란의 여지가 있어 왔다. 특히 진주종의 수술 시 외이도 후벽을 보존한 경우에는 잔류성 진주종이 35%[8], 재발성 진주종이 18%[9]에서 관찰된다고 보고되어진다. 게다가 술후에 발생한 경우에는 고막의 상처나 비후로 인하여 이학적 검사만으로 재발을 빨리 알아내기는 매우 힘든 것으로 알려져 있다[10].
수술후 발생할 수 있는 재발성 혹은 잔류성 진주종에 대한 의심은 때때로 이루(otorrhea)를 통하여 이루어진다. 만약 적절한 약물 치료에도 불구하고 이루가 지속될 경우에는 진주종이 발생하였을 가능성을 예측할 수 있으며, 반대로 이루가 약물 치료 이후 조절되었을 경우에는 만성 화농성 중이염일 가능성이 높을 것이라고 생각할 수 있다. 그러나 이 경우에도 역시 진주종을 완전히 배제할 수 없으므로 시험적인 고실 개방술을 시행하거나 추가적인 방사선학적 검사를 시행하여야 한다[9]. 따라서 이러한 경우 진주종을 감별하기 위해 여러 가지 방사선학적 검사들이 시행되고 발전되어 왔다.
Thomassin과 Braccini [11]는 그들의 연구에서 TBCT상 연부조직 음영이 관찰되지 않는 경우 모든 환자에서 재발성 혹은 잔류성 진주종을 관찰할 수 없어 100%의 음성 예측률(NPV)을 가진다고 보고하였다. 따라서 Williams 등[12]은 TBCT에서 연부조직 음영이 관찰되지 않을 경우에는 추가적인 검사나 수술을 할 필요가 없을 것이라고 생각하였다. 그러나 TBCT에서 연부조직 음영이 관찰되었을 경우 TBCT 소견만으로는 관찰된 병변이 육아종이나 콜레스테롤 육아종 혹은 비후된 점막과 감별이 어려우며 진주종이 있음을 예측하는 데 도움을 줄 수 있는 주변 골의 미란 등의 소견도 술후에는 그 신뢰도가 떨어짐으로 인해 낮은 양성 예측률(PPV)을 가지게 된다[13]. 이 외에도 술후에 발생한 진주종에 있어 TBCT의 진단적 유용성에 대해 많은 연구가 있어 왔으며 민감도를 48~54%, 특이도를 29~41%로 보고하였다[11,14,15].
MRI의 경우에는 수술을 하지 않은 경우에 진주종과 다른 염증성 변화를 감별할 수 있으나, 술후 변성이 있는 경우에는 역시나 그 정확도가 떨어지는 것으로 알려져 있으며 기존에 시행되어 온 일반적인 pulse sequence의 T1, T2 강조영상은 진주종과 다른 연조직 혹은 점액성 분비물을 감별하지 못하는 것으로 알려져 있다[16].
따라서 확산강조영상을 사용하지 않는 기존의 MRI를 사용한 경우 수술후에 발생한 진주종의 진단에 있어 그 민감도와 특이도를 각각 63~71%, 50~78%로 보고하였다[13,16,17].
Maheshwari와 Mukherji [18]는 그들의 증례 보고에서 MRI 확산강조영상에서는 진주종과 육아종을 감별할 수 있음을 기술하였다. 확산강조영상에서는 조직에서의 물의 분자 확산(molecular diffusion)에 대한 정보를 제공하여 진주종에 있어 고강도의 신호를 나타내는 것으로 생각된다[19]. 이를 활용한 연구에서 Aikele 등[20]은 single-shot spin-echo echo planar pulse sequence를 사용하여 얻은 확산강조영상에서 수술후 발생한 진주종 진단의 민감도와 특이도, 양성예측률과 음성 예측률을 각각 77%, 100%, 100%, 75%로 보고하였다.
최근에는 진주종의 진단에 있어 non-echo planar image에 기반을 둔 확산강조영상이 개발되어 사용되고 있으며 대표적으로 Half Fourier Acquisition Single Shot Turbo Spin Echo(HASTE; Siemens, Erlanagen, Germany) 확산강조영상과 K-space sampling 방법을 사용하는 BLADE(Siemens) 확산강조영상과 프로펠러 확산강조영상(General Electric)을 들 수 있다[21-24]. 그 중 프로펠러 확산강조영상은 최근 그 임상적 유용성에 대한 많은 연구가 이루어지고 있다. 특히 수요가 점점 늘어나고 있는 고자장 MRI의 경우 susceptibility artifact의 영향을 더 크게 받는 문제점 때문에 기존의 에코 평면 영상과 같은 pulse sequence의 경우 artifact로 인한 영상정보 소실은 1.5T에 비해 보다 더 크게 나타난다. 이러한 경우에 있어 프로펠러 확산강조영상은 artifact의 영향을 덜 받기 때문에 고자장(3.0T)에서 보다 유용하게 이용될 수 있을 것으로 사료된다[25]. 그러나 프로펠러 확산강조영상은 축면(axial plane)의 영상만 제공되고, 주변 뼈의 구조가 잘 관찰되지 않는 MRI의 특성상 중이와 유양동에 있는 진주종의 정확한 위치를 관찰하기에는 한계가 있어 TBCT와 함께 사용되어야 할 것으로 생각된다[26].
본 연구에서 프로펠러 확산강조영상을 이용하였을 경우 만성 진주종성 중이염의 진단에 있어 민감도, 특이도, 양성 예측률, 음성 예측률이 각각 94.1%, 100%, 100%, 83.2%로 보고되어 그 효용성을 확인할 수 있었다.
위음성을 보인 3예의 경우 수술 소견상 3 mm 미만의 작은 병변이었으며 영상의 간격(3 mm)으로 인하여 진주종이 확인되지 않았을 것으로 생각된다. 그리고 프로펠러 확산강조영상에서 고강도의 신호는 진주종 기질의 각질(keratin)을 반영하는 것으로 생각되며 가장자리의 고강도 신호가 관찰되는 경우에는 내부의 저음영은 진주종의 실질과는 다른 염증성 변화가 존재함을 술후 조직 검사를 통해 확인할 수 있었다.
본 연구에서 수술후 재발한 진주종은 6예가 있었으며, 6예 모두 프로펠러 확산강조영상에서 고강도의 신호를 관찰할 수 있어 100%의 민감도를 보였다.
이번 연구의 한계점으로는 비진주종성 중이염 환자군이 16예로 51예의 진주종성 중이염에 비해 적은 것을 들 수 있겠다. 따라서 발생할 수 있는 위양성 소견에 대한 연구는 향후 더 많은 환자군에서 이루어져야 할 것으로 사료되며, 재발성 혹은 잔류성 진주종에 있어서도 추가적인 연구가 필요할 것으로 사료된다.
REFERENCES
2. Woo HY, Sohn JH, Cho KR, Kim HJ, Kim JY. Clinical features of cholesteatoma in the normal hearing ear. Korean J Otorhinolaryngol-Head Neck Surg. 2008; 51(10):861–5.
3. Vercruysse JP, De Foer B, Pouillon M, Somers T, Casselman J, Offeciers E. The value of diffusion-weighted MR imaging in the diagnosis of primary acquired and residual cholesteatoma: a surgical verified study of 100 patients. Eur Radiol. 2006; 16(7):1461–7.

4. Forbes KP, Pipe JG, Karis JP, Heiserman JE. Improved image quality and detection of acute cerebral infarction with PROPELLER diffusion-weighted MR imaging. Radiology. 2002; 225(2):551–5.

5. Pipe JG, Farthing VG, Forbes KP. Multishot diffusion-weighted FSE using PROPELLER MRI. Magn Reson Med. 2002; 47(1):42–52.

7. Koot RW, Jagtap AP, Akkerman EM, Den Heeten GJ, Majoie CB. Epidermoid of the lateral ventricle: evaluation with diffusion-weighted and diffusion tensor imaging. Clin Neurol Neurosurg. 2003; 105(4):270–3.

8. Chinski A. Cholesteatomatous chronic otitis media. Int J Pediatr Otorhinolaryngol. 1999; 49 Suppl 1:S75–9.

9. Nadol JB Jr. Causes of failure of mastoidectomy for chronic otitis media. Laryngoscope. 1985; 95(4):410–3.

10. Stasolla A, Magliulo G, Parrotto D, Luppi G, Marini M. Detection of postoperative relapsing/residual cholesteatomas with diffusion-weighted echo-planar magnetic resonance imaging. Otol Neurotol. 2004; 25(6):879–84.

11. Thomassin JM, Braccini F. [Role of imaging and endoscopy in the follow up and management of cholesteatomas operated by closed technique]. Rev Laryngol Otol Rhinol (Bord). 1999; 120(2):75–81.
12. Williams MT, Ayache D, Alberti C, Héran F, Lafitte F, Elmaleh-Bergès M, et al. Detection of postoperative residual cholesteatoma with delayed contrast-enhanced MR imaging: initial findings. Eur Radiol. 2003; 13(1):169–74.

13. Vanden Abeele D, Coen E, Parizel PM, Van de Heyning P. Can MRI replace a second look operation in cholesteatoma surgery? Acta Otolaryngol. 1999; 119(5):555–61.
14. Blaney SP, Tierney P, Oyarazabal M, Bowdler DA. CT scanning in “second look” combined approach tympanoplasty. Rev Laryngol Otol Rhinol (Bord). 2000; 121(2):79–81.
15. Tierney PA, Pracy P, Blaney SP, Bowdler DA. An assessment of the value of the preoperative computed tomography scans prior to otoendoscopic ‘second look’ in intact canal wall mastoid surgery. Clin Otolaryngol Allied Sci. 1999; 24(4):274–6.

16. Kimitsuki T, Suda Y, Kawano H, Tono T, Komune S. Correlation between MRI findings and second-Look operation in cholesteatoma surgery. ORL J Otorhinolaryngol Relat Spec. 2001; 63(5):291–3.

17. Denoyelle F, Silberman B, Garabedian EN. [Value of magnetic resonance imaging associated with X-ray computed tomography in the screening of residual cholesteatoma after primary surgery]. Ann Otolaryngol Chir Cervicofac. 1994; 111(2):85–8.
18. Maheshwari S, Mukherji SK. Diffusion-weighted imaging for differentiating recurrent cholesteatoma from granulation tissue after mastoidectomy: case report. AJNR Am J Neuroradiol. 2002; 23(5):847–9.
19. Bergui M, Zhong J, Bradac GB, Sales S. Diffusion-weighted images of intracranial cyst-like lesions. Neuroradiology. 2001; 43(10):824–9.

20. Aikele P, Kittner T, Offergeld C, Kaftan H, Hüttenbrink KB, Laniado M. Diffusion-weighted MR imaging of cholesteatoma in pediatric and adult patients who have undergone middle ear surgery. AJR Am J Roentgenol. 2003; 181(1):261–5.

21. De Foer B, Vercruysse JP, Bernaerts A, Maes J, Deckers F, Michiels J, et al. The value of single-shot turbo spin-echo diffusion-weighted MR imaging in the detection of middle ear cholesteatoma. Neuroradiology. 2007; 49(10):841–8.

22. Lehmann P, Saliou G, Brochart C, Page C, Deschepper B, Vallée JN, et al. 3T MR imaging of postoperative recurrent middle ear cholesteatomas: value of periodically rotated overlapping parallel lines with enhanced reconstruction diffusion-weighted MR imaging. AJNR Am J Neuroradiol. 2009; 30(2):423–7.

23. Li PM, Linos E, Gurgel RK, Fischbein NJ, Blevins NH. Evaluating the utility of non-echo-planar diffusion-weighted imaging in the preoperative evaluation of cholesteatoma: a meta-analysis. Laryngoscope. 2013; 123(5):1247–50.

24. Mateos-Fernández M, Mas-Estellés F, de Paula-Vernetta C, Guzmán-Calvete A, Villanueva-Martí R, Morera-Pérez C. The role of diffusion-weighted magnetic resonance imaging in cholesteatoma diagnosis and follow-up. Study with the diffusion PROPELLER technique. Acta Otorrinolaringol Esp. 2012; 63(6):436–42.

Fig. 1.
Case of chonic otits media without cholesteatoma. TBCT shows soft tissue density in mastoid antrum (A) but, no definite high signal intensity was noted in a PROPELLER diffusion-weighted imaging (B). TBCT: temporal bone CT.
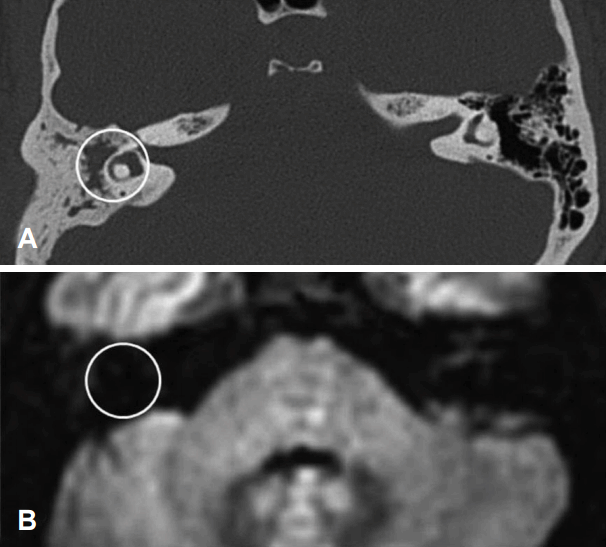
Fig. 2.
TBCT shows soft tissue filling the mastoid cavity (A). And shape of high signal intensity of PROPELLER diffusion-weighted imaging (B) reflects the soft tissue density at TBCT. TBCT: temporal bone CT.
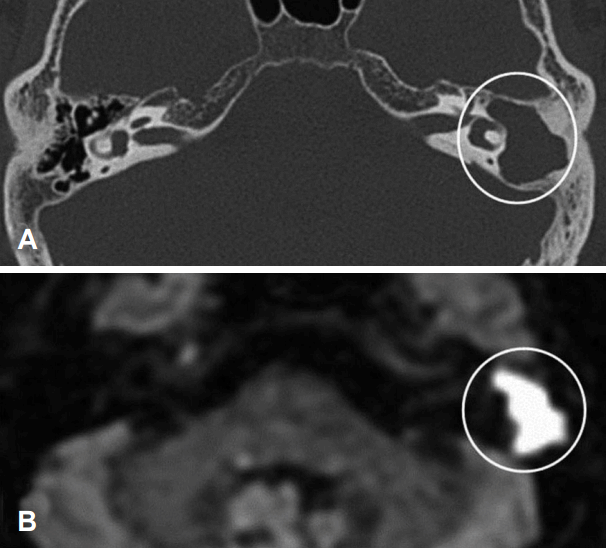
Fig. 3.
TBCT (A) shows soft tissue density filling the right mastoid cavity. PROPELLER-diffusion weighted imaging (B) shows peripheral rim like high signal intensity and central low signal intensity lesion. TBCT: temporal bone CT.
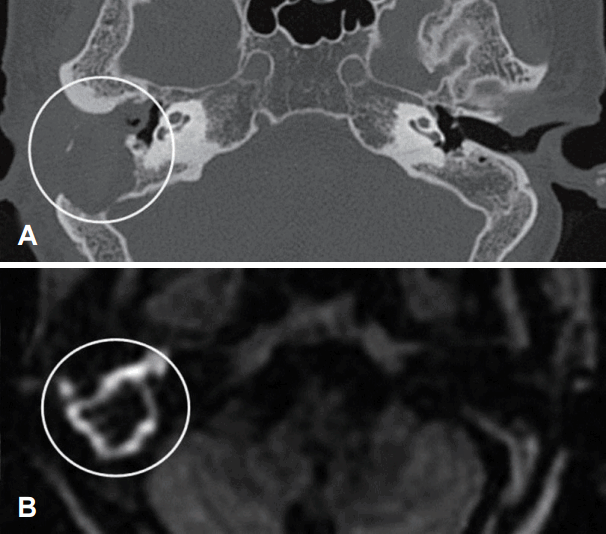
Fig. 4.
MRI PROPELLER-diffusion weighted imaging and migroscopic finding of group I cholesteatoma. Microscopic finding shows mass filled with keratin material that reflects the high signal of MRI finding (H&E, ×100).
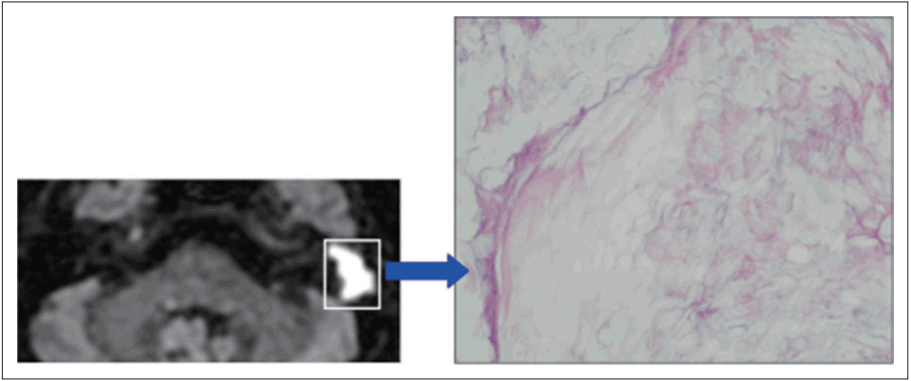
Fig. 5.
Gross finding of group II cholesteatoma shows whitish pearl-like surface (A) and inflammatory change of inner portion of cross sectional area (B).
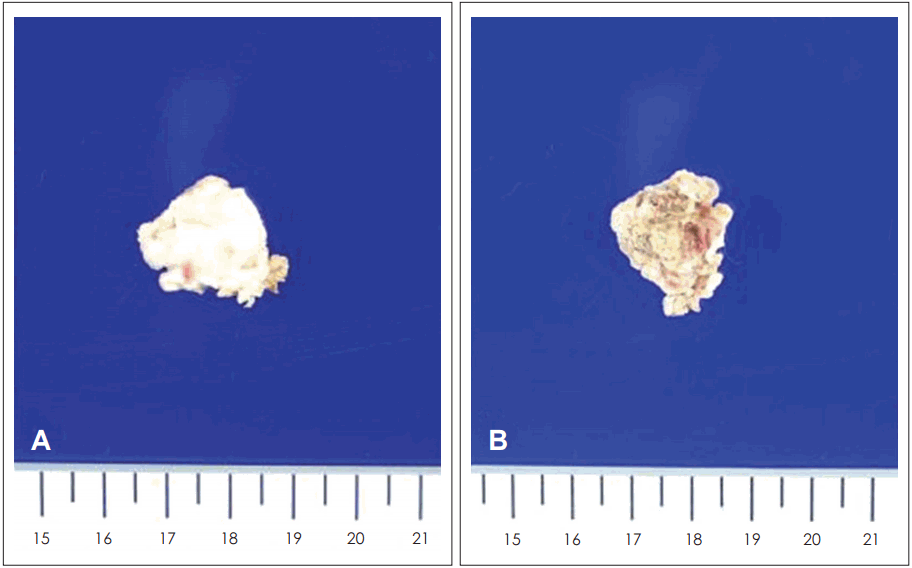
Fig. 6.
Microscopic finding of group II cholesteatoma. Peripheral rim-like high signal intensity reflect the surrounding cholesteatoma matrix (A) and central low signal intensity lesion reflect the inflammatory lesion with aggregated neutrophils (B) (H&E, ×100).
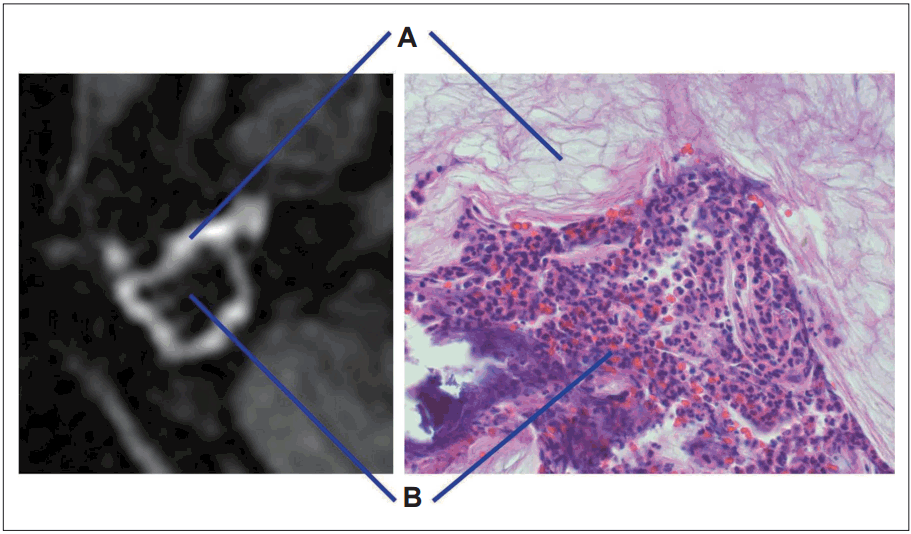
Table 1.
General characteristics of patients
| Cholesteatoma (n=51) | No cholesteatoma (n=16) | p-value | |
|---|---|---|---|
| Age (years) | 42.19±17.97 | 39.75±13.22 | 0.617* |
| Sex (M:F) | 19:32 | 10:6 | 0.075† |
| Ear (right:left) | 27:24 | 9:7 | 0.817† |




 PDF
PDF Citation
Citation Print
Print



 XML Download
XML Download