서 론
대상 및 방법
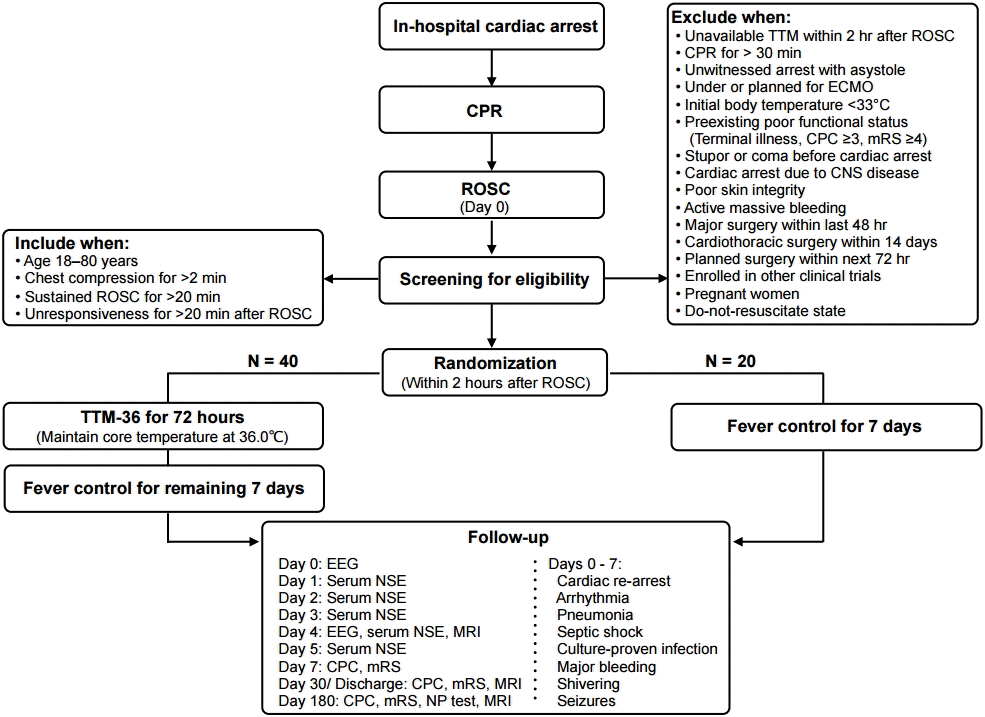
연구 디자인
연구 대상
1) 포함 기준
(1) 나이 18-80세
(2) 병원 입원 중 발생한 심장정지에 대해 심장마사지를 2분 이상 시행함
(3) 심폐소생술 후 심장박동회복 상태가 20분 이상 유지됨
(4) 심장박동회복 후 20분이 경과하여도 불러도 의식저하로 인하여 반응이 없고 명령 수행을 제대로 하지 못함
2) 제외 기준
(1) 심장박동회복 후 2시간이내에 TTM을시행할 수 없는 상황
(2) 심장마사지 30분 이상 시행
(3) 심장정지 발생 당시 목격자가 없으며 첫 심전도에서 심장 무수축이 관찰됨
(4) 체외순환기 적용 중이거나 적용 계획 있음
(5) 심부체온 33°C 이하
(6) 말기 질환으로 기대여명 6개월 미만
(7) 입원 전 Cerebral Performance Category (CPC) 점수 3-5점[19]
(8) 입원 전 modified Rankin Scale (mRS) 점수 4-6점[20]
(9) 심장정지발생전에도의식저하로 혼수 또는 혼미상태지속
(10) 심장정지 발생이 중추신경계질환에 의한 것으로 추정되는 경우(뇌졸중, 뇌종양, 루게릭병 등)
(11) 피부질환으로 인하여 피부부착패드 적용이 힘든 환자(화상, 아물지 않은 수술 상처, 욕창, 연조직염 등)
(12) 다량의 출혈이 멎지 않는 경우
(13) 48시간 이내 주요 수술 시행 받음
(14) 14일 이내 심장 흉부 수술 받음
(15) 72시간 이내 수술을 계획하고 있는 경우
(16) 다른 임상연구에 이미 등록된 경우
(17) 임산부
(18) 심폐소생술거절요청을 받은 경우
(19) 환자의 대리인과 담당 의사가 본 연구 참여에 동의하지 않는 경우
선별 및 무작위 추출
중재
결과 변수
1) 실행가능성(총 연구기간 2년 동안 평가)
(1) 연구기간 2년 동안 총 60명의 환자 등록
(2) 연구대상 가능성 있는 환자 중 50%가 연구에 참여
(3) 실험군 또는 대조군 배정 이후 다른 군으로 재배정되는 사례 10% 이내
(4) 등록된 환자들 중 90% 이상 추적 완료
2) 안전성 변수(각 환자당 무작위 배정 후 7일 동안 평가)
(1) 무작위 배정 후 다시 발생한 심장정지에 대한 심폐소생술 시행
(2) 부정맥: 심실세동, 심실빈맥, 심방세동, 심방조동, 빈맥(분당 130회 이상 1시간 이상 지속), 서맥(분당 40회 이하 1시간 이상 지속)
(3) 폐렴: 흉부방사선촬영에서 침윤이 관찰되고 발열, 백혈구 증가증, 화농성 객담 배출 중 2가지 이상 발생[21]
(4) 패혈증 쇼크: 패혈증으로 인하여 적절한 수액요법에도 불구하고 수축기 혈압이 90 mmHg 이하, 평균 혈압 70 mmHg 이하, 또는 수축기 혈압 감소 40 mmHg 이상[22]
(5) 배양검사를 통해 확인된 감염
(6) 주요 출혈: 2시간 이내 적혈구 수혈 2 팩 이상 시행
(7) 오한: The Bedside Shivering Assessment Scale 2-3점[23]
3) 유효성 변수(각 환자당 무작위 배정 후 180일 동안 평가)
(1) 180일째 CPC 점수 3-5 (일차 유효성 변수)
(2) 7일째 및 30일째 CPC 점수 3-5
(3) 7일째 mRS 점수 4-6
(4) 첫 5일간 혈청 뉴런특이에놀라아제(neuron specific enolase) 최고값
(5) 예후 불량을 시사하는 뇌파 패턴: 광범위한 진폭 억제(generalized suppression), 돌발 억제양상 동반 뇌전증모양방전(burst-suppression with generalized epileptiform activity), 편평한 배경의 전신주기뇌전증모양방전(generalized periodic epileptiform discharge on a flat background), 뇌파 반응 없음(no electrographical reactivity), 발작(electrographical seizures), 뇌전증지속상태(electrographical status epilepticus)
(6) 4일째 뇌 자기공명영상(magnetic resonance imaging, MRI) 소견: 확산강조영상(diffusion-weighted imaging, DWI)과 액체감쇠역전회복(fluid attenuated inversion recovery, FLAIR) 영상에서 확인된 total MRI score [24], 전체 뇌 영역 중 겉보기확산계수(Afferent Diffusion Coefficient, ADC) 값 650 × 10-6 mm2/sec 미만 영역이 차지하는 비율, 전체 뇌 영역 중 ADC 값 450 × 10-6 mm2/sec 미만 영역이 차지하는 비율, susceptibility-weighted imaging (SWI)에서 확인된 미세출혈(cerebral microbleeds)의 개수
(7) 첫 7일간 근간대경련(myoclonic seizure), 강직간대발작(tonic-clonic seizure) 또는 뇌전증지속상태(status epilepticus)
(8) 30일째 및 180일째 생존 여부
(9) 30일째(또는 30일 이내 퇴원 시 퇴원 직전) 및 180일째 뇌 MRI 소견: SWI에서 확인된 미세출혈 개수, resting state functional MRI (fMRI) 소견(connectivity strength 값과 비율), 확산텐서영상(diffusion tensor imaging, DTI) 소견(global mean diffusivity, gray matter mean diffusivity, white matter mean diffusivity, mean fractional anisotropy, proportional increase of white matter global fractional anisotropy, proportional increase of white matter global mean diffusivity), 고해상도 T1-weighted imaging으로 측정한 뇌 용적 및 기저 상태와 비교한 용적 변화율
(10) 신경심리검사결과: Seoul Neuropsychological Screening Battery 제2판(SNSB II)을 통한 주의집중력, 언어 기능, 시공간기능, 기억력, 전두엽 및 실행능력, 전반적 인지 기능, 일상생활능력 평가
(11) 환자와 보호자를 대상으로 한 설문 평가: 우울증(Beck Depression Inventory), 삶의 질(Short-Form 36-item Health Survey), 일상생활능력(Instrumental Activities of Daily Living), 정신병 증상(Neuropsychiatric Inventory), 인지기능(Informant Questionnaire on Cognitive Decline in the Elderly), 파킨슨병증(Unified Parkinson’s Disease Rating Scale), 실조증(International Cooperative Ataxia Rating Scale)




 PDF
PDF Citation
Citation Print
Print


 XML Download
XML Download